美托洛尔对慢性心力衰竭患者外周血Th17细胞及其相关因子表达水平的影响研究
2015-02-22吕晓伟王热华
吕晓伟,王热华
·论著·
美托洛尔对慢性心力衰竭患者外周血Th17细胞及其相关因子表达水平的影响研究
吕晓伟,王热华
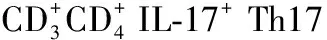
心力衰竭;美托洛尔;Th17细胞
已有文献表明,CHF患者存在Th17细胞百分率升高现象[3],但Th17细胞分化特征不同,正调控Th17细胞分化的核转录因子视黄酸相关核孤独受体γt(RORγt)和负调控Th17细胞分化的细胞因子信号传送阻抑蛋白3(SOCS3)及Th17细胞相关趋化因子CX型趋化因子配体1(CXCL1)、CXCL5、CXCL8在疾病发生过程中的作用尚未明确。新一代β受体阻滞剂——美托洛尔可通过抑制炎性因子白介素1β(IL-1β)、白介素6(IL-6)等的表达而有效改善患者心功能,研究发现IL-1β、IL-6均可诱导幼稚性CD4原始T细胞向Th17细胞方向分化,因此本研究选择美托洛尔治疗CHF,并探讨其对CHF患者外周血Th17细胞及其相关因子的影响。
1 资料与方法
1.1 一般资料 选择2014年1—6月福建省晋江市医院心血管内科住院的CHF患者60例,其中男32例,女28例;病程1~8年;年龄48~76岁,平均年龄(62.8±8.6)岁;基础疾病:高血压心脏病16例,扩张型心肌病24例,冠心病20例。纳入标准:(1)确诊为CHF至少3个月;(2)纽约心脏病协会(NYHA)心功能分级Ⅱ~Ⅳ级;(3)左心室射血分数(LVEF)<40%。排除标准:(1)静息状态下心率<55次/min、血压≤90/50 mm Hg(1 mm Hg=0.133 kPa),Ⅱ度及以上房室传导阻滞者;(2)患有短期内可能导致死亡的疾病者;(3)有β受体阻滞剂禁忌证(如支气管哮喘、房室传导阻滞、胰岛素依赖型糖尿病等)及不能耐受β受体阻滞剂治疗者。入院后将60例患者随机分成常规治疗组和美托洛尔组,各30例,两组患者性别、年龄、病程、基础疾病及心功能分级比较,差异均无统计学意义(P>0.05,见表1),具有可比性。另选择同期在本院体检健康者30例作为健康对照组,其中男16例,女14例;平均年龄(56.0±12.0)岁。本研究方案经医院伦理委员会审查批准,所有受试者知情同意。
1.2 治疗方法 常规治疗组患者给予洋地黄、利尿剂、血管紧张素转换酶抑制剂(ACEI)等常规治疗。美托洛尔组患者在常规治疗基础上加用美托洛尔,起始剂量为6.25 mg/次、2次/d,心力衰竭无加重者12.5 mg/周递增,直至100 mg/d,1次/d。两组患者均治疗6个月,治疗期间追踪随访,定期到门诊体检,详细观察并记录两组患者治疗前后心力衰竭症状、心率、血压、呼吸等变化,记录治疗前后心电图及24 h动态心电图。
1.3 主要试剂与仪器 多甲藻叶绿素蛋白标记的CD3(CD3-PerCP)、异硫氰酸荧光素标记的CD4(CD4-FITC)、藻红蛋白标记的IL-17(IL-17-APC)流式抗体(德国Miltenyi公司);Trizol(美国Invitrogen公司);RPMI-1640培养基、胰酶和胎牛血清(美国Gibco公司);Ficoll-Hypaque人淋巴细胞分离液(福建诺普生物科技有限公司);流式染色用细胞固定和穿膜缓冲液、莫能菌素、离子霉素、佛波酯(杭州联科生物技术有限公司);M-MLV Reverse Transcriptase反转录试剂盒(美国Promega公司),One Step SYBR®PrimeScriptTMRT-PCR Kit Ⅱ(日本Takara公司);Light Cycler实时荧光定量PCR仪(罗氏诊断产品上海有限公司);BD FACSCantoTMⅡ流式细胞仪(美国BD Biosciences公司)。
1.4 方法
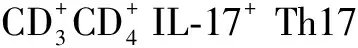
1.4.2 实时荧光定量PCR 使用EDTA-K2抗凝管抽取各组受试者前臂外周血3 ml,同上所述提取PBMC(1×106/ml),将PBMC沉淀弹匀,加入1 ml Trizol,充分混匀,室温放置30 min。而后加入200 μl预冷三氯甲烷,充分震荡混匀15 s,室温放置2~3 min,再次震荡15 s,室温放置2~3 min。4 ℃,12 000×g离心15 min,小心吸取上层水相500 μl,移至无RNase的EP管中。再加入500 μl异丙醇上下轻轻颠倒混匀,室温放置20 min。4 ℃,12 000×g离心10 min,小心弃上清液,RNA沉于管底,提取得到总RNA。参照M-MLV Reverse Transcriptase反转录试剂盒说明书合成cDNA,RORγt、SOCS3、IL-6、IL-17、IL-23、CXCL1、CXCL5、CXCL8的引物设计采用Primer5程序,并在BLAST数据库比对后由上海Invitrogen公司合成(见表2)。反应体系均为20 μl,扩增反应条件为95 ℃ 5 min,40个循环的95 ℃ 5 s,60 ℃ 30 s。样本均为一式3份,mRNA含量用比较域值的方法通过相对每个样本的内参基因GAPDH计算。目的基因量=2-ΔΔCt,ΔCt 是目的基因和内参基因循环域值的差值。数据通过健康对照组进行标准化,ΔΔCt=实验组Ct目的基因-Ct内参基因-健康对照组Ct目的基因-Ct内参基因。PCR实验结束后进行产物的溶解曲线分析,系统软件自动分析在每个周期中产生的荧光信号,阈循环值用于确定与GAPDH作为参考基因计算基因表达的相对定量。
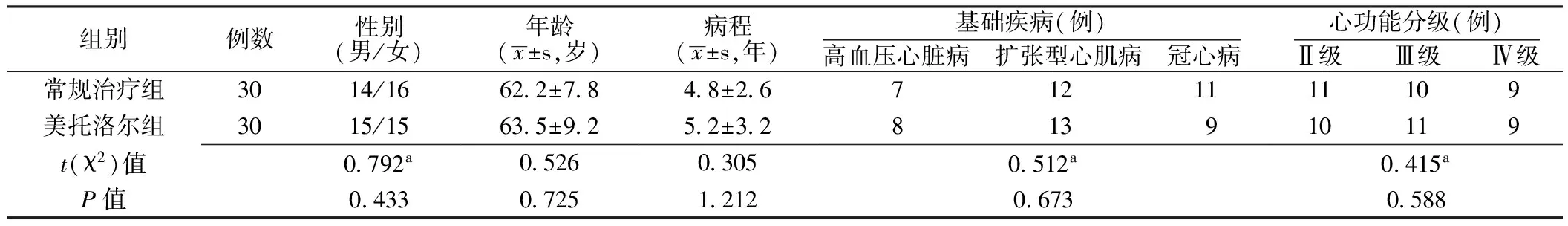
表1 两组患者一般资料比较
注:a为χ2值
1.4.3 心功能检测 CHF患者于入院24 h及治疗6个月随访时检测心功能,采用心脏彩超仪(GE公司)于左心长轴切面腱索水平采用M型超声检测LVEF,于胸骨旁左心长轴切面腱索水平检测左心室舒张末期直径(LVEDD)。

2 结果
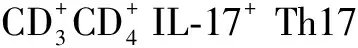
2.2 各组血清Th17细胞相关因子的表达 治疗前3组PBMC中RORγt、IL-6、IL-17、IL-23及趋化因子CXCL1、CXCL5、CXCL8 mRNA表达水平比较,差异均有统计学意义(P<0.05);其中常规治疗组和美托洛尔组患者PBMC中RORγt、IL-6、IL-17、IL-23及趋化因子CXCL1、CXCL5、CXCL8 mRNA表达水平高于健康对照组,SOCS3 mRNA表达水平低于健康对照组,差异有统计学意义(P<0.05);而常规治疗组和美托洛尔组患者RORγt、SOCS3、IL-6、IL-17、IL-23及趋化因子CXCL1、CXCL5、CXCL8 mRNA表达水平比较,差异均无统计学意义(P>0.05)。治疗后美托洛尔组患者PBMC中RORγt、IL-6、IL-17、IL-23、CXCL1、CXCL5、CXCL8 mRNA表达水平均低于常规治疗组,SOCS3 mRNA表达水平高于常规治疗组,差异有统计学意义(P<0.05,见表3~5)。CXCL1、CXCL5、CXCL8与IL-17 mRNA表达水平均呈正相关(r值分别为0.438、0.345、0.423,P<0.01)。
2.3 CHF患者心功能指标比较 两组CHF患者治疗前LVEF和LVEDD比较,差异无统计学意义(P>0.05);治疗后美托洛尔组患者LVEF高于常规治疗组,LVEDD小于常规治疗组,差异有统计学意义(P<0.05,见表6)。

Table 3 Comparison of RORγt and SOCS3 mRNA expression levels of PBMC among the three groups before and after treatment

组别例数RORγt治疗前 治疗后SOCS3治疗前 治疗后健康对照组300 35±0 08-0 98±0 23-常规治疗组301 63±0 50a0 95±0 220 45±0 09a0 66±0 02美托洛尔组301 66±0 49a0 47±0 13b0 47±0 08a0 86±0 14bF(t)值101 377 987c120 497 798cP值0 0000 0010 0000 001
注:-表示未测;与健康对照组比较,aP<0.05;与常规治疗组比较,bP<0.05;c为t值

表2 基因引物序列
注:RORγt=核转录因子视黄酸相关核孤独受体γt,SOCS3=细胞因子信号传送阻抑蛋白3;IL-6=白介素6,IL-17=白介素17,IL-23=白介素23;CXCL1=CX型趋化因子配体1,CXCL5=CX型趋化因子配体5,CXCL8=CX型趋化因子配体8

图1 各组受试者PBMC中细胞百分率

表4 3组受试者治疗前后PBMC中IL-6、IL-17及IL-23 mRNA表达水平比较
注:-表示未测;与健康对照组比较,aP<0.05;与常规治疗组比较,bP<0.05;c为t值

表5 3组受试者治疗前后PBMC中CXCL1、CXCL5及CXCL8 mRNA表达水平比较
注:-表示未测;与健康对照组比较,aP<0.05;与常规治疗组比较,bP<0.05;c为t值

Table 6 Comparison of cardiac function index between the two groups before and after treatment
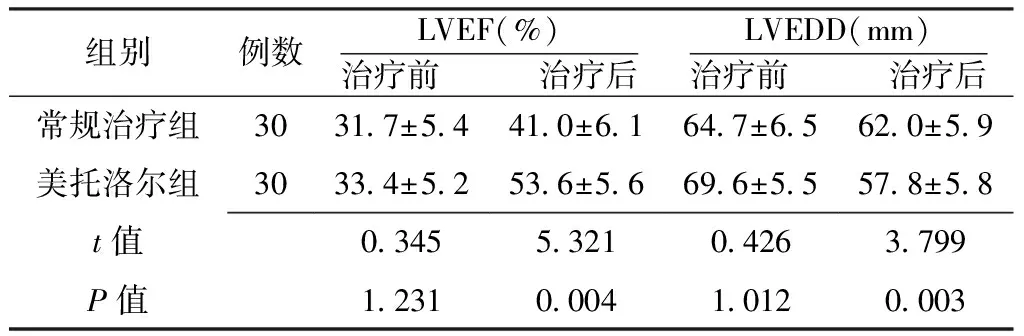
组别例数LVEF(%)治疗前 治疗后LVEDD(mm)治疗前 治疗后常规治疗组3031 7±5 441 0±6 164 7±6 562 0±5 9美托洛尔组3033 4±5 253 6±5 669 6±5 557 8±5 8t值0 3455 3210 4263 799P值1 2310 0041 0120 003
注:LVEF=左心室射血分数,LVEDD=左心室舒张末期直径
3 讨论
美托洛尔作为新一代β受体阻滞剂,不仅能通过阻断β受体而改善患者心功能,还具有抗炎、抑制细胞凋亡等辅助作用[10]。本研究结果显示,美托洛尔组患者治疗后心功能指标改善程度优于常规治疗组,这可能与其阻断β受体作用相关,该结果与Schiller[11]的研究结果一致。同时本研究结果还提示,美托洛尔可能具有抑制Th17细胞分化、下调Th17细胞功能、改善慢性炎症的作用,这可能是美托洛尔从机体免疫方面改善CHF患者心功能的作用机制之一,该结果与Tian等[12]报道的关于美托洛尔对于趋化因子的抑制作用相符。
综上所述,CHF患者存在强烈的Th17细胞免疫反应,增高的IL-6、IL-17、IL-23、CXCL1、CXCL5、CXCL8有利于维持CHF患者Th17细胞优势的体内微环境,并通过RORγt和SOCS3两种途径共同调控TH17细胞的优势分化。美托洛尔可以通过抑制机体Th17细胞极向分化而逆转该疾病的发展,改善患者预后。由于本研究样本量较小,随访时间短,因此需要扩大样本量证实美托洛尔对改善CHF患者预后及确切机制,为临床治疗提供参考价值。
[1]Zhu ZF,Li JJ,Liu J,et al.Circulating Th17 cells are not elevated in patients with chronic heart failure[J].Scand Cardiovas J,2012,46(5):295-300.
[2]Li N,Bian H,Zhang J,et al.The Th17/Treg imbalance exists in patients with heart failure with normal ejection fraction and heart failure with reduced ejection fraction[J].Clin Chim Acta,2010,411(23/24):1963-1968.
[3]Kinugawa T,Kato M,Yamamoto K,et al.Proinflammatory cytokine activation is linked to apoptotic mediator,soluble fas level in patients with chronic heart failure[J].Int Heart J,2012,53(3):182-186.
[4]Stanciu AE,Vatasescu RG,Stanciu MM,et al.Cardiac resynchronization therapy in patients with chronic heart failure is associated with anti-inflammatory and anti-remodeling effects[J].Clin Biochem,2013,46(3):230-234.
[5]Del Ry S,Morales MA,Scali MC,et al.Effect of concomitant oral chronic dipyridamole therapy on inflammatory cytokines in heart failure patients[J].Clin Lab,2013,59(7/8):843-849.
[6]Cittadini A,Monti MG,Iaccarino G,et al.SOCS1 gene transfer accelerates the transition to heart failure through the inhibition of the gp130/JAK/STAT pathway[J].Cardiovasc Res,2012,96(3):381-390.
[7]Booth AJ,Bishop DK.TGF-beta,IL-6,IL-17 and CTGF direct multiple pathologies of chronic cardiac allograft rejection[J].Immunotherapy,2010,2(4):511-520.
[8]Liu Y,Zhu H,Su Z,et al.IL-17 contributes to cardiac fibrosis following experimental autoimmune myocarditis by a PKCβ/Erk1/2/NF-κB-dependent signaling pathway[J].Int Immunol,2012,24(10):605-612.
[9]Baudhuin LM,Miller WL,Train L,et al.Relation of ADRB1,CYP2D6,and UGT1A1 polymorphisms with dose of,and response to,carvedilol or metoprolol therapy in patients with chronic heart failure[J].Am J Cardiol,2010,106(3):402-408.
[10]Le DE,Pascotto M,Leong-Poi H,et al.Anti-inflammatory and pro-angiogenic effects of beta blockers in a canine model of chronic ischemic cardiomyopathy:Comparison between carvedilol and metoprolol[J].Basic Res Cardiol,2013,108(6):384.
[11]Schiller AM,Haack KK,Pellegrino PR,et al.Unilateral renal denervation improves autonomic balance in conscious rabbits with chronic heart failure[J].Am J Physiol Regul Integr Comp Physiol,2013,305(8):R886-R892.
[12]Tian X,Zhang L,Hou Y,et al.Effects of cAMP and β-adrenergic receptor antagonists on the function of peripheral T helper lymphocytes in patients with heart failure[J].Neuroimmunomodulation,2011,18(2):73-78.
(本文编辑:谢武英)
Impact of Metoprolol on Peripheral Blood Th17 Cells and Related Factors Levels in Patients with Chronic Heart Failure
LYVXiao-wei,WANGRe-hua.DepartmentofCardiovascularDisease,JinjiangMunicipalHospital,Jinjiang362000,China

Heart failure;Metoprolol;Th17 cell
国家自然科学基金青年基金科学项目(31400858)
362000福建省晋江市医院心血管内科(吕晓伟);福建省立医院心血管内科(王热华)
吕晓伟,王热华.美托洛尔对慢性心力衰竭患者外周血Th17细胞及其相关因子表达水平的影响研究[J].实用心脑肺血管病杂志,2015,23(6):7-12.[www.syxnf.net]
R 541.6
A
10.3969/j.issn.1008-5971.2015.06.003
2015-04-12;
2015-06-14)
【编者按】 慢性心力衰竭是指持续存在的心力衰竭状态,目前,免疫因素作为慢性心力衰竭发病的重要原因已被广泛认可。美托洛尔为新一代β受体阻滞剂,被广泛用于治疗心绞痛及心力衰竭,但关于美托洛尔对慢性心力衰竭患者外周血Th细胞影响的研究报道较为少见。本研究探讨了美托洛尔对慢性心力衰竭患者外周血Th17细胞及其相关因子表达水平的影响,结论认为慢性心力衰竭患者存在强烈的Th17细胞免疫反应,美托洛尔具有抑制Th17细胞分化、下调Th17细胞功能、改善慢性炎症等作用,提出了美托洛尔治疗慢性心力衰竭的可能的免疫作用机制,选题新颖,结论可靠,临床指导价值较高。
Lyv XW,Wang RH.Impact of metoprolol on peripheral blood Th17 cells and related factors levels in patients with chronic heart failure[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(6):7-12.
