酶解桃仁分离蛋白制备肾素和ACE双重抑制肽的工艺研究
2015-02-22朱振宝易建华王留续
朱振宝, 杨 梅, 易建华, 王留续
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
酶解桃仁分离蛋白制备肾素和ACE双重抑制肽的工艺研究
朱振宝, 杨梅, 易建华, 王留续
(陕西科技大学 食品与生物工程学院, 陕西 西安710021)
摘要:以桃仁分离蛋白(PKPI)为原料,采用碱性蛋白酶水解桃仁分离蛋白制备了肾素和ACE双重抑制肽.以体外ACE抑制率和肾素抑制率为指标,通过单因素实验对酶解温度、酶解pH值、底物质量浓度和加酶量等酶解工艺参数进行了研究,并利用响应面法优化了酶解工艺.结果表明,碱性蛋白酶水解桃仁分离蛋白制备肾素和ACE双重抑制肽的最佳工艺参数为:酶解温度50.6 ℃、酶解pH值8.02、加酶量3.06%,所得到的酶解产物ACE抑制率为69.03%、肾素抑制率为57.61%.
关键词:桃仁分离蛋白; 肾素; ACE抑制肽; 响应面法
0引言
当今世界威胁人类健康的重要疾病之一是心脑血管疾病,而高血压则是最常见的心血管病.从食物源提取的降血压肽因具有营养及安全性,已被用于开发与降血压有关的功能性食品和保健品.其中,ACE抑制肽因其无毒副作用的降血压功能而成为活性肽研究的热点[1].虽然其在临床应用中表现出了较好的降血压效果,但随之而来的副作用如神经性水肿和咳嗽等却很严重[2];近年来研究表明,肾素抑制肽的降血压效果很好.故肾素作为降血压药物的新靶点,由其研制的降血压药剂受到了很大关注.虽然肾素抑制肽在降血压方面有着独特的效果,但是其可能亦存在风险.
鉴于单独的肾素抑制肽和ACE抑制肽都存在一定问题,许多研究者尝试将不同功能的抑制剂联合使用,以期降低其副作用从而达到更好的降血压效果.研究发现,ACE抑制剂和肾素抑制剂的联合使用在降低血压的同时,还可以减少对其它器官的损伤[3].何荣[4]已从菜籽蛋白中分离出了肾素和ACE双重抑制肽.
桃仁为桃加工的副产品,除少数用作中药外,大部分被当成废弃物抛弃,造成了资源的浪费和环境的污染.国内外研究主要集中在对桃仁的化学、生物化学、血液动力学[5]、药理[6]、免疫[7]等方面的研究.已有研究[8-10]表明,桃仁中蛋白质含量较高,具有重要的生理活性.
本文以桃仁分离蛋白为研究对象,用不同的蛋白酶酶解桃仁蛋白,对其效果进行了比较,确定了最适的蛋白酶源.通过单因素实验,对酶解温度、酶解pH值、底物质量浓度和加酶量等酶解工艺参数进行了研究,并根据Box-Behnken的中心组合实验设计原理对酶解工艺进行了优化,这为桃仁蛋白资源的深度开发利用提供了理论依据和技术参考.
1材料与方法
1.1 实验材料
桃仁分离蛋白(PKPI),实验室自制(质量分数78.2%);ACE(血管紧张素转化酶),来源于兔肺;HHL(马尿酰-组胺酰-亮氨酸)、马尿酸,购自Sigma公司;肾素活性测定试剂盒,购自TSZ公司;乙腈、三氟乙酸,色谱纯;其它试剂均为实验室常见分析纯级.
1.2 实验仪器
501A型超级恒温器,上海实验仪器厂有限公司;Waters 600型高效液相色谱仪,美国Waters公司;ALPHA1-2/LD-2型冷冻干燥机,德国Martin Christ公司;JBZ-14H型磁力搅拌器,上海大普仪器有限公司;全波长扫描式多功能读数仪,Varioskan Flash,芬兰赛默飞世尔科技有限公司.
1.3 实验方法
1.3.1PKPI的制备工艺流程[10]
桃仁→盐酸浸泡手工脱皮→烘干→过40目筛粉碎→石油醚脱脂→烘干→碱溶酸沉法提取蛋白→冷冻干燥→PKPI.
1.3.2桃仁蛋白的酶解[11,12]
称取一定质量的PKPI,加无CO2水配制成一定质量浓度的蛋白质溶液,迅速加热至85 ℃灭活酶20 min,冷却至室温,调节pH后,加入适量蛋白酶,混匀,在超级恒温器中反应,在反应过程中不断加入0.5 mol/L的NaOH标准溶液维持体系pH,酶解一定时间后,将酶解液煮沸2 min灭活酶,冷却,室温后,调pH值至中性,在10 000 r/min、4 ℃条件下离心20 min,取上清液经浓缩、冷冻干燥得桃仁蛋白酶解物多肽粉,测定多肽ACE抑制率和肾素抑制率.
1.3.3蛋白酶的筛选[12,13]
分别用复合蛋白酶、中性蛋白酶、木瓜蛋白酶、风味蛋白酶、碱性蛋白酶、胃蛋白酶、胰蛋白酶和胃+胰蛋白酶等,在酶制剂厂家提供的最适条件下酶解桃仁分离蛋白.通过测定ACE抑制率和肾素抑制率来分析确定适合酶解桃仁分离蛋白的酶.
1.3.4酶解物的抗消化酶解实验
选取ACE抑制率和肾素抑制率均较高的蛋白酶酶解产物,分别用胃蛋白酶、胰蛋白酶、胃蛋白酶+胰蛋白酶等进行模拟体内抗消化实验,消化后再进行ACE抑制率和肾素抑制率的测定.
1.3.5酶解工艺的单因素实验
以酶解液的ACE抑制率和肾素抑制率为指标,分别研究酶解温度、酶解pH值、底物质量浓度和加酶量等工艺参数对酶解效果的影响.
1.3.6酶解工艺的响应面优化试验
根据单因素实验结果,采用响应面优化试验设计,选择对ACE抑制率有影响的3个因素,即酶解温度、酶解pH值、加酶量等,进行三因素三水平的响应面优化试验,以ACE抑制率和肾素抑制率为响应变量.
1.3.7ACE抑制活性的测定[11-13]
ACE抑制活性的测定采用RP-HPLC直接进样法进行.取桃仁分离蛋白的酶解多肽粉溶于硼酸盐缓冲溶液(pH8.3,0.1 mol/L,其中含0.3 mol/L的NaCl),配成2.5 mg/mL的样品溶液.取50μL、5 mmol/L的HHL(溶于相同的硼酸盐缓冲溶液中) 加入20μL的样品溶液,混合均匀后于37 ℃预热10 min,然后加入10μL、0.1 UN/mL的ACE(溶于上述相同的硼酸盐缓冲溶液中),在37 ℃反应30 min后,用100μL、1 mol/L的HCl溶液终止反应,冷却至室温后过0.45μm滤膜,取20μL反应产物进样,通过RP-HPLC洗脱图谱定量马尿酸的生成量,再以马尿酸的生成量来计算样品对ACE的抑制活性,同时做样品空白(以硼砂-硼酸缓冲液代替样品溶液).其计算公式如下:
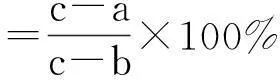
(1)
式(1)中:c为样品空白反应的色谱峰面积;b为ACE不参与反应的色谱峰面积;a为ACE和样品溶液都参与反应的色谱峰面积.
色谱条件如下:色谱柱,DiamonsilTMC18柱(4.6 mm×250 mm);紫外检测器,波长228 nm;流动相A,25%乙腈;流动相B,75%超纯水(含0.1%TFA);流速,1.0 mL/min;进样量,20μL;柱温,30 ℃;检测时间,20 min.
1.3.8肾素抑制活性的测定[14]
桃仁蛋白水解肽的肾素抑制活性的测定根据肾素活性试剂盒提供的方法进行.在96孔板中依次加入20μL底物、150μL测试用缓冲液(50 mmol/L Tris-HCL缓冲液,含0.3 mol/L的NaCl,pH7.5)、10μL样品(浓度为1 mg/mL),对照组和空白组以纯水代替样品溶液,然后在对照组和样品组依次加入10μL肾素以启动反应(空白组加10μL测试用缓冲液).
将该微量培养板摇动10 s并在37 ℃下保温15 min,然后在10 min内用荧光酶标仪在激发波长340 nm和发射波长490 nm下检测样品的荧光强度(FI).其计算公式如下:

(2)
2结果与讨论
2.1 蛋白酶的筛选
选取底物质量浓度为2%、加酶量为5%,在各种蛋白酶的最适酶解pH和温度条件下反应3 h,其不同蛋白酶酶解产物的ACE抑制率和肾素抑制率测定结果如表1所示.
由表1可知,上述蛋白酶在其最适宜条件下对桃仁分离蛋白进行水解后,其ACE抑制率和肾素抑制率各有差异.其中,碱性蛋白酶作用于桃仁分离蛋白其酶解产物的ACE抑制率和肾素抑制率均最高.故选用碱性蛋白酶作为酶解桃仁分离蛋白的最适水解酶.并选用碱性蛋白酶解物做模拟体内抗消化实验.

表1 不同蛋白酶酶解的最适条件及结果
2.2 碱性酶解物的抗消化酶解实验结果
酶解物的模拟体内抗消化实验结果如表2所示.由表2可以看出,碱性蛋白酶的酶解产物经消化后,其ACE抑制活性和肾素抑制活性均有所降低,但整体仍保持了较高的活性.相比单独使用胃蛋白酶或者胰蛋白酶的消化,经胃蛋白酶和胰蛋白酶连续消化后其抑制活性有所升高,其原因可能是经胃蛋白酶消化后,部分活性肽被降解,再用胰蛋白酶处理后又释放出了有活性的肽.
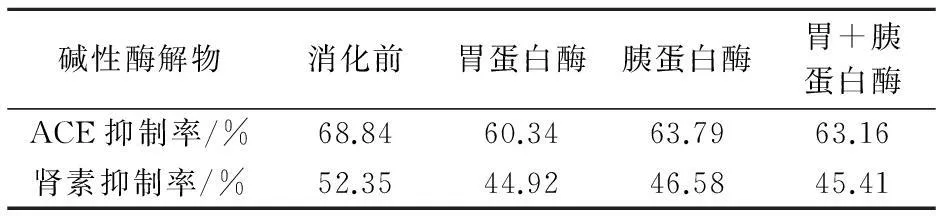
表2 模拟体内抗消化实验结果
2.3 单因素实验
2.3.1酶解温度对ACE抑制率和肾素抑制率的影响
在底物质量浓度为2%、酶解pH8.0、加酶量为5%时,酶解3 h,调节酶解温度(40 ℃、45 ℃、50 ℃、55 ℃和60 ℃),桃仁分离蛋白酶解物的ACE抑制率和肾素抑制率的变化如图1所示.
从图1可以看出,桃仁分离蛋白的ACE抑制率和肾素抑制率随着酶解温度的升高均呈现先迅速上升然后下降的趋势,当酶解温度达50 ℃时,ACE抑制率和肾素抑制率均达到最高.该研究结果与李建杰等[15]的研究基本保持一致.所以初步选定响应面试验酶解温度的较优水平为45 ℃、50 ℃、55 ℃等.
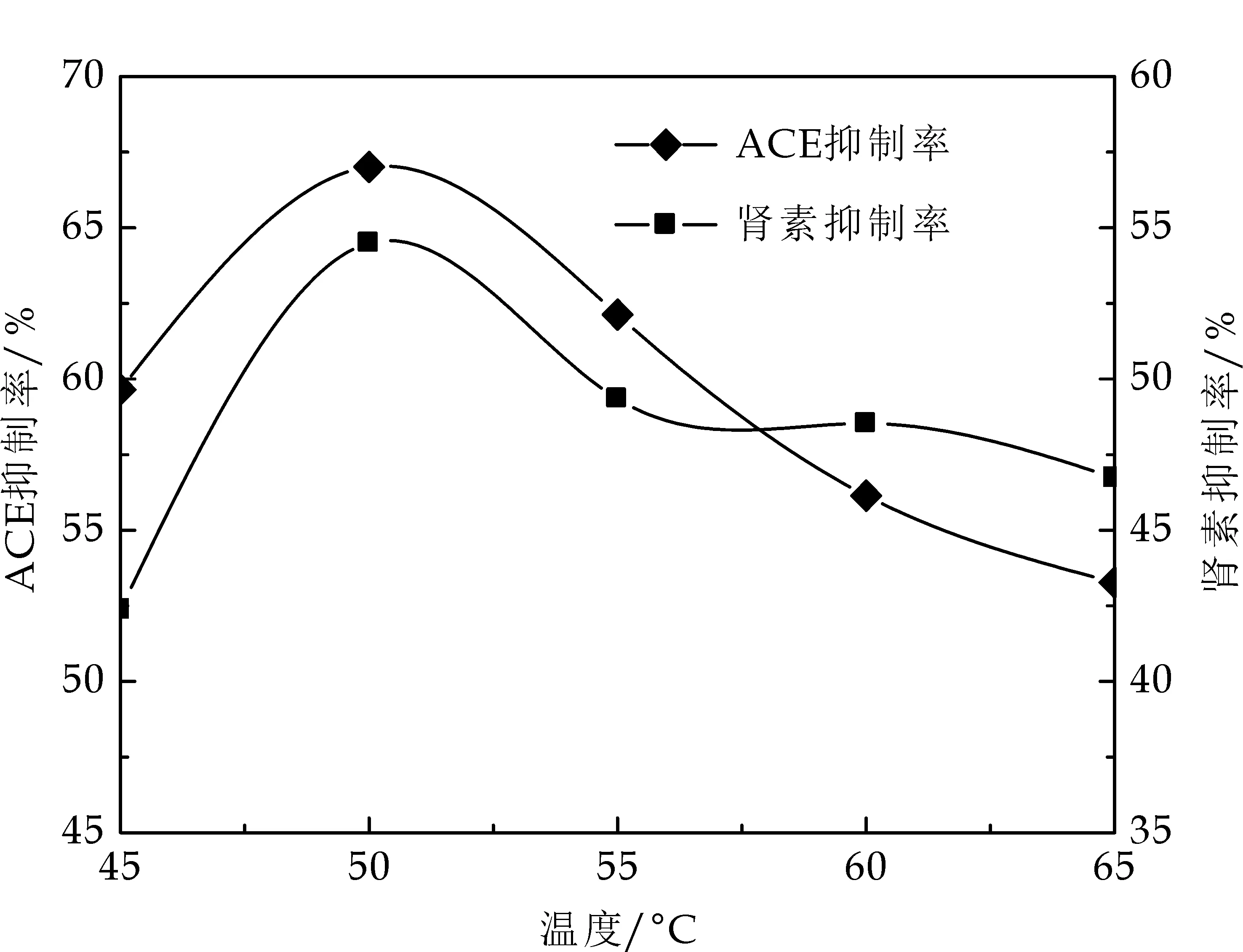
图1 温度对ACE 抑制率和肾素抑制率的影响
2.3.2酶解pH对ACE抑制率和肾素抑制率的影响
在酶解温度为55 ℃、底物质量浓度为2%、加酶量为5%、酶解时间为3 h的条件下,以体外ACE抑制率和肾素抑制率为指标,调节不同酶解pH值对酶解效果的影响如图2所示.
从图2可以看出,桃仁蛋白的ACE抑制率和肾素抑制率随着pH的变化均呈现先迅速上升然后下降的趋势.酶解产物的ACE抑制率从50%上升至65%左右,后有所下降,在pH8.0的条件下达到最高;而肾素抑制率在pH8.5的条件下最高.通过用SPSS软件分析,综合考虑酶解物对ACE抑制率和肾素抑制率的影响,选择响应面试验酶解pH的较优水平为7.5、8.0、8.5等.

图2 pH对ACE 抑制率和肾素抑制率的影响
2.3.3酶解底物质量浓度对ACE抑制率和肾素抑制率的影响
在酶解温度为55 ℃、酶解pH值8.0、加酶量为5%时,酶解3 h,其底物质量浓度对桃仁分离蛋白酶解物的ACE抑制率和肾素抑制率的影响如图3所示.
由图3可知,在1%~5%的底物质量浓度范围内,ACE抑制率和肾素抑制率均先升高后下降.这是由于随着底物质量浓度的增大,大多数底物被酶解成无活性多肽,较少被酶解为有活性的小肽片段.因此继续增加底物质量浓度,已经对酶解过程影响较小.在底物质量浓度为2%时,ACE抑制率和肾素抑制率均达到最高,故选取底物质量浓度为2%.

图3 底物质量浓度对ACE抑制率和肾素抑制率的影响
2.3.4加酶量对ACE抑制率和肾素抑制率的影响
在底物质量浓度为2%、酶解温度为55 ℃、酶解pH8.0时,酶解3 h,其加酶量对桃仁分离蛋白酶解物的ACE抑制率和肾素抑制率的影响如图4所示.

图4 加酶量对ACE抑制率和肾素抑制率的影响
由图4可知,在加酶量为3%时,ACE抑制率和肾素抑制率均达到最高,之后随着加酶量的逐渐加大,ACE抑制率和肾素抑制率均显著下降.其原因可能是随着加酶量的增加,部分有活性的肽被降解为无活性的片段或者游离氨基酸[16].在4%~6%的加酶量范围内,ACE抑制率和肾素抑制率变化趋于平缓,因此选择响应面试验加酶量的较优水平为2%、3%、4%等.
2.4 响应面分析
根据单因素实验结果,选取3个主要的因素,即温度(X1)、pH值(X2)、加酶量(X3),选择底物质量浓度为2%,酶解时间3 h,进行碱性蛋白酶酶解桃仁分离蛋白的响应面试验设计及分析.其因素水平及试验结果见表3所示.
以ACE抑制率和肾素抑制率为响应值,各因素及其交互作用为自变量,采用Design Expert 8.0.6软件对表3的试验数据进行二次多项式回归拟合,得到了回归方程.
(1)ACE抑制率的拟合方程
ACE抑制率(%)=69.47-0.03X1+3.08X2+2.29X3-2.21X1X2+2.48X1X3-3.76X2X3-5.53X12-8.14X22-3.54X32
(2)肾素抑制率的拟合方程
肾素抑制率(%)=56.28+1.67X1-2.25X2+1.37X3+5.09X1X2+1.17X1X3+4.07X2X3-2.83X12-6.26X22-6.40X32
上式中:X1为温度编码值;X2为pH编码值;X3为加酶量编码值.
对回归方程做显著性检验与方差分析,其方差分析结果如表4所示.ACE抑制率中模型方程决定系数R12=0.942 4,肾素抑制率中模型方程决定系数R22=0.956 7,说明得到的模型拟合程度良好,试验误差小,该模型能够较好地描述试验结果.
通过对回归系数(F值)的检验可知,各因素对桃仁蛋白酶解物ACE抑制率的影响顺序为:X2(pH)>X3(加酶量)>X1(温度);对肾素抑制率的影响大小顺序为:X2(pH)>X1(温度)>X3(加酶量).另外失拟项的P值分别为0.680 9、0.595 2均大于0.05,这表明两模型的失拟项均不显著,说明这两个模型建立的回归方程能够预测碱性蛋白酶酶解桃仁分离蛋白制备肾素和ACE双重抑制肽的条件.
通过Design Expert 8.0.6软件分析,对回归方程进行求导,得到碱性蛋白酶酶解PKPI的最适酶解条件为:温度50.6 ℃、pH值8.02、加酶量3.06%.在此条件下,理论预测PKPI的碱性蛋白酶酶解物ACE抑制率为69.60%、肾素抑制率为56.29%.在此优化条件下,做验证性试验,得到酶解产物ACE抑制率为69.03%,肾素抑制率为57.61%,与软件得到的理论预测值接近.所以,在此优化条件下,可用碱性蛋白酶酶解PKPI得到桃仁分离蛋白碱性蛋白酶酶解物.

表4 回归模型方差及显著性分析
3结论
本实验分别采用多种蛋白酶酶解桃仁蛋白,通过比较桃仁蛋白酶解产物的ACE抑制率和肾素抑制率,确定了碱性蛋白酶为最适水解酶.在单因素实验的基础上,当底物质量浓度为2%时,采用响应面分析法,以ACE抑制率和肾素抑制率为指标,优化了碱性蛋白酶酶解桃仁蛋白制备肾素和ACE双重抑制肽的工艺条件.最优酶解工艺为:温度50.6 ℃、pH 8.02、加酶量3.06%.在此优化条件下,ACE抑制率为69.03%、肾素抑制率为57.61%.
参考文献
[1] 姜瞻梅,霍贵成.不同食物来源的ACE抑制肽的研究现状[J].食品研究与开发,2003,24(1):27-29.
[2] 王莉,徐怀德,贺学林,等.碱性蛋白酶酶解魔芋飞粉制备ACE抑制肽研究[J].中国食品学报,2010,10(1):43-46.
[3] Cherney D Z,Scholey J W,Jiang S,et al.The effect of direct renin inhibition alone and in combination with ACE inhibition on endothelial function,arterial stiffness,and renal function in type 1 diabetes[J].Diabetes Care,2012,35(11):2 324-2 330.
[4] 何荣.菜籽蛋白源肾素和ACE双重抑制肽的制备及其抑制机制研究[D].无锡:江南大学,2013.
[5] Li Liu,Jinao Duan,Yuping Tang,et al.Taoren-Honghua herb pair and its main components promoting blood circulation through influencing on hemorheology,plasma coagulation and platelet aggregation[J].Journal of Ethnopharmacology,2012,139(2):381-387.
[6] 江苏新医学院《中药大辞典》编写组.中药大辞典[M].上海:上海人民出版社,1977.
[7] 刘英,李雅杰,杨红,等.桃仁蛋白的单剂量及重复给药毒性试验[J].辽宁中医杂志,2008,35(7):1 076-1 077.
[8] 刘云,刘通讯.桃仁蛋白的提取及性质研究[J].现代食品科技,2010,26(8):860-863.
[9] 赵敏,周欢,姜钟丽,等.桃仁蛋白的提取及功能性质研究[J].农产品加工,2014(7):42- 44.
[10] 李静娟,易建华,朱振宝.响应面法优化桃仁蛋白提取工艺[J].中国油脂,2010,35(12):20-23.
[11] 朱振宝,周慧江,易建华,等.响应面法优化核桃ACE抑制肽的制备工艺研究[J].陕西科技大学学报(自然科学版),2012,30(5):67-72.
[12] 周慧江.核桃蛋白源ACE抑制剂肽的酶法制备及分离、纯化[D].西安:陕西科技大学,2013.
[13] 朱振宝.杏仁蛋白源ACE抑制肽制备及其降血压功能研究[D].西安:陕西师范大学,2010.
[14] Rong He,Sunday A.Malomo,et al.Purification and hypotensive activity of rapeseed protein-derived renin and angiotensin converting enzyme inhibitory peptides[J].Journal of Functional Foods,2013,5(2):781-789.
[15] 李建杰,荣瑞芬.碱性蛋白酶对核桃蛋白水解条件的优化研究[J].中国食品学报,2011,11(2):129-135.
[16] Guo Y X,Pan D D,Masaru T K.Optimisation of hydrolysis conditions for the production of the angiotensin-I-converting enzyme (ACE) inhibitory peptides from whey protein using response surface methodology[J].Food Chem,2009,114(1):328-333.
Study on enzymatic hydrolysis conditions for the preparation
of dual rennin and ACE inhibitory peptide from
peach kernel protein isolate
ZHU Zhen-bao, YANG Mei, YI Jian-hua, WANG Liu-xu
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:The preparation of dual rennin and angiotensin-I-converting enzyme (ACE) inhibitory peptides from peach kernel protein isolate with Alcalase 2.4 L was investigated.ACE inhibitory rate in vitro and renin inhibitory rate in vitro were investigated with respect to hydrolysis parameters including temperature,pH,substrate concentration and enzyme dosage.As a result, the optimum conditions for enzymatic preparation of dual rennin and ACE inhibitory peptides from peach kernel protein isolate were found to be hydrolysis at pH 8.02,temperature of 50.6 ℃ and enzyme dosage of 3.06%.Under these conditions,the prepared peptides showed an ACE inhibitory rate of 69.03%,renin inhibitory rate of 57.61%.
Key words:peach kernel protein isolate; rennin; ACE inhibitory peptide; response surface methodology
作者简介:朱振宝(1971-),男,陕西商洛人,副教授,博士,研究方向:功能性油脂与植物蛋白
基金项目:陕西省科技厅农业科技攻关计划项目(2014K01-10-04)
*收稿日期:2015-09-23
中图分类号:TQ936
文献标志码:A
*文章编号:1000-5811(2015)06-0116-05
