产α-半乳糖苷酶菌株的筛选、酶学特性和固定化研究
2015-02-19赵晴潇
赵晴潇,魏 群
(东北电力大学化学工程学院,吉林吉林132012)
α-半乳糖苷酶也称蜜二糖酶,属于外切糖苷酶类,加水可以分解蜜二糖[1]。α-半乳糖苷酶广泛存在于动物、植物和微生物中,不同来源的α-半乳糖苷酶其理化特性相差明显。以植物(咖啡、车前草、蚕豆、西瓜)取材的α-半乳糖苷酶研究得较多。在各种哺乳动物组织匀浆中也存在α-半乳糖苷酶,以人和鼠的甲状腺、肾脏和脾脏的酶活最高。微生物来源的α-半乳糖苷酶研究的也比较深入。特别是丝状真菌α-半乳糖苷酶由于其合适的pH、良好的稳定性、细胞外分泌和表达量较高的特点而成为研究的热点。但当前国内外学者对于不同来源α-半乳糖苷酶的研究发现,无论是从动植物、微生物或者采用其它技术手段获得的α-半乳糖苷酶均存在着如下两个问题:一是该酶的提取工艺复杂,耗费大量生产成本,为该酶在工业上大量应用的一个弊端;二是普遍酶活性不高,固定化后活力进一步下降,导致重复使用的困难,不能满足工业化生产中特殊要求[2-5]。本实验试图筛选一株具有高酶活的产α-半乳糖苷酶菌株并对其固定化研究,以求解决这一问题。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
泡菜汁(市售)、对硝基苯α-D-半乳糖苷和对硝基酚、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-α-Gal)、棉子糖。
1.1.2 主要仪器
离心机、恒温培养箱、摇床、数显恒温水浴锅、灭菌锅、紫外诱变箱、循环水多用真空泵。
1.1.3 培养基
初筛培养基:蛋白胨10 g、牛肉膏10 g、酵母提取物5 g、磷酸二氢钾2 g、柠檬酸二胺2 g、乙酸钠5 g、葡萄糖20 g、七水硫酸镁0.58 g、四水硫酸锰0.25 g、吐温800 mL,琼脂15 g,蒸馏水1 000 mL。1 mL X-α-Gal/L溶液(每800毫升添加50毫克指示剂)。
发酵培养基:初筛培养基中2%的葡萄糖用棉子糖取代。
1.2 分析方法
1.2.1 产α-半乳糖苷酶菌株的筛选
(1)初筛
在无菌条件下,用无菌双蒸水对泡菜汁进行逐级梯度稀释(10-1-10-7),吸取 10-5、10-6及 10-7三个梯度各100 μL溶液分别涂布在初筛固体培养基上,37℃下培养3-4 d,使菌落变成蓝色的菌落,挑取单菌落进行液体发酵。
(2)发酵
将初筛的菌种接种于发酵培养基中,用对硝基酚法测定酶活,筛选出酶活力最大的菌株作为目标菌株[5]。
(3)紫外线诱变
将制备好的菌悬液放置在紫外诱变箱中,利用15W紫外灯,照射距离25 cm,设置照射时间分别为0.5 min、1.0 min、1.5 min、2.0 min、2.5 min、3 min 6 个梯度处理。
(4)亚硝酸钠诱变
将制备好的菌悬液用亚硝酸钠及醋酸分别处理2 min、4 min、6 min、8 min、10 min,加入 pH 8.6的Na2HPO4溶液终止反应。以亚硝酸钠处理6 min的菌株A为实验菌种,在斜面上连续传代5代。
1.2.2 对硝基酚法测α-半乳糖苷酶酶活力
利用对硝基酚法测α-半乳糖苷酶酶活力[6]。
1.2.3 酶学性质研究
(1)α-半乳糖苷酶的最适pH
将α-半乳糖苷酶液在pH4.5-pH7.5下进行酶促反应以测定其最适pH值。以pNPG为底物,37℃下反应15 min测定酶活[7]。
(2)α-半乳糖苷酶的最适温度
将α-半乳糖苷酶液在35℃-65℃下进行酶促反应以测定其最适温度,以pNPG为底物,pH5.5反应15 min测定酶活。
(3)热稳定性
以pNPG为底物,pH5.5,温度分别为30℃、40℃、50℃、60℃、70℃、80℃的条件下保温1 h,测定保温后的残余酶活性[8]。
(4)金属离子对α-半乳糖苷酶活力的影响
用浓度为0.01 mol/l的金属离子Ca2+、K+、Fe3+、Cu2+、EDTA分别与酶液以1:1的比例进行混合,37℃保存1 h后,分别在最适条件下进行酶活的测定。以未处理的酶液的酶活为100%计。
1.2.4 α-半乳糖苷酶固定化
配制不同浓度(1%、2%、3%、4%、5%)的海藻酸钠,各取5 mL放于不同的烧杯中,各加入5 mL菌悬液,混匀静置30 min,用7号注射器吸取1 mL混合液逐滴滴入20 mL 2%的CaCl2溶液中,室温固定0.5 h。
2 结果与讨论
2.1 高产α-半乳糖苷酶菌株的筛选
2.1.1 菌种的定向筛选
吸取10-5、10-6及10-7三个梯度稀释的泡菜汁涂布于初筛固体培养基上,37℃下培养3-4 d后,菌落显示蓝色的有9株,进一步通过发酵培养后测定酶活。酶活力最强菌株酶活可达19.7 U/mL,本研究以此菌株作为出发菌株。此菌株在固体培养基上生长48 h后,形成乳白色圆形菌落,且表面光滑、边缘整齐、无褶皱、呈短杆状、直径约1 mm、革兰氏染色阳性。
2.1.2 紫外诱变选育
将制备好的菌悬液放置在紫外诱变箱中,诱变 0.5 min、1.0 min、1.5 min、2.0 min、2.5 min、3 min,紫外诱变对致死率的影响结果如表1所示。根据菌种诱变致死率与基因突变率的一般规律,致死率在80%时的正突变率较高,确定照射时间为2.0 min为最佳处理时间。将照射时间为2.0 min的菌株进行发酵培养,取发酵培养液测酶活,结果显示酶活达28.6 U/mL,酶活提高45%。

表1 紫外线诱变处理结果
2.1.3 亚硝酸钠诱变
将制备好的菌悬液用亚硝酸钠与醋酸的混合液分别处理2 min、4 min、6 min、8 min、10 min,加入pH 8.6的Na2HPO4溶液终止反应。处理时间对致死率的影响结果如表2所示。根据菌种诱变致死率与基因突变的一般规律,致死率在80%时的正突变率较高,确定处理时间为6 min为最佳处理时间,酶活达36.9 U/mL酶活相比出发菌株提高87%。

表2 亚硝酸钠诱变处理结果
2.1.4 传代性能
传代后测定酶活力结果如表3所示,经多次传代,该菌株产α-半乳糖苷酶活性没有多大变化,均保持在95%左右。表明该突变菌株具有较好的遗传稳定性,可作为工业化大生产的种子使用。

表3 传代稳定性
2.2 α-半乳糖苷酶酶学性质研究
2.2.1 α-半乳糖苷酶的最适pH和温度
以pNPG为底物,反应温度37℃,pH为4.5-7.5,设pH间隔为0.5的不同pH缓冲液,反应时间15 min,测定酶活。所测得的最高酶活为基准酶活100%,其余数据折算,以比较不同的pH缓冲液对相同酶液的酶活影响。结果如图1所示,菌株液体发酵产生的α-半乳糖苷酶在pH5.5左右表现出较高的酶活力。说明该酶最适pH偏酸,适合应用于酸性环境下的工业化生产。
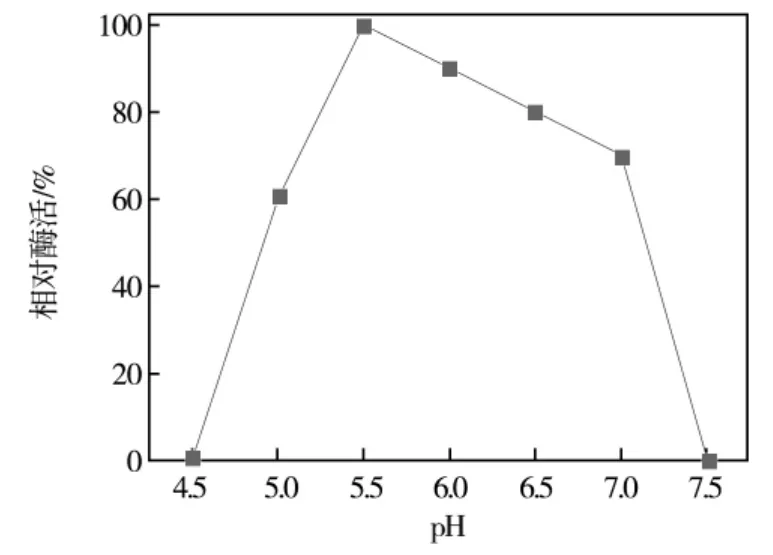
图1 pH对α-半乳糖苷酶活力的影响
以pNPG为底物,反应pH5.5,35℃-65℃,设间隔温度5℃,反应时间15 min,测定酶活。所测得的最高酶活为基准酶活100%,其余数据折算,以比较不同的温度对相同酶液的酶活影响。结果如图2所示,酶活力随温度升高而增大,测得最适反应温度,超过此温度,酶活力便急剧下降。菌株所产α-半乳糖苷酶的最适作用温度为50℃,当温度超过50℃酶活力下降较快。
2.2.2 α-半乳糖苷酶的热稳定性
以pNPG为底物,pH5.5,温度分别为30℃、40℃、50℃、60℃、70℃、80℃的条件下保温1 h,测定保温后的残余酶活性,结果如图3所示。酶活力在30℃、40℃和50℃时都比较稳定,保持为90%以上;在60℃时酶活力保留在35%左右,70℃时酶活仅保留了约5%;而80℃保温1.0 h酶活就已降到0%,完全失活。说明α-半乳糖苷酶在50度以下比较稳定,50℃以上酶活逐渐丧失,实际应用中应尽量将其存放在50℃以下环境,保证其最大酶活力的发挥。
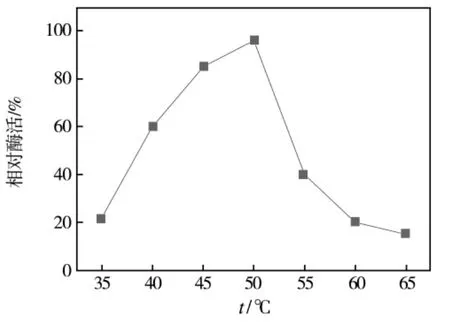
图2 温度对α-半乳糖苷酶活力的影响
2.3 α-半乳糖苷酶的固定化初步探索
将1%-6%海藻酸钠溶液与酶液按1∶1比例混合,吸入注射器内,再逐滴滴入2%氯化钙和卡拉胶混合溶液中,即成规则球形,0.5 h后,测定酶的活力。结果如图4所示,海藻酸钠固定化后,酶活有不同程度损失,海藻酸钠浓度为4%时酶活力较高,可以保持在70%左右[9]。因此可用4%海藻酸钠固定α-半乳糖苷酶。

图3 α-半乳糖苷酶的热稳定性图

图4 海藻酸钠浓度对固定化酶酶活的影响
3 结 论
本实验以泡菜汁为原料筛选产α-半乳糖苷酶菌株,通过X-α-Gal平板显色初筛,获得9株产α-半乳糖苷酶的菌株。其中酶活力最强菌株酶活达19.7 U/mL。以该菌株为出发菌株,分别通过紫外线诱变和亚硝酸钠诱变处理,使诱变菌株酶活达到36.9 U/mL。对高酶活菌株进行5次传代培养,诱变后的菌株的高酶活性能未发生很大变化,表明其具有良好的遗传稳定型。接着研究了复筛得到的α-半乳糖苷酶酶学性质,此酶的最适反应温度为50℃,最适pH为5.5。初步探索该酶的固定化结果表明海藻酸钠固定化α-半乳糖苷酶的最佳浓度条件为:以4%的海藻酸钠与稀释酶液1∶1(V∶V)混合时固定化酶的酶活较高。一种固定化酶能否应用于工业生产,关键在于固定化方法要简单易行、固定化后酶的活性要高、操作半衰期要长、固定化费用要低。本试验用海藻酸钠固定化α-半乳糖苷酶的方法虽然简单易行、固定化费用较低、所得固定化酶的酶活较高,但机械强度较差。凝胶强度不够而导致易破碎溶解且海藻酸钙凝胶不耐热,高温下加速溶解,因此仍有待进一步研究。成品化的α-半乳糖苷酶有望于解决特殊人群对豆类食品的消化障碍,提高豆粕在饲料中的利用率,提高蔗糖的析出率,增加包埋药物的稳定性,延长药效[10-13]。
[1]郝桂娟,张凯,王学智.α-半乳糖苷酶的研究进展[J].中国畜牧兽医,2013,23(3):223-225.
[2]边连全,白东伟,刘显军.α-半乳糖苷酶和木聚糖酶在断奶仔猪日粮中的应用效果评价[J].动物营养学报,2010,21(2):66-69.
[3]辛永平,孔文涛,陆文伟,等.K1α-半乳糖苷酶酶学性质[J].山东大学学报:理学版,2015,50(1):50-55.
[4]朱振元,刘晓翠,郭蓉,等.蛹虫草多糖对α-葡萄糖苷酶活性的抑制研究[J].现代食品科技,2014,30(12):55-60.
[5]许尧兴,许少春,姚晓红,等.α-半乳糖苷酶产酶菌种的定向筛选及诱变选育[J].浙江农业学报,2006,18(5):362-264.
[6]许尧兴,李艳丽.黑曲霉变种α-半乳糖苷酶的分离纯化及其酶学性质研究[J].浙江大学学报:农业与生命科学版,2009,352:147-152.
[7]崔爱萍,迟乃玉,张庆芳.海洋低温β-半乳糖苷酶菌株筛选、鉴定及酶的分离纯化[J].食品与发酵工业.2013,39(2):92-96.
[8]董岩岩,张燕婕,黄遵锡.产α-半乳糖苷酶菌株的筛选、鉴定及其酶学特性的研究[J].饲料工业,2011,32(14):22-25.
[9]乔楠,郭威,于大禹.固定化基因工程菌应用于水环境污染治理的研究进展[J].东北电力大学学报,2010,30(2):18-21.
[10]Patil A,Praveen K,Mulimani V,et al.alpha-galactosidase from bacillus megaterium VHM1 and its application in removal of flatulence-causing factors from soymilk[J].Microbiol Biotechnol.2010,20(5):1546-1554.
[11]Yafeng Z,Gang S,Xiao-Tong Z,et al.Identification of an intestine-specific promoter and inducible expression of bacterial alpha-galactosidase in mammalian cells by a lac operon system[J].J Anim Sci Biotechnol,2012,3(1)32:245-248.
[12]张兰河,韩猛,郑梅花,等.Cu2+对SBR运行效果的影响[J].东北电力大学学报,2014,34(6):30-33.
[13]杨日光,张兰河,刘强,等.废水生物处理工艺短程硝化影响因素探讨[J].东北电力大学学报,2012,32(1):62-64.
