稳定小鼠缓慢颅内加压法脑死亡模型的建立
2015-02-19李崇辉肖年军李文杰梁雨荣葛新兰
石 雍,李崇辉,肖年军,李文杰,梁雨荣,潘 可,葛新兰
中国人民解放军总医院肝胆外科 全军肝胆外科研究所,北京 100853
稳定小鼠缓慢颅内加压法脑死亡模型的建立
石雍,李崇辉,肖年军,李文杰,梁雨荣,潘可,葛新兰
中国人民解放军总医院肝胆外科全军肝胆外科研究所,北京 100853
摘要:目的建立稳定的改良小鼠脑死亡模型,分享脑死亡建模和维护经验。方法C57BL/6小鼠随机数字表法分为脑死亡组(n=25)和假手术组(n=10),颅内插入2F Fogarty球囊导管并应用缓慢持续颅内加压法建立小鼠脑死亡模型,经口腔气管插管机械通气和颈静脉补液维持脑死亡状态,颈动脉插管监测心率和平均动脉压,假手术组插入球囊导管但不加压,光镜下观察供肝组织学改变(HE染色)。结果颅内加压20 min后成功诱导小鼠脑死亡,对应的球囊内平均液体量为(105.77±21.57)μl。濒临脑死亡期间平均动脉压和心率迅速升高达峰值后逐渐降低,峰值分别为(128.28±17.16)mmHg(1 mmHg=0.133 kPa)和(434.16±55.75)次/min,均显著高于对应点的假手术对照组(均P=0.000)。在4 h的观察期内,72%(18/25)的小鼠平均动脉压和心率维持血流动力学稳定,麻醉和手术过程中未发生死亡事件。脑死亡小鼠供肝呈轻度的局部缺血性损伤(水肿、淤血、炎症浸润),假手术对照组小鼠供肝缺血性损伤程度较脑死亡组轻。结论本研究建模技术降低了手术难度和手术并发症,小鼠脑死亡模型稳定、可靠、具有可重复性。
关键词:脑死亡;小鼠;动物模型;肝移植;血流动力学
ActaAcadMedSin,2015,37(2):195-200
脑死亡器官捐献(donors of brain death,DBD)已成为当前我国肝脏移植的重要供体来源。然而,与活体肝移植相比,DBD的供肝质量下降,肝移植术后原发性移植物无功能和急、慢性排斥反应等并发症的发生率明显升高[1- 2]。因此,建立一个稳定、合适的脑死亡动物模型,对研究脑死亡(brain death,BD)和DBD具有重要的意义。自上世纪80年代初起,学者们先后建立了狒狒[3]、猪[4]、家兔[5- 6]、大鼠[7- 8]等动物的BD模型。但由于缺乏基因敲除和转基因模型,以往以这些动物为载体的BD相关研究存在不同程度的局限性,使得目前对于促使BD供体器官质量下降机制的认识多是描述性的。2009年,Atkinson等[9]率先建立了小鼠BD模型,意味着可以利用成熟的小鼠基因敲除和转基因技术以及丰富的小鼠特异性试剂[10],从分子层面探寻导致BD供体器官损伤及影响DBD器官移植效果的确切因素和机制。本研究借鉴国外BD模型的建模经验,采用缓慢持续颅内加压法,在国内建立更加稳定的小鼠BD模型,并改进了某些技术环节。
材料和方法
实验动物及分组8~12周SPF级雄性C57BL/6小鼠35只,20~28 g,由军事医学科学院实验动物中心提供[许可证号:SCXK-(军)2012- 0004]。饲养于昼夜比值为12 h/12 h、温度为20~25 ℃、湿度为50~70%的标准啮齿动物饲养房内,自由进食、水。利用数字表法将小鼠随机分为脑死亡组(n=25)和假手术对照组(n=10)。
BD诱导前准备术前不禁饮食,5%异氟醚与0.4~0.6 L/min纯氧混合吸入诱导麻醉。麻醉成功后,20G套管针经口腔气管内插管,连接小动物呼吸机(ALC-V8S型,上海奥尔科特生物科技有限公司)进行机械通气(潮气量0.4~0.5 ml,呼吸频率125次/min,吸呼比值1∶2.5),1.5~2.0%异氟醚维持麻醉。仰卧位将小鼠固定于电热毯上,经肛门插入动物恒温系统(ALC-HTP型,上海奥尔科特生物科技有限公司)的温度探头,维持直肠温度36.5~37.0℃。颈前正中纵行切口1.0~1.5 cm,游离气管,4- 0尼龙线固定套管针;手术显微镜(GX.SS.22- 3型,上海医光仪器有限公司)下游离右侧颈总动脉和颈外静脉,行动脉、静脉置管术,分别插入PE- 10导管并用8- 0高分子线固定。动脉导管连接TSD- 104A压力传感器,通过多通道生物信息采集与分析系统(MP150;BIOPAC Systems 公司,美国)全程监测平均动脉压和心率;静脉导管连接微量输液泵(北京思路高医疗科技有限公司),以备用于血容量复苏。俯卧位固定小鼠,头顶正中线纵行开口1.5 cm,分离皮下组织、肌肉和骨膜,用电动钻在右侧额骨、顶骨各开一个孔(直径约0.5 mm),将脑电图模块(electroencephalogram,EEG)正、负线经此二孔插入硬膜外并用牙托粉固定,EEG地线插入颈背部皮下;矢状缝左侧外4 mm顶骨区域斜向后45°钻直径为1 mm的孔,将连接微量注射泵(KD scientific 公司,美国)的2F Fogarty球囊导管(爱德华生命科技有限公司,美国)经该孔插入颅内并缝合头皮。
BD诱导血压稳定后打开微量注射泵,以6 μl/min的速度向颅内球囊导管注射生理盐水,球囊膨胀压缩脑干,形成脑疝,造成脑干不可逆性损伤。自主呼吸停止时停止加压,撤掉麻醉,进行脑死亡诊断。参考2013版《脑死亡判断标准与技术规范(成人质控版)》[11],拟定诊断指标如下:无自主呼吸(断开呼吸机30 s内未观察到胸、腹部呼吸运动);瞳孔极度扩大并固定;角膜反射和瞳孔对光反射消失;EEG呈电静息;针刺小鼠头面部,小鼠无反应(撤掉麻醉10~15 min后进行该检测)。BD后保持球囊扩张状态。假手术对照组行颅内球囊导管置入术但不加压,其余操作同脑死亡组,全程异氟醚维持麻醉。
血流动力学维护观察期间,仅通过颈外静脉补液(10%羟乙基淀粉)维持血流动力学稳定,不使用正性肌力药物或血管活性药物。根据平均动脉压(mean blood pressure,MAP)水平变化,将补液速度控制在0.2~0.6 ml/h,维持MAP在50 mmHg(1 mmHg= 0.133 kPa)以上。如MAP<50 mmHg超过10 min仍无法纠正,则将小鼠剔除。
肝脏组织学检测实验结束时,取出肝脏并用10%甲醛固定。石蜡包埋,4 μm切片,HE染色后在光镜下观察肝脏组织形态学改变。
观察指标记录平均动脉压、心率及EEG变化。
统计学处理采用SPSS 19.0统计软件分析,计量资料用均数±标准差表示,t检验比较两组间的差异,P<0.05为差异具有统计学意义。
结果
手术时间及成功率共建立小鼠BD模型25例。平均手术时间为(60±10)min,其中颈动、静脉插管所需时间为(20±7)min,BD诱导时间为(20±2.4)min,成功诱导脑死亡所需的液体量为(105.77±21.57)μl。手术过程中未发生麻醉、插管意外及由其所致的死亡事件。但在脑死亡后4 h的观察期内有7例BD小鼠突发循环衰竭,加快补液速度后仍未好转,结果脑死亡组小鼠维持脑死亡状态4 h的成功率为72%(18/25)(图1)。

图 1脑死亡小鼠“心脏存活率”变化
Fig 1“Cardiac survival” of brain death mice
脑电活动及反射状态由于处于深麻醉状态,颅内加压前小鼠的EEG以高振幅δ波为主(图2A);加压后EEG示δ波幅降低、θ波出现,快波插入增多(图2B);BD后脑电静息,EEG呈等电位(图2C)。BD前,角膜反射和瞳孔对光反射可测;角膜反射消失、自主呼吸停止,提示BD诱导成功。在所有BD模型中,脑电静息总是伴随着自主呼吸停止、角膜与瞳孔对光反射消失及瞳孔极度放大等BD临床征象出现。
MAP球囊导管置入后颅内加压早期,脑死亡组平均MAP为(78.50±7.38)mmHg,与假手术对照组平均MAP(76.53±6.22)mmHg比较差异无统计学意义(P=0.482);加压过程中可见MAP呈波动上升趋势,颅内加压后(19±2)min MAP急剧升高,(20±2.4)min时达到峰值(128.28±17.16)mmHg,随后MAP迅速下降并维持在低水平状态。脑死亡组血压维持所需补液量为(1.8±0.5)ml,明显多于假手术对照组(1.2±0.3)ml(P=0.03)。虽然补充血容量,但在观察后期MAP仍然逐渐下降,可能与心脏功能下降等有关(图3)。
心率颅内加压初期,脑死亡组小鼠心率(heart rate,HR)因麻醉作用而处于低水平状态,与同时间点假手术对照组小鼠比较差异无统计学意义[(290.04±40.54)次/min比(302.62±39.92)次/min,P=0.436];颅内加压过程中可见HR突然加快并于3 min内达峰值(434.16±55.75)次/min,与假手术对照组比较差异有统计学意义(P=0.000)。HR加快的同时伴随MAP急剧升高(Cushing 反射);BD后HR虽约有下降但仍维持在较高水平;假手术对照组小鼠HR在30 min内逐渐升高至正常水平(图4)。
肝脏组织学变化光镜下观察,4 h的脑死亡组小鼠肝脏呈轻度水肿和淤血,其中个别小鼠肝脏存在少量中性粒细胞浸润(图5A);而同时期假手术对照组小鼠缺血性损伤程度低于脑死亡组,未观察到炎症细胞浸润(图5B)。
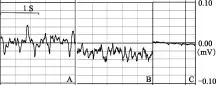
A.颅内加压前;B.颅内加压期间;C.脑死亡后
A.before the increase of intracranial pressure;B.during the increase of intracranial pressure increase;C.after brain death
图 2脑死亡过程中脑电图变化
Fig 2Electroencephalographic change in the course of brain death

1 mmHg=0.133 kPa;BD:脑死亡组;Sham:假手术对照组;0 min表示脑死亡诊断时间点;与假手术对照组比较,aP<0.05
BD:brain death group;Sham:sham control group;Time point of 0 min reflects diagnosis of brain death;aP<0.05 compared with sham control group
图 3脑死亡组和假手术对照组的平均动脉压变化
Fig 3Change of mean arterial pressure in brain death group and sham control group

BD:脑死亡组;Sham:假手术对照组;0 min表示脑死亡诊断时间点;与假手术组对应时间点比较,aP<0.05,bP<0.01
BD:brain death group;Sham:sham control group;Time point of 0 min reflects diagnosis of brain death;aP<0.05,bP<0.01 compared with sham-operated control group
图 4脑死亡组与假手术对照组小鼠的心率随时间变化过程
Fig 4Time course of heart rate in group brain death compared with sham-operated control group
讨论
本研究主要介绍了一个用于研究DBD移植相关的小鼠BD模型。虽然猪、狒狒、家兔、大鼠等[3- 8]动物BD模型已经相当成熟,且以这些动物为基础的相关研究已表明BD因素不仅能够改变供体器官质量,而且影响移植后的移植器官功能和生存,但受限于基因敲除或转基因技术在这些动物中的应用不成熟,BD对移植的影响机制尚未阐述清楚。而小鼠在分子机制研究中具有诸多优势,如转基因或基因敲除小鼠的应用,因此是各领域研究不可或缺的实验动物。本研究建立的小鼠BD模型,可为DBD肝、心脏等器官移植相关研究提供合适的模型保障。
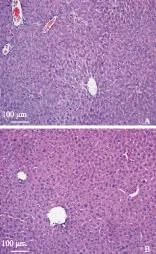
图 5脑死亡组(A)和 假手术组(B)小鼠肝脏组织的HE染色(×200)
Fig 5HE staining of hepatic tissues in brain death(A)and sham control group(B)mice(×200)
经典的BD动物模型诱导方法包括缓慢和爆发式球囊加压法。在众多BD动物模型中已经证实,缓慢球囊加压法BD模型的循环稳定时间均优于爆发式球囊颅内加压法[8,12- 13]。所以本研究选择前者作为BD诱导方法。本研究BD诱导过程中均可见MAP突然急剧升高、HR加快,同时伴随呼吸幅度加深、频率减慢为特点的典型的Cushing反射,该结果与文献报道一致[9,12- 14]。Cushing反射是颅内压急剧升高的代偿性表现,是BD诱导成功的征兆。MAP达到峰值后下降,在1 min内出现自主呼吸停止,角膜反射消失,瞳孔极度散大并固定,提示BD诱导成功。EEG呈等电位是确认BD的重要参考指标[11]。本研究显示角膜反射消失、自主呼吸停止等临床表现出现后,EEG最终呈等电位。提示小鼠BD模型中,在排除麻醉干扰的情况下,仅根据深昏迷、自主呼吸停止、角膜反射消失等临床指标判断BD,其诊断结果也是可靠的。在4 h内的观察期内,72%的BD小鼠未发生循环衰竭,表明本研究小鼠BD模型是稳定、可重复性的。
深昏迷是BD判断的必备指标,但麻醉药残留会干扰该指标判断的及时性与准确性。因此,小动物BD模型最好选用短效麻醉药。目前国际上常用麻药是氯胺酮/噻拉嗪腹和异氟醚,但在我国,氯胺酮已经停产。虽然国内有采用乙醚麻醉[15],但本研究前期预实验显示,乙醚麻醉小鼠的气道梗阻、麻醉过深等并发症和死亡事件发生率高,所以并不适合于小鼠麻醉。而异氟烷作为国际惯用麻醉药,具有并发症少、死亡率低、对动物生理指标干扰小等优点,是理想的麻醉方法。结果表明,1.5%~2.0%异氟醚麻醉,麻醉深度适当,血压等指标稳定,未发生麻醉因素引起的并发症及死亡事件。
本研究改进了建模的某些技术环节,使BD模型更加简易和合理。首先,采用经口腔气管插管进行机械通气,将20G套管针进行加工,使插管后小鼠门齿刚好卡在套管针的凹槽内,起到牢固固定的作用,同时经颈部气管外用5- 0尼龙线进一步固定套管针。以往BD模型均采用气管切开插管进行机械通气。与之相比,该插管方式无需气管切开,降低了气管损伤;避免了手术过程中麻醉中断引起的动物苏醒;可以更完整的缝合颈部皮肤,减少颈部液体丢失;经口腔气管插管还有便于小鼠头、颈部手术过程中体位的变换。其次,采用经颈静脉插管,通过微量输液泵控制补液速度,输注10%羟乙基淀粉进行容量复苏。在小鼠BD模型中,Wauters等[13]选择经尾静脉补液,Floerchinger等[14]则直接经颈总动脉补液。然而,BD状态下小鼠需要多次、大量补液才能维持血循环稳定,尾静脉穿刺注射不能保证补液的及时性及成功率,还可能造成鼠尾组织水肿,增加不必要损伤;而颈动脉注射使心脏前负荷骤增,对心脏功能造成潜在危害。本研究的补液方式避免上述两种补液途径存在的问题,同时微量输液泵能够确保根据MAP水平适时调整补液速度以达到最理想的结果。而经颈静脉插管操作简单,并不明显增加总体手术时间。最后,采用通过微量输液泵以6 μl/min的速度持续缓慢地向球囊导管注射生理盐水进行颅内加压,与间断颅内加压法(20 μl/5 min)[12- 13]相比,更好地复制了临床BD的过程,而BD后MAP和HR 也较稳定。
本研究BD模型尚可保证72%的小鼠维持4 h的血循环稳定,维持时间比Atkinson等[9]报道的3 h维持期延长了1 h,但所有小鼠BD状态的极限维持时间均未达到6 h。推测原因可能为大量补液、机械通气所致的心、肺进行性损伤及脑死亡后内分泌激素耗竭等因素所致。其中性能较差的呼吸机所引起的机械通气肺损伤加重,可能是本模型BD状态维持时间不如Wauters等[13]报道的BD模型的重要原因。然而研究表明,BD小鼠3 h内组织、循环炎症因子表达就已经明显上调[13- 14],而6和3 h的表达水平差异无统计学意义[13];本研究BD后4 h的肝脏组织学已有组织水肿、淤血等改变,个别组织有局部炎症细胞浸润,该结果与Simas等[16]在BD大鼠肝脏中的表现一致,表明BD早期就有分子水平和组织学水平的改变。所以本研究模型能够满足BD相关研究的实验需要,而提高呼吸机性能、进一步优化外科技术和补液方案等措施可能会使BD状态下的维持时间延长。
综上,本研究应用更加简便、优化的外科技术成功建立了稳定、可重复性的小鼠BD模型,本研究小鼠BD模型能够应用转基因或基因敲除小鼠深入开展BD相关研究。
参考文献
[1]Floerchinger B,Oberhuber R,Tullius SG.Effects of brain death on organ quality and transplant outcome[J].Transplant Rev(Orlando),2012,26(2):54- 59.
[2]Dziodzio T,Biebl M,Pratschke J.Impact of brain death on ischemia/reperfusion injury in liver transplantation[J].Curr Opin Organ Transplant,2014,19(2):108- 114.
[3]Novitzky D,Wicomb WN,Cooper DK,et al. Electrocardiographic,hemodynamic and endocrine changes occurring during experimental brain death in the Chacma baboon[J].J Heart Transplant,1984,3(4):63- 69.
[4]Mertes PM,El AK,Jaboin Y,et al.Changes in hemodynamic and metabolic parameters following induced brain death in the pig[J].Transplantation,1994,58(4):414- 418.
[5]Biswas SS,Chen EP,Bittner HB,et al. Brain death further promotes ischemic reperfusion injury of the rabbit myocardium[J].Ann Thorac Surg,1996,62(6):1808- 1815.
[6]Imai K,Sato K,Ito Y,et al. Hormonokinetics and histopathological evaluation of rabbit brain death model[J].Transplant Proc,1996,28(3):1273- 1274.
[7]Takada M,Nadeau KC,Hancock WW,et al. Effects of explosive brain death on cytokine activation of peripheral organs in the rat[J].Transplantation,1998,65(12):1533- 1542.
[8]Pratschke J,Wilhelm MJ,Kusaka M,et al. A model of gradual onset brain death for transplant-associated studies in rats[J].Transplantation,2000,69(3):427- 430.
[9]Atkinson C,Varela JC,Tomlinson S.Complement-dependent inflammation and injury in a murine model of brain dead donor hearts[J].Circ Res,2009,105(11):1094- 1101.
[10]Kamal RP,Katz JM,York IA.Molecular determinants of influenza virus pathogenesis in mice[J].Curr Top Microbiol Immunol,2014,385(3):243- 274.
[11]国家卫生和计划生育委员会脑损伤质控评价中心.脑死亡判定标准与技术规范(成人质控版)[J].中华神经科杂志,2013,46(9):637- 640.
[12]Pomper G,Trescher K,Santer D,et al. Introducing a mouse model of brain death[J].J Neurosci Methods,2010,192(1):70- 74.
[13]Wauters S,Somers J,De Vleeschauwer S,et al. Evaluating lung injury at increasing time intervals in a murine brain death model[J].J Surg Res,2013,183(1):419- 426.
[14]Floerchinger B,Yuan X,Jurisch A,et al. Inflammatory immune responses in a reproducible mouse brain death model[J].Transpl Immunol,2012,27(1):25- 29.
[15]陆海盛,马毅,朱晓峰.改良大鼠渐进性脑死亡模型的制作[J].中华实验外科杂志,2010,27(9):1341- 1343.
[16]Simas R,Kogiso DH,Correia CJ,et al. Influence of brain death and associated trauma on solid organ histological characteristics[J].Acta Cir Bras,2012,27(7):465- 470.
DOI:10.3881/j.issn.1000- 503X.2015.02.010
Establishment of A Stable Mouse Model of Brain Death by the Method of the Gradually Increasing Intracranial Pressure
SHI Yong,LI Chong-hui,XIAO Nian-jun,LI Wen-jie,LIANG Yu-rong,PAN Ke,GE Xin-lan
Department of Hepatobiliary Surgery & Hepatobiliary Surgical Institute,Chinese PLA General Hospital,Beijing 100853,China
Corresponding author:LIANG Yu-rongTel:010- 66938233,E-mail:yurongliang@hotmail.com
ABSTRACT:ObjectiveTo establish a stable and modified mouse model of brain death(BD)and to share our experiences in BD induction and maintenance.MethodsTotally 35 C57BL/6 male mice were randomized into BD group(n=25)or sham control group(n=10).BD was induced by inserting a 2F Fogarty catheter connected to a syringe pump after trepanation of the left frontoparietal area and injecting volume at the speed of 6 μl/min until spontaneous respiration ceased.BD was diagnosed by electroencephalogram,apnea testing,as well as testing of brain stem reflexes.Mechanical ventilation was performed by orotracheal intubation.Right carotid artery was intubated by a PE- 10 cannula for the continuous monitoring of mean blood pressure(MAP)and heart rate(HR).The right external jugular vein was catheterized for volume resuscitation.The sham control group underwent the same procedure with catheter insertion but without balloon inflation.Livers were removed and fixed in paraffin to evaluate the histological alterations with the light microscopy.ResultsMouse models of BD were successfully established about 20 minutes after balloon inflation,and the mean balloon volume at the time of BD was(105.77±21.57)μl.The MAP and HR rapidly increased on occurrence of BD and the peak value was(128.28±17.16)mmHg and(434.16±55.75)beat/min,respectively,which were significant higher than those in the sham control group at the same time point(P=0.000).During the 4-hour follow-up time,MAP and HR in 72%(18/25)of BD animals remained haemodynamically stable.No animal died due to anesthesia and surgical operation.Hepatic tissues in BD mice showed mild focal ischemic damages(cellular edema,congestion,and inflammatory infiltration),which were slighter and fewer in sham control group.ConclusionThe mouse model of BD was successfully established with lower surgical difficulty and can be performed in a standardized,reproducible and successful way.
Key words:brain death;mice;animal model;liver transplantation;hemodynamics
(收稿日期:2014- 09- 22)
中图分类号:R33-33
文献标志码:A
文章编号:1000- 503X(2015)02- 0195- 06
通信作者:梁雨荣电话:010- 66938233,电子邮件:yurongliang@hotmail.com
基金项目:国家自然科学基金(30740093)和吴阶平医学基金(320.6750.11010)Supported by the National Natural Sciences Foundation of China(30740093)and Wu Jieping Medical Foundation(320.6750.11010)
·论著·
