新型“D-π-A”香豆素荧光染料的合成及光谱性能
2015-02-19魏梦怡崔艳红高建荣
韩 亮,康 蕊,张 敏,魏梦怡,崔艳红,高建荣
(浙江工业大学 化学工程学院,浙江 杭州 310014)
新型“D-π-A”香豆素荧光染料的合成及光谱性能
韩亮,康蕊,张敏,魏梦怡,崔艳红,高建荣
(浙江工业大学 化学工程学院,浙江 杭州 310014)
摘要:以刚性环取代的香豆素为电子给体,噻吩为桥键,丙二酸为电子受体,设计合成了新型“D-π-A”类香豆素荧光染料,对其紫外光谱和荧光光谱性能进行了测试.与传统荧光染料7-二乙氨基-3-苯并噁唑香豆素荧光染料比较,该新型香豆素荧光染料具有更刚性的香豆素电子给体、吸电子能力更强的丙二酸电子受体和相对较大的共轭体系,其紫外吸收波长以及荧光发射波长均红移,Stokes位移增大.同时采用了密度泛函理论和含时密度泛函理论对分子的基态和激发态进行了计算,并从分子构型以及分子轨道能级方面对其光谱性能的改进进行了分析.
关键词:香豆素;荧光染料;吸收光谱;发射光谱;理论计算
Synthesis and spectral property of new “D-π-A” coumarin fluorescent dye
HAN Liang, KANG Rui, ZHANG Min, WEI Mengyi, CUI Yanhong, GAO Jianrong
(College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:A New “D-π-A” coumarinfluoresecent dye was prepared with rigid cycle substituted coumarin as the electron donor, thiophene as π-bridge, and malonic acid as the electron acceptor. Its absorption and emission spectra were evaluated. Compared with traditional coumarin fluorescent dye 7-diethylamino-3-benzoxazole-coumarin, this new coumarin fluorescent dye has the coumarin electron donor with improved rigidity, the malonic acid electron acceptor with stronger electron-withdrawing ability and expanded conjugation system, which lead to its red-shifted absorption and emission spectra and large Stokes shift. Moreover, the ground state and excited state of this new coumarin fluorescent dye were calculated with density functional theory (DFT) and time-dependent density functional theory (TD-DFT). The improvement of spectra properties was analyzed through the molecular configuration and orbital energy level.
Keywords:coumarin; fluorescent dye; absorption spectrum; emission spectrum; theoretical calculation
进入20世纪,纺织工业的快速发展,一些综合性能更好的染料品种不断开发出来,并且增加了还原染料、活性染料、分散染料等高档染料系列[1-4].有机荧光色素用途广泛,近几年多应用于荧光探针并使其拥有广阔的应用前景[5-8].香豆素化合物是一类典型的具有共轭结构的分子内电荷转移化合物,是目前荧光材料中研究最为广泛和活跃的一类,广泛应用于香料、化妆品及其有关行业[9-13].香豆素母环本身没有荧光,其荧光的有无及强弱与环上取代基的种类和位置有关.通常,在香豆素母环7位引入供电子基团,3位引入吸电子基团,可以使整个分子形成标准的电子“供体-受体”共轭模式,于是相应的稠杂环香豆素衍生物就变成带有强烈荧光的功能染料,并以其较好的荧光性能引起广泛关注.该类荧光色素的典型代表是7-二烷氨基-3-杂环取代的香豆素衍生物,此衍生物是性能优良的艳绿光黄色溶剂染料,可用于聚酯纤维,有较好的光牢度及快速染色等性能[14].
二烷氨基是良好的供电子基团,广泛应用于香豆素染料中.但此类二烷氨基取代的香豆素衍生物易发生光降解反应,导致分子结构被破坏、荧光减弱.因此,于香豆素母环上引入含氮的刚性环结构,并于刚性环上引入4个甲基进行改造.环化增强了C—N键的强度,自由活动的甲基则可抑制氮上α位碳原子的光氧化,所以此类甲基化含氮刚性杂环的香豆素类化合物具有较好的抗光降解和抗氧化作用,荧光效率也进一步增强[15].我们选择含氮刚性杂环取代的香豆素作为母体,丙二酸作为吸电子基团,并在两者之间引入噻吩环连接,增大共轭系统,设计合成了目标化合物.
1实验
1.1仪器与试剂
溴代异戊烯、间氨基苯酚、丙二酸、噻吩乙腈及其他常用试剂均为化学纯试剂;化合物CM为自己合成.Shimadzu UV-2550紫外-可见光谱仪;核磁共振仪为BrukerAvance Ⅲ 500 MHz型;X-4数字显示显微熔点测定仪;Agilent 6210 Series Time-of-Flight质谱仪(ESI/APCI);日本岛津RF-5301PC荧光分光光度计;Thermo Finnigan LCQ Series.
1.2合成
1.2.1N,N-二(3-甲基-2-丁烯)-3-羟基苯胺氢溴酸盐Ⅰ的合成
间氨基苯酚(21.83 g,200 mmol)和CaCO3(10.06 g,100 mmol)溶于DMF(70 mL),搅拌升温至65 ℃,缓缓滴加溴代异戊烯(46 mL,400 mmol),加完后,升温至80 ℃进行反应.反应1 h后,冷至室温,反应液倒入冰水(500 mL)中,搅拌下先生成白色固体,继而白色固体消失,继续搅拌会生成黄色油状物,此时强力搅拌,黄色油状物会逐渐消失,同时会有大量黄色固体析出,再少量多次加入冰水,直至析出的固体不再增加.抽滤,所得固体用异丙醚洗涤多次后,100 ℃真空干燥,得到白色固体35.64 g(收率54.8%).GC-MS:m/z[M+H]+为245.2.
1.2.28-羟基-1,1,7,7-四甲基久洛尼定Ⅱ的合成
化合物Ⅰ(35.64 g,109.2 mmol)溶于MeSO3H(40 mL,616 mmol)中,于100 ℃下反应1 h,反应结束后待体系降至室温,将反应体系倒入一定量冰水(500 mL)中,并用NaOH溶液调节体系pH至6~7,静置后析出大量微红色固体,减压抽滤,用水洗涤数次,在80 ℃下真空干燥24 h,得到微红色固体4.04 g(收率89.7%).m.p.157~162 ℃;GC-MS:m/z[M+H]+为245.8.
1.2.39-甲酰基-8-羟基-1,1,7,7-四甲基久洛尼定Ⅲ的合成
在冰浴条件下,将无水DMF(26.5 mL)注入到三口烧瓶中,再将无水POCl3(26.5 mL)缓慢滴加至体系中,滴加完毕后搅拌1 h.化合物Ⅱ(25.96 g,105.8 mmol)溶于DMF(53 mL)中,得到暗红色溶液,加入上述POCl3的DMF溶液中,65 ℃下回流6 h.反应完毕,将反应液倒入水(500 mL)中,乙酸乙酯萃取、饱和食盐水洗涤、无水Na2SO4干燥.过滤浓缩得到黑色油状物,柱层析V(PE)∶V(EA)=30∶1分离得到淡黄色晶体28.9 g(收率83.3%).m.p.71~72 ℃(74~76 ℃)[8];1H NMR(500 MHz,CDCl3):δ12.24(s,1H,CHO),9.40(s,1H,ArH),7.05(s,1H,OH),3.33(t,J=6 Hz,2H,NCH2),3.24(t,J=6 Hz,2H,NCH2),1.76~1.71(m,4H,NCH2CH2),1.45(s,6H),1.26(s,6H);GC-MS:m/z[M+H]+为273.3.
1.2.41,1,7,7-四甲基-10-(噻吩-2-基)-2,3,6,7-四氢-1H-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-11(5H)-酮Ⅳ的合成
化合物Ⅲ(2.20 g,8.14 mmol),2-噻吩乙腈(0.93 g,8.14 mmol),哌啶(2.41 mL,24.42 mmol)和乙酸(1.42 mL,24.42 mmol)溶于DMF(25 mL)中,150 ℃下加热回流4 h.反应完毕后,将反应体系倒入水(250 mL)中,CH2Cl2萃取,饱和食盐水洗涤3次,无水Na2SO4干燥.过滤浓缩得到黑色液体,柱层析V(PE)∶V(EA)=30∶1分离得到橘黄色固体1.25 g(收率45.0%).m.p.164~169 ℃;1H NMR(500 MHz,CDCl3):δ7.87(s,1H,coumarin-H),7.67(dd,J=3.7,1.1 Hz,1H,thiophene-H),7.30(dd,J=5.1,0.9 Hz,1H,thiophene-H),7.18(s,1H,coumarin-H),7.09(dd,J=5.0,3.7 Hz,1H,thiophene-H),3.31(t,J=6 Hz,2H,NCH2),3.23(t,J=6 Hz,2H,NCH2),1.82(t,J=6 Hz,2H,NCH2CH2),1.77(t,J=6 Hz,2H,NCH2CH2),1.59(s,6H,CH3),1.33(s,6H,CH3).
1.2.55-(1,1,7,7-四甲基-11-氧-2,3,5,6,7,11-六氢-1H-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-基)噻吩-2-甲醛Ⅴ的合成
在冰浴条件下,将无水POCl3(1 mL)缓慢滴加至无水DMF(2 mL)中,滴加完毕后搅拌1 h.化合物Ⅳ(1.52 g,4 mmol)溶于DMF(5 mL)中,得到深绿色溶液,将该溶液加入到上述POCl3的DMF溶液中,65 ℃下回流8 h.将体系冷却至室温并倒入一定量冰水(100 mL)中,NaOH溶液调节pH至6~7,静置析出砖红色沉淀,减压抽滤,用水洗涤3次,干燥.柱层析分离V(CH2Cl2)∶V(PE)=8∶1得到红色固体0.87 g(收率53.2%).m.p.207~209 ℃;1H NMR(500 MHz,CDCl3):9.89(s,1H,CHO),7.98(s,1H,coumarin-H),7.75~7.73(m,2H,thiophene-H),7.19(s,1H,coumarin-H),3.37(t,J=6 Hz,2H,NCH2),3.29(t,J=5.5 Hz,2H,NCH2),1.83(t,J=5.5 Hz,2H,NCH2CH2),1.78(t,J=6 Hz,2H,NCH2CH2),1.58(s,3H,CH3),1.33(s,3H,CH3).
1.2.62-((5-(1,1,7,7-四甲基-11-氧-2,3,5,6,7,11-六氢-1H-吡喃[2,3-f]吡啶[3,2,1-ij]喹啉-10-基)噻吩-2-基)亚甲基)丙二酸KR-1的合成
丙二酸(0.21 g,2 mmol)和化合物Ⅴ(0.41 g,1 mmol)加入25 mL三口烧瓶中,真空置氮,加入哌啶(1 mL)和氯仿(10 mL),加热回流6 h.反应结束后,将反应液旋干,柱层析分离V(CH2Cl2)∶V(CH3OH)∶V(AcOH)=400∶8∶2得到深红色固体0.44 g(收率为89.2%).m.p.281~284 ℃;1H NMR(500 MHz,d-DMSO)δ8.36(s,1H,CH=C(COOH)2),8.10(s,1H,coumarin-H),7.68~7.63(m,2H,thiophene-H),7.48(s,1H,coumarin-H),3.34~3.26(m,4H,NCH2),1.77~1.71(m,4H,NCH2CH2),1.50(s,6H,CH3),1.27(s,6H,CH3);ESI-MSm/z492.1[M-H]-为493.16.
2结果与讨论
2.1分子设计及合成
在经典的香豆素荧光染料如7-二烷氨基-3-杂环取代的香豆素衍生物即化合物CM分子中,苯并噁唑受体直接与二乙氨基香豆素荧光团相连,为典型的“D-A”结构.而在目标化合物KR-1中,电子给体换成了刚性结构的含氮杂环稠和的香豆素环,电子受体则改用吸电性更强的丙二酸替代.由于丙二酸与香豆素之间由单键连接,丙二酸绕单键旋转较容易,使得S1态以非辐射跃迁形式失活,因而电子受体与电子给体之间插入噻吩桥键,设计得到了“D-π-A”结构的香豆素荧光染料.化合物KR-1和CM的结构式分别为
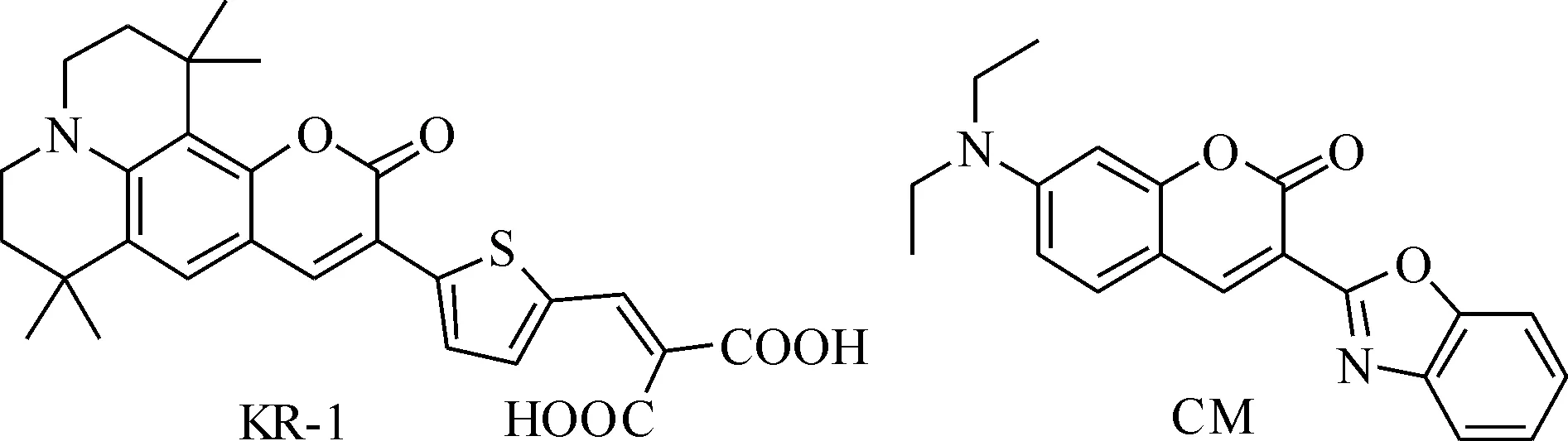
间氨基苯酚和溴代异戊烯经过亲核取代反应得到化合物ⅠN,N-二(3-甲基-2-丁烯)-3-羟基苯胺氢溴酸盐,化合物Ⅰ通过亲电取代关环生成化合物Ⅱ8-羟基-1,1,7,7-四甲基久洛尼定,化合物Ⅱ经Vilsmeir-Haack反应得到9-甲酰基-8-羟基-1,1,7,7-四甲基久洛尼定Ⅲ.Ⅲ在乙酸和哌啶的催化下,与噻吩乙腈关环形成香豆素环,制备得到中间产物Ⅳ.经再次Vilsmeir-Haack反应引入醛基,并与丙二酸进行Knoevenagel缩合后,合成得到目标产物KR-1,其反应式为

2.2光谱性能
测试了KR-1的紫外吸收光谱和荧光发射光谱,并将其与7-二乙氨基-3-苯并噁唑香豆素化合物CM进行了比较,相关图谱及数据见图1和表1.

图1 香豆素类荧光染料的光谱图Fig.1 Spectrum of coumarin fluorescent dye

化合物λ1)max/nmε/(L·mol-1·cm-1)Λ2)max/nmStokes位移/nmKR-14783020056285CM4415110049453
注:1) DMF溶液,c=3×10-5mol/L;2) 发射条件下:DMF溶液,c=5×10-6mol/L.
由图2可以看出:KR-1的紫外光谱图中有两个吸收峰:较短波长的峰出现在341 nm左右,为分子中π→π*的跃迁;较长波长478 nm处的峰则为分子内香豆素给体的电子通过噻吩环向吸电子的丙二酸转移所引起.化合物CM的最大吸收峰则出现在441 nm.与化合物CM相比,KR-1共轭体系增大,且电子受体吸电子能力增强,导致分子内电荷更易转移,跃迁能级减小,最大吸收波长红移.除此之外,KR-1的紫外吸收边缘位于575 nm,相较CM的500 nm红移了75 nm.同样由于KR-1共轭体系增大,使得离域π电子更易激发,因而其荧光发射峰出现在562 nm处,较CM的494 nm红移了约70 nm,Stokes位移也较CM增大了32 nm.

图2 香豆素荧光染料HOMO和LUMO轨道分布Fig.2 Frontier molecular orbitals(HOMO and LUMO) of coumarin fluorescent dyes
2.3理论计算
为了进一步了解香豆素类荧光染料结构变化与光谱性能之间的关系,我们对化合物KR-1和CM进行了gaussian计算.用Gaussian 03量子化学计算程序,采用DFT-B3LYP/6-31G(d)对化合物进行几何全优化,得到了基态几何构型的参数.在基态几何结构优化的基础上用TD-DFT-B3LYP/6-31G(d)计算得到吸收光谱、发射光谱以及激发态分子轨道分布图等,结果见图2,相关数据见表2~4.
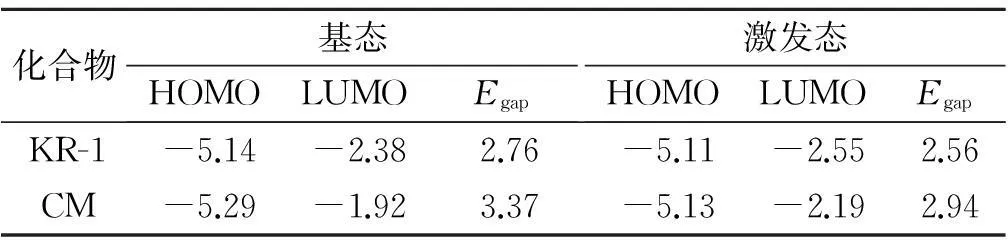
表2 高斯密度泛函(B3LYP/6-31G)计算所得染料能级数据
由表2可知:CM基态的HOMO为-5.29 eV,LUMO为-1.92 eV,而KR-1基态HOMO升高到-5.14 eV,LUMO则下降到-2.38 eV,能级差较CM缩小了0.61 eV.这是因为一方面平面性好且富电子噻吩是良好的电子传输通道,其引入可抑制丙二酸的扭转失活,同时可增大KR-1化合物的共轭体系,有利于升高HOMO,降低LUMO,从而缩小能级差,电子更容易发生跃迁;另一方面更强吸电性的丙二酸替代苯并噁唑,也有利于LUMO能级的降低.表3所列光谱性能数据也可以看出,KR-1由于电子跃迁能级减小,从而其紫外最大吸收波长较CM红移,理论计算所得数据变化趋势与实验测量吻合较好.
表3染料光谱性能计算值和实测值比较1)
Table 3Comparation of calculated and measured value of dyes

nm
注:1)λab化合物紫外吸收波长;λem为荧光发射波长.
表4高斯密度泛函(B3LYP/6-31G)计算染料部分键长和键角数据1)
Table 4Part bond length and bond angle value of dyes at the B3LYP/6-31G level

化合物基态∠1/(°)∠2/(°)μ/D激发态∠1/(°)∠2/(°)μ/DKR-1-2.2111.2311.640.912.0212.69CM0.55—7.460.13—8.33
注:1) ∠1为香豆素3位相连的杂环与香豆素之间的二面角;∠2为噻吩与双键之间的二面角;μ为偶极矩.
从表4优化得到的基态和激发态构型参数分析可知:激发后CM分子构型变化不大,而KR-1分子中,噻吩与双键之间二面角由2.02度增大到11.23度.且KR-1激发后,偶极矩改变了1.05 D,较CM的偶极矩改变大,因而其激发态电荷分离程度更大.由此可知:KR-1分子中激发态分子构型变化较大,当其调整形成稳定构型时,其间损失更多能量,从而使得其Stokes位移增大,激发光谱发生红移.
3结论
间氨基苯酚和溴代异戊烯经过亲核取代、亲电取代和Vilsmeir-Haack反应得到9-甲酰基-8-羟基-1,1,7,7-四甲基久洛尼定.9-甲酰基-8-羟基-1,1,7,7-四甲基久洛尼定与噻吩乙腈关环形成3-噻吩香豆素衍生物,再经Vilsmeir-Haack反应和Knoevenagel缩合后,合成得到新型“D-π-A”类香豆素荧光染料KR-1.与传统的“D-A”型染料相比,KR-1中噻吩桥键的引入,不仅可以抑制“D-A”体系中受体的扭转失活,同时缩小了分子前线轨道能级差,因而电子跃迁能级减小,紫外吸收红移.另一方面,光激发后,KR-1的激发态构型进行了更大的调整,使得Stokes位移增大,激发光谱红移.
参考文献:
[1]夏姚姚,贾建洪,高建荣,等.甲臜型铁络合染料的合成研究[J].浙江工业大学学报,2011,39(2):154-157.
[2]贾建洪,赵国生,盛卫坚,等.纳米级分散蓝2BLN的制备及应用[J].精细化工,2008,25(9):918-921.
[3]董华青,贾建洪,高建荣.双偶氮含氟活性染料的合成[J].浙江工业大学学报,2014,42(1):88-92.
[4]贾建洪,俞冬萍,许萌,等.超细分散蓝291的制备[J].浙江工业大学学报,2012,40(5):477-480.
[5]GNAIM S, SHABAT D. Quinone-methide species, a gatewan to founctional molecular systems:from self-immolative dendrimers to long-wavelength fluorescent dyes[J]. Accounts of Chemical Research,2014,47:2970-2984.
[6]PARIS V F, LASSALETTA J M, FERNANDEZ R, et al. Organic fluorescent thermometers based on borylated arylisoquinoline dyes[J].Chemistry-A European Journal,2014,20:7638-7645.
[7]BREUL A M, HAGER M D, SCHUBERT U S. Flurescent monomers as building blocks for dye labeled polymers:synthesis and application in energy conversion,biolabeling and sensors[J].Chemical Society Reviews,2013,42:5366-5407.
[8]DSOUZA R N, PISCHEL U, NAU W M. Fluorescent dyes and their supramolecular host/guest complexes with macrocycles in aqueous solution[J]. Chemical Reviews,2011,111:7941-7980.
[9]陈庆峰,高建荣,韩亮,等.新型香豆素染料的合成及荧光性能研究[J].浙江工业大学学报,2013,41(2):191-194.
[10]LIU X G, MAO D Q, COLE J M,et al. Temperature insensitive fluorescence intensity in a coumarin monomer-aggregate coupled system[J].Chemical Communications,2014,50:9329-9332.
[11]SOUMYA T V, THASNIM P, BAHULAYAN D. Step-economic and cost effective synthesis of coumarin based blue emitting fluorescent dyes[J].Tetrahedron Letters,2014,55:4643-4647.
[12]PRACHUMRAK N, POTJANASOPA S, RATTANAWAN R, et al. Coumarin-cored carbazole dendrimers as solution-processed non-doped green emitters for electroluminescent devices[J].Tetrahedron,2014,70:6249-6257.
[13]BAROOAH N, SUNDARARAJAN M, MOHANTY J, et al. Synergistic effect of intramolecular charge transfer toward supramolecular pKa shift in cucurbit[7]uril encapsulated coumarin dyes[J].Physical Chemistry B,2014,118:7136-7146.
[14]ZHOU S H, JIA J H, GAO J R,et al. The one-pot synthesis and fluorimetric study of 3-(2-benzothiazolyl)coumarins[J].Dyes and Pigments,2010,86:123-128.
[15]BULOVIC V, KHALFIN V B, GU G,et al.Weak microcavity effects in organic light-emitting devices[J] Physical Review B,1998,58:3730-3740.
(责任编辑:刘岩)
中图分类号:O629.11+3
文献标志码:A
文章编号:1006-4303(2015)03-0302-05
作者简介:韩亮(1977—),女,湖南湘潭人,副教授,研究方向为精细有机合成,E-mail:hanliang814@163.com.
基金项目:国家自然科学基金资助项目(21176223,21406202);浙江省自然科学基金资助项目(13B020012)
收稿日期:2014-12-31
