秋水仙素对刺果甘草染色体倍性诱变的影响
2015-02-17杨萍郭晔红史军周
杨萍,郭晔红,史军周
(甘肃农业大学农学院,甘肃 兰州 730070)
秋水仙素对刺果甘草染色体倍性诱变的影响
杨萍,郭晔红,史军周
(甘肃农业大学农学院,甘肃 兰州730070)
摘要:以刺果甘草种子为试验材料,分别用0.05%、0.1%和0.2%的秋水仙素处理甘草种子16、20、24 h,进行刺果甘草多倍体的诱导研究.结果表明:以0.05%秋水仙素处理16 h刺果甘草染色体的诱变率最低为7.5%,0.2%秋水仙素处理24 h时刺果甘草染色体诱变率最高,为88.64%;在0.1%秋水仙素处理种子24 h得到刺果甘草四倍体(4n=4x=32),此时刺果甘草染色体诱变率可达42%.
关键词:刺果甘草;秋水仙素;染色体;诱变率
刺果甘草(GlycyrrhizapallidifloraMax.),别名野甘草、胡苍耳、狗甘草等,为豆科蝶形花亚科甘草属多年生半灌木.以根及种子入药,具有催乳、杀虫、止泻、抗癌等功效.主要分布在黑龙江、辽宁、内蒙古等地[1],因其具有抗寒、抗旱、耐热、耐盐碱等优良特性,且植株高大,枝叶繁茂,适生性强,生命力旺盛,成为干旱、半干旱地区园林绿化及水土保持的重要植物资源之一[2].植物的多倍体(polyploid)现象自二十世纪初被发现以来,以其根、茎、叶等营养器官的巨型性及优良的抗性成为各界专业人士研究的焦点.
为大幅度提高甘草产量、得到具有较强抗性的甘草植株,国内外许多学者都对甘草进行了多倍体的诱导研究.如葛淑俊等[3]研究了乌拉尔甘草同源四倍体诱导技术,武晓阳[4]研究了胀果甘草体细胞染色体加倍技术等.但对于刺果甘草染色体加倍的研究却少有报道,吴玉香等[5]虽采用改良琼脂涂抹法和直接滴渗法处理刺果甘草幼苗顶芽进行多倍体诱变,但方法较麻烦,且时间较长,也未对染色体进行鉴定.鉴于此,本研究采用秋水仙素处理刺果甘草种子的方法,进行刺果甘草多倍体的诱导研究,以期为培植多倍体刺果甘草提供科学依据.
1材料与方法
1.1试验材料
试验使用的刺果甘草种子采自吉林农业大学中药材学院中草药实验圃.
1.2试验方法
1.2.1刺果甘草染色体加倍选取成熟饱满、健康无病虫害的刺果甘草种子经沙磨处理后用98%浓H2SO4浸泡40 min,1%升汞消毒10 min,之后以0.05%、0.1%、0.2%的秋水仙素溶液分别浸泡刺果甘草种子16、20、24 h,用不加秋水仙素的种子作对照,每个处理设3次重复.
将处理过的种子接种到以MS培养基为基质的锥形瓶中,25 ℃下暗培养.待种子完全发芽后,每天以2 000 lx强度光照10 h,26 ℃下培养.待植株长到5 cm左右时剪取下胚轴(约0.5 cm)接入MS+0.5 mg/L NAA+0.8 mg/L 6-BA的培养基,每处理接30个,重复3次.于23 ℃、2 000 lx强度下光照16 h诱导愈伤组织.20 d后愈伤组织进行两次继代培养,之后进行染色体观察分析.
1.2.2染色体倍性分析剪取新生的愈伤组织于0.01%秋水仙素和0.002 mol/L 8-羟基喹啉混合液中预处理2.5 h左右,水洗后用乙醇—冰醋酸(3∶1)固定液固定2 h;再用混合酶液(纤维素酶和果胶酶各占2.5%)在25 ℃恒温箱内处理3 h;倒去酶液,用蒸馏水泡30 min,去除蒸馏水后,加入固定液固定0.5 h后制备细胞悬液.用悬滴法制片,干燥后用改良苯酚品红染色2~3 min,常规压片,冰冻后揭去盖玻片,自然干燥,中性树胶封片,用Olympum Bx61观察并采集图像.
2结果与分析
2.1秋水仙素对刺果甘草种子发芽的影响
秋水仙素质量分数和处理时间对刺果甘草种子的发芽率和发芽势有明显影响.随着秋水仙素质量分数的增加和处理时间的延长,刺果甘草种子的发芽率和发芽势明显降低,以0.2%的秋水仙素处理24 h的刺果甘草种子发芽率和发芽势最低,分别较对照降低了77.5%和88.6%;以0.05%秋水仙素处理20 h,发芽率和发芽势降低幅度最小,分别为19%和46.8%.由表1可见,秋水仙素质量分数和浸泡时间对刺果甘草种子的萌发有显著性的抑制作用.

表1 不同秋水仙素质量分数和处理时间对刺果
2.2秋水仙素处理对刺果甘草染色体诱变率的影响
秋水仙素处理对刺果甘草染色体诱导试验表明,不同质量分数的秋水仙素处理对刺果甘草染色体诱导率和诱变率均有明显影响(表2),随着秋水仙素质量分数的增加和浸泡时间延长,刺果甘草染色体愈伤组织诱导率呈下降趋势,当秋水仙素质量分数达到0.2%处理24 h时,刺果甘草染色体的诱导率最低,为10%,而且使用秋水仙素处理后刺果甘草染色体愈伤组织诱导率均有下降,说明秋水仙素对刺果甘草染色体愈伤组织诱导率具有抑制作用.而且随着秋水仙素质量分数的增加和浸泡时间延长,刺果甘草染色体诱变率呈上升趋势,以0.05%秋水仙素处理16 h时诱变率最低,为7.5%;0.2%秋水仙素处理24 h的刺果甘草染色体诱变率最高,为88.64%.由此可见,一定质量分数的秋水仙素和处理时间能够促使刺果甘草产生变异,并且诱变率随秋水仙素质量分数和处理时间的增加而增大(表2).
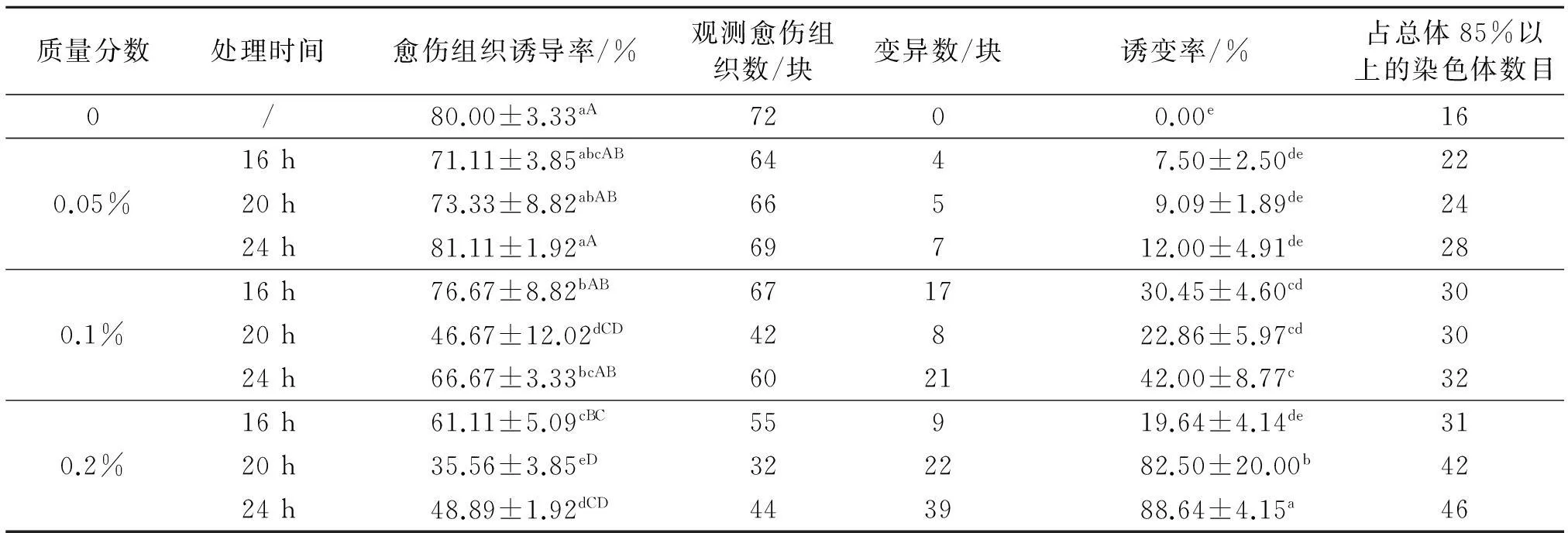
表2 秋水仙素处理对刺果甘草愈伤组织诱导率和诱变率的影响
2.3刺果甘草染色体计数与鉴定
从表2和图1中诱导的多倍体染色体数目可知,染色体数目随着秋水仙素质量分数和处理时间的增加而增加,但并不呈倍性增加.仅以0.1%秋水仙素处理24 h时得到刺果甘草的四倍体,4n=4x=32.用0.05%秋水仙素处理16 h得到22条染色体, 0.05%秋水仙素处理24 h、0.1%处理16 h、0.1%处理20 h、0.1%处理24 h和0.2%处理16 h所得染色体数目变化范围不大,为28~32.用0.2%秋水仙素处理20 h、24 h诱导的染色体数目明显多于其他处理.周朴华等[6]用秋水仙素诱导黄花菜的愈伤组织,得到了四倍体植株;王俐等[7]取得了芦荟和库拉索芦荟的四倍体植株;另有丹参、菘蓝、党参、枸杞、福录考、牛膝、黄芪、杜仲、百合、菊花脑、君子兰等试验也支持本试验结果[8-15].
而本试验秋水仙素作用于刺果甘草诱导多倍体发生率较低,推测可能原因是刺果甘草种子硬实现象影响秋水仙素浸入种子.另外,秋水仙素有毒害作用,其致死率也随着秋水仙素质量分数的增大和处理时间的延长而增大.

A:0;B1:0.05%,16 h;B2:0.05%,20 h;B3:0.05%,24 h;C1:0.1%,16 h;C2:0.1%,20 h;C3:0.1%,24 h;D1:0.2%,16 h;D2:0.2%,20h;D3:0.2%,24 h.
图1不同质量分数、不同时间秋水仙素处理对刺果甘草染色体的诱导
Fig.1Induction of different concentration and duration of colchicine treatment on
GlycyrrhizapallidifloraMax.chromosome
3讨论与结论
秋水仙素质量分数和浸泡时间都对刺果甘草种子的萌发有显著性抑制作用.说明秋水仙素能够抑制刺果甘草的正常萌发.
使用秋水仙素处理种子后刺果甘草染色体愈伤组织诱导率均有下降,说明秋水仙素对刺果甘草染色体愈伤组织诱导率具有抑制作用.一定质量分数的秋水仙素和处理时间能够促使刺果甘草产生诱变,并且诱变率与秋水仙素质量分数和处理时间呈显著正相关,0.2%秋水仙素处理24 h刺果甘草染色体诱变率最高,为88.64%.在0.05%~0.2%内刺果甘草染色体诱变率随着秋水仙素质量分数和处理时间的升高而增大.
秋水仙素处理刺果甘草种子能够诱导产生多倍体,以0.1%秋水仙素处理24 h得到四倍体(4n=4x=32).
陈荣等[16]用秋水仙诱导观音莲四倍体,发现20 mg/L秋水仙素处理8 d诱导率最高.田丹青等[17]采用秋水仙素进行红掌四倍体离体诱导, 证明0.20 g/L秋水仙素液体培养15 d 的四倍体诱导率最高.这说明因物种的不同,秋水仙素诱导多倍体的质量浓度和时间差异较大.而本试验使用的方法简单并易于操作,诱导时间较短,仅需24 h,并对刺果甘草进行了染色体鉴定.
参考文献
[1]梁军.刺果甘草的提取及化学成分的研究[J].齐齐哈尔医学院学报,2009,30(8):978-979
[2]初艳.刺果甘草种子发芽试验初报[J].特产研究,2007(3):33-35
[3]葛淑俊,袁静娅,武晓阳,等.秋水仙素诱导乌拉尔甘草同源四倍体的研究[J].作物杂志,2009(3):8-11
[4]武晓阳.乌拉尔甘草同源四倍体诱导技术研究[D].保定:河北农业大学,2008
[5]吴玉香,贺润丽,高建平,等.刺果甘草多倍体诱变育种的研究[J].山西农业大学学报:自然科学版,2004(2):116-117,129
[6]周朴华,何立珍,刘选明.组织培养中用秋水仙素诱发黄花菜同源四倍体的研[J].中国农业科学,1995,28(1):49-50
[7]王俐,郑思乡,枝林,等.库拉索芦荟的多倍体诱变及其变异初报阴[J].云南植物研究,2001,23(4):493-496
[8]高山林,徐德然,蔡朝晖,等.丹参同源四倍体新物种的培育[J].中国药科大学学报,1992,23(4):224-228
[9]乔传卓,吴美区,戴富宝,等.菘蓝多倍体育种的研究[J].植物学报,1989,31(9):678-683
[10]陈素萍,王莉,宋秀清.党参多倍体育种的研究[J].中草药,1991,22(5):224-227
[11]牛德水.四倍体宁夏枸杞培育成功[J].植物杂志,1986(4):7
[12]秦金山.枸杞同源四倍体新物种的建立[J].遗传学报,1985,12(3):200
[13]宋智青,梁运章,李玉峰,等.药用植物的多倍体育种[J].生物学通报,2006,41(7):13
[14]陈发棣,蒋甲福,房伟民.秋水仙素诱导菊花脑多倍体的研究[J].上海农业学报,2002,18(1):46-50
[15]王冲,雷家军,邢桂梅,等.君子兰未成熟胚四倍体诱导及染色体数鉴定[J].园艺学报,2011,38(7):1371-1376
[16]陈荣,朱昌叁.秋水仙素诱导观音莲染色体加倍研究[J].江苏农业科学,2013,41(2):166-167
[17]田丹青,潘晓韵,葛亚英,等.秋水仙素离体诱导红掌四倍体试验[J].浙江农业科学,2013(9):1125-1127
(责任编辑赵晓倩)
Effects of colchicine on chromosome mutation of
Glycyrrhizapallidiflora
YANG Ping,GUO Ye-hong,SHI Jun-zhou
(College of Agronomy,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:The seeds of Glycyrrhiza pallidiflora were used as the material to induce the polyploidy plant with different colchicine concentration and duration treatments.The results showed that the mutation rate were the lowest (7.50%) under the treatment with colchicine at 0.05% for 16 h,the mutation rate was the highest (88.64%) under the treatment at 0.2% for 24 h.The tetraploid (4n=4x=32) appeared under treated with colchicine at 0.1% for 24 h.
Key words:Glycyrrhiza pallidiflora;colchicine;chromosome;mutation rate
收稿日期:2014-04-02;修回日期:2014-04-15
基金项目:甘肃省高等学校基本科研业务费项目.
通信作者:郭晔红,女,副教授,博士,主要从事野生中药材引种驯化与鉴定方面的教学和科研工作.E-mail:guoyh@gsau.edu.cn
中图分类号:S 567.1
文献标志码:A
文章编号:1003-4315(2015)01-0089-04
第一作者:杨萍(1988-),女,硕士研究生,研究方向为中药材引种驯化与鉴定.E-mail:15117190782@163.com
