不同海拔梯度下小叶锦鸡儿的居群遗传多样性响
2015-02-16黄文达赵学勇李玉霖罗亚勇王少昆潘成臣中国科学院寒区旱区环境与工程研究所奈曼沙漠化研究站甘肃兰州730000甘肃省寒区旱区逆境生理与生态重点实验室甘肃兰州730000
黄文达,赵学勇,李玉霖,罗亚勇,王少昆,潘成臣(.中国科学院寒区旱区环境与工程研究所奈曼沙漠化研究站, 甘肃 兰州 730000; 2. 甘肃省寒区旱区逆境生理与生态重点实验室,甘肃 兰州 730000)
植物生产层
不同海拔梯度下小叶锦鸡儿的居群遗传多样性响
黄文达1,2,赵学勇1,李玉霖1,罗亚勇1,王少昆1,潘成臣1
(1.中国科学院寒区旱区环境与工程研究所奈曼沙漠化研究站, 甘肃 兰州 730000; 2. 甘肃省寒区旱区逆境生理与生态重点实验室,甘肃 兰州 730000)
以小叶锦鸡儿(Caraganamicrophylla)为研究对象,利用ISSR分子标记技术,对不同海拔梯度下小叶锦鸡儿6个居群遗传多样性进行分析。研究发现,8条ISSR扩增引物得到142条清晰的DNA条带,其中多态性条带为126条,多态位点百分率为88.73%。用POPGENE软件计算不同海拔梯度下各居群间和居群内的遗传参数,结果表明, Nei’s基因多样性为0.292 9,香农信息指数为0.441 7,表明在物种水平上小叶锦鸡儿居群具有较高的遗传多样性;低海拔区域居群的所有遗传多样性高于高海拔区域居群,表明海拔高度增加阻碍了居群间的基因交流,导致小叶锦鸡儿居群遗传多样性水平降低。
小叶锦鸡儿;海拔梯度;ISSR
小叶锦鸡儿(Caraganamicrophylla)属豆科锦鸡儿属多年生灌木,在我国多分布于海拔介于200~1 500 m的东北及内蒙古、河北、山西、陕西等地的固定和半固定沙地[1]。具有较强的抗风蚀和固氮能力,在植被恢复过程中具有重要作用[2]。ISSR(Inter Simple Sequence Repeat)分子标记通常用于估算植物种群的遗传多样性水平和遗传结构,尤其对基因组序列还不清楚的物种特别有用[3-4]。截至目前,关于小叶锦鸡儿遗传多样性的研究主要集中在以下几个方面: 1)小叶锦鸡儿作为锦鸡儿属的一种植物,研究其种间遗传差异[5-9]; 2)种质资源遗传多样性[10]; 3)形态学性状遗传多样性[11];4)内蒙古草原区小叶锦鸡儿遗传多样性和遗传分化[12-13]; 5)SSR-PCR体系优化及应用[14]。但是针对不同海拔梯度下小叶锦鸡儿居群的遗传多样性研究还未见报道。为此,利用ISSR分子标记技术研究了小叶锦鸡儿居群在不同海拔梯度下的遗传差异,以期揭示小叶锦鸡儿居群间和居群内的遗传多样性水平,分析其遗传多样性与海拔梯度之间的相互关系,阐明该物种的生态学适应过程,从而为干旱-半干旱地区生态系统的持续稳定恢复提供遗传学理论依据。
1 材料与方法
1.1 材料
采样包括6个居群,67个个体,每一居群的样本量为10~12,居群内个体与个体之间至少间隔30 m(表1)。样本具有代表性,在每一个呈岛屿状不连续分布的居群中,取样个体代表该地区所有分布的个体。每个居群的海拔和经纬度在采集地中心使用GIS仪(Garmin)测定。
采集每个个体的幼嫩叶片10 g以上,用变色硅胶迅速干燥后,装入密封塑料袋带回实验室,放于-20 ℃冰箱中保存。
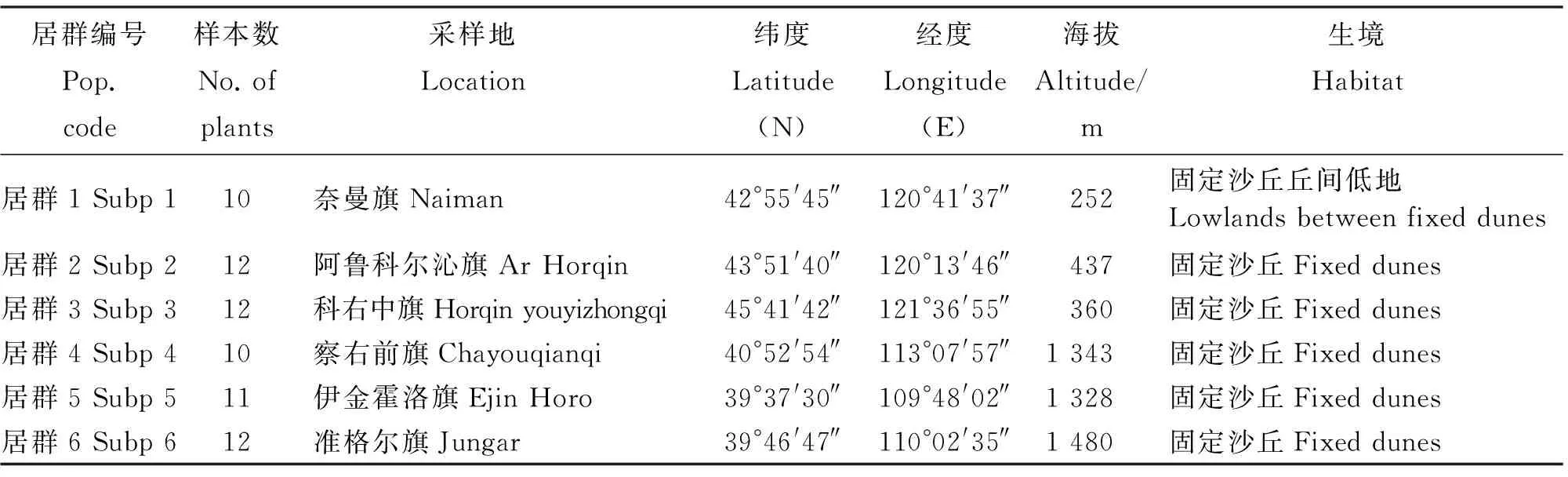
表1 小叶锦鸡儿6个居群的个体数、生境类型及地理分布Table 1 Location, number of plants and habitats of 6 populations ofCaraganamicrophylla
1.2 总DNA提取
采用常规试剂盒AxyPrep Genomic DNA Mini Kits对所有小叶锦鸡儿个体进行总DNA提取。
1.3 PCR扩增、纯化及序列测定
从100条ISSR扩增引物(加拿大哥伦比亚大学UBC Primer Set No.9, http://www.biotech.ubc.ca/services/NAPS/Primer_Set/Primers.pdf)中筛选出8条条带清晰、重复性和稳定性好且多态性条带相对较多的引物用于全部DNA样品的PCR扩增。PCR扩增程序为94 ℃预变性3 min,94 ℃变性30 s,退火30 s,72 ℃延伸1 min,共30个循环,72 ℃延伸5 min,4 ℃保存。扩增反应结束后,以100 bp Ladder marker做参照,用1.8%的琼脂糖凝胶电泳(含EB 0.5 μg·mol-1)分离,稳压100 V,电泳时间2 h, 凝胶成像系统照相,观察扩增结果。
1.4 数据分析
将扩增产物中有条带的记做“1”,无条带的记做“0”,只记载清晰易辨的扩增带,数据输入数据矩阵,应用POPGENE 1.32软件,假定这些小叶锦鸡儿居群在这些ISSR标记位点处于Hardy-Weinberg平衡状态,对全部居群和不同海拔梯度下的群体分别计算下列遗传参数:多态位点百分率;观测等位基因数;有效等位基因数;Nei’s基因多样性;香农信息指数(1972)[15];总基因多样性;群体内基因多样性;基因分化系数;基因流;遗传一致度和Nei’s遗传距离[15]。应用SPSS 17.0 软件分析居群内的遗传多样性水平与海拔梯度之间的相关关系。应用ARLEQUIN软件包分析低海拔区域、高海拔区域和区域内居群内的遗传变异[16]。应用NTSYS pc 2.02软件构建小叶锦鸡儿居群的聚类图[17]。
2 结果
2.1 多态位点比率
通过ISSR扩增,从100条引物中筛选出8条扩增条带多、信号强、背景清晰且重复性好的引物用于ISSR-PCR扩增反应。经统计,这8条扩增引物得到142条清晰的DNA条带,其中多态性条带为126条,所占的百分比是88.73%,扩增的DNA片段长度介于150~2 000 bp。8条引物扩增的DNA条带数平均为17.75条。引物857所产生的条带数和多态性条带最多,分别为22条和21条。引物826所产生的条带数和多态性条带最少,分别为12条和10条。引物864的多态百分率最高,达100.00%。引物842的多态百分率最低,为80.00%(表2)。
2.2 遗传多样性和遗传分化
不同海拔区域6个小叶锦鸡儿居群的遗传多样性结果(表3)表明,8条引物在6个居群所产生的多态位点数为8~61条;多态位点百分率为5.63%~42.96%;观测等位基因数为1.056 3~1.429 6;有效等位基因数为1.036 1~1.305 0;Nei’s基因多样性为0.021 4~0.173 3;香农信息指数为0.031 8~0.253 3。其中居群2的所有遗传多样性参数(多态位点百分率、观察等位基因数、有效等位基因数、Nei’s基因多样性和香农信息指数)都明显高于其他居群,居群1的所有遗传多样性参数均低于其他居群。在物种水平上,多态位点百分率为88.73%,观察等位基因数为1.887 3,有效等位基因数为1.496 7,Nei’s基因多样性为0.292 9,香农信息指数为0.441 7,该结果揭示了小叶锦鸡儿居群具有丰富的遗传多样性。在海拔梯度上,低海拔区域小叶锦鸡儿居群的所有遗传多样性参数都高于高海拔区域居群,其中重要的遗传多样性参数Nei’s基因多样性和香农信息指数差异最为明显。低海拔区域Nei’s基因多样性和香农信息指数均明显高于多年生植物的平均值0.25和0.35,分别为0.280 6和0.415 8。而高海拔区域Nei’s基因多样性和香农信息指数均低于多年生植物的平均值,分别为0.193 0和0.288 6。
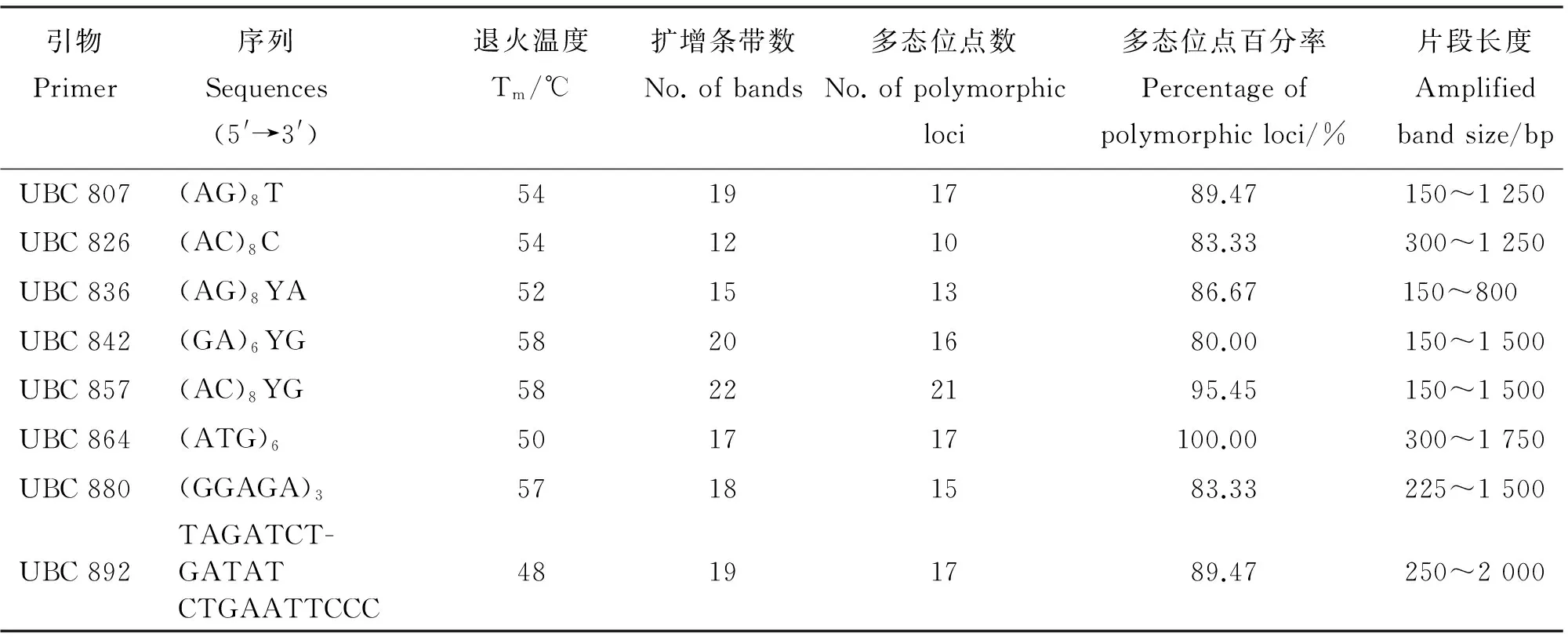
表2 用于小叶锦鸡儿ISSR扩增的引物及其退火温度和多态位点百分率Table 2 Primers sequence, melting temperature and percentage of polymorphism in ISSR analysis ofCaraganamicrophylla
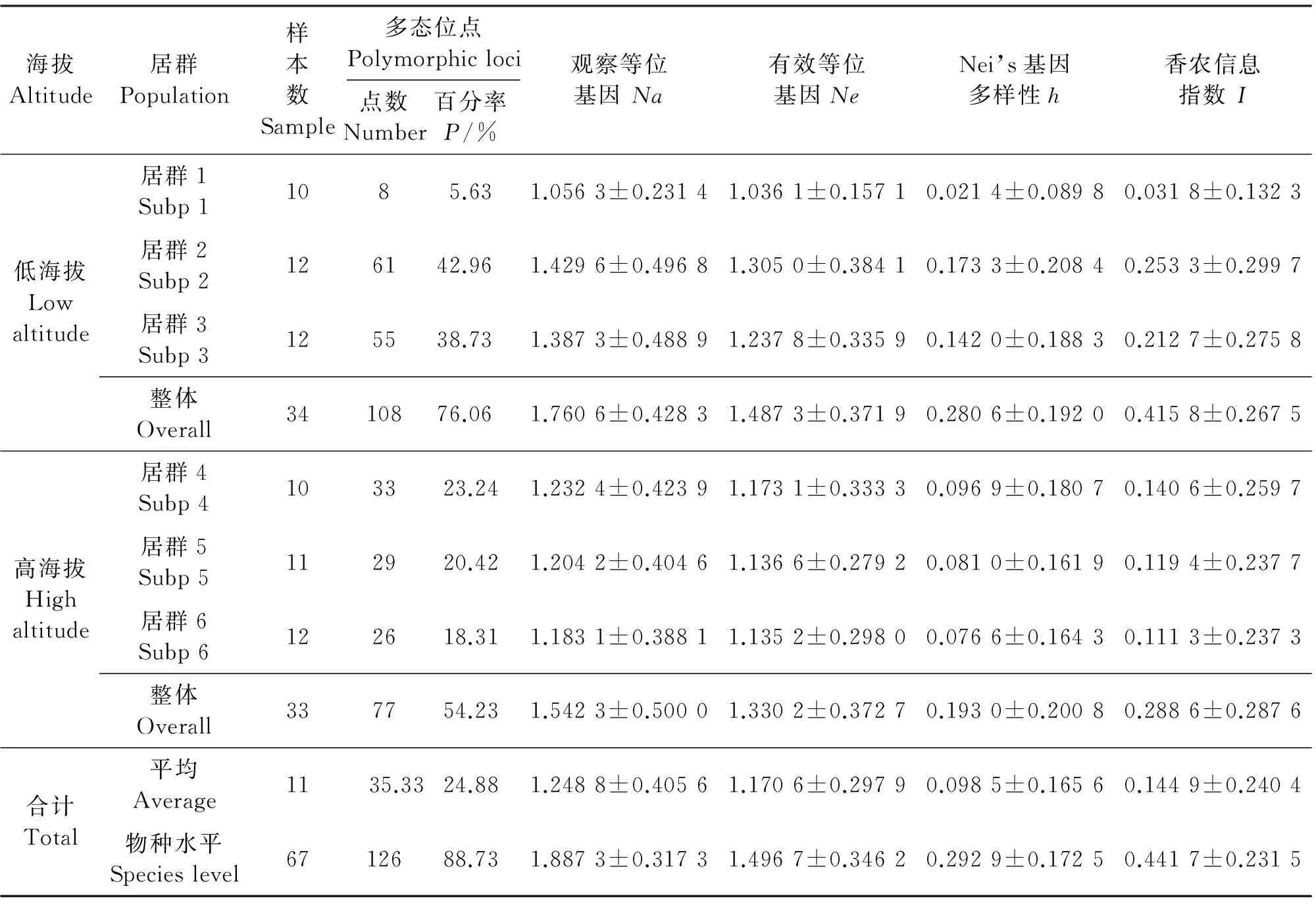
表3 小叶锦鸡儿居群遗传多样性Table 3 Genetic diversity indices ofCaraganamicrophyllapopulations
本试验研究居群为随机交配群体,因此,可以假定为Hardy-Weinberg平衡群体。根据Hardy- Weinberg平衡定律,采用Nei’s基因多样性指数对6个小叶锦鸡儿居群间基因多样性和遗传分化进行比较(表4)。
试验结果表明,海拔梯度对小叶锦鸡儿居群的遗传变异产生了一定程度的影响。低海拔区域小叶锦鸡儿居群大部分遗传分化参数都高于高海拔区域居群。在低海拔区域,小叶锦鸡儿居群的总基因多样性为0.278 3;群体内基因多样性为0.112 2;在同一区域中不同居群间的基因分化系数为0.596 6,即小叶锦鸡儿在不同居群间产生了一定程度的遗传分化,居群间的遗传变异占总变异的59.66%;居群间的基因流为0.338 0(表4)。高海拔区域小叶锦鸡儿居群的基因流为0.391 0,高于低海拔区域居群。在居群水平上,小叶锦鸡儿居群的总基因多样性为0.287 6,高于区域水平上;群体内基因多样性和基因分化系数分别为0.098 5和0.582 1,都低于低水热区域居群(表4)。AMOVA 分析结果显示(表5),小叶锦鸡儿居群的主要遗传变异来自于居群间,居群间的遗传差异百分率达到72.79%(P<0.001),居群内遗传差异百分率为27.21%。
为了进一步说明小叶锦鸡儿各居群间的分化程度,用Popgen 1.32软件计算了居群间的遗传距离(表6),发现居群5和居群4之间的遗传相似度最大,为0.844 1,遗传距离最小,为0.169 5。居群1和居群4之间的遗传相似度最小,为0.646 6,遗传距离最大,为0.436 0。从UPGMA聚类图可以看出(图1),高海拔区域的小叶锦鸡儿居群4、5和6聚为一支,低海拔区域的居群各聚一支。相关性分析表明,小叶锦鸡儿居群的海拔高度与观察等位基因的相关系数为-0.027,与有效等位基因的相关系数为-0.014,与Nei’s基因多样性的相关系数为-0.003,与香农指数的相关系数为-0.001,这些遗传多样性参数与海拔均呈负相关,但均未达到显著水平。

表4 海拔梯度对小叶锦鸡儿居群遗传分化的影响Table 4 Effects of altitude gradient on the genetic differentiation ofCaraganamicrophyllapopulations

表5 小叶锦鸡儿居群分子变异分析Table 5 Analysis of molecular variance (AMOVA) forCaraganamicrophyllapopulations
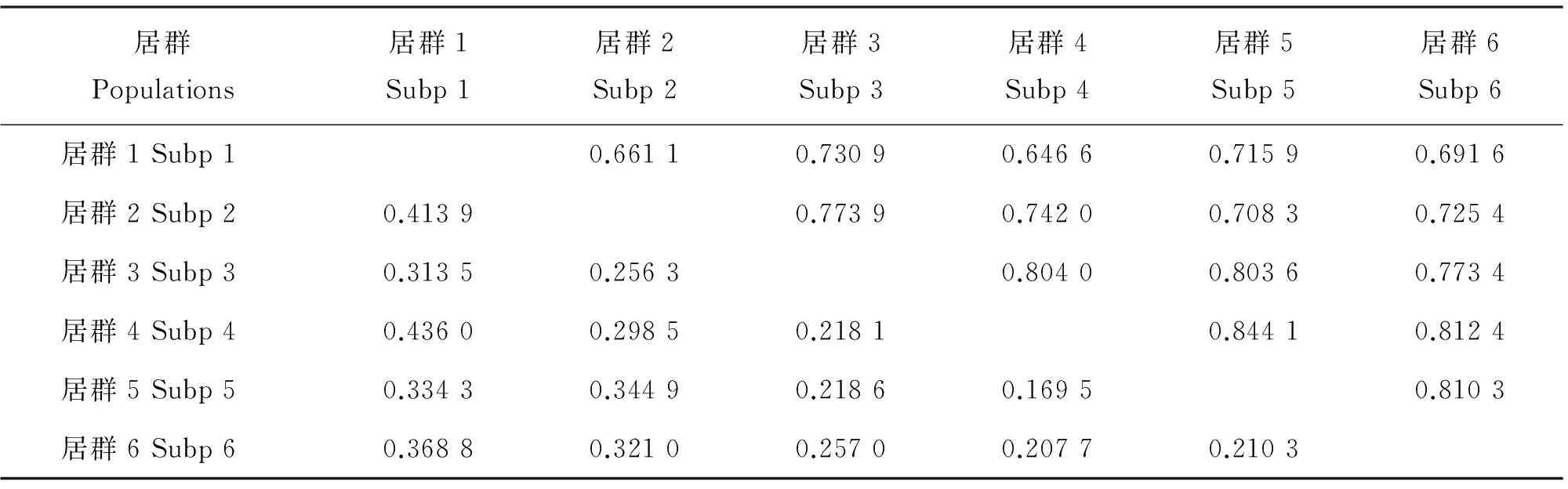
表6 小叶锦鸡儿各居群遗传相似度(对角线以上)和遗传距离(对角线以下)Table 6 Nei’s genetic identity (above diagonal) and genetic distance (below diagonal) betweenCaraganamicrophyllapopulations
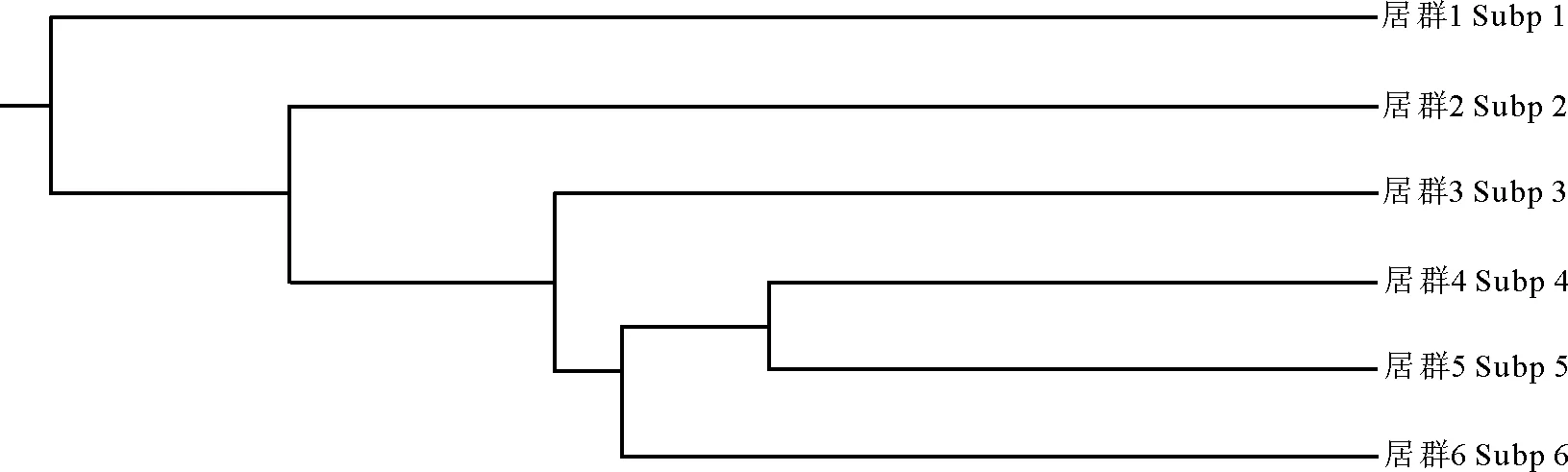
图1 基于Nei’s (1972)遗传距离的小叶锦鸡儿居群UPGMA聚类图Fig.1 UPGMA dendrogram ofCaraganamicrophyllapopulations based on Nei’s (1972) genetic distances from ISSR data
3 讨论与结论
物种的遗传多样性与其对环境变化的适应性紧密相关,估测遗传差异是物种保护和生态恢复的重要步骤,通过估测遗传多样性指数(如多态位点百分率等)来衡量物种的遗传丰富度。本研究结果显示,在物种水平上,小叶锦鸡儿居群的多态位点百分率为88.73%,这个值与3种锦鸡儿的平均多态位点百分率(87%)相近[8],说明不同海拔区域的小叶锦鸡儿居群具有较高水平的遗传多样性,这与以往的研究结果一致[5,7,10]。相对于多态位点百分数来说,Nei’s基因多样性和香农信息指数能更好地反映条带的丰富度和均匀程度,而丰富度和均匀度是衡量多样性的两个重要指标,Nei’s基因多样性还与物种的生物学特性紧密相关。本研究发现,物种水平上小叶锦鸡儿居群的Nei’s基因多样性是0.292 9,香农信息指数为0.441 7,结果与杨明博等[18]利用ISSR分子标记研究中间锦鸡儿(C.davazamcii)的值相近(Nei’s基因多样性为0.296 3,香农信息指数为0.454 2),而明显高于郭宏宇等[12]利用RAPD分子标记对内蒙古草原区小叶锦鸡儿的研究结果(Nei’s基因多样性为0.184 5,香农信息指数为0.394 2)。这可能是分子标记技术的不同所导致的。Hamrick和Godt[19]、Nybom和Bartish[20]认为植物的遗传多样性水平虽依赖物种的生活史特征,例如繁殖系统、种子扩散机制、地理分布和生活型,但主要受环境因子的影响[21-22]。小叶锦鸡儿是靠虫媒传粉的多年生灌木,具有广泛的生态幅,除了能异花授粉外,还可以进行自花授粉,具有极强的生命力与竞争力,这些生物学特征都可以使小叶锦鸡儿获得高水平的遗传多样性[23-25];从而使得小叶锦鸡儿成为中国北方的广布种和优势种。Ayala和Keger[26]指出,经过长期的进化过程,物种对环境变化的适应性主要依靠其种内的遗传变异水平。
在海拔梯度上,低海拔区域小叶锦鸡儿居群的所有遗传多样性参数都高于高海拔区域居群,这表明海拔增加阻碍了小叶锦鸡儿居群间的基因交流,原因可能是高海拔地区温度低,降水丰富,在一定程度上限制了花粉及果实的散布,导致遗传多样性水平降低,这与马丹炜等[27]对岩生植物金发草(Pogonatherumpaniceum)的遗传多样性研究一致。低海拔区域小叶锦鸡儿居群总基因多样性、群体内基因多样性和基因分化系数都高于高海拔区域居群,而居群间的基因流低于高海拔区域居群, 这说明低海拔区域小叶锦鸡儿居群的遗传分化程度高于高海拔区域居群。这主要是因为低海拔区域为沙漠化草地,生境的片段化导致小叶锦鸡儿居群间产生较大的遗传漂变,这与Huang等[13]对科尔沁沙地小叶锦鸡儿居群的研究结果一致。也有研究证明,生境片段化会影响植物居群间的遗传多样性[28-33]。在海拔水平上,低海拔区域和高海拔区域小叶锦鸡儿居群间的遗传变异都占总变异的50%以上,其群体内分化系数分别为0.596 6和0.561 2, 这说明海拔梯度对小叶锦鸡儿居群的遗传分化有一定影响。显著性检测也显示小叶锦鸡儿居群间的变异所占比例较大,且对总体遗传变异有显著影响(P<0.001),说明各地理居群间有一定程度的分化,这与郭宏宇等[12]对小叶锦鸡儿和杨明博等[18]对中间锦鸡儿遗传分化的研究不一致,这可能是由物种差异和采样地的地理差异引起的。本研究发现,居群4和居群5之间的遗传相似度最大,遗传距离最小, 这是由于居群4和居群5都处于高海拔区域,居群间的地理距离较小,居群间会有基因流动。有研究表明,小尺度范围内物种的遗传多样性指数和地理距离之间没有相关性[34-35]。本研究结果发现,居群1和居群4之间的遗传相似度最小,遗传距离最大,这主要因为生境差异,居群1来自于丘间低地,其微生境条件比流动沙地好[36-44],而且居群1和居群4之间存在一定的地理距离。根据UPGMA聚类,小叶锦鸡儿居群的遗传多样性呈现出一定的分布规律,聚类结果将高海拔区域居群聚在一起。相关性分析表明,小叶锦鸡儿居群的遗传多样性参数与海拔呈负相关,说明海拔高度的变化对小叶锦鸡儿的遗传分化产生了一定的影响,但结果未达到显著水平,这与王赞和高洪文[10]对柠条锦鸡儿(C.korshinskii)表型性状与地理因子的相关性研究结果一致。
概而言之,不同海拔梯度影响了小叶锦鸡儿居群的遗传多样性,而且低海拔区域小叶锦鸡儿居群的遗传多样性参数高于高海拔区域居群。随着海拔高度的增加,小叶锦鸡儿居群产生了一定的遗传分化,这表明海拔增加阻碍了居群间的基因交流,导致其遗传多样性水平降低[27]。
[1] 赵一之.小叶、中间和柠条三种锦鸡儿的分布式样及其生态适应[J].生态学报,2005,25(12):3411-3414.
[2] 富象乾.内蒙古植物志[M].第二版.呼和浩特:内蒙古人民出版社,1993:639-648.
[3] Meloni M,Perini D,Filigheddu R,Binelli G.Genetic variation in five Mediterranean populations ofJuniperusphoeniceaas revealed by inter-simple sequence repeat (ISSR) markers[J].Annals of Botany,2006,97(2):299-304.
[4] 钱迎倩,马克平.生物多样性研究的原理与方法[M].北京:中国科学技术出版社,1994:13-16.
[5] 郭强,时永杰,魏臻武,杨占花,卢娟,贾艳琼.河西走廊14种锦鸡儿遗传多样性SSR分析[J].草地学报,2008,16(3):227-233.
[6] 杨九艳,杨劼,杨明博,鞠爱华,渠弼. 鄂尔多斯高原锦鸡儿属药用植物的ISSR分析[J].中草药,2006,37(10):1562-1566.
[7] 盛红梅,陈拓,安黎哲,郑晓玲,蒲玲玲,刘亚洁,孙学刚.锦鸡儿属植物的遗传多样性及其种间关系[J].中国沙漠,2005,25(5):697-701.
[8] 宋俊双,王赞,高洪文.三种锦鸡儿遗传多样性ISSR分析(简报)[J].草地学报,2006,14(4):384-386.
[9] Ma C C,Gao Y B,Wang J L,Guo H Y.Interspecific transition amongCaraganamicrophylla,C.davazamciiandC.korshinskiialong geographic gradient.Ⅰ. Ecological and RAPD evidence[J].Acta Botanica Sinica,2003,45(10):1218-1227.
[10] 王赞,高洪文.锦鸡儿属植物种质资源遗传多样性研究进展[J].植物遗传资源学报,2008,9(3):397-400.
[11] 陆景伟,王赞,张新全,裴玉红,高洪文.小叶锦鸡儿天然居群形态学性状遗传多样性分析[J].湖北农业科学,2008,47(3):328-331.
[12] 郭宏宇,高玉葆,马成仓,吴建波,王银华.内蒙古高原小叶锦鸡儿遗传分化的研究[J].西北植物学报,2008,28(1):0072-0077.
[13] Huang W D,Zhao X Y,Zhao X,Luo Y Q,Feng J,Su N.Genetic variation within the sand-fixation speciesCaraganamicrophylla(Leguminosae) in Horqin sandy land detected by inter-simple sequence repeats analysis[J].Biochemical Systematics and Ecology,2013,51(11):343-348.
[14] 韩永增,王赞,高洪文.小叶锦鸡儿SSR-PCR体系优化及应用[J].草业科学,2011,28(3):399-413.
[15] Yeh F C,Yang R C,Boyle T.POPGENE,Miceosoft Windows-based Freeware for Population Genetic Analysis[M].Edmonton,Canada:Molecular Biology and Biotechnology Center,University of Alberta,1999.
[16] Schneider S,Roessli D,Excoffier L.Arlequin Ver.2.000:A software for population genetics data analysis.Geneva:Genetics and Biometry Laboratory,University of Geneva,2000.
[17] Rohl F J.NTSYSpc:Numerical Taxonomy and Multivariate Analysis System,Version 2.02..New York:Exeter Software,Setauket,1998.
[18] 杨明博,杨劼,杨九艳,臧春鑫.鄂尔多斯高原不同降雨量地区中间锦鸡儿(CaraganadavazamciiSancz)种群的ISSR遗传分析[J].植物生理学通讯,2006,42(3):411-416.
[19] Hamrick J L,Godt M J.Allozyme diversity in plant species[A].Brown A D H,Clegg T,Kahler A L,Weir B S.(Eds.),Plant Population Genetics,Breeding and Genetic Resources[M].Sunderland,Massachusetts:Sinauer Associates,1990:43-63.
[20] Nybom H,Bartish I V.Effects of life history traits and sampling strategies on genetic diversity estimates obtained with RAPD markers in plants[J].Perspectives in Plant Ecology,Evolution and Systematics,2000,3(2):93-114.
[21] Loveless M D,Hamrick J L.Ecological determinants of genetic structure in plant populations[J].Annual Review of Ecology and Systematics,1984,15(1):65-95.
[22] Hamrick J L,Godt M J W.Effects of life history traits on genetic diversity in plant species[J].Philosophical Transactions:Biological Sciences,1996,351(9):1291-1298.
[23] Babbel G R,Selander R K.Genetic variability in edaphically restricted and widespread plant species[J].Evolution,1974,28(4):619-630.
[24] Pearse D E,Crandall K A.Beyond FST:Analysis of population genetic data for conservation[J].Conservation Genetics,2004,5(5):585-602.
[25] Ge S,Wang K Q,Hong D Y,Zhang W H,Zu Y G.Comparisons of genetic diversity in the endangeredAdenophoralobophyllaand its widespread congener,A.potaninii[J].Conservation Biology,1999,13(3):509-513.
[26] Ayala F J,Keger J A.Modern Genetics[M].Second edit Menlo Park,USA:Benjami-Cumings Publishing Company Inc.,1984.
[27] 马丹炜,王胜华,罗通,王文国,庄国庆,陈放.环境因子对盐生植物金发草遗传多样性的影响[J].中山大学学报(自然科学版),2006,45(2):73-77.
[28] 李静,叶万辉,葛学军. 生境片段化对植物的遗传影响[J].中山大学学报(自然科学版),2005,44(2):193-199.
[29] 黄文达,赵学勇,左小安,李玉强,连杰.不同生境梯度下差不嘎蒿(Artemisiahalodendron)种群ITS基因的序列分析[J].中国沙漠,2013,33(2):554-559.
[30] Huang W D,Zhao X Y,Zhao X,Zhao H L,Wang S K,Lian J.A combined approach using ISSR and ITS analysis for the characterization ofArtermisiahalodendronfrom Horqin Sandy Land,Northern China[J].Biochemical Systematics and Ecology,2011,39(4):346-351.
[31] 张颖娟,高瑞霞,李青丰.不同干扰生境中荒漠小灌木红砂种群遗传多样性研究[J].干旱区资源与环境,2008,22(3):147-151.
[32] 陈克霞,王嵘,陈小勇.天然片段生境中山姜(Alpiniajaponica)种群遗传结构[J].生态学报,2008,28(6):2480-2485.
[33] 黄文达,赵学勇,赵昕,赵哈林,连杰,王少昆.分子标记在种群遗传学研究中的应用[J].草业科学,2010,27(11):115-120.
[34] 府宇雷,钱吉,马玉虹,李军,郑师章.不同尺度下野大豆种群的遗传分化[J].生态学报,2002,22(2):176-184.
[35] 李珊,蔡宇良,钱增强,赵桂仿.云南金钱槭形态变异与遗传变异的相关性研究[J].生态学报,2005,24(5):925-931.
[36] Zuo X A,Zhao H L,Zhao X Y.Plant distribution at the mobile dune scale and its relevance to soil properties and topographic features[J].Environmental Geology,2008,54(5):1111-1120.
[37] Zuo X A,Zhao H L,Zhao X Y.Spatial pattern and heterogeneity of soil properties in sand dunes under grazing and restoration in Horqin sandy land,Northern China[J].Soil and Tillage Research,2008,99:202-212.
[38] Burke I C,Lauenroth W K,Riggle R.Spatial variability in soil properties in the shortgrass steppe:the relative importance of topography,grazing,microsite,and plant species in controlling spatial patterns[J].Ecosystems,1999,2(5):422-438.
[39] Sebastiá M T. Role of topography and soils in grassland structuring at the landscape and community scales[J].Basic and Applied Ecology,2004,5(4):331-346.
[40] Li Y Q,Zhao H L,Li Y L,Cui J Y,Zuo X A.Soil nitrogen mineralization and nitrification in different habitats,Horqin sandy land[J].Journal of Desert Research,2009,29(3):438-444.
[41] Li Y Q,Zhao H L,Yi X Y,Zuo X A,Chen Y P.Dynamics of carbon and nitrogen storages in plant-soil system during desertification process in Horqin sandy land[J].Environmental Science,2006,27(4):635-640.
[42] Holmgren M,Scheffer M.El Ninõ as a window of opportunity for the restoration of degraded arid ecosystems[J].Ecosystems,2001,4(2):151-159.
[43] Su Y Z,Zhao H L,Li Y L,Cui J Y.Influencing mechanisms of several shrubs on soil chemical properties in semi-arid Horqin sandy land,China[J].Arid Land Research and Management,2004,18(3):251-263.
[44] Li S G,Harazono Y,Zhao H L,He L,Chang X L.Micrometeorological changes following establishment of artificially establishedArtemisiavegetationon desertified sandy land in the Horqin sandy land,China and their implication in regional environmental change[J].Journal of Arid Environments,2002,52(1):101-119.
(责任编辑 王芳)
Genetic diversity analysis ofCaraganamicrophyllapopulation in different altitude gradients
HUANG Wen-da1,2, ZHAO Xue-yong1, LI Yu-lin1, LUO Ya-yong1, WANG Shao-kun1, PAN Cheng-chen1
(1.Naiman Desertification Research Station, Cold and Arid Region Environmental and Engineering Research Institute, Chinese Academy of Sciences, Lanzhou 730000, China;2.Key Laboratory of Stress Physiology and Ecology in Cold and Arid Regions, Lanzhou 730000;China)
Caraganamicrophyllais the most dominant and constructive shrub species. We evaluated the level of genetic variation within and among populations sampled from two different altitude gradients using inter-simple sequence repeat polymorphism (ISSR) molecular markers. The results showed that eight ISSR primers generated 142 bands, of which 126 (88.73%) were polymorphic. Based on Nei’s Gst value calculated by POPGENE, the gene diversity (h) and Shannon’s information index (I) was 0.292 9 and 0.441 7, respectively indicating considerable genetic variations at the species level. At the altitude gradients, the genetic diversity index in populations from low altitude region was higher than from high altitude region, shows that the gene exchange between populations was blocked by the increase of altitude.
Caraganamicrophylla; altitude gradients; ISSR
HUANG Wen-da E-mail:huangwenda2008@163.com
10.11829j.issn.1001-0629.2014-0379
2014-08-13 接受日期:2014-01-19
国家自然科学基金项目(41201561);中科院寒旱所人才基金项目(Y351151001);甘肃省自然科学基金(145RJYA269)
黄文达(1980-),女,甘肃平川人,助理研究员,博士,主要从事干旱区植物分子生态学研究。E-mail:huangwenda2008@163.com
Q943;S542+.903
A
1001-0629(2015)04-0552-08*
黄文达,赵学勇,李玉霖,罗亚勇,王少昆,潘成臣.不同海拔梯度下小叶锦鸡儿的居群遗传多样性[J].草业科学,2015,32(4):552-559.
HUANG Wen-da,ZHAO Xue-yong,LI Yu-lin,LUO Ya-yong,WANG Shao-kun,PAN Cheng-chen.Genetic diversity analysis ofCaraganamicrophyllapopulation in different altitude gradients[J].Pratacultural Science,2015,32(4):552-559.
