肉芽肿性乳腺炎的MRI诊断
2015-02-14陈园园张嫣王霞刘永熙沈敏郭庆禄
陈园园,张嫣,王霞,刘永熙,沈敏,郭庆禄
肉芽肿性乳腺炎(granulomatous mastitis,GM)是一种慢性、非干酪样、坏死性乳腺炎症,临床起病多隐袭,无明确感染史及典型的炎性表现,手术是其首选治疗方法。超声、钼钯对GM的诊断存在局限性,不能用于定性诊断。随着乳腺专用线圈、脂肪抑制技术、MRS等MRI硬、软件的发展,MRI在乳腺疾病诊断中的应用日趋成熟。本文拟对我院经病理证实的34例GM患者(手术病理证实30例,穿刺活检病理证实4例)的临床及MRI表现进行回顾性分析,以提高对该病的MRI诊断水平。
材料与方法
1.临床资料
34例均为女性,年龄20~44岁,中位年龄32岁。3例未婚,31例已婚(其中哺乳期1例)。病程2周~6个月,34例中1例有左乳肿块切除史,口服避孕药史不详。34例均以乳腺肿块就诊,其中2例于体检发现。10例出现乳腺肿块迅速增大,12例伴疼痛,3例伴局部皮肤发红及皮温升高。34例均经穿刺活检病理证实为GM,且均使用激素治疗,其中30例经激素治疗后行乳腺区段切除术,另4例未手术。
2.检查方法
MRI检查采用Aurora公司1.5T乳腺专用磁共振(DBMRI)扫描仪及乳腺专用线圈。患者取俯卧位,双乳自然下垂至线圈内,扫描范围包括双侧乳腺区及双侧腋窝区。扫描序列及参数:横轴面T1WI(层厚1.1mm,层 距0,TE 4.8ms,TR 29ms,视 野360mm×360mm,矩阵360×360×128)、横轴面脂肪抑制T2WI(层 厚3.0mm,层 距0,TE 68ms,TR 6680ms,视野360mm×360mm,矩阵320×256×40)、横轴面脂肪抑制T1WI(蒙片,层厚2.8mm,层距0mm,TE 5.3ms,TR 12.9ms,视 野360mm×360mm,矩阵285×296×84)及动态增强4回合扫描。MRI动态增强前先平扫蒙片,然后采用高压注射器经手背静脉以团注方式注入对比剂Gd-DTPA(剂量0.2mmol/kg,注射流率2.0mL/s),并注入等量生理盐水,注射对比剂后1min 30s行第一回合增强扫描,第2~4期增强扫描时间均间隔3min。扫描结束,自动重建并传至医生诊断工作站。乳腺MRI图像后处理在Aurora后处理工作站完成,自动获取包括多期扫描的多平面重组(MPR)图、最大强度投影(MIP)图及血管减影图,并绘制时间-信号强度曲线(TIC)。
3.分析方法
2003年美国放射学会将肿块样强化定义为病灶局限,呈局部肿块特征;非肿块样强化为不具备肿块特征的强化区域,其范围或很小或广泛,其内部强化特点是内部强化灶互不相连,被周围正常乳腺组织所分隔[1]。参考以上标准,并根据GM强化后的分布形态大致将病灶分为肿块样和非肿块样强化分布病灶。根据病变内部强化特征分为均匀强化、薄壁环形强化和厚壁环形强化。将所得TIC分为三型:Ⅰ型为流入型;Ⅱ型为平台型;Ⅲ型为流出型[2]。观察及诊断要点包括病灶形态学特点(大小、形态、边界、内部信号、周围腺体、局部皮肤改变、腋下淋巴结是否增大)和血流动力学表现(TIC类型及血管减影图)。最终诊断由1名专门从事乳腺影像诊断工作副主任医师及1名主治医师共同完成,二者意见不一致时,通过协商、讨论达成一致意见。
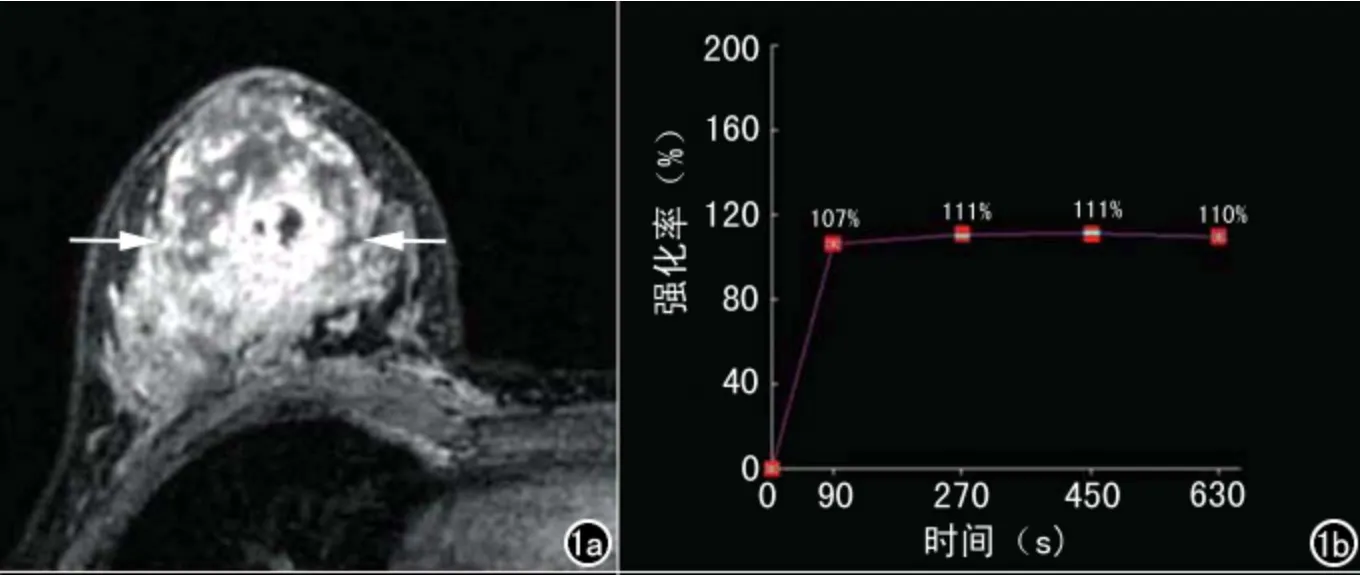
图1 31岁,GM。a)横轴面抑脂T1WI动态增强示右乳上方类圆形肿块样强化灶(箭),边缘毛糙,呈厚壁环形强化,其内斑片状坏死区无强化,内壁尚光滑,周围腺体结构充血水肿;b)TIC类型为平台型。
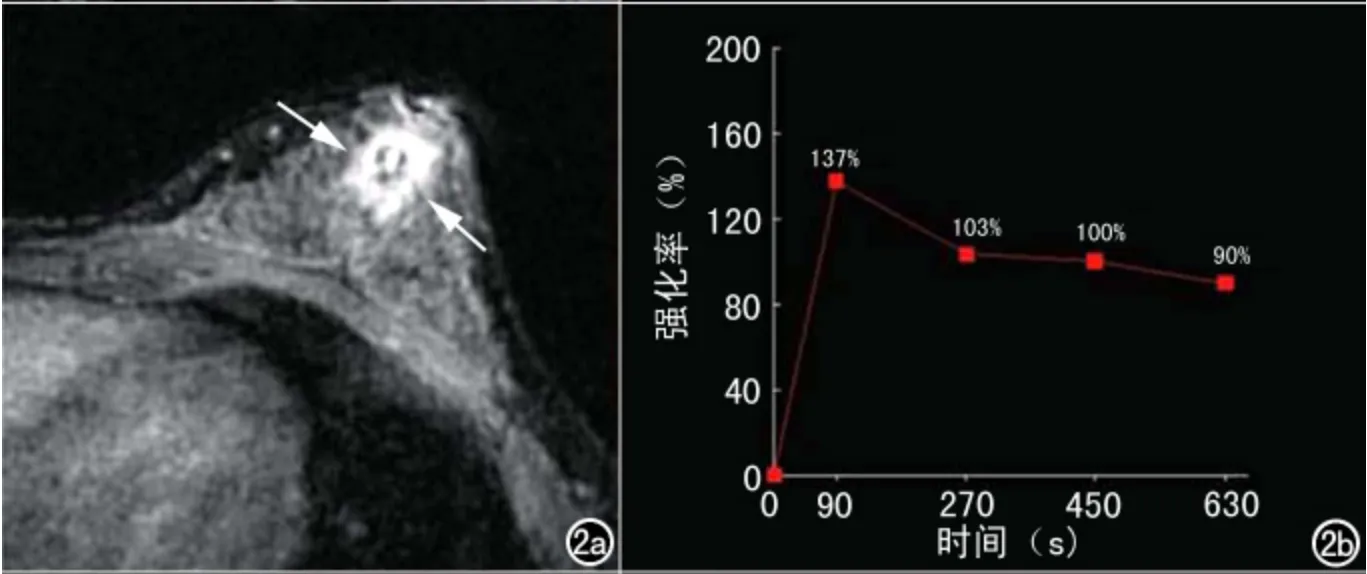
图2 22岁,GM,该例误诊为乳腺癌。a)横轴面抑脂T1WI动态增强示左乳上方不规则形态肿块样强化灶(箭),边界欠清,厚壁明显强化,边缘毛糙,其内可见斑片状坏死及壁结节;b)TIC类型流出型。
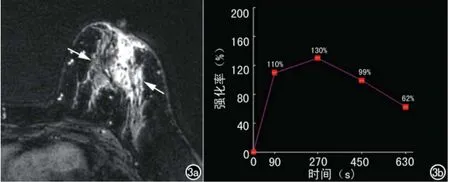
图3 30岁,GM。a)横轴面抑脂T1WI动态增强示左乳外上非肿块样强化灶(箭),呈段样分布,环形薄壁强化,内壁光整,周围腺体呈网格样;b)TIC类型为流出型。
结 果
34例GM中,5例位于乳腺中央区(占14.7%),2例位于乳晕后区(占5.9%),27例发生于乳腺外周区域(占79.4%)。32例双侧乳腺基本对称(占94.1%),2例患乳较对侧体积增大(占5.9%)。平扫T1WI上32例呈等信号,2例呈低信号,抑脂T2WI上32例呈混杂略高信号,2例呈等信号。MRI动态增强示病灶边界较平扫清晰,病灶强化后分布形态表现为肿块样强化分布1 1例和非肿块样强化分布2 3例。1 1例肿块样强化分布病灶最大径0.5~5.0cm;呈类圆形4例(图1),不规则形7例(图2);边缘清晰3例,边界欠清8例;11例中10例可见脓肿形成。23例非肿块样强化分布病灶中,呈段样强化分布15例(图3),区域样强化分布8例(图4),边界均模糊,22例可见脓肿形成。34例病灶内部强化表现为均匀强化3例、厚壁环形强化10例和薄壁环形强化21例。均匀强化病灶边界均清晰,呈斑片状强化病灶1例(图5),结节样强化病灶2例(图6),其中1例结节样强化病灶内可见脓肿形成,其他2例均未见脓肿形成,TIC均为流入型;31例厚壁、薄壁环形强化病灶内均可见脓肿形成(图1、7、8),脓肿内壁均光整,其中1例因脓肿内壁结节形成,且病灶TIC为流出型,误诊为乳腺癌(图2);34例病灶TIC呈流入型、平台型和流出型分别为17、9和8例。13例病灶周围腺体呈网格样改变,增强后明显强化,邻近皮肤受牵拉(图3、4a)。血管减影显示30例患乳病灶旁血管增加(图4b)。10例出现腋下淋巴结增大。
讨 论
肉芽肿性乳腺炎(GM)无明确感染病史及典型的炎性表现,目前多数学者认为该病属自身免疫性疾病[3]。Diesing等[4]认为该病与乳汁积聚所致的免疫现象和局部超敏反应以及口服避孕药史有关,还与感染、创伤、化学刺激等引起的小叶肉芽肿炎症有一定的关系。最近有研究表明,GM合并感染可能与棒状杆菌引起的感染有关[5]。GM的临床体征不明显,部分出现肿块迅速增大而表现为红肿热痛,当伴有淋巴结反应性增大时,易误诊为乳腺癌。影像学检查中钼靶及超声均无特异性,而MRI已成为乳腺疾病的重要检查手段,特别是随着乳腺专用线圈、脂肪抑制技术、DWI、尤其是动态增强MRI、灌注、MRS等的应用,大大提高了乳腺疾病的诊断符合率;对于需手术治疗的乳腺病灶,MRI可评估病灶范围,从而取得较好疗效[6]。
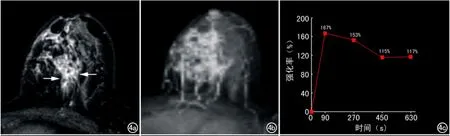
图4 32岁,GM。a)横轴面抑脂T1WI动态增强示左乳上方非肿块样强化灶(箭),呈区域分布,其内脓肿壁为环形强化,内壁光滑,周围腺体呈明显网格样均匀强化;b)血管减影图显示病灶周围血供明显增加;c)TIC类型为流出型。
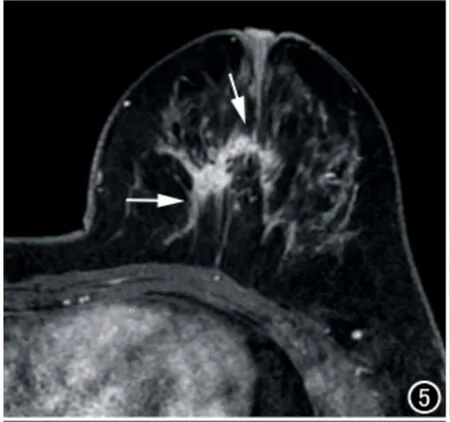
图5 36岁,GM。GM治疗后复查,横轴面抑脂T1WI动态增强示左乳条索状、斑片状均匀强化(箭),边界大部分清晰。
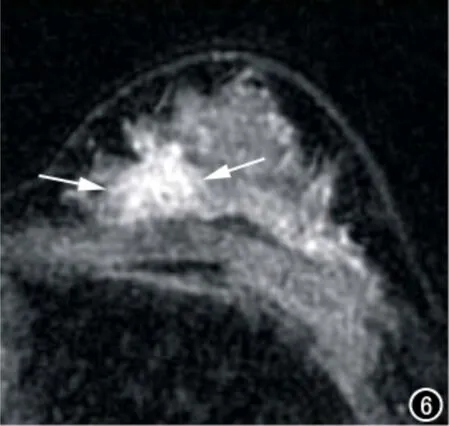
图6 28岁,GM。横轴面抑脂T1WI动态增强示左乳内上结节样均匀强化灶(箭)。

图7 29岁,GM。横轴面抑脂T1WI动态增强示右乳下方区域分布强化病灶(箭),排列如串珠样,薄壁环形强化,内壁光滑。
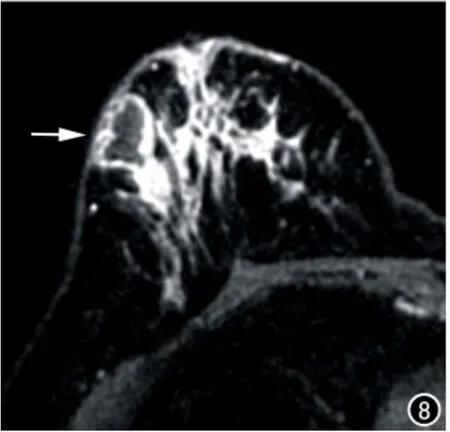
图8 34岁,GM。横轴面抑脂T1WI动态增强示右乳上方病灶明显环形薄壁强化(箭),其内脓肿形成,内壁光滑。
在非孕期,乳腺终末导管小叶的直径约1~8mm,腺小叶由小叶内终末导管和腺泡组成,其间松散的纤维结缔组织基质对小叶导管结构起支持作用[7]。GM的病理表现为以乳腺小叶为中心,多灶分布,小叶内末梢导管或腺泡大部分消失,多种炎性细胞(淋巴细胞、中性粒细胞、泡沫细胞)浸润并形成肉芽肿。病灶内常可见脓肿形成[8]。本组34例GM,表现为肿块样强化分布11例和非肿块样强化分布23例。笔者认为肿块样强化分布说明病灶周围纤维结缔组织对小叶结构的支持作用,使病灶相对局限;而非肿块样强化分布病灶说明炎性细胞的大量浸润使小叶结构融合、消失,并伴周围间质的急慢性炎症。
GM病灶内部强化方式主要表现为均匀强化、厚壁环形强化和薄壁环形强化。病灶均匀强化,无明显脓肿形成的原因,可能为炎症早期,病变局限,还未发展成脓肿。环形强化的出现主要与乳腺小叶中心非干酪样坏死伴肉芽肿形成有关。值得注意的是,GM的脓肿内壁清晰光滑,这与乳腺癌病灶内坏死不同,后者坏死内壁毛糙不光整,可有壁结节。本组中1例厚壁环形强化病灶,因其内出现壁结节,TIC为流出型,误诊为乳腺癌,对于这样的病例,诊断较困难,本例病灶内壁虽出现壁结节,但大部分内壁仍光整,TIC为流出型增加了诊断的难度。文献报道[9]30例GM的TIC类型为流入型、平台型、流出型分别占40%、50%和10%,而本组34例病灶TIC呈流入型、平台型和流出型分别为17例(占50%)、9例(占26.5%)和8例(占23.5%),可见GM的TIC类型虽以流入型为主,但平台型及流出型也占了很大比例,因此TIC类型不能作为GM的有效诊断依据,应更加关注病灶形态特征。
GM由于炎性细胞浸润,肉芽组织形成,周围乳腺组织充血肿胀,血管增加,血管减影图表现为病灶旁血管增多。该征象与乳腺癌周围血供增多相似,但后者的血供增多是由于恶性肿块的迅速生长需要更多的营养血管支持所致。刘万花[10]认为三维血管减影图有助于乳腺疾病的诊断,而本组34例中30例血管减影图显示患乳病灶旁血管增加,与文献报道相仿,但此点与乳腺癌的鉴别诊断意义不大。
实际工作中,GM与浸润型乳腺癌最难鉴别。乳腺癌的发病年龄为中老年女性,但有年轻化趋势,早期可表现为无痛性肿块、质地硬、活动度差、生长较快,中晚期可侵犯皮肤、乳头及出现淋巴结转移,双乳多发少见。GM多见于青年已婚已育女性,偶然发现或病灶迅速增大而就诊,大部分为体检出现病灶迅速增大就诊,无乳腺癌触诊征象。MRI病灶形态上,乳腺癌表现为毛刺、分叶、肿块内不规则形态坏死、内含结节样改变、周围腺体结构少有网格样改变;而GM病灶边缘可清晰或模糊,周围组织炎症浸润呈膨胀样改变,无毛刺及分叶,大部分病灶内有脓肿形成,且内壁光整。TIC类型上,乳腺癌多以平台型及流出型为主,而GM多以流入型及平台型为主,对于TIC类型为平台型及流出型的病例,TIC的诊断意义有限。
[1]American College of Radiology(ACR).Breast imaging reporting and data system atlas(BI-RADS atlas)[S].ACR,2003.
[2]Kuhl CK,Mielcareck P,Klaschik S,et al.Dynamic breast MR imaging:are signal time course data useful for differential diagnosis of enhancing lesions in dynamic breast MR imaging?[J].Radiology,1999,211(1):101-110.
[3]Akbulut S,Yilmaz D,Bakir S.Methotrexate in the management of idiopathic granulomatous mastitis:review of 108published cases and report of four cases[J].Breast J,2011,17(6):661-668.
[4]Diesing D,Axt Fliedner R,Hornung D,et al.Granulomatous mastitis[J].Arch Gynecol Obstet,2004,269(4):233-236.
[5]Renshaw AA,Derhagopian RP,Gould EW.Cystic neutrophilic granulomatous mastitis:an underappreciated pattern strongly associated with gram-positive bacil[J].Am J Clin Pathol,2011,136(3):424-427.
[6]张超杰,范培芝,刘鹏,等.动态磁共振成像在肉芽肿性乳腺炎手术评估中的应用价值[J].中国现代医学杂志,2012,22(21):86-89.
[7]艾伦,萧帕雷.乳腺X线影像图谱[M].沈阳:科学技术出版社,2011:2.
[8]刘佩芳.浆细胞性乳腺炎和肉芽肿性乳腺炎的影像学诊断及鉴别诊断[J].国际医学放射学杂志,2009,32(3):268-273.
[9]孙东方,谭红娜,彭卫军,等.非产后期乳腺炎的MRI表现分析[J].放射学实践,2011,26(11):1176-1179.
[10]刘万花.3.0动态增强MR血管成像对乳腺良恶性病变的诊断价值[J].东南大学学报(医学版),2013,32(4):389-393.