胸膜孤立性纤维瘤的CT表现
2015-02-14王玉婕黄遥唐威刘莉吴宁
王玉婕,黄遥,唐威,刘莉,吴宁
孤立性纤维瘤(solitary fibrous tumor,SFT)作为一种独立的间叶组织来源的梭形细胞软组织肿瘤,可发生于胸膜、纵隔、腹膜、甲状腺、会厌、涎腺、肾脏、乳腺等,其中最好发于胸膜[1-2]。胸膜孤立性纤维瘤(solitary fibrous tumor of the pleura,SFTP)来源于胸膜间皮下的结缔组织,约占所有胸膜肿瘤的5%[3-4]。与胸膜肿瘤中常见的胸膜间皮瘤不同,SFTP的主要治疗手段为根治性切除并长期随诊,预后较好[5]。SFTP于1931年由Klemperer和Rabin首次报道,据统计,2002年1月-2012年1月国外文献共报道1760例[2]。近年来,国内对SFT也有报道,但多以个案报道及临床病理学分析为主。本文通过复习33例SFTP患者的CT图像及临床资料,总结SFTP的CT表现,以提高对该病的认识及诊断水平。
材料与方法
1.一般资料
搜集我院2005年1月-2013年12月经病理证实的SFTP患者33例,男13例,女20例,男女比例1:1.5,年龄25~69岁(中位年龄44岁),40岁以上者23例(占69.7%)。33例SFTP患者中,临床无症状者16例(占48.5%),伴非特异性呼吸系统症状17例(占51.5%),包括胸闷、气短、胸痛、咳嗽;伴体重减轻4例;伴双下肢水肿及杵状指1例。
2.仪器与方法
33例患者采用64层螺旋CT扫描20例,16层螺旋CT扫描8例,8层螺旋CT扫描5例。行CT平扫12例(其中3例同时行增强扫描),增强扫描24例(非离子型对比剂300mg I/mL,采用高压注射器以流率2.5mL/s经肘静脉注射,延迟时间30/35s);扫描范围自胸廓入口至肺底;层厚及间距均为5.0mm。所有病例均行CT薄层重建,重建层厚及间距为1.25mm/0.8mm或1.0mm/0.8mm。
3.CT图像诊断标准
根据病变长轴与胸膜的关系将病变部位记录为邻近肋胸膜、纵隔胸膜、膈肌胸膜及叶间胸膜,以病变最大截面的长径作为肿瘤的最大径。以同层背部肌肉平均CT值为标准,将肿瘤的强化程度分为轻度强化(低于肌肉)、中度强化(与肌肉相仿)、高度强化(高于肌肉)。肿瘤内无肉眼可辨的密度不均匀区称为均匀强化;见无明显分界的高低混杂密度区称为“地图样”不均匀强化;见条形、纡曲走形的血管影称为“匍样血管”[6]。
4.图像分析
由2名放射科医师对所有患者的CT图像进行复阅、评判,二者意见不一致时,经讨论协商达成一致意见。观察项目包括肿瘤的部位、数目、大小、边缘、密度特征(囊变坏死、钙化)、增强方式(均匀强化、地图样不均匀强化、匍样血管)、伴随征象(肺组织膨胀不全、胸腔积液)等。
5.病理检查方法
手术标本经10%中性福尔马林溶液固定,石蜡包埋、切片,经苏木素-伊红染色及免疫组织化学检测,检测指标主要包括CD34、CD99、Vimentin、Desmin、Bcl-2、S-100、Actin及SMA。
6.统计学方法
采用SPSS 19.0软件进行统计分析。计数资料比较采用Fisher′s精确检验,以P<0.05为差异有统计学意义。
结 果
1.影像学表现
33例SFTP共检出35个病灶。35个病灶CT图像上均表现为宽基底贴邻胸膜的结节/肿块,其中肋胸膜14个(图1),纵隔胸膜12个,膈肌胸膜7个(其中5个呈“蕈伞状”坐于膈肌上),叶间胸膜2个(图2),但手术中所见的“蒂”样结构CT中均未明确显示。32个病灶位于中下胸腔(91.4%),2个呈“铸型”镶嵌于肋膈角内。
35个病灶最大径1.0~19.0cm,中位数7.7cm,≥10.0cm者15个(占42.9%),<3.0cm者3个(占8.6%)。CT表现与肿瘤大小的关系见表1。伴囊变、坏死(图3)的11个病灶中,10个(10/11,占90.9%)最大径≥10.0cm;伴钙化的7个病灶中,5个(5/7,占71.4%)最大径≥10.0cm;伴胸腔积液(8例)的10个病灶中,最大径≥10.0cm者8个(8/10,占80.0%),另2个为多发病灶中较小者。
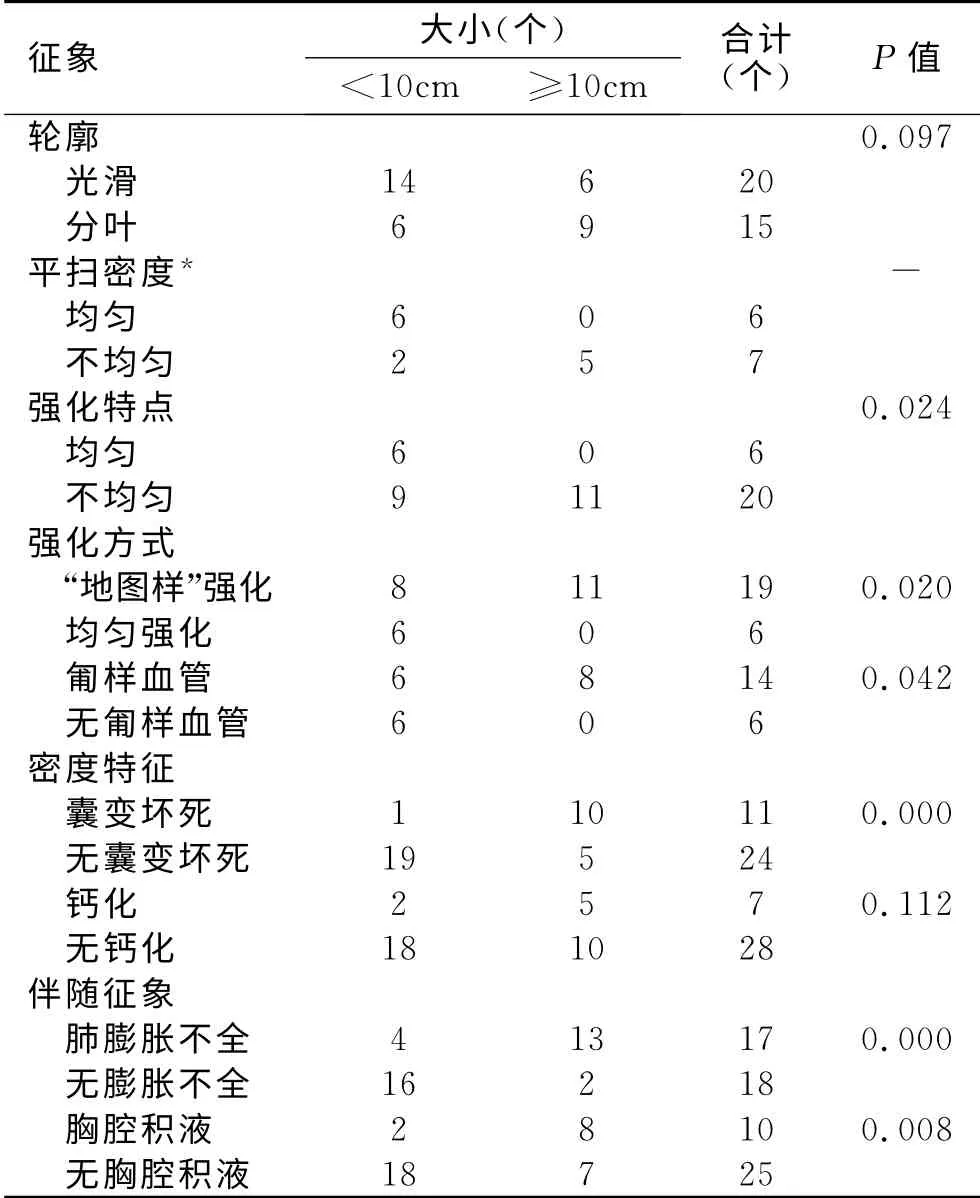
表1 SFTP的主要CT表现与大小的关系
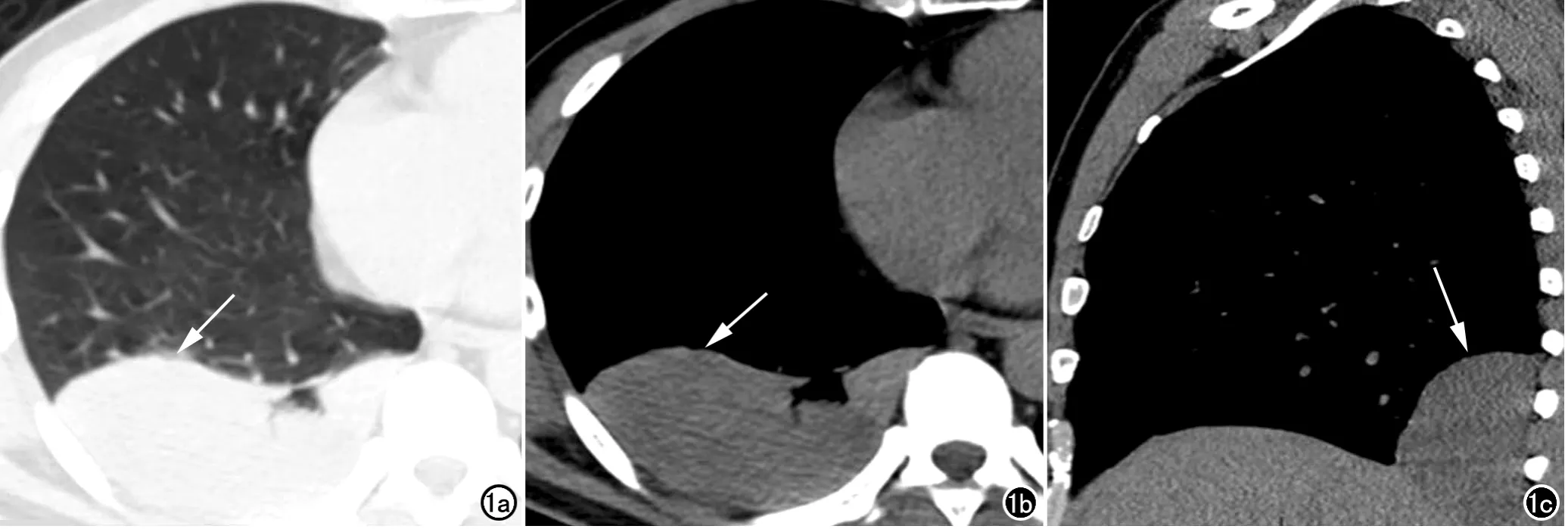
图1 男,44岁,右下后肋胸膜SFTP。a)横轴面CT平扫(肺窗)示右下后胸腔肿块,大小约10.0cm×4.6cm×8.0cm,边界较清(箭);b)横轴面CT平扫(纵隔窗)示右下后胸腔软组织肿块,呈等密度,边界清楚(箭);c)CT平扫矢状面重组图(纵隔窗)示肿块呈“铸型”镶嵌于右侧后肋膈角(箭)。
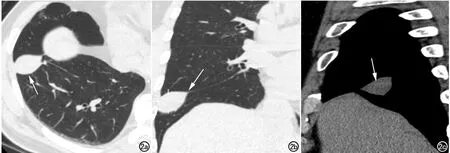
图2 男,65岁,右侧斜裂胸膜SFTP。a)横轴面CT平扫(肺窗)示右侧斜裂胸膜结节呈“双凸透镜”样,大小约3.7cm×3.0cm×2.0cm,边界清楚(箭);b)CT平扫冠状面重组图(肺窗)示“胸膜尾征”(箭);c)CT平扫矢状面重组图(纵隔窗)示肿块宽基底贴邻右侧斜裂胸膜(箭),呈等、偏高密度,密度均匀,边界清楚。
13个CT平扫病灶,与同层背部肌肉比较,呈低密度1个,等密度9个,高密度3个;6个密度均匀(10~3 0HU),最大径均<1 0.0cm,7个密度不均(4~70HU),≥10.0cm者5个。26个增强扫描病灶中,呈中、高度强化22个,轻度强化4个。均匀强化(30~80HU)6个;“地图样”不均匀强化(16~127HU)19个,其中13个同时伴“匍样血管”(图4、5);另1例仅见“匍样血管”。
本组中3例恶性SFTP共4个病灶(4/35,占11.4%),最大径≥10.0cm者3个,伴囊变、坏死3个,伴钙化3个,2个病灶破坏邻近肋骨骨质,另有1个病灶伸入纵隔生长。
2.手术及病理结果
33例SFTP患者共35个病灶,1例为我院病理科对外院穿刺活检标本会诊后证实,余32例均由我院胸外科手术切除并经病理证实。术中完整切除34个病灶(另1例行放射治疗,未手术),其中2例均有2个病灶,并明确34个病灶的来源及与胸膜的关系如下:脏层胸膜来源25个(其中2个来自叶间胸膜),壁层胸膜来源(包括壁层胸膜、纵隔胸膜及膈肌胸膜)9个;带蒂肿瘤13个,宽基底贴邻胸膜21个。
35个病灶均经组织病理学及免疫组织化学确诊为SFTP,CD99(12/12)、Bcl-2(27/27)、Vimentin(13/13)阳性率100%;CD34(32/34)阳性率94.1%;Actin(5/5)、Desmin(16/16)、S-100(10/10)阴 性 率100.0%;SMA(19/20)阴性率95.0%。
本组35个病灶根据①细胞丰富;②较多核分裂相(10个高倍镜视野下核分裂相>4个);③细胞多形性;④出血、坏死等标准鉴别SFTP的良恶性,其中,良性31个(占89.6%),恶性4个(占11.4%)。
讨 论
胸膜孤立性纤维瘤(SFTP)是一种罕见的梭形细胞肿瘤,发病率为2.8/100000,该病年龄分布较广,可发生于5~87岁,以40~60岁为主,男女发病率相仿[5]。本组病例年龄分布亦广泛,且中位年龄44岁,与文献报道相仿,但女性较男性多(约1.5:1)。
SFTP呈慢性病程,50.0%以上的患者为偶然发现,不伴或仅伴咳嗽、胸闷、气短、胸痛等非特异性呼吸系统症状。另有10.0%~22.0%的患者伴杵状指或肥大性肺性骨关节病[5-6]。本组病例伴临床症状者51.5%,与文献报道一致;仅1例伴双下肢水肿及杵状指(占3.0%)。
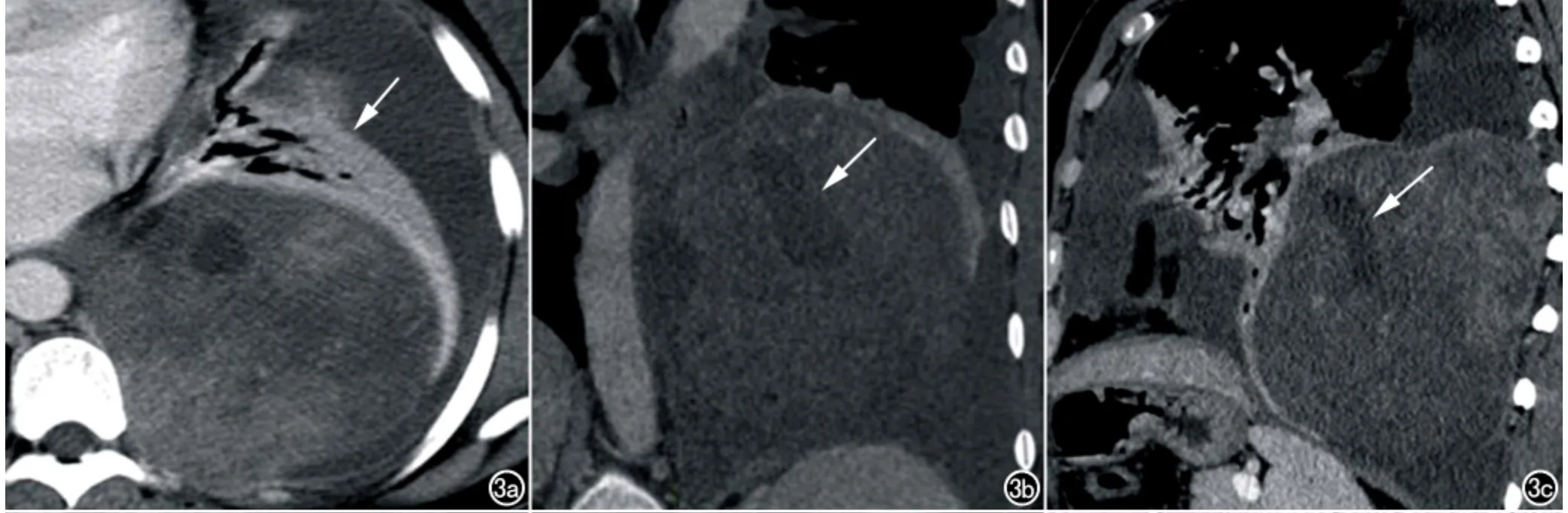
图3 女,41岁,左侧纵隔胸膜SFTP。a)横轴面CT增强扫描(纵隔窗)示左侧胸腔巨大肿块,大小约14.5cm×7.0cm×11.0cm,呈“地图样”不均匀强化,左肺膨胀不全(箭),左侧胸腔积液;b)CT增强扫描冠状面重组图(纵隔窗)示肿块内低密度囊变、坏死区(箭);c)CT增强扫描矢状面重组图(纵隔窗)示肿瘤内低密度囊变、坏死区(箭)。
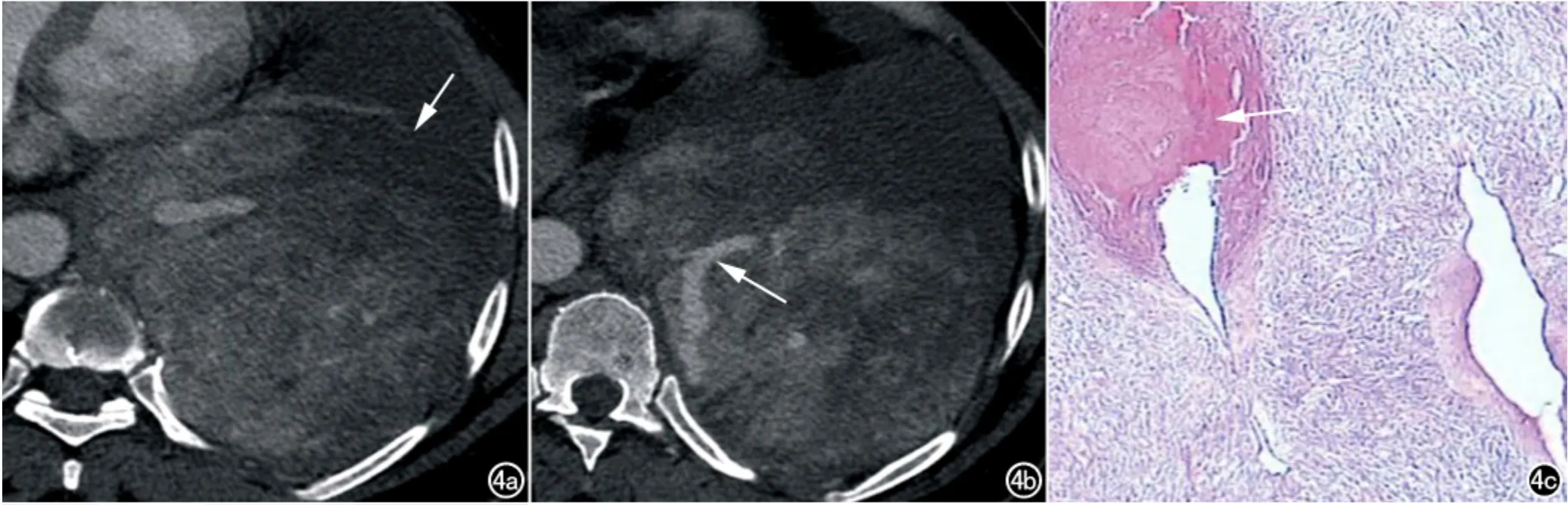
图4 女,51岁,左侧纵隔胸膜SFTP。a)横轴面CT增强扫描(纵隔窗)示左侧胸腔巨大肿块,大小约15.0cm×15.0cm×15.0cm,呈“地图样”不均匀强化(箭),可见少量胸腔积液;b)横轴面CT增强扫描(纵隔窗)示肿块内部粗大、纡曲走行血管影(箭);c)镜下可见粗大血管及大量出血(×100,HE,箭)。
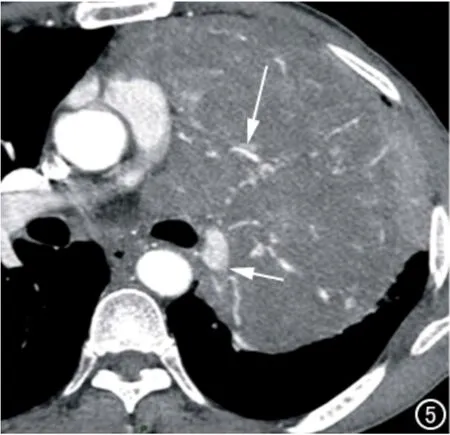
图5 男,61岁,左侧纵隔胸膜恶性SFTP。横轴面CT增强扫描(纵隔窗)示左侧纵隔旁巨大软组织肿块伸入纵隔生长,大小约16.4cm×9.7cm×12.8cm,包绕肺动脉主干及左下肺动脉(短箭),并可见纡曲走行的“匍样血管”(长箭)。
SFTP通过手术或穿刺活检获得足够的组织经病理及免疫组织化学染色确诊[7]。显微镜下肿瘤细胞的典型排列方式为“无特征性结构”,细胞稀疏区和细胞密集区共存,大部分排列呈短席纹状、条束状,被纤维组织间质分隔,具有血管外皮细胞瘤样分支状血管。免疫组织化学染色表现为CD34、CD99阳性,Bcl-2部分阳性,Actin、Desmin阴性[8]。本组CD99(12/12)、Bcl-2(27/27)、Vimentin(13/13)阳性率100%;CD34(32/34)阳性率94.1%;Actin(5/5)、Desmin(16/16)、S-100(10/10)阴 性 率100%;SMA(19/20)阴 性 率95.0%,支持SFTP诊断,与文献相符。
SFTP好发于中下胸腔,大小不一[9-10],本组32个病灶(91.4%)位于中下胸腔,最小者最大径约1.0cm,最大者占据整个胸腔,与文献报道相符。另外,发生于特定部位的肿瘤有其特征性的形态特点,比如发生于后肋胸膜近肋膈角处的病变呈“铸型”镶嵌于肋膈角内(本组2个病灶),而发生于膈肌胸膜的SFTP多呈“蕈伞样”坐于膈肌之上(本组5个病灶),有助于诊断。CT可根据肿瘤与胸膜及肺组织的关系判断其胸膜来源,但很难判断病灶来源于脏层胸膜还是壁层胸膜,并很少显示术中所见的“蒂”样结构。有报道称可根据肿瘤的供血血管来源判断胸膜来源,并称“蒂”状结构即为供血血管[7],但本组病例未得到证实。
CT表现与肿瘤大小相关,病灶较小时密度通常较均匀,增强扫描呈均匀强化,伴随征象少;较大者通常密度不均,呈不均匀强化,伴随征象多[2]。本组病例显示,随着肿瘤增大,表现为“地图样”不均匀强化及“匍样血管”的概率增加,且差异具有统计学意义(P=0.020,P=0.042),前者是因肿瘤体积增大时,内部发生囊变、坏死的概率增加,有学者还认为与肿瘤组织学排列的多种形态有关[7,11];后者则与肿瘤内部血管外皮细胞瘤样分支状血管有关,有的可见粗大的血管穿行。当肿瘤较大时,其内部容易发生囊变、坏死,本组11个伴囊变、坏死病灶,其中10个最大径≥10.0cm(占90.9%),相对于1个最大径<10.0cm的病灶(占9.1%,1/11)具有显著统计学意义(P=0.000)。另有文献报道认为7.0%~26.0%的SFTP可伴点状、线样或粗大钙化[4-5],本组伴钙化7个(占20.0%),其中5个(占71.4%)最大径≥10.0cm,亦与文献报道相符,但与最大径<10.0cm者比较不具有统计学差异(P=0.101)。随着肿瘤增大,出现胸腔积液等伴随征象的概率增加[5],在最大径<10.0cm及≥10.0cm两组间具有显著性差异,与文献报道相符。
平扫时SFTP多呈中等或略高密度,这与肿瘤内部致密的胶原组织及大量的血管网有关[5,12],本组13个平扫病灶中12个呈中高密度(占92.3%),与文献报道相符。增强扫描SFTP较胸腔其它软组织肿瘤强化程度高,多呈中等偏高程度强化,这与肿瘤内部的血管分布有关[3]。本组26个增强扫描病灶中,22个(84.6%)呈中、高程度强化,与文献报道相符。
根据England等[13]提出的显微镜下鉴别良恶性SFTP的标准,12.0%~37.0%的SFTP为恶性,其中约63.0%可浸润周围组织。本组恶性SFTP 3例,共4个病灶(占11.4%,4/35),最大径≥10.0cm者3个(75.0%,3/4),伴囊变、坏死3个,伴钙化3个,伴邻近胸壁破坏或纵隔浸润3个(75.0%,3/4),均与文献报道相符。
虽然SFTP有一些特征性的表现,但其可发生于胸膜的任何部位,有时需与局限性胸膜间皮瘤、胸膜肉瘤、孤立性胸膜转移瘤等进行鉴别,而后者常伴有其他恶性征象,可结合病史及影像学表现综合诊断。
另外,贴邻后纵隔及侧胸壁的SFTP需与神经源性肿瘤鉴别,后者与肋骨及椎体相交处可见压迫性骨质吸收所致的凹陷切迹,局部肋间隙、椎间孔可增宽[14]。贴邻前、中纵隔的SFTP有时需与纵隔肿块鉴别,后者多沿纵隔间隙生长,伴纵隔增宽,但很少引起纵隔移位[5]。位于中下胸腔的肿瘤还需与膈膨出、膈疝等鉴别,后者常可见腹腔组织及脂肪组织突入胸腔,有助于两者鉴别。叶间胸膜来源的SFTP需与肺实质内病变鉴别,如果发现肺内较小的病变,可见“胸膜尾征”及“双凸透镜征”[4,7],需考虑叶间胸膜来源SFTP的可能。
SFTP的CT表现具有一定特征性,常表现为孤立的软组织病灶,好发于中下胸腔,大小不一,边界清晰,宽基底贴邻胸膜。CT表现与肿瘤大小相关,肿瘤较大时密度多不均匀,增强扫描可见“地图样”不均匀强化和“匍样血管”,可伴囊变、坏死、钙化。虽然恶性SFTP通常体积较大,且易伴囊变、坏死及钙化,但是单从CT表现很难鉴别SFTP的良恶性,如果伴有肿瘤邻近组织浸润、破坏则应考虑恶性SFTP的可能。
[1]Robinson LA.Solitary fibrous tumor of the pleura[J].Cancer Control,2006,13(4):264-269.
[2]Cardillo G,Lococo F,Carleo F,et al.Solitary fibrous tumors of the pleura[J].Curr Opin Pulm Med,2012,18(4):339-346.
[3]Rosado-de-Christenson ML,Abbott GF,McAdams HP,et al.From the archives of the AFIP:Localized fibrous tumor of the pleura[J].Radiographics,2003,23(3):759-783.
[4]Salahudeen HM,Hoey ET,Robertson RJ,et al.CT appearances of pleural tumours[J].Clin Radiol,2009,64(9):918-930.
[5]Luciano C,Francesco A,Giovanni V,et al.CT signs,patterns and differential diagnosis of solitary fibrous tumors of the pleura[J].J Thorac Dis,2010,2(1):21-25.
[6]Cardinale L,Allasia M,Ardissone F,et al.CT features of solibary fibrous tumor of the pleura experience in 26patients[J].Radiol Med,2006,111(5):640-650.
[7]Chu X,Zhang L,Xue Z,et al.Solitary fibrous tumor of the pleura:an analysis of forty patients[J].J Thorac Dis,2012,4(2):146-154.
[8]de Perrot M,Fischer S,Bründler MA,et al.Solitary fibrous tumors of the pleura[J].Ann Thor Surg,2002,74(1):285-293.
[9]Truong M,Munden RF,Kemp BL.Localized fibrous tumor of the pleura[J].AJR,2000,174(1):42.
[10]Ordóńéonez NG.Localized(solitary)fibrous tumor of the pleura[J].Adv Anat Pathol,2000,7(6):327-340.
[11]Bicer M,Yaldiz S,Gursoy S,et al.A case of giant benign localized fibrous tumor of the pleura[J].Eur J Cardiothorac Surg,1998,14(2):211-213.
[12]周涛,潘爱珍,陈颖瑜,等.胸膜孤立性纤维性肿瘤的MSCT及病理学特征[J].放射学实践,2010,25(1):40-43.
[13]England DM,Hochholzer L,McCarthy ML.Localized benign and malignant fibrous tumors of the pleura.A clinicopathological review of 223cases[J].Am J Surg Pathol,1989,13(8):640-658.
[14]Tateishi U,Gladish GW,Kusumoto M,et al.Chest wall tumors:radiologic findings and pathologic correlation:part 1.Benign tumors[J].Radiographics,2003,23(6):1477-1490.