立方氧化亚铜的制备及在无酶葡萄糖传感器中的应用
2015-02-14钟小辉胡万平
钟小辉,胡万平,陈 婷,张 进,2
(1.重庆文理学院材料与化工学院,重庆 永川 402160;2.重庆文理学院新材料技术研究院,重庆 永川 402160)
近年来,由于葡萄糖传感器具有高的灵敏度、选择性、重现性及装置简易等特点而引起众多科研工作者的关注[1].葡萄糖检测广泛应用于临床诊断、医疗和食品工业中[2],基于葡萄糖氧化酶的葡萄糖酶传感器已被广泛应用[3-4].由于酶电极稳定性低,反应条件苛刻且酶固定过程繁琐,容易脱落使其稳定性不好[5-7].所以,高灵敏度和高稳定性的无酶葡萄糖传感器是重要的研究方向之一.Cu2O是一种新型的P 型半导体材料,具有活性的电子-空穴对系统,表现出良好的催化活性[8],在电极材料、太阳能电池、传感器和光催化等方面有潜在的应用价值[9].近年来已研究制备出多种形貌的Cu2O 广泛应用于光催化技术中[10-11],而对其电化学性质有少量研究[12-13].本实验通过液相还原法控制合成立方结构的Cu2O 晶体,利用Nafion 将Cu2O固定于玻碳电极表面构建无酶葡萄糖传感器,研究合成产物Cu2O 的电催化性能,探讨Nafion/Cu2O/GCE 电极对葡萄糖的电催化活性.
1 实验部分
1.1 仪器与药品
SEM (美国FEI Quanta 250);X 射线衍射分析仪(通达TD-3500X);μAUTOLAB Ⅲ电化学工作站(瑞士万通);电子天平(赛多利斯科学仪器(北京)有限公司);DZF -6020 型真空干燥箱(上海齐欣科学仪器有限公司);TGL -16C 型离心机(上海安亭科学仪器有限公司);KQ3200DB 型数控超声波清洗仪器(昆山市超声仪器有限公司);SZCL-2 型数显智能控温磁力搅拌器(巩义市予华仪器有限责任公司).
本实验所用药品有:CuCl2·2H2O,NaOH,抗坏血酸(AA),葡萄糖(Glu),果糖(Fru),蔗糖(Suc)(均为分析纯,成都科龙化工试剂),多巴胺(DA),尿酸(UA),Nafion(美国Sigma).实验用水为二次蒸馏水.
1.2 实验步骤
1.2.1 立方Cu2O 的合成
按照文献[14]的方法,在55 ℃不断搅拌下,向100 mL 0.01 mol/L CuCl2·2H2O 浅绿色水溶液中加入10 mL 的2 mol/L NaOH 溶液,将得到的深棕绿色悬浮液继续搅拌0.5 h,然后缓慢地逐滴加入10 mL 0.6 mol/L 的AA 溶液,将所得混合物在55 ℃恒温搅拌3 h 后离心,分别用蒸馏水和乙醇清洗沉淀物,最后在40 ℃真空干燥12 h 得到立方结构的Cu2O.
1.2.2 Nafion/ Cu2O/GCE 修饰电极的制备
将玻碳电极依次用1.0 μm、0.3 μm 的氧化铝粉在抛光布上抛光至镜面,依次用1∶1 乙醇、1∶1 HNO3和蒸馏水超声清洗.彻底清洗后,电极在0.5 ~1 mol/L H2SO4溶液中,-1.0 ~1.0 V扫描范围内循环伏安法活化至稳定为止.最后在0.2 mol/L KNO3中记录1 mol/L K3Fe(CN)6溶液的循环伏安曲线,扫描范围0.1 ~0.6 V,所得的氧化还原峰电位差在80 mV 以下,电极方可使用.将制备的Cu2O 配成5 mg/mL 溶液,用移液枪量取5 μL 的Cu2O 悬浮液滴涂于预处理后的玻碳电极表面,干燥后滴加3 μL 1﹪ Nafion 溶液,自然晾干后在4 ℃条件下保存备用.
1.2.3 电化学检测
在μAUTOLAB Ⅲ电化学工作站中以Nafion/Cu2O/GCE 修饰电极或裸GCE 作为工作电极、饱和甘汞电极(SCE)为参比电极、铂电极为对电极的三电极体系中进行电化学检测,支持电解质溶液为0.1 mol/L NaOH 溶液.在0 ~0.8 V 下进行循环伏安扫描,扫速为100 mV/s ,得到循环伏安曲线.采用计时电流法向0.1 mol/L 的NaOH 溶液间隔90 s 连续加入一定浓度的葡萄糖,得到优化工作电位.在选择的工作电位下采用计时电流法研究该修饰电极对葡萄糖的电催化活性.
2 结果与讨论
2.1 氧化亚铜的表征
图1(a)和图1(b)分别是Cu2O 的SEM 图和XRD 衍射图谱.由图1(a)可以看出,利用此方法制得的Cu2O 为立方结构,粒长约为500 nm.从图1(b)中可以看出,该Cu2O 样品XRD衍射图谱的2θ 值依次为29.6°、36.5°、42.4°、52.6°、61.5°、73.6°和77.5°,与标准卡片(JCPDS 99-0041)相比较确定为单相赤铜矿Cu2O 晶体.
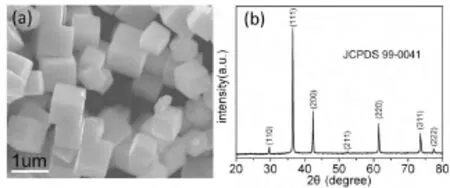
图1 Cu2O 样品的SEM 图(a)和XRD 衍射图谱(b)
2.2 葡萄糖在Nafion/ Cu2O/GCE 电极上的电化学行为
利用循环伏安法考察了葡萄糖在Nafion/Cu2O/GCE 电极上的电化学行为,如图2所示.图2a 是裸玻碳电极在含1 ×10-3mol/L 葡萄糖的NaOH 溶液中的CV 曲线,图2b 是Nafion/Cu2O/GCE 电极在空白NaOH 底液中的CV 曲线,图2c 是Nafion/Cu2O/GCE 电极在含1 ×10-3mol/L 葡萄糖的NaOH 溶液的CV 曲线.由图2a和图2c 可以看出:相对于裸玻碳电极,Nafion/Cu2O/GCE 电极对葡萄糖有明显的电化学响应.由图2b 和图2c 对比看出:葡萄糖加入,修饰电极的氧化电流明显增大,说明此修饰电极对葡萄糖产生了电催化氧化.可能是由于Cu(Ⅲ)作为葡萄糖氧化的电子转移介体[15],有效地促进葡萄糖与电极之间的电子转移而提高了Cu2O 电催化葡萄糖的性能,同时由于立方状Cu2O 大的比表面积,也有利于电化学反应的进行.

图2 裸玻碳电极(a),Nafion/Cu2O/GCE 电极在含1 ×10 -3 mol/L 葡萄糖的NaOH 溶液(c)及Nafion/Cu2O/GCE 电极在空白NaOH 溶液(b)的CV 曲线
2.3 工作电位的选择
实验中采用计时电流法考察了Nafion/Cu2O/GCE 电极对葡萄糖电催化氧化时工作电位的影响,在0.2 ~0.7 V 电位范围内研究了0.2 V、0.3 V、0.4 V、0.5 V、0.6 V、0.7 V 电位下响应电流的大小.结果表明,随着电位的升高,修饰电极对葡萄糖的响应电流逐渐增大,但在0.7 V 的工作电位下,基线电流稳定性明显下降.因此,实验中采用0.6 V 作为Nafion/Cu2O/GCE 电极电催化葡萄糖的工作电位.
2.4 扫速对葡萄糖伏安行为的影响
在含1 ×10-3mol/L 葡萄糖的NaOH 溶液中,考察了扫速对葡萄糖电化学行为的影响.由图3可知,当扫速由25 mV/s 增至169 mV/s 时,在0.6 V 工作电位下,葡萄糖的氧化电流值随着扫速的增加而增大,电流值与扫速成线性关系:I = 0.131 5 ν +10.371,单位I(μA),ν(mV/s),相关系数R = 0.999 7 ,说明葡萄糖在Nafion/Cu2O/GCE 电极上的电催化氧化过程是受吸附控制的.

图3 不同扫速下1 ×10 -3 mol/L 葡萄糖在Nafion/Cu2O/GCE 电极上的循环伏安曲线(a)、扫速与电流的线性关系图(b)
2.5 传感器对葡萄糖的电流响应及标准曲线的建立
图4(a)为Nafion/Cu2O/GCE 电极在0.6 V工作电位下,向0.1 mol/L NaOH 溶液间隔90 s连续加入不同浓度葡萄糖的计时电流曲线,图4(b)为对应葡萄糖浓度下绘制的响应电流—浓度的线性关系图.为了使传感器达到较高的稳定性,在加入葡萄糖溶液前响应足够时间,结果表明,响应电流随着葡萄糖浓度的增大而线性增大,且具有良好的线性关系:I = 22.297 C + 11.13,单位I(μA),C (mmol/L),相关系数R =0.999 4,线性范围为7.5 ×10-5~2.0 ×10-2mol/L,检出限为0.375 ×10-6mol/L (S/N=3).
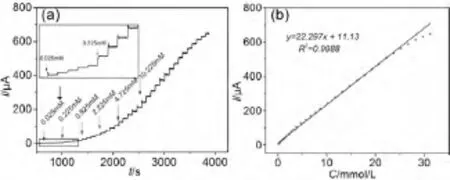
图4 Nafion/Cu2O/GCE 电极在0.1 mol/L 的NaOH溶液中连续加入不同浓度葡萄糖后的电流—时间曲线(a)、葡萄糖浓度与氧化电流的线性关系图(b)
2.6 抗干扰和稳定性实验
抗干扰能力也是影响传感器性能的重要因素,本实验研究的无酶葡萄糖传感器主要应用于血糖含量的检测.人体血液中与葡萄糖共存的易氧化的物质主要有尿酸、抗坏血酸、多巴胺和碳水化合物.实验采用计时电流法向0.1 mol/L NaOH 溶液中连续间隔加入Glu、Fru、Suc、DA、AA、UA、Glu,葡萄糖与干扰物质的摩尔比为10∶1,响应曲线如图5所示.可以看出,底液中加入葡萄糖后响应电流迅速增加,而加入上述干扰物以后最大干扰电流变化很小,仅为葡萄糖响应电流的7.9﹪左右,说明此传感器具有很好的抗干扰能力.测定了Nafion/Cu2O/GCE 电极对1 ×10-3mol/L 的葡萄糖的响应电流,其相对标准偏差为3.8﹪ (n=10),说明此修饰电极具有良好的重现性.将使用后的修饰电极用蒸馏水冲洗后,置于冰箱中4 ℃保存,1 周后对葡萄糖的响应电流为原来的92.3﹪,表明此电极的稳定性较好.
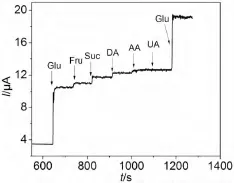
图5 干扰物质对葡萄糖测定的影响
3 结论
本文采用液相还原法成功制备了立方状的Cu2O,采用滴涂法制得Nafion/Cu2O/GCE 电极,构建了基于Cu2O 立方体的无酶葡萄糖传感器,用于对葡萄糖的电化学检测.此方法的无酶葡萄糖传感器具有宽的线性范围,检测限低,灵敏度高,稳定性好.这有助于研究Cu2O 在传感器领域的潜在应用.
[1]Newman J D,Turner A P F.Home blood glucose biosensors:a commercial perspective[J].Biosens.Bioelectron.,2005,20 (12):2435 -2453.
[2]白红艳,王秀华,戴志晖.无酶葡萄糖检测的研究进展[J].应用化学,2012,29 (6):611 -616.
[3]Deng C Y,Chen J H,Chen X L,et al.Direct electrochemistry of glucose oxidase and biosensing for glucose based on boron-doped carbon nanotubes modified electrode[J].Biosens.Bioelectron.,2008,23 (8):1272 -1277.
[4]吴立剑,何凤云,邵秀丹,等.基于纳米MnO2-MWCNTs 复合材料修饰的葡萄糖传感器[J].分析试验室,2012,31 (3):62 -65.
[5]Wilson R,Turner A P F.Glucose oxidase:an ideal enzyme[J].Biosens Bioelectron,1992,7(3):165-168.
[6]Park S,Boo H,Chung T D.Electrochemical non -enzymatic glucose sensors[J].Anal.Chim.Acta,2006,556(1):46 -57.
[7]杨绍明,孙青,李红,等.基于钴铝水滑石/铁氰化钴的无酶葡萄糖传感器的研究[J].分析试验室,2014,33(2):148 -150.
[8]Zahmaklran M,Özkar S,Kodaira T,et al.A novel,simple,organic free preparation and characterization of water dispersible photoluminescent Cu(2)O nanocubes[J].Mater.Lett.,2009,63(1):400 -402.
[9]Liu Y L,Liu Y C,Mu R,et al.The structural and optical properties of Cu2O films electrodeposited on different substrates semicon[J].Sci.Tech.,2005,20(1):30-44.
[10]Ho J Y,Huang M H.Temperature-dependent oxidation of Pt nanoclusters on a thin film of Al2O3on NiAl(100)[J].J.Phys.Chem.C.,2009,113(32):14159 -14164.
[11]Ma L L,Li J L,Sun H Z,et al.Self - assembled Cu2O flowerlike architecture:Polyol synthesis,photocatalytic activity and stability under simulated solar light[J].Mater.Res.Bull,2010,45(8):961-968.
[12]刘传银,胡军福,李学强.纳米氧化亚铜的制备及其电化学性质[J].化学研究,2005,16(4):55 -57.
[13]胡军福,朱圣平,杜飞鹏,等.纳米氧化亚铜固载亚甲蓝复合膜修饰玻碳电极的电化学性质及其对多巴胺的电催化[J].2006,25(7):5 -8.
[14]Zhang D F,Zhang H,Guo L,et al.Delicate control of crystallographic facet-oriented Cu2O nanocrystals and the correlated adsorption ability[J].J.Mater.Chem.,2009,19:5220 -5225.
[15]Tian L L,Liu B T.Fabrication of CuO nanosheets modified Cu electrode and its excellent electrocatalytic performance towards glucose[J].Appl Surf.Sci.,2013,283:947 -953.
