羊草基因型多样性能增强种群对干扰的响应
2015-02-11申俊芳任慧琴辛晓静高玉葆赵念席
申俊芳,任慧琴,辛晓静,徐 冰,高玉葆,赵念席
南开大学生命科学学院,天津 300071
羊草基因型多样性能增强种群对干扰的响应
申俊芳,任慧琴,辛晓静,徐 冰,高玉葆,赵念席*
南开大学生命科学学院,天津 300071
研究了不同基因型多样性(1、3、6 三种基因型组合)羊草种群的地上生物量、地下生物量、分蘖数、根茎芽数和根冠比5个指标对干扰强度(用不同留茬高度来模拟)的响应。结果表明:(1) 基因型多样性和干扰强度对地上生物量、地下生物量、分蘖数和根茎芽数均有显著影响(P< 0.05),但两者的交互作用不显著(P> 0.05)。其中,多基因型组合(3、6 基因型组合)羊草种群中这4个响应变量的值均显著高于单基因型羊草种群(P< 0.05);而干扰强度的增加显著降低了这4个响应变量的值(P< 0.05)。对于根冠比这一响应变量来说,仅干扰强度对其产生了显著地影响(P< 0.05)。(2) 29个基因型多样性效应值中,有25个值大于0,其中12个表现为显著的基因型多样性正效应。依 Loreau 和 Hector 的方法将多样性净效应分解后发现,互补效应和选择效应共同主导12个响应指标的基因型多样性效应,而互补效应独自主导3个、选择效应独自主导5个响应指标的基因多样性效应;但对基因型多样性正效应起主要贡献的是互补效应。所得结果表明,基因型多样性能提高羊草种群的表现,能增强羊草种群对干扰的响应,不同基因型间的互补作用对这种正效应起主要贡献,这将为该物种种质资源保护和合理利用提供理论指导。
羊草;多样性净效应;互补效应;选择效应
近年来,基因型多样性与生态系统功能的关系,引发了生态学家的广泛关注[1-5]。大量的实验表明,在物种较少、相对脆弱的生态系统中,建群种的基因型多样性与物种丰富的生态系统中总的物种多样性有相似的功能,如多样性的增加可以提高种群的生产力,减少干扰对种群的影响等[6-10]。在生态学范畴内,互补效应和选择效应是解释基因型多样性功能的主要机制。互补效应认为,不同的基因型在资源(时间或空间)的利用上存在差异,这种差异提高了基因型对资源的利用率,进而提高生产力。选择效应是指基因型多样性高的种群含有高产基因型的可能性更大,高产基因型对种群表现所占份额更多。二者对基因型多样性净效应的影响程度随研究区域和研究对象的不同而不同。Reusch等在关于不同基因型组合(1、3、6三种基因型组合)海草(Zosteramarina)种群对高温响应的研究中发现,基因型多样性能减少海草在高温胁迫下生物量的损失,基因型多样性效应由互补效应和选择效应共同主导,其中互补效应表现为显著正效应,是基因型多样性正效应的主要贡献者,而选择效应表现为显著负效应,限制多样性正效应的效果[11];Crutsinger等研究了不同基因型组合(1、3、6、12四种基因型组合)对北美一枝黄花(Solidagoaltissima)种群生产力的影响,结果表明基因型多样性净效应为显著正效应,由互补效应主导并起主要贡献[12]。
典型草原是我国北方草原主要的草原类型之一,近半个世纪以来,频繁的人类活动、气候异常等使得典型草原退化加剧[13-14],群落内植物种类减少,部分群落植物种类仅9 种/m2[15]。羊草(Leymuschinensis)为禾本科根茎型禾草,是典型草原区重要的建群种,抗干扰能力强,即使在典型草原的退化地段,多度也较大,在群落中具有重要作用。因此,研究羊草基因型多样性对干扰的响应及其响应机制,对羊草群落的合理利用和种质资源保护具有重要作用,但相关工作还未深入展开。本文通过构建不同基因型组合的羊草种群,并施加不同强度干扰(用不同留茬高度代替),来分析基因型多样性和干扰强度对羊草种群表现(生物量等)的影响,并探讨基因型多样性效应在羊草种群表现中的作用及其影响因素。通过以上研究,拟验证如下科学假设:(1)多基因型组合能提高羊草种群的表现,这种高水平的表现在干扰条件下也能发生;(2)互补效应在羊草基因型多样性效应中起主导作用并对基因型多样性效应起主要贡献。
1 材料方法
1.1 实验材料
本实验所用羊草为2010年于内蒙古锡林浩特市阿巴嘎旗典型草原西界采集的羊草基株,利用ISSR分子标记(AG)7T和(CA)6A确定不同基株的基因型[16],并进行编号。随后,在同样的条件下培养以去除母体效应,通过根茎无性繁殖得到同一基因型的大量分蘖。2013年6月1日,利用这些羊草分蘖进行实验。
1.2 实验方法
本实验采用基因型多样性(1、3、6三种基因型组合)×干扰强度(无刈割、留茬10cm、留茬5 cm)两因素三水平的实验设计,共构建9种处理的实验种群。在直径30cm的塑料盆中,放入5 kg砂质土壤(土壤全C、全N和全P含量分别为C 1.1 g/kg、N 0.11 g/kg、P 0.37 g/kg),每盆中分别移栽6株羊草单株分蘖。本实验共使用21个羊草基因型,每种干扰处理,单基因型(G1)共移栽21盆,三基因型组合(G3)共移栽18盆,六基因型组合(G6)共移栽21盆,共得到60盆,3种干扰处理总共得到180盆。为了保证每个重复都保持在最高的多样性水平,且避免每个重复之间存在过多相同的基因型[17],多基因型组合由这21个基因型按照基因型数目要求在Excel中随机组合得到,如表1。移栽时,将羊草分蘖统一去除根茎并以基因型编号进行标记,并修剪使得地上部高度为15 cm,地下根系长度为10cm,地上部叶片数为4片。对移栽1周内死去的分蘖,重新种植。

表1 本研究所用基因型组合方式Table 1 Genotype combinations in the present study
不同基因型组合用分号隔开
经过一段时间的恢复生长后,2013年7月15日,对实验种群进行不同强度的刈割处理:无刈割(NM)、留茬10cm(H10)、留茬5 cm(H5)。2013年10月15日,以盆为单位,并依照羊草基株的基因型,分别进行收获,记录分蘖数(个/盆)、根茎芽数(个/盆)。随后将鲜样放入烘箱中,105 ℃杀青2 h后,80℃烘干至恒重后,用万分之一天平称量地上生物量干重(g/盆)、地下生物量干重(g/盆),并计算根冠比。所得响应变量按照变量名称(基因型组合,留茬高度)进行命名,如地上生物量(G3, H5)表示三基因型组合留茬5 cm处理组的地上生物量。实验期间,土壤湿度控制在(10±2)%左右,无营养添加,定期除去杂草,无高温和遮阳等胁迫;所有盆随机放置,每周移动位置1次以避免位置效应。
1.3 数据分析
1.3.1 互补效应和选择效应的分离
依照Loreau和Hector的方法[18],将多基因型组合种群表现的增加量ΔY可分解为互补效应和选择效应(ΔY也称作基因型多样性净效应)。其计算公式为:
ΔY =YO-YE=∑iRYO,iMi-∑iRYE,iMi=∑iΔRYiMi
= N mean(ΔRY) · mean(M) + N cov (ΔRY, M)
式中,Mi为基因型i单独种植时,以盆为单位得到的响应变量(地上生物量、地下生物量、分蘖、根茎芽和根冠比)的值;YO,i为在含有基因型i的多基因型组合中,以盆为单位得到的基因型i的响应变量值;YO = ∑iYO,i为多基因型组合中,以盆为单位得到的盆中所有基因型的响应变量值;RYE,i为多基因型组合中,基因型i响应变量的期望相对值,即基因型i初始移栽时所占据该基因型组合的比例;RYO,i= YO,i/Mi为多基因型组合中,基因型i响应变量的实际相对值;YE,i= RYE,iMi为多基因型组合中,基因型i响应变量的期望值;YE = ∑iYE,i为多基因型组合中,每盆中所有基因型响应变量的期望值;ΔY= YO-YE为多基因型组合中,以盆为单位多基因型组合响应变量的实际值与期望值的偏差;ΔRYi = RYO,i- RYE,i为多基因型组合中,以盆为单位多基因型组合响应变量的实际相对值与期望相对值的偏差;N为多基因型组合种群所包含的基因型数;Nmean(ΔRY) · mean(M) 为互补效应值,Ncov (ΔRY,M) 为选择效应值。
上式的基本前提是假设基因型多样性对种群表现无影响,即ΔY= 0。当ΔY> 0时,基因型多样性对多基因型组合种群表现产生正效应;当ΔY< 0,基因型多样性对多基因型组合种群表现产生负效应。互补效应和选择效应的变化及其含义与此相同。在留茬5 cm处理组中,六基因型组合种群中有基因型未长出根茎芽,因此无法计算得到相应的多样性净效应、互补效应和选择效应。
1.3.2 数据处理
首先将数据进行对数转换,以满足正态分布,然后进行数据分析。其次,因各处理重复不等,因此采用混合模型(Mixed model)检验基因型多样性和干扰强度对地上生物量、地下生物量、分蘖数、根茎芽数和根冠比的影响,将基因型多样性和干扰强度设为固定因子。再次,借助单样本t-检验来检验多样性净效应(ΔY)、互补效应和选择效应与0的差异显著性,其中,多样性净效应的主导效应由互补效应或者选择效应t-检验的显著性来决定,检验结果显著(P< 0.05)则表明该效应为主导效应。最后,采用混合模型(Mixed model)检验基因型多样性和干扰强度对地上生物量、地下生物量、分蘖数和根冠比的互补效应和选择效应的影响,因根茎芽有数据缺失,所以未进行相关检验。以上数据统计分析均利用SPSS20.0完成。
2 结果与分析
2.1 基因型多样性和干扰强度对羊草响应变量的影响
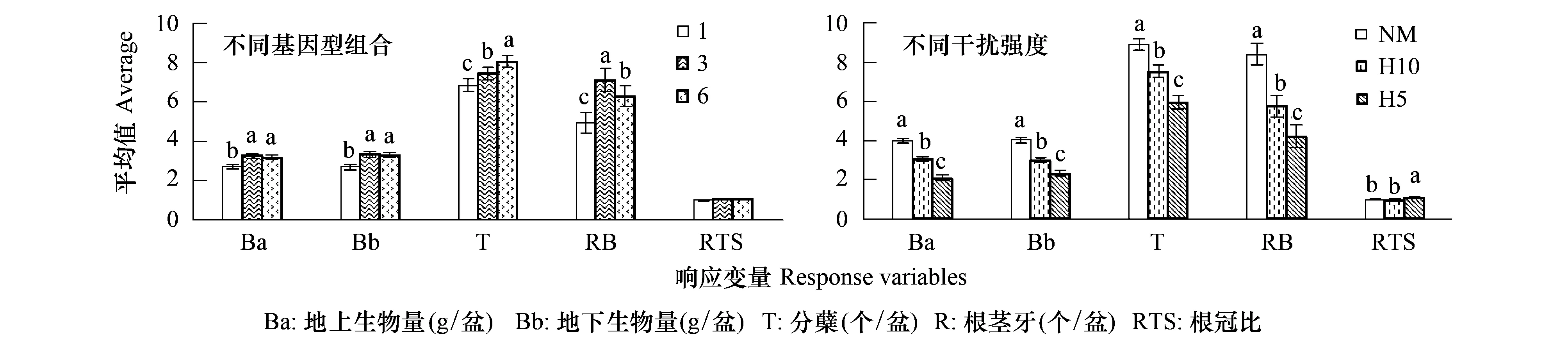
图1 不同基因型组合和不同干扰强度下各响应变量的平均值Fig.1 The average of 5 response variables in different genotypic diversity and under different intensity of disturbance 相同字母表示处理间差异不显著(P > 0.05)
基因型多样性和干扰强度对羊草的地上生物量、地下生物量、分蘖数和根茎芽数均有显著地影响(P< 0.05),但两者的交互作用并不显著(P> 0.05);干扰强度对根冠比有显著的影响(P< 0.05)(表2)。地上生物量、地下生物量、分蘖数、根茎芽数在不同基因型组合间的差异主要表现在单基因型种群和多基因型组合种群之间,而在多基因型组合种群中三基因型组合和六基因型组合之间差异不显著(图1)。羊草的地上生物量、地下生物量、分蘖数、根茎芽数均随着干扰强度的增加而显著地降低(P< 0.05);而根冠比在留茬5 cm处理组中显著高于其他处理组(图1)。
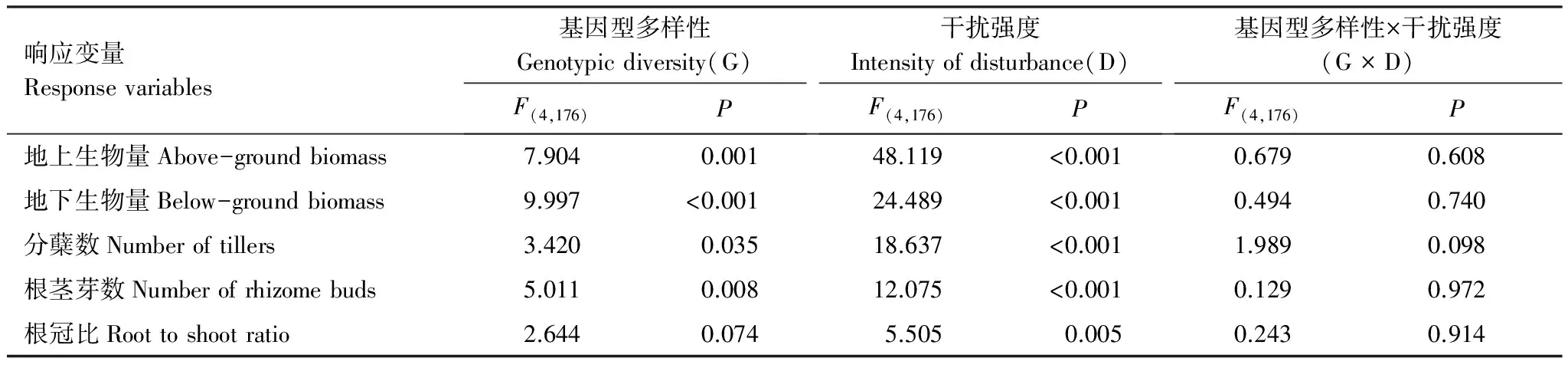
表2 基因型多样性和干扰对羊草各响应变量影响的结果Table 2 The effect of genotypic diversity and intensity of disturbance on the response variables of Leymus chinensis by Miexed mode
2.2 基因型多样性净效应、互补效应和选择效应
经计算得到的29个多样性净效应值中,仅有4个为负值,其他25个均为正值,且其中的12值与0差异显著,包括地上生物量(G3 / 6, NM),地上生物量(G3, H5),地下生物量(G6, NM),地下生物量(G3, H10/ H5),分蘖数(G6, NM),分蘖数(G3, H5),根茎芽数(G3 / 6, H10),根冠比(G3 / 6, H5),即这些响应变量的基因型多样性净效应为显著正效应(P< 0.05)(表3)。
根据Loreau和Hector的公式,将多样性净效应分解得到的选择效应均大于0而互补效应均小于0,即互补效应为基因型多样性正效应起主要贡献(表3)。t-检验结果显示:羊草响应变量的基因多样性效应由互补效应和选择效应共同主导的指标有12个,包括地上生物量(G3, NM),地下生物量(G3/6,nm),地下生物量(G6, H10),分蘖数(G6,NM),根茎芽数(G6, NM)和根冠比(G3 / 6, NM / H10/H5),由互补效应起主导作用的指标有3个,包括地上生物量(G6, NM),地下生物量(G3,H10),地上生物量(G3, H10),由选择效应起主导作用的指标有5个,包括地上生物量(G6, H10),分蘖数(G3, NM),分蘖数量(G6, H10),分蘖数(G3 /6, H5),占总指标数的68.97%(20/29);而其他9个指标,互补效应和选择效应均不占主导作用。

表3 羊草各响应变量的多样性净效应、互补效应和选择效应Table 3 Genotypic diversity net effect, complementarity effect and selection effect of variable of L. chinensis
*,**,***:表示在0.05和0.01水平上与0差异显著
2.3 基因型多样性和干扰强度对选择效应和互补效应的影响
经分析发现,基因型多样性、干扰强度以及它们的交互作用对根冠比这一指标的互补效应和选择效应均具有显著的影响(P< 0.05);基因型多样性和干扰强度的交互作用对分蘖数的选择效应具有显著的影响(P< 0.05)(表4)。
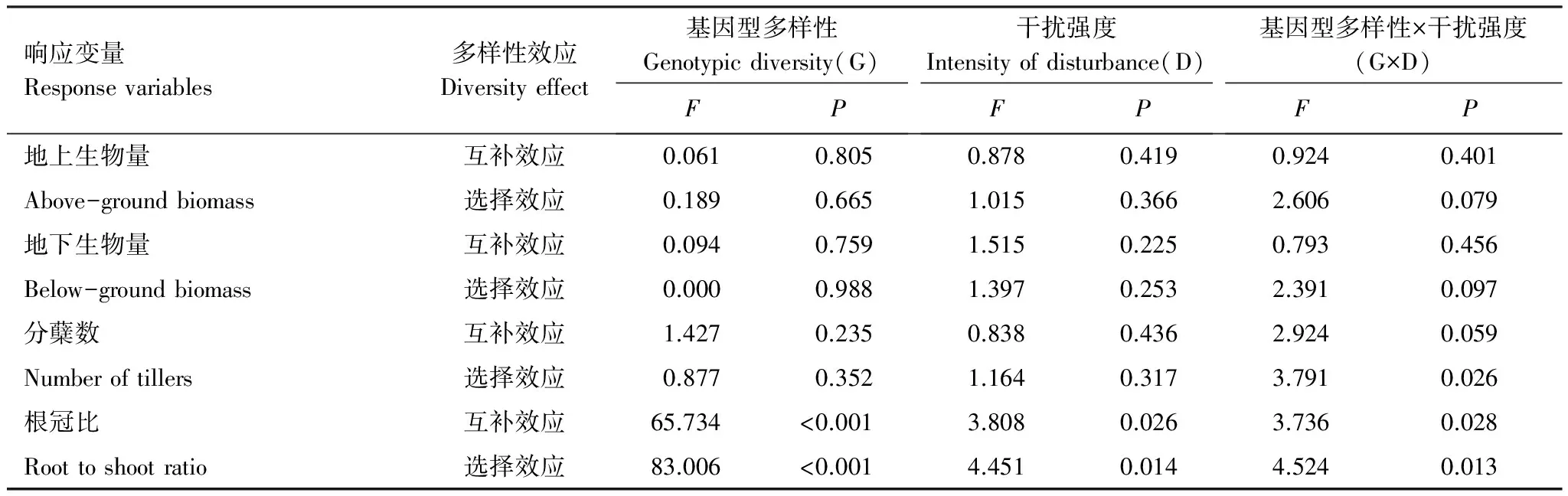
表4 基因型多样性和干扰强度对各响应变量的互补效应和选择效应影响的结果Table 4 The effect of genotypic diversity and intensity of disturbance on the complementarity effect and selection effect of variables of L. chinensis
3 讨论
物种的基因型多样性净效应表现为正效应时,植物的基因型增加不仅能够增加该物种的生长表现,而且能够提高该物种应对胁迫或者干扰的能力,Ehlers等[6]和Hughes和Stachowicz[19]研究发现不同基因型组合的海草种群受到高温胁迫或者放牧干扰后,多基因型组合种群的分蘖数比单基因型种群的分蘖数降低的少,且多基因型组合种群的恢复速率快于单基因型种群,本文对羊草的研究所得结果与这些结果基本一致(表2,表3,图1)。对羊草基因型多样性正效应起主要贡献的是互补效应,而选择效应为负值,限制基因型多样性正效应的表现(表3)。Cook-Patton等[20]关于不同基因型多样性(1、8两种基因型组合)月见草(Oenotherabiennis)的种群生产力的研究,以及McArt等[21]关于不同基因型丰富度的月见草的花和芽的多度的研究,都表明互补效应对基因型多样性正效应起主要贡献。而Tomimatsu等[22]对不同基因型组合芦苇(Phragmitesaustralis)种群初级生产力的研究则发现选择效应和互补效应均对基因型多样性的正效应起贡献。关于互补效应对基因型多样性正效应,科学家一致认为是不同的基因型在形态特征和生理特征上有差异[23],导致不同基因型植株的资源利用方式不同[8],而在多基因型组合种群中各个基因型间生态位互补,提高资源的利用率而发生的。作者先前关于本研究所使用的羊草的基因型植株进行研究,也证实了不同基因型羊草在形态特征和生理特征上存在差异[24]。而选择效应则不同,它是由在单基因种植中高表现(生产力、分蘖数等指标的表现)基因型植株在混合基因型种群中是否仍能保持其优势地位来决定的,如果这种优势在混合基因型组合中消失,则选择效应为负值从而不能对基因型多样性正效应起正面作用。就本研究的结果来看,羊草各响应变量的选择效应均为负值,且某些指标的选择效应经检验与0差异显著,从而限制了基因多样性正效应的表现;关于海草的研究中也有类似的报道[11]。
虽然基因型多样性的互补效应为羊草基因型多样性正效应的主要贡献者,但互补效应仅在3个响应变量中独立起主导作用(在表3中,t-检验结果显著则表示起主导作用),而29个指标中的12个指标的多样性效应是由互补效应和选择效应作用共同主导的。根茎植物种群内不同基因型个体的根茎在水平方向扩展,那么随着时间的延续,种内竞争就会加剧,但存在一定的干扰时,就会抑制某些特殊基因型(高产或抗性)在种群中的优势,即干扰会促进基因型间的互补效应[11, 25-27]。相似的结果在非根茎植物中也有报道,Drummond和Vellend研究表明,对蒲公英(Taraxacumofficinale)基因型多样性起主导作用的效应,在无干扰条件下为选择效应,而在干扰条件下为互补效应[28]。但在本研究中,基因型多样性的互补效应并未表现出上述的趋势,且在六基因型组合中,随着干扰强度的增加,各个响应变量所得互补效应值还有减小的趋势(表3)。这与实验观测时期有关,已有研究表明基因型多样性效应的作用程度会随时间发生改变[22,28];同时也受实验中基因型的组合方式的影响,因为某种基因型在一种组合中占优势,但有可能在另一种组合中并不具有优势[26],本研究中也发现同一基因型(如Y1)在与不同基因型组形成的几种6个基因型组合中,在相同的刈割处理下各组合的响应变量所得互补效应(或选择效应)值的大小和方向上均存在差异(数据未列出),从而影响该处理下互补效应和选择效应的方向和大小[29]。这方面的影响要求我们在实验设计时尽量多的选择基因型以保证每个重复都保持在最高的多样性水平,基因型组合时随机组合以避免每个重复之间存在过多相同的基因型[17]。
在关于基因型多样性效应的研究中,多数研究者关注与生产力相关的指标(如生物量)[6-10]而很少涉及根冠比。根冠比是衡量植物耐受性及生态适应的一个重要指标,在本研究中根冠比的观测值仅受干扰强度的影响,而其多样性效应由选择效应和互补效应共同主导,且这两种效应受基因型多样性、干扰强度以及它们的交互作用的影响显著,是对环境因子反应非常敏感的一个指标。因此,建议在以后关于基因型多样性效应对干扰的响应进行研究时,可以尝试使用这一指标。
在典型草原,羊草对维持种群稳定、提高种群的初级生产力、乃至维持生态系统多样性和稳定性方面都具有非常重要的作用。羊草的基因型多样性效应为正效应,互补效应为主要贡献者,这一结果对该物种种质资源的采集和保护具有重要的指导意义,应该更加重视保护该物种的基因型多样性,从而提高个体间的互补作用,而不能仅仅关注和保护某些高水平表现基因型,避免选择效应负效应对种群表现的限制。
[1] Wimp G M, Young W P, Woolbright S A, Martinsen G D, Keim P, Whitham T G. Conserving plant genetic diversity for dependent animal communities. Ecology Letters, 2004, 7(9):776- 780.
[2] Johnson M T J, Lajeunesse M J, Agrawal A A. Additive and interactive effects of plant genotypic diversity on arthropod communities and plant fitness. Ecology Letters, 2006, 9(1):24- 34.
[3] Whitlock R A J, Grime J, Booth R, Burke T. The role of genotypic diversity in determining grassland community structure under constant environmental conditions. Journal of Ecology, 2007, 95(5):895- 907.
[4] Creissen H E, Jorgensen T, Brown J K M. Stabilization of yield in plant genotype mixtures through compensation rather than complementation. Annals of Botany, 2013, 112(7):1439- 1447.
[5] Hughes A R, Inouye B D, Johnson M T J, Underwood N, Vellend M. Ecological consequences of genetic diversity. Ecology Letters, 2008, 11(6):609- 623.
[6] Ehlers A, Worm B, Reusch T B H. Importance of genetic diversity in eelgrassZosteramarinafor its resilience to global warming. Marine Ecology Progress Series, 2008, 355:1- 7.
[7] Kotowska A M, Cahill J J, Keddie B A. Plant genetic diversity yields increased plant productivity and herbivore performance. Journal of Ecology, 2010, 98(1):237- 245.
[8] Vellend M, Drummond E B M, Muir J L. Ecological differentiation among genotypes of Dandelions (Taraxacumofficinale). Weed Science, 2009, 57(4):410- 416.
[9] Roger F, Godhe A, Gamfeldt L. Genetic diversity and ecosystem functioning in the face of multiple stressor. PloS One, 2012, 7(9):e45007.
[10] Huxham M, Kumara M P, Jayatissa L P, Krauss K W, Kairo J, Langat J, Mencuccini M, Skov M W, Kirui B. Intra- and interspecific facilitation in mangroves may increase resilience to climate change threats. Philosophical Transactions of the Royal Society B:Biological Sciences, 2010, 365(1549):2127- 2135.
[11] Reusch T B H, Ehlers A, Hammerli A, Worm B. Ecosystem recovery after climatic extremes enhanced by genotypic diversity. Proceedings of the National Academy of Sciences of the United State of America, 2005, 102(8):2826- 2831.
[12] Crutsinger G M, Collins M D, Fordyce J A, Gompert Z, Nice C C, Sanders N J. Plant genotypic diversity predicts community structure and governs an ecosystem process. Science, 2006, 313(5789):966- 968.
[13] 李金花, 潘浩文, 王刚. 内蒙古典型草原退化原因的初探. 草业科学, 2004, 21(5):49- 51.
[14] 李博. 中国北方草地退化及其防治对策. 中国农业科学, 1997, 30(6):1- 9.
[15] 高际玫, 金海峰. 锡林郭勒盟不同草原类型植物群落多样性初步研究. 北方环境, 2011, 23(9):222- 225.
[16] 王丹. 内蒙古中东部草原羊草(Leymuschinensis)种内变异与分化研究[D]. 天津:南开大学, 2004:39- 41.
[17] Fukami T, Naeem S, Wardle D A. On similarity among local communities in biodiversity experiments. Oikos, 2001, 95(2):340- 348
[18] Loreau M, Hector A. Partitioning selection and complementarity in biodiversity experiments. Nature, 2001, 412(6842):72- 76.
[19] Hughes A R, Stachowicz J J. Genetic diversity enhances the resistance of a seagrass ecosystem to disturbance. Proceedings of the National Academy of Sciences of the United State of America, 2004, 101(24):8998- 9002.
[20] Cook-Patton S C, McArt S H, Parachnowitsch A L, Thaler J S, Agrawal A A. A direct comparison of the consequences of plant genotypic and species diversity on communities and ecosystem function. Ecology, 2011, 92(4):915- 923.
[21] McArt S H, Cook-Patton S C, Thaler J S. Relationships between arthropod richness, evenness, and diversity are altered by complementarity among plant genotypes. Oecologia, 2012, 168(4):1013- 1021.
[22] Tomimatsu H, Nakano K, Yamamoto N, Suyama Y. Effects of genotypic diversity ofPhragmitesaustralison primary productivity and water quality in an experimental wetland. Oecologia, 2014, 175(1):163- 172
[23] Hughes A R, Stachowicz J J, Williams S L. Morphological and physiological variation among seagrass (Zosteramarina) genotypes. Oecologia, 2009, 159(4):725- 733.
[24] 李军鹏. 羊草种群内基因型多样性对不同水热条件的响应研究[D]. 天津:南开大学, 2012:1- 36.
[25] Cardinale B J. Biodiversity improves water quality through niche partitioning. Nature, 2011, 472(7341):86- 89.
[26] Hughes A R, Stachowicz J J. Seagrass genotypic diversity increases disturbance response via complementarity and dominance. Journal of Ecology, 2011, 99(2):445- 453.
[27] Wang J, Zhang C B, Chen T, Li W H. From selection to complementarity:the shift along the abiotic stress gradient in a controlled biodiversity experiment. Oecologia, 2013, 171(1):227- 235.
[28] Drummond E B M, Vellend M. Genotypic diversity effects on the performance ofTaraxacumofficinalepopulations increase with time and environmental favorability. PloS One, 2012, 7(2):e30314.
[29] Hughes A R, Best R J, Stachowicz J J. Genotypic diversity and grazer identity interactively influence seagrass and grazer biomass. Marine Ecology Progress Series, 2010, 403:43- 51.
Leymuschinensisgenotypic diversity increases the response of populations to disturbance
SHEN Junfang, REN Huiqin, XIN Xiaojing, XU Bing, GAO Yubao, ZHAO Nianxi*
CollegeofLifeScience,NankaiUniversity,Tianjin300071,China
The current rapid loss of biodiversity from the ecosystem to the species level at global regional and local scales is considered to be one of the major threats to the continued good functioning of ecosystems and the biosphere at large. Recent research has demonstrated that genotypic diversity within species also has important ecological impacts. Especially for dominant and constructive species, genotypic diversity within species may enhance plant population productivity and resistance to disturbance, reduce susceptibility to alien plant invasions, and affect associated arthropod community composition and diversity through several of mechanisms. The underlying mechanisms by which genotypic diversity within species may alter ecosystem processes are analogous to those proposed for species diversity. For both species diversity and genotypic diversity within species, the effects of diversity may be partitioned into “selection” and “complementarity” effects, where selection effect occurs if the community includes a genotype with a specific trait that becomes dominant over time. Complementarity effects occur when function increases or decreases as a result of interactions among conspecifics. Selection effects result in higher or lower functioning than expected, based on the average performance of the genotypes in monoculture, which is called non-transgressive over-yielding. Complementarity effects result in a diverse assemblage that performs better than its best performing member, which is called transgressive over-yielding. In northern China, typical steppe is one of the main steppe types.Leymuschinensisis the dominant and constructive species of the typical steppe, playing an important role in the community. Due to climate change and frequent human activities, the typical steppe has seriously degraded over half a century, but we found thatL.chinensisin degraded steppe still plays an important role in maintaining the structure and functioning of typical steppe. Therefore, it is necessary to investigate how the genotypic diversity ofL.chinensisaffects the structure and functioning of an ecosystem. In this study, we examined the effects ofL.chinensisgenotypic diversity on the performance of the above- and below-ground biomass, number of tillers, number of rhizome buds, and root to shoot ratio in response to disturbance over four months. (1) The genotypic diversity and the intensity of disturbance had significant effects (P< 0.05) on the above- and below-ground biomass, number of tillers, and number of rhizome buds, but their interactions had no significant effects on these variables (P> 0.05). The values of these 4 response variables in polyculture (3, 6 genotypes) were significantly higher than those in monoculture (P< 0.05), and these response values decreased with increasing of disturbance. The intensity of disturbance had a significant effect (P< 0.05) on the performance of the root to shoot ratio, which was higher for the most serious disturbance condition (H5) compared to the other conditions. (2) The net diversity effects were positive for 25 out of 29 variables, and were significantly higher than 0for 12 variables. After partitioning the net diversity effect by the Loreau & Hector method, the results showed that genotypic diversity effects were driven by both the complementarity and selection effects for 12 variables, by the complementarity effect for 3 variables, and by the selection effect for 5 variables; however, the complementarity effect contributed more to the positive diversity effect. These results indicated that genotypic diversity may improve the performance ofL.chinensisby the complementarity effect, even under disturbance conditions, with this information being expected to contribute to the conservation and utilization of germplasm resources of this species.
Leymuschinensis; net diversity effect; complementarity effect; selection effect
国家自然科学基金项目(31270463, 30800132)
2014- 05- 13; < class="emphasis_bold">网络出版日期:
日期:2015- 05- 19
10.5846/stxb201405130979
*通讯作者Corresponding author.E-mail:zhaonianxi@nankai.edu.cn
申俊芳,任慧琴,辛晓静,徐冰,高玉葆,赵念席.羊草基因型多样性能增强种群对干扰的响应.生态学报,2015,35(23):7682- 7689.
Shen J F, Ren H Q, Xin X J, Xu B, Gao Y B, Zhao N X.Leymuschinensisgenotypic diversity increases the response of populations to disturbance.Acta Ecologica Sinica,2015,35(23):7682- 7689.
