青年大学生血清和肽素水平与血压及相关危险因素关系的研究
2015-02-09唐群许波田建伟王新宴王安琪黄翠莹臧春梅
唐群,许波,田建伟,王新宴,王安琪,黄翠莹,臧春梅
· 论著 ·
青年大学生血清和肽素水平与血压及相关危险因素关系的研究
唐群,许波,田建伟,王新宴,王安琪,黄翠莹,臧春梅
目的探讨青年大学生血清和肽素水平与外周血压和中心动脉收缩压(CSBP)及相关危险因素的关系。方法入选西安工业大学在校大学生高血压患者(172例)及血压正常者(198例),测量研究对象CSBP、外周血压(收缩压、舒张压、平均动脉压)、臂围、身高体重,计算体重指数(BMI),并抽血测定和肽素、血管紧张素Ⅱ、醛固酮、一氧化氮、三酰甘油、胆固醇、肌酐、尿素氮、血糖水平,分析和肽素与血压及相关危险因素的相关性。结果青年大学生CSBP与外周收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)呈显著正相关性,相关系数(r)分别为0.940,0.834,0.901(P<0.01)。随着和肽素水平增高,外周收缩压、舒张压、平均动脉压、中心动脉收缩压均逐渐升高,差异有显著统计学意义(P<0.01)。血清和肽素与CSBP、SBP、DBP、MAP、BMI、血管紧张素Ⅱ、醛固酮水平呈正相关性(r分别为0.136,0.138,0.170,0.155,0.137,0.153,0.220,P<0.05),与一氧化氮呈负相关性(r=-0.117,P<0.05)。多元线性逐步回归分析显示:调整了年龄、性别、体重、BMI、血糖、胆固醇等因素后,DBP 随血清和肽素水平增高而上升的趋势仍然存在(β=1.219, P=0.041)。SBP、MAP及CSBP主要与BMI、血糖、胆固醇相关(P<0.05)。结论血清和肽素水平不仅与中心动脉收缩压和外周血压相关,还与BMI、血糖、胆固醇等代谢及生化指标之间存在相关性。
青年;中心动脉收缩压;高血压;和肽素
和肽素(copeptin)是一种富含亮氨酸的糖肽,来源于血管加压素(vasopressin,AVP)原的C末端,是AVP的前体,AVP具有收缩血管、升高血压、抗利尿的作用,两者在血浆中变化的趋势及摩尔浓度一致[1]。大量研究表明,和肽素作为血浆AVP释放的替代因子有助于脓毒血症、下呼吸道感染、急性心肌梗死、心力衰竭等多种急性疾病的预后评价[2,3]。近期国外有研究[4,5]表明,和肽素水平增高与高血压病及其他代谢综合征发生发展具有相关性。与肱动脉血压相比,中心动脉压(central arterial pressure,CAP)能够更好的预测靶器官损害以及不良心血管事件。青年血清和肽素水平与血压水平的关系及其影响因素目前尚不清楚,有待进一步研究,本研究旨在探讨青年大学生和肽素水平中心动脉收缩压(central systolic blood pressure,CSBP)和外周血压及相关危险因素的相关性。
1 资料与方法
1.1 研究对象在2014年7月筛查西安工业大学4755名在校学生,平均年龄为(21.03±1.192)岁,男性2709人,女性2046人。所有人均测量外周肱动脉血压,入选所有血压升高者,共计172例(男性151例,女性21例)。以班级为单位分别从光电工程学院、经济管理学院、电子信息工程学院、计算机科学与工程学院、外国语学院整群随机抽取血压正常者,共计198例(男性160例,女性38例)。入选总人数共计370例,年龄17~24岁,最终纳入比为7.7%。按照和肽素水平三分位将所有血压升高者及随机抽取的血压正常者分为低组、中组、高组三分位组进行分析。排除继发性高血压、严重的肝肾功能不全、严重心功能不全及恶性肿瘤、有其他全身性疾病如糖尿病、甲状腺功能亢进患者。
1.2 方法
1.2.1 体格检查①测量外周收缩压(SBP)、舒张压(DBP):测量受试者右上臂坐位血压,连续测量2次,间隔1分钟,计算平均值,如两次收缩压或舒张压差值>10 mmHg(1 mmHg=0.133 kPa),则进行第3次测量,计算后两次平均值;②CSBP测量:用SphygmoCor无创主动脉脉搏分析仪的触压式探头置于右侧桡动脉搏动最明显处,实时记录连续10 s的桡动脉脉搏波群,经计算机普通转换函数自动转化为中心动脉脉搏波,并计算相应的CSBP[6];③测量身高、体重,计算体质指数(BMI),BMI=体重(kg)/身高2(m2)(BMI<18.5为消瘦,18.5≤BMI<24为正常,24≤BMI<28为超重,BMI≥28为肥胖);④测量臂围(右上肢自然下垂时,测量上臂肱二头肌最粗处的水平围长);⑤测量心率。
1.2.2 血液标本采集所有研究对象均未服用任何治疗药物,于清晨空腹采静脉血,含10%EDTA-K2抗凝剂和含促凝剂采血管分别采血5 ml,混匀,离心10 min,分别分离血浆和血清于塑料密封管内,置-80℃保存。
1.2.3 试剂和肽素试剂盒、血管紧张素Ⅱ试剂盒、醛固酮试剂盒、一氧化氮试剂盒及胆固醇等各生化指标试剂盒均购于上海博湖生物科技有限公司。
1.2.4 仪器①外周血压测量采用台式水银血压计,CSBP测量采用SphygmoCor无创主动脉脉搏分析仪;②胆固醇等各生化指标检测以酶分析法作为主要方法,采用日立7600-010全自动生化仪;③和肽素、一氧化氮、血管紧张素Ⅱ、醛固酮以酶联免疫分析法作为主要方法,采用Thermo(雷勃)FC酶标仪。
1.3 统计学处理应用SPSS16.0软件进行统计分析,计量资料数据采用均数±标准差(±s),计数资料用例数(百分数)表示,组间均数比较符合正态性和方差齐性采用方差分析,不符合正态和方差齐性,采用Kruskal-Wallis H检验,组间例数(百分数)比较采用χ2检验。将血清和肽素作为连续性变量进行分析时,先对其进行对数转换,使其分布呈正态后用于统计分析。用单因素关联分析及多元逐步回归模型分析血清和肽素与外周血压、CSBP及相关因素的关系。P<0.05为差异有统计学意义。
2 结果
2.1 受检者的基本特征纳入本研究的370人外周平均肱动脉血压为129/82 mmHg,平均CSBP为114 mmHg,血清和肽素中位数为38 pg/ml(范围:6~360 pg/ml)。根据和肽素的三分位将患者分为低组(≤23.99 pg/ml)、中组(24~63.99 pg/ml)、高组(≥64 pg/ml)三分位组,三组男女比例、年龄、心率、身高差异无统计学意义(P>0.05);臂围、体重、BMI有统计学差异(P<0.05);三组高血压患病率分别为27.2%,53.3%,59.2%,差异有显著统计学意义(P<0.01)(表1)。
2.2 和肽素三分位组患者血压情况比较随着和肽素水平增高,SBP、DBP、MAP、CSBP均逐渐升高,差异有统计学意义(P<0.01)(表2)。
2.3 和肽素三分位组生化指标、神经内分泌因子的比较根据血清和肽素三分位数分组的三组之间,血糖、胆固醇、血管紧张素Ⅱ、醛固酮、一氧化氮有统计学差异(P<0.05)。肌酐、尿素氮、甘油三酯无明显差异(P>0.05)(表3)。
2.4 CSBP与外周血压相关性青年大学生CSBP与SBP、DBP、MAP呈显著正相关性,相关系数r 分别为0.940,0.834,0.901(P均<0.01)。
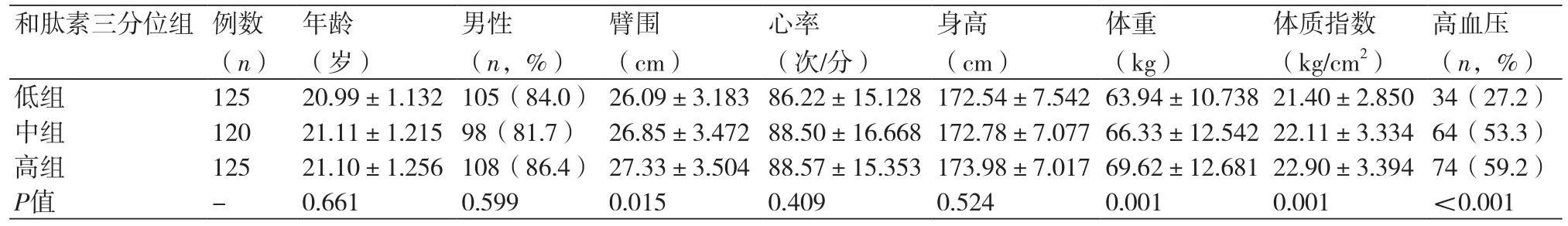
表1 和肽素三分位组患者一般情况
2.5 血清和肽素与各指标的相关性采用控制年龄、性别的偏相关分析,血清和肽素与CSBP、SBP、DBP、MAP、BMI、血管紧张素Ⅱ、醛固酮均呈正相关性,r分别为0.136、0.138、0.170、0.155、0.137、0.153、0.220,P均<0.05,与一氧化氮呈负相关性,r为-0.117,P<0.05。

表2 和肽素三分位组患者血压情况比较(mmHg)
2.6 外周血压及CSBP与相关因素的多元线性回归分析调整了年龄、性别、体重、BMI、血糖、胆固醇等因素后,DBP随血清和肽素水平增高而上升的趋势仍然存在(β=1.219,P=0.041)。SBP、MAP及CSBP主要与BMI、血糖、胆固醇相关(P<0.05)(表4)。
3 讨论
通过本研究发现,随着血清和肽素水平增加,SBP、DBP、MAP及CSBP均逐渐升高。在调整了体重、BMI、血糖、胆固醇等因素后,血清和肽素水平主要与DBP升高相关(P<0.01)。
外周肱动脉压的预测价值已经得到公认,而中心动脉压由于近年来无创中心动脉压测量技术的发明也越来越受到重视。与肱动脉血压相比,中心动脉压与靶器官损害和心血管疾病关系更为密切[7],主动脉直接与心脏相连,CSBP是左心室收缩时的后负荷,直接与左室肥厚相关;而中心动脉舒张压(CDBP)则是冠状动脉的灌注压;主动脉直接发出颈动脉和肾动脉等,与脑、肾等疾病的关系更为密切。本次研究发现,CSBP水平与SBP、DBP和MAP呈明显正相关性,该年龄阶段人群还处于病变早期,心脏等靶器官损害较小,直接反映左室肥厚的CSBP变化还是与外周血压一致。
和肽素分别与CSBP、SBP、DBP、MAP呈正相关。国内外大量研究证实,AVP的V1a受体的活动通过对平滑肌细胞的直接影响或者增多的肾素分泌物间接影响收缩血管导致血压上升[8]。也有人猜测AVP有可能通过V2调节增加钠潴留导致高血压[9]。而且提出V1和V2受体之间存在复杂的相互作用[10]。实验研究表明缓慢阻断垂体后叶的V1a、V2受体后血压水平缓慢的正常化[11]。Tenderenda-Banasiuk等[4]的最新研究结果表明高血压患者血清和肽素水平明显比正常人高。在本次研究中,和肽素三分位组最高组与最低组的SBP、DBP、MAP相比,差异有统计学意义(P<0.01),这与以往研究结果是一致的。还发现和肽素最高组的CSBP也显著高于最低组(P<0.01)。
大脑中肾素血管紧张素系统(RAS)的活动已被证实与高血压发生发展有关,实验证明RAS系统不仅通过兴奋交感神经系统而且通过调整下丘脑-垂体轴和AVP的释放来调整心血管系统和体液电解质平衡[12]。关于AVP影响血压有两个主要机理已经被证实,一是视上核和下丘脑室旁核的RAS系统的活动刺激AVP的产生和释放[13];二是脑干RAS的活动改变交感神经输出的压力反射功能。有一定数量的AVP表达神经元与规律的交感神经活动有关[14,15]。这就意味着AVP有可能是这两种机制存在的中间介质。我们研究发现作为AVP替代因子的血清和肽素水平与血管紧张素Ⅱ、醛固酮水平呈正相关。这可能是因为AVP在高血压发病机制中的重要作用所导致的结果。
本研究还发现血清和肽素水平与一氧化氮呈负相关,这可能间接与高血压相关,以往研究证实高血压患者一氧化氮水平显著低于健康人群。
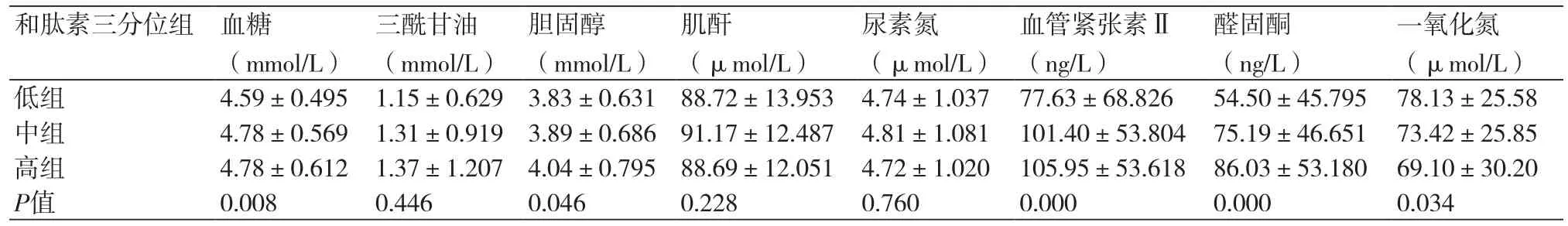
表3 和肽素三分位组患者生化指标、神经内分泌因子的比较

表4 外周血压及CSBP与相关因素的多元线性回归分析
本研究多元线性逐步回归分析显示外周血压及CSBP与体重、BMI、胆固醇、血糖水平等代谢综合征指标有相关性。Enhorning等[16]通过长时间的随访研究发现升高的和肽素水平预测了腹型肥胖、微白蛋白尿甚至是糖尿病的发展。AVP在葡萄糖和脂质代谢中的作用非常复杂,在血糖水平高的时候,AVP通过在肝脏的V1a受体影响糖异生和糖酵解,从而刺激胰高血糖素和胰岛素产生。另外,AVP发挥抗脂肪分解的作用。本研究发现血清和肽素水平与BMI、血糖之间存在很强的正相关,这与Enhorning的研究是一致的,但是本研究没有发现和肽素与三酰甘油、胆固醇之间存在相关性,这也有可能是因为研究对象都还处于代谢综合征的早期。
总之,青年大学生CSBP与外周血压呈明显正相关性。作为AVP的替代物质,高的和肽素水平不仅与CSBP、SBP、DBP和MAP有关联,还与代谢综合征指标BMI、血糖和若干高血压神经内分泌因子血管紧张素Ⅱ、醛固酮、一氧化氮相关。然而,目前,为了证实和肽素作为一个新的高血压升高和代谢综合征的预测指标的作用,中心动脉压与高血压神经内分泌因子之间的关系,我们需要更多的研究。
[1] Katan M,Morgenthaler NG,Dixit KC,et al. Anterior and posterior pituitary function testing with simultaneous insulin tolerance test and a novel copeptin assay[J]. J Clin Endocrinol Metab,2007,92(7):2640-3.
[2] Voors AA,von Haehling S,Anker SD,et al. C-terminal provasopressin (copeptin) is a strong prognostic marker in patients with heart failure after an acute myocardial infarction: results from the OPTIMAAL study[J]. Euro Heart J,2009,30(10):1187-94.
[3] Keller T,Tzikas S,Zeller T,et al.Copeptin Improves Early Diagnosis of Acute Myocardial Infarction[J]. J Am Coll Cardiol,2010, 55(18):2096-106.
[4] Tenderenda-Banasiuk E,Wasilewska A,Filonowicz R,et al. Serum copeptin levels in adolescents with primary hypertension[J]. Pediatr Nephrol,2014,29(3):423-9.
[5] Belen Ponte,Menno Pruijm,Daniel Ackermann,et al. Copeptin Is Associated with Kidney Length, Renal Function, and Prevalence of Simple Cysts in a Population-Based Study[J]. J Am Soc Nephrol,2015, 26(6):1415-25.
[6] 左君丽,严子君,张瑞岩,等. 评价无创中心动脉压与有创中心动脉压测量值的一致性[J]. 中华高血压杂志,2009,17(4):343-6.
[7] Charalambos V,Konstantinos A,O'Rourke MF,et al. Prediction of cardiovascular events and all-cause mortality with central haemodynamics: a systematic review and meta-analysis[J]. Euro Heart J,2010,31(15):1865-71.
[8] Toshinori A,Yuichiro I,Masami H,et al. Vasopressin regulates the renin-angiotensin-aldosterone system via V1a receptors in macula densa cells[J]. Am J Physiol Renal Physiol,2008,295(1):F100-7.
[9] Bankir L,Bichet DG,Bouby N. Vasopressin V2 receptors, ENaC, and sodium reabsorption: a risk factor for hypertension?[J]. Am J Physiol Renal Physiol,2010,299(5):F917-28.
[10] Bankir L. Antidiuretic action of vasopressin: quantitative aspects and interaction between V1aand V2receptor-mediated effects[J]. Cardiovasc Res,2001,51(3):372-90.
[11] Aoyagi T, Koshimizu TA. Vasopressin regulation of blood pressure and volume: findings from V1a receptor-deficient mice[J]. Kidney Int, 2009,76(10):1035-9.
[12] Baltatu O,Campos LA,Bader M. Genetic targeting of the brain reninangiotensin system in transgenic rats: impact on stress-induced renin release[J]. Acta Physiol Scan,2004,181(4):579-84.
[13] Coleman CG,Anrather J,Iadecola C,et al. Angiotensin II type 2 receptors have a major somatodendritic distribution in vasopressincontaining neurons in the mouse hypothalamic paraventricular nucleus[J]. Neuroscience,2009,163(1):129-42.
[14] Grobe JL,Xu D,Sigmund CD. An intracellular renin-angiotensin system in neurons: fact, hypothesis, or fantasy[J]. Physiology (Bethesda), 2008, 23(4):187-93.
[15] Head GA,Mayorov DN. Central Angiotensin and Baroreceptor Control of Circulation[J]. Ann N Y Acad Sci,2001,940:361-79.
[16] Enhörning S,Struck J,Wirfält E,et al. Plasma copeptin, a unifying factor behind the metabolic syndrome[J]. J Clin Endocrinol Metab,2011, 96(7):E1065-72.
Relationship among serum copeptin level, blood pressure and related risk factors in young university students
TANG Qun*, XU Bo, TIAN Jian-wei, WANG Xin-yan, WANG An-qi, HUANG Cui-ying, ZANG Chunmei.*The air force general hospital, Beijing 100142, China.
TIAN Jian-wei, E-mail: tianjianwei029@aliyun.com
ObjectiveTo investigate the relationship among serum copeptin level, central systolic blood pressure (CSBP) and related risk factors in young university students.MethodsThe students of Xi’an Technological University were chosen including 172 cases of hypertension and 198 cases of normal blood pressure (BP). The indexes of CSBP, peripheral BP [systolic blood pressure (SBP), diastolic blood pressure (DBP) and mean arterial pressure (MAP)], arm circumference, height and weight were detected and BMI was calculated, and levels of copeptin, angiotensin II (Ang II), aldosterone (ALD), nitric oxide (NO), triglyceride (TG), cholesterol (CH), creatinine (Cr), blood urea nitrogen (BUN) and plasma glucose were detected. The correlation among copeptin, BP and related risk factors was analyzed.ResultsCSBP was positively related to SBP, DBP and MAP (r=0.940, r=0.834, r=0.901, P<0.01) in young university students. As the increase of copeptin level, SBP, DBP, MAP and CSBP increased gradually (P<0.01). Copeptin level was positively related to CSBP, SBP, DBP, MAP, BMI, Ang II and ALD (r=0.136, r=0.138, r=0.170, r=0.155, r=0.137, r=0.153, r=0.220, P<0.05), and negatively related to NO (r=-0.117, P<0.05). Multiple linear regression analysis showed that DBP ascending trend still existed as the increases of copeptin level after regulating age, sex, weight, BMI, plasma glucose and CH (β=1.219, P=0.041). SBP, MAP and CSBP were mainly correlated to BMI, plasma glucose and CH (P<0.05).ConclusionThe level of serum copeptin is not only related to CSBP and peripheral BP, but also correlated to BMI, plasma glucose and CH.
Youth; central systolic blood pressure; Hypertension; Copeptin
R544.1
A
1674-4055(2015)06-0723-03
2015-06-10)
(责任编辑:田国祥)
科技基础性工作专项(2013FY114000)
100142 北京,空军总医院(唐群,许波,田建伟,王新宴,黄翠莹);大连医科大学(王安琪)
田建伟,E-mail:tianjianwei029@aliyun.com
10.3969/j.issn.1674-4055.2015.06.06
