气候变化对海藻龙须菜生长与光合作用耐热特性的影响
2015-02-08丁柳丽邹定辉邓亚运
丁柳丽, 邹定辉,2,* , 刘 露, 邓亚运
1 华南理工大学环境与能源学院, 广州 510006 2 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
气候变化对海藻龙须菜生长与光合作用耐热特性的影响
丁柳丽1, 邹定辉1,2,*, 刘 露1, 邓亚运1
1 华南理工大学环境与能源学院, 广州 510006 2 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
为探讨大气CO2升高和温室效应对龙须菜生长及生理生化特性的影响,在4种条件下培养龙须菜:1)对照组(390 μL/L CO2+ 20 ℃),2)CO2升高组(700 μL/L CO2+ 20 ℃),3)温度升高组(390 μL/L CO2+ 24 ℃),4)温室效应组(700 μL/L CO2+ 24 ℃),测定藻体生长和生化组分以及高温胁迫下的最大光化学量子产量(Fv/Fm)和光能利用效率(α)、光合速率(Pn)和呼吸速率(Rd)。结果表明,CO2升高、温度升高以及温室效应均促进龙须菜的生长,温室效应下的促进作用更明显。温室效应使龙须菜具较高的Pn和Rd以及较低的可溶性蛋白(SP)和可溶性碳水化合物(SC)含量。高浓度CO2对叶绿素(Chl a)和类胡萝卜素(Car)含量没有显著影响,而高温使其上升;藻红蛋白(PE)和藻蓝蛋白(PC)含量不受CO2浓度和温度的影响。龙须菜Fv/Fm、α、Pn和Rd值,在32 ℃处理3 h后略有上升,在36 ℃处理3 h后下降,而在40 ℃处理20 min后降到极低水平。正常温度(20 ℃)生长的龙须菜最高耐受温度在32—36 ℃之间,而较高温(24 ℃)生长的龙须菜在36—40 ℃之间;生长温度对光合作用和呼吸作用耐热性能的影响比CO2浓度的影响更大;而温室效应生长条件下的龙须菜光合作用表现出更突出的耐热性能。
CO2; 温度; 龙须菜; 生化组分; 叶绿素荧光; 光合作用; 呼吸作用
自然界中因植物光合作用和呼吸作用所引起的CO2交换量远大于因化石燃料燃烧所产生的CO2量[1]。因此,CO2浓度和温度对植物光合作用和呼吸作用的影响,在极大程度上影响着全球大气的变化。预计在21世纪末,CO2的浓度将上升到700 μL/L至1000 μL/L,其所引起的全球变暖将导致全球海洋表面平均温度上升1.0—4.4 ℃[2]。
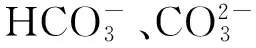
大气CO2浓度上升引起的温度变化也影响大型海藻生命活动。光合作用涉及到的一系列酶促反应以及作为光合作用反应场所的叶绿体膜完整性几乎都受温度的影响。Kübler等[11]早期研究表明,角叉菜对其生长温度的适应很大程度上决定了其耐热性能和热胁迫后的恢复能力。温度变化可导致光饱和光合作用电子传递或者碳代谢受抑制,从而影响海藻光合作用特性[12]。此外,随着温度的升高,Rubisco酶对O2的亲和力逐渐增加并高于其对CO2的亲和力,从而导致光呼吸作用增加,这种高温引起的光呼吸作用增强也会影响饱和光合作用速率。虽然原初光化学反应不受温度的影响,但是光反应阶段的电子传递和光合磷酸化过程以及质体醌的扩散等与温度密切相关,因此温度会影响光能捕获效率或者光能利用效率[12]。
1 材料及方法
1.1 龙须菜采集及暂养
龙须菜生长期为每年的1—6月,于2012年5月采自汕头南澳岛,此时汕头海域水温约为20 ℃。低潮时从潮间带采集健康无损的龙须菜,用装有少量海水的保温箱将藻体控制在低温并在最短时间内运至实验室。藻体在温度20 ℃和光照强度150—200 μmol m-2s-1条件下进行持续通气暂养,光照周期为L∶D=12 h∶12 h(光照时间为9:00至21:00)。培养海水为过滤的天然海水,盐度为32,添加一定浓度的NaNO3和NaH2PO4并使其终浓度分别为200 μmol/L和25 μmol/L。暂养3 d后进行实验。
1.2 实验处理及测定方法
准备12个装有5 L天然过滤海水的三角瓶来培养龙须菜,每个三角烧瓶中加入6.15 g(± 0.04 g)龙须菜。将2个植物培养箱CO2浓度设定为700 μL/L,温度分别设定为20 ℃和24 ℃两个温度,每个温度下放置6个重复样,向其中3个平行样通入正常空气(通过气泵从外界泵入空气流通良好区域的空气,CO2浓度约为390 μL/L),向另外3个平行样通入高CO2浓度空气(通过气泵从培养箱内泵入高CO2浓度的空气,CO2浓度约为700 μL/L)。其他条件与暂养条件一致。综上所述,实验中龙须菜的4种培养条件分别为:1)对照组或CK组(390 μL/L + 20℃);2)CO2升高组(700 μL/L + 20 ℃);3)温度升高组(390 μL/L + 24 ℃);4)温室效应组(700 μL/L + 24 ℃)。培养10 d后进行相关生理生化特性测定及温度胁迫实验。
1.2.1 生长和生化组分
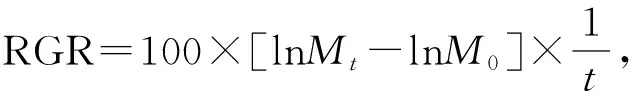
可溶性蛋白(SP)含量的测定采用考马斯亮蓝G- 250染料结合法[18]。利用苯酚-硫酸法测定可溶性碳水化合物(SC)含量[19]。参照Beer和Eshel[20]的方法测定藻红蛋白(PE)和藻蓝蛋白(PC) 含量。根据Jensen[21],采用丙酮提取法测定叶绿素(Chl a)和类胡萝卜素(Car)的含量。
1.2.2 高温胁迫对叶绿素荧光参数的影响
培养结束后,将不同条件下生长的龙须菜进行短期高温(32、36 ℃和40 ℃)胁迫处理,并测定其叶绿素荧光参数随时间的变化。从4种培养条件下生长的龙须菜中各自选出6枝生长状态一致的藻体,放入预先准备好的4个三角烧瓶内进行胁迫处理(用光照培养箱将4个装有1 L过滤天然海水的三角烧瓶的温度控制在胁迫温度,实验前海水至少通气12 h以保证海水中无机碳系统达到平衡),务必使龙须菜在胁迫处理时的通气条件与其培养时的通气条件保持一致。在高温32 ℃和36 ℃胁迫0、0.5、1、3 h和6 h时和高温40 ℃胁迫的0 h、5 min、10 min、20 min和30 min时测定龙须菜叶绿素荧光参数。
利用调制叶绿素荧光仪Junior-PAM(Walz, German)测定叶绿素荧光参数。向藻体连续照射8个光强梯度的光化光(66—820 μmol m-2s-1),照射间隔为10 s,得到快速光曲线。光系统Ⅱ(PSⅡ)的最大光化学量子产量Fv/Fm可通过公式计算[22]:Fv/Fm=(Fm-Fo)/Fm,其中Fm为最大荧光值,Fo为最小荧光值;对快速光曲线的非线性曲线拟合可得光能利用效率α,拟合公式[23]为:rETR=rETRmax·tanh(α·PPFD/rETRmax),式中:rETR为相对电子传递速率;rETRmax为相对最大电子传递速率;PPFD为光量子通量密度。
1.2.3 高温胁迫对呼吸速率和光合放氧速率的影响
高温胁迫处理方法与1.2.2相同,分别在高温32 ℃和36 ℃胁迫的0、1、3 h和6 h时以及高温40 ℃胁迫的0 、10、20 min和30 min时测定各条件下生长的龙须菜呼吸速率(黑暗状态)和光合放氧速率(饱和光强400 μmol m-2s-1)。
呼吸速率和光合放氧速率采用氧电极测定(YSI- 5300, USA)。将龙须菜剪成0.8 cm左右的小段,放在原生长条件下至少恢复1 h。称取约0.15 g鲜重藻样,放入装有8 mL反应介质的反应槽中,利用循环水浴使反应槽的温度与胁迫温度保持一致。黑暗状态利用不透光塑料膜遮盖反应槽所得,饱和光强通过光量子计测定来调节光源与反应槽间距离而得。测定过程中用转子不断搅拌反应介质,每次测定在5 min至10 min内完成。
1.3 统计与分析
采用Origin 8.0软件绘制图形,利用SPSS软件进行t-检验或单因子方差分析鉴定数据差异性,设P<0.05为显著性差异水平。
2 结果
2.1 生长和生化组分含量
如图1所示,各组龙须菜FW随时间的变化呈上升趋势。CO2升高组、温度升高组以及温室效应组龙须菜FW和RGR均大于对照组。温室效应组龙须菜RGR显著高于其他条件下的龙须菜(P<0.05)(图1)。
各组龙须菜生化含量差异如表1所示。与CK组相比,CO2升高组SC含量明显下降(P<0.05),而其他生化指标基本不受影响;温度升高组龙须菜SP和SC含量明显下降。温室效应组龙须菜SP和SC含量明显下降(P<0.05)。温度升高组和温室效应组Chl a和Car含量均上升,而这两种色素含量在两组龙须菜之间未表现出显著差异(P>0.05)。PE和PC基本不受CO2和温度的影响(表1)。
2.2 叶绿素荧光参数高温忍耐特性
图2所示为不同条件下生长的龙须菜Fv/Fm、α值在高温32 ℃胁迫时随时间的变化。随胁迫时间的延长,各组龙须菜Fv/Fm值下降率均不超过10%(图2)。α值呈上升趋势,其中CK组龙须菜α值上升了43.0%,温度升高组或者CO2升高组龙须菜的α值随高温32 ℃处理时间变化的影响程度均不超过25%,而温室效应组龙须菜的α值在受高温32 ℃胁迫后上升了116.4%(图2)。整个处理过程中,各组龙须菜的Fv/Fm和α值未表现出显著差异(P>0.05)。
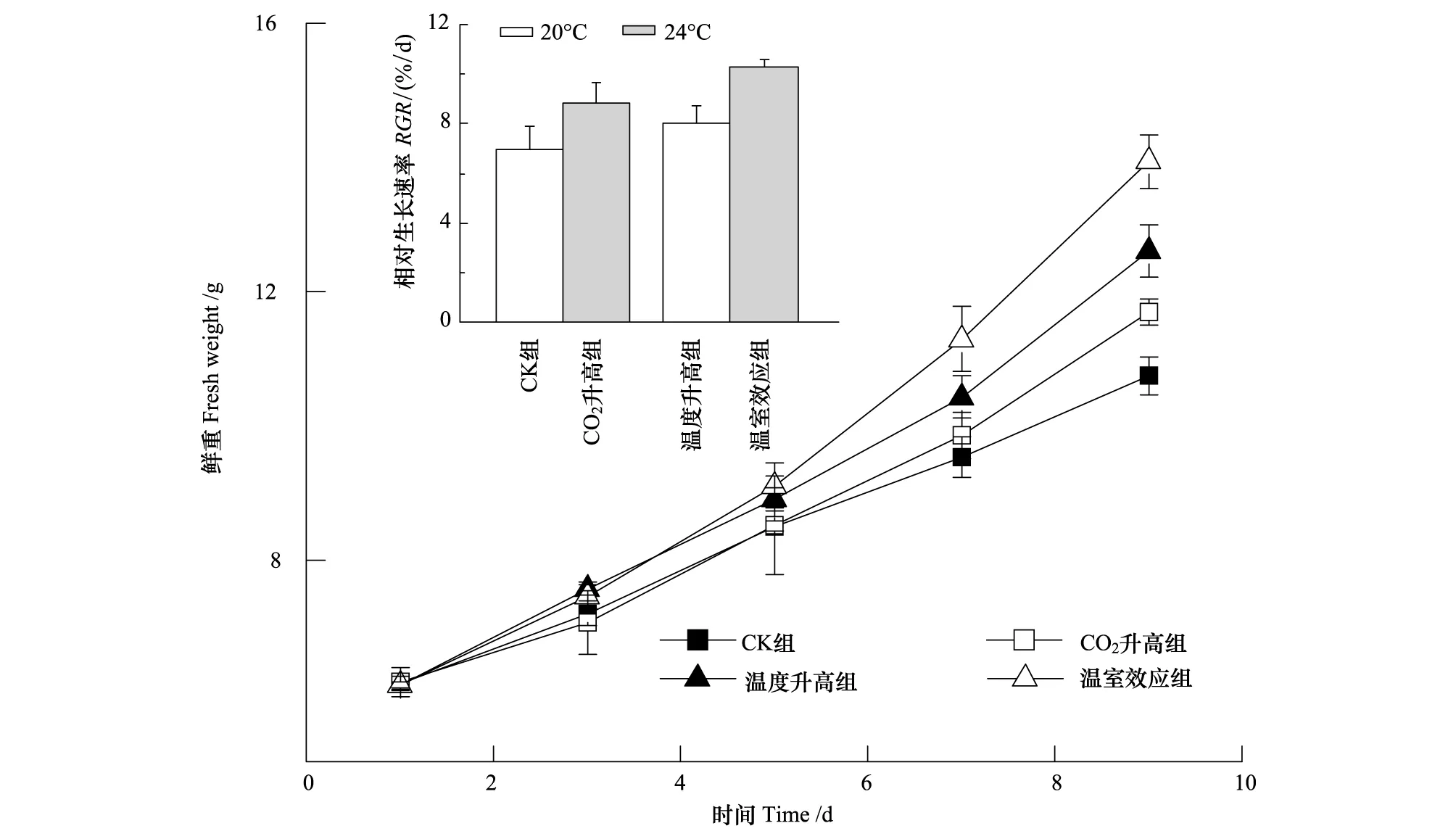
图1 不同生长条件对龙须菜鲜重(FW)和相对生长速率的影响Fig.1 Effects of different growth conditions on the biomass (FW) and relative growth rate (RGR) of Gracilaria lemaneiformis
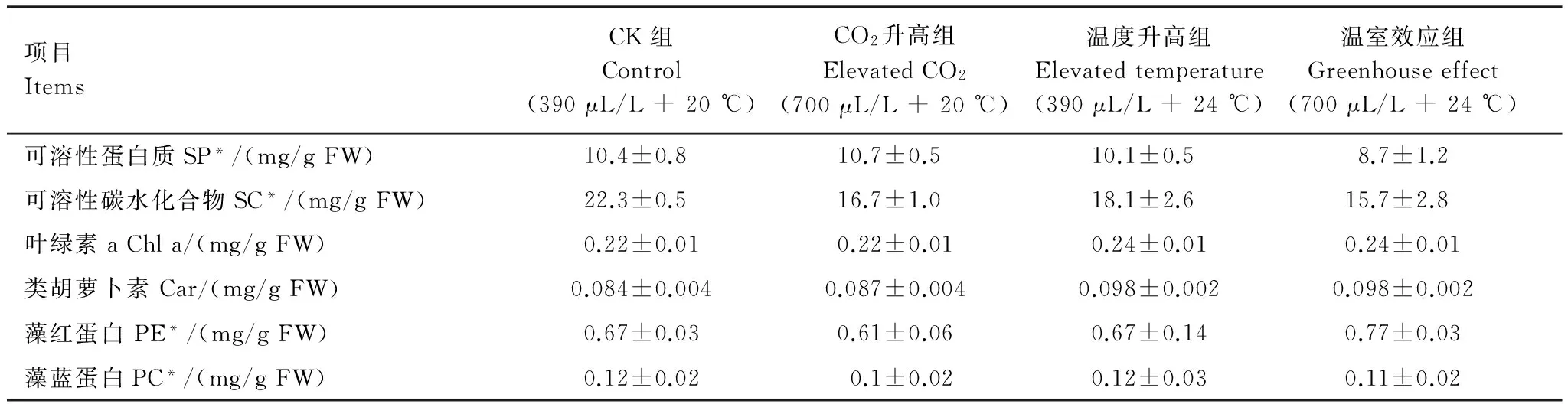
表1 不同生长条件下的龙须菜的生化组分含量Table 1 Contents of biochemical compositions in Gracilaria lemaneiformis cultured under different conditions
* SP全称为Solution Protein; SC全称为Soluble Carbohydrate; PE全称为Phycoerythrin; PC全称为Phycocyanin
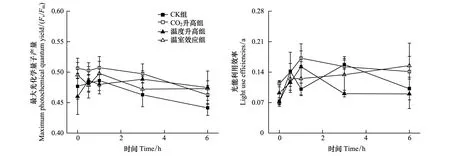
图2 不同条件下生长的龙须菜Fv/Fm 和α 值在32 ℃胁迫时随时间的变化
图3为各条件下生长的龙须菜Fv/Fm和α受36 ℃胁迫时随时间的变化趋势。高温36 ℃胁迫使各组龙须菜Fv/Fm值明显下降,其中CK组和CO2升高组分别下降了77.7%和71.2%,而温度升高组和温室效应组则下降了不到25%(下降率分别为24.9%和21.8%)(图3)。各组龙须菜的α值变化趋势与Fv/Fm值一致,其中CK组和CO2升高组龙须菜α值下降了75%以上,而温度升高组和温室效应组则分别下降了26.0%和7.8%(图3)。整个胁迫过程中,温度升高组以及温室效应组龙须菜Fv/Fm和α值显著高于CK组和CO2升高组(P<0.05)。可见,高温(24 ℃)的生长条件使龙须菜光合参数在高温36 ℃胁迫下较稳定。
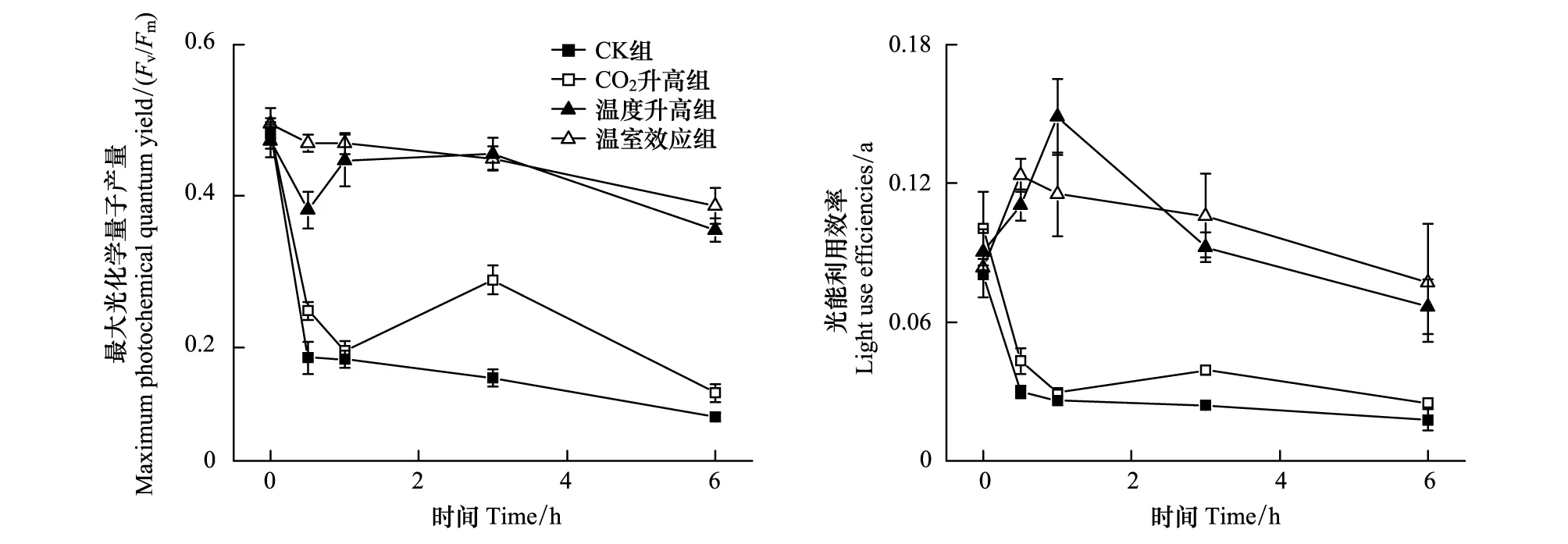
图3 不同条件下生长的龙须菜Fv/Fm 和α 值受36 ℃胁迫时随时间的变化
高温40 ℃胁迫对不同生长条件下的龙须菜Fv/Fm和α值的影响如图4所示。各组龙须菜Fv/Fm值(图4)和α值(图4)的差异不显著(P>0.05),在胁迫处理5 min后均急剧下降到极低值。
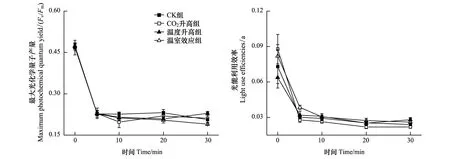
图4 不同条件下生长的龙须菜Fv/Fm 和α 值受40 ℃胁迫时随时间的变化
2.3 光合作用和呼吸作用高温忍耐特性
图5所示为不同生长条件下的龙须菜呼吸作用随着高温胁迫处理时间延长的变化。32 ℃胁迫6 h使各组龙须菜Rd呈上升趋势,其中CK组、CO2升高组、温度升高组和温室效应组分别上升了11.23%、22.55%、14.27%和17.1%。整个过程中,温度升高组龙须菜Rd显著低于其他组龙须菜(P<0.05)。36 ℃胁迫6 h后,CK组和温室效应组龙须菜Rd基本不变,温度升高组和CO2升高组龙须菜Rd分别下降了7.95%和15.67%。40 ℃胁迫30 min后,龙须菜Rd均呈下降趋势,其中CK组龙须菜Rd下降率最大(下降了30.42%),温度升高组和温室效应组龙须菜Rd显著低于对照组(P<0.05)(图5)。
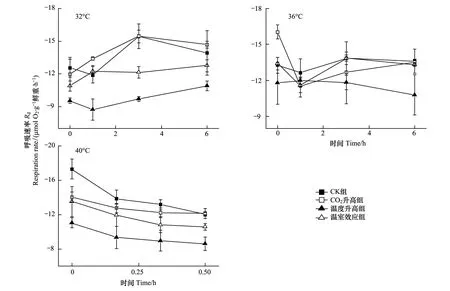
图5 高温32、36 ℃和40 ℃对不同生长条件下的龙须菜呼吸速率的影响
图6为不同生长条件下的龙须菜光合放氧速率随着高温胁迫处理时间的变化。32 ℃胁迫6 h,各组龙须菜Pn呈上升趋势,其中CK组龙须菜Pn上升幅度最大,高达40.72%。整个处理过程中,温度升高组和温室效应组龙须菜Pn显著大于CK组龙须菜(P<0.05)。36 ℃胁迫6 h后,各组龙须菜Pn下降,其中温室效应组龙须菜Pn显著高于其他组(P<0.05)。40 ℃胁迫10 min后,龙须菜Pn均下降到零,而此时呼吸作用维持相对较高的水平(图6)。
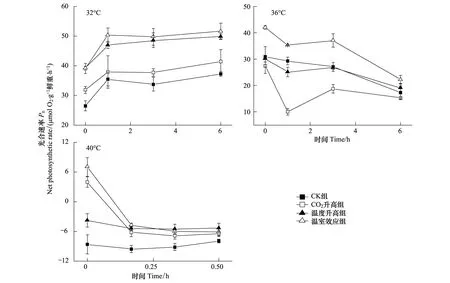
图6 高温32、36 ℃和40 ℃对不同生长条件下的龙须菜光合速率的影响
如图7,温度升高组或者CO2升高组龙须菜Rd与CK组未表现出显著差异(P>0.05),而温室效应组龙须菜Rd显著高于CK组和CO2升高组(P<0.05)。温度升高组龙须菜Pn与CK组无之间无显著差异,CO2升高组和温室效应组龙须菜Pn显著高于CK组(P<0.05)。温度升高组Rd和Pn与CK组无显著差异,CO2升高组具有较低的Rd和较高的Pn,温室效应组则表现出较高的Rd和Pn(图7)。
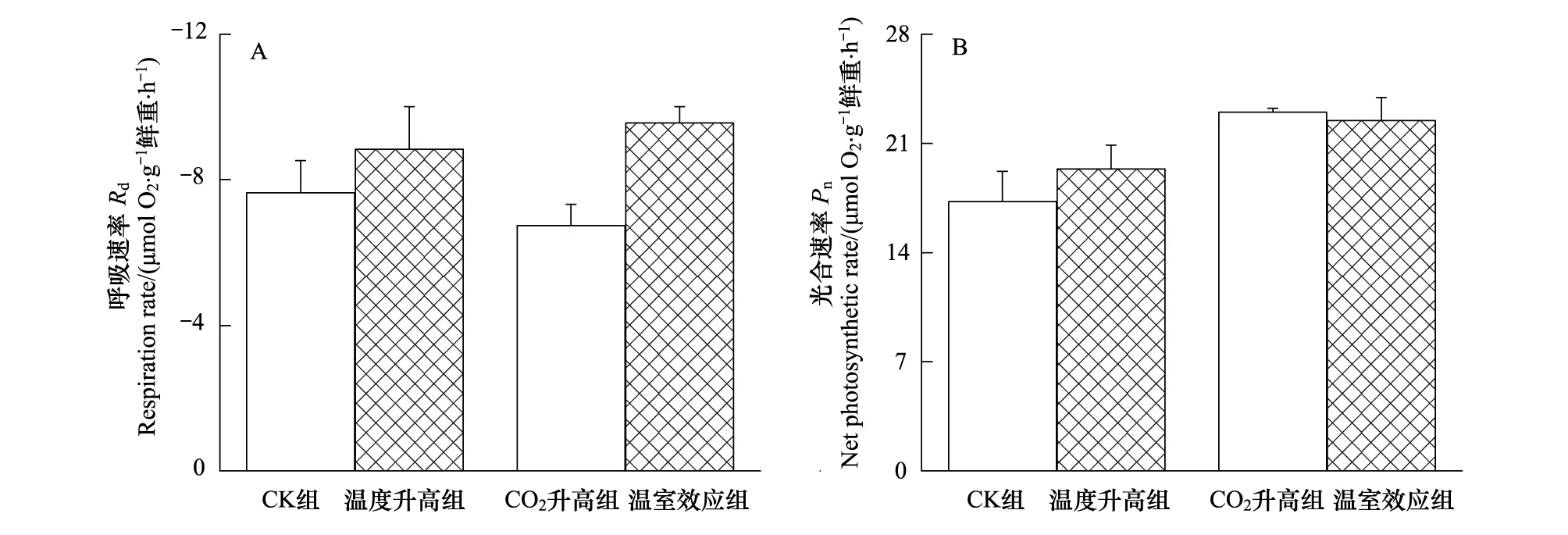
图7 不同条件下生长的龙须菜在原位下的呼吸速率和光合速率
3 讨论
通常情况下,高CO2浓度培养使海藻可溶性蛋白含量下降,而可溶性碳水化合物含量增加[8]。本实验中,温室效应组龙须菜SP和SC含量均下降,这与该组龙须菜所表现出的较高RGR、Rd和Pn的现象一致。光合固碳和生长的加速使龙须菜对N的需求量更高,藻体内可溶性蛋白含量下降可能是因为可溶性蛋白被作为生长所需氮源而导致[24]。此外,呼吸作用的增强消耗了大量的糖类等能源物质,因此温室效应组龙须菜SC含量也下降。本实验结果还表明Chl a和Car含量不受CO2浓度的影响,温度升高使龙须菜Chl a和Car含量上升。这与Zou等[16]关于龙须菜Chl a含量不受CO2水平影响而受光照水平的影响的结果一致。Chl a和Car含量的增加为光合作用提供更多的光能,此外,Car的增加增强了保护光合膜的功能[25]。Zou等[16]发现龙须菜PE和PC含量受CO2浓度和光照强度的影响,而本实验结果表明,龙须菜PE和PC不受CO2和温度的影响。
叶绿素荧光对热胁迫的感应非常灵敏,当外界温度变化时,植物通过迅速改变PSⅡ反应中心开合状态使植物快速适应外界温度变化[1]。本实验中,龙须菜Fv/Fm和α值在32 ℃高温胁迫6 h后并无下降趋势,在36 ℃高温胁迫6 h后表现出不同程度的下降,而在40 ℃胁迫20 min后均下降到极低。这表明龙须菜在6 h高温32 ℃条件下并未受到胁迫,其潜在的最大光能转换效率以及光能利用效率未受到影响;在高温36 ℃处理时受到不同程度的胁迫,不同条件下生长的龙须菜最大光能转换效率以及光能利用效率下降程度不同;龙须菜在高温40 ℃处理时遭到严重胁迫,最大光能转换效率以及光能利用效率在短时间下降到极低值,PSⅡ反应中心受损严重。类似的结果在Ralph[26]对高等植物Halophilaovalis的研究也有发现,该植物在25—30 ℃内未受到胁迫影响,对超出该范围外的其他温度较敏感,高温40 ℃处理5 h使得Fv/Fm下降了一半且PSⅡ受到不可修复的损伤。此外,正常温度生长(20 ℃,包括对照组和CO2升高组)与高温生长的龙须菜(24 ℃,包括温度升高组和温室效应组)Fv/Fm和α值在36 ℃高温胁迫下表现出明显差异,前者Fv/Fm和α值下降了70%以上,而后者下降率不超过26%,表明正常温度(20 ℃)生长的龙须菜最高耐受温度限度可能在32—36 ℃之间,而高温(24 ℃)生长的龙须菜可能在36—40 ℃之间,进一步证明了低温生长的植物对高温胁迫的耐受力相对于高温生长的植物会下降[12, 27]。本实验中不同温度生长下的龙须菜在热胁迫下所表现出的叶绿素荧光参数敏感性的差异可能是龙须菜对各自生长温度的长期适应所引起,对温度的长期适应可能涉及到类囊体膜重组、热激蛋白和脂类以及内源蛋白的合成等生理过程[28]。此外,CO2升高与对照组龙须菜叶绿素荧光参数在高温胁迫过程中的差异不显著。可见,生长温度比CO2浓度对龙须菜抗高温逆境胁迫能力的影响更大。
光合作用和呼吸作用是影响植物碳代谢及生物量的两个重要生理过程。本实验中,温室效应组龙须菜Rd显著高于CO2升高组,而对照组和温度升高组之间的差异不显著,即CO2浓度升高只有在高温生长条件下才对龙须菜呼吸作用表现出显著影响,表明CO2对龙须菜Rd的影响可能与温度有关。温室效应组和温度升高组龙须菜Pn显著高于其他两组,表明温度对龙须菜光合作用的影响更显著。有研究表明,CO2浓度升高可通过增加光合固碳底物浓度和优化光系统结构来促进植物光合作用[29],该实验中CO2升高并未对龙须菜光合作用产生显著促进作用,可能是龙须菜所具有的CCM机制以及其光系统结构并没有发生太大的变化所致。高温32 ℃下,龙须菜Rd和Pn均随时间的延长而上升;高温36 ℃下,各组龙须菜Rd和Pn表现出不同程度的下降;高温40 ℃胁迫时,所有Rd和Pn均急剧下降。这与叶绿素荧光参数的变化趋势一致。Luo等[30]关于葡萄藤研究表明,35 ℃高温不足以对葡萄藤光合作用产生影响,而40 ℃胁迫引起的葡萄藤光合作用下降主要与 Rubisco酶活性提高以及PSⅡ反应中心和受体侧活性受抑制这三方面的因素有关。一般植物的光合作用都有其最适温度,超出这个温度范围,光合产量将逐步减少最终导致CO2吸收的终止。植物在短期热胁迫下,PSⅡ中水裂解反应受阻,最大光化学量子产量和来自PSⅡ电子受体的电子流减少,从而引起PSⅡ反应中心关闭,发生光合作用下调现象,这是对短期温度变化的有效适应方式。对几小时短期热胁迫的适应可能涉及到热保护化合物的积累、类囊体pH值梯度的改变以及因淬灭机制改变所导致的下调等过程。红藻光系统受热胁迫时,按各器官对热胁敏感程度的高低,会先后发生放氧复合体活性下降、捕光色素复合体解离、藻胆体内部结构改变以及PSⅡ受体侧活性受抑制等现象[31]。本实验中,胁迫温度的高低和时间长短影响着光系统受损的状态,进而影响光合作用和呼吸作用。高温胁迫使得Rubisco酶及Calvin循环酶等活性发生变化,光合膜系统结构因脂肪酸饱和程度的变化而改变,胁迫温度越高对酶以及膜结构损伤越严重并伴随着相关生理功能的丧失[1]。在高温胁迫光合作用的早期,主要涉及到叶绿体膜特性的变化和能量转移机制的解偶联等[1],当胁迫温度足够高时,胁迫时间越长终将导致蛋白质的变性和细胞功能的完全丧失。
此外,高温(24 ℃)生长的龙须菜(温度升高组和温室效应组)在高温32 ℃胁迫下表现出较高的光合作用速率,其中温度升高组龙须菜在整个过程中呼吸作用显著低于其他组,温室效应组呼吸作用在胁迫3 h后也逐渐低于其他两组龙须菜,说明高温生长条件下的龙须菜具有较好的高温耐受性和碳代谢状态。Zou等[32]研究表明,低温生长的羊栖菜幼苗在其生长温度下的光合速率高于高温生长的羊栖菜在低温下的光合速率,这种大型海藻光合作用对温度的适应性与高等植物具有相同的机制,对低温的适应涉及到光合作用限制酶(如Rubico酶)含量或者活性增加,对高温的适应与光合作用器官的热稳定增强有关[32, 33]。高温36 ℃胁迫时,对照组和温室效应组龙须菜Rd基本不受温度胁迫影响,温室效应组龙须菜Pn显著高于其他3种,说明温室效应使其在受36 ℃高温胁迫时保持较好的碳代谢状态,即高CO2和高温生长条件共同提高了龙须菜光合作用和呼吸作用的耐热性能。温度升高组和CO2升高组龙须菜Rd在36 ℃胁迫时虽有所下降,但整个胁迫过程Rd值与其他两组并未表现出显著差异,温度升高组Pn在胁迫过程中与对照组无显著差异,而CO2升高组Pn显著低于对照组。这些说明CO2升高使得龙须菜光合作用和呼吸作用的高温耐受性下降,而温度升高的生长条件对其并未产生负面影响。彭长连等[34]研究也表明,高CO2浓度的生长环境对水稻叶片短期高温胁迫耐受能力未产生积极影响。
综上所述,CO2浓度或温度升高提高了龙须菜的生长速率,而温室效应更促进了龙须菜的生长;但温室效应降低了龙须菜SP和SC含量,温度升高使Chl a和Car上升,而CO2对两种色素无显著影响;CO2和温度对PE和PC均无影响。对生长温度的适应使得龙须菜具有不同的最高耐受温度限度,其中正常温度(20 ℃)生长的龙须菜可能在32—36 ℃之间,而高温(24 ℃)生长的龙须菜可能在36—40 ℃之间。生长温度对光合作用和呼吸作用耐热性能的影响比CO2浓度的影响更大,而温室效应更显著的提高了龙须菜光合作用的耐热性能。在温室效应背景下,龙须菜作为在海藻栽培最大重要地位的大型海藻之一,其生长加速以及光合固碳能力的增强,在全球碳循环和减缓未来大气CO2浓度上具有非常重要的意义。
[1] 泰兹, 齐格尔. 植物生理学. 王学路, 宋纯鹏, 译. 4版. 北京: 科学出版社, 2009.
[2] Taiz L, Zeiger E. Plant Physiology. Wang X L, Song, C P, Trans. 4th ed. Beijing: Science Press, 2009.
[3] Solomon S, Qin D, Manning M, Chen Z, Marquis, M, Averyt K B, Tignor M, Miller H L. Climate change 2007: The physical science basis // Contribution of Working Group I to the Fourth Assessment Report of the Inter-governmental Panel on Climate Change. Cambridge: Cambridge University Press, 2007: 996- 996.
[4] Doney S C, Fabry V J, Feely R A, Kleypas J A. Ocean acidification: the other CO2problem. Annual Review of Marine Science, 2009, 1: 169- 192.
[5] 邹定辉, 高坤山. 高CO2浓度对大型海藻光合作用及有关过程的影响. 生态学报, 2002, 22(10): 1750- 1757.
[6] Zou D H, Gao K S. Physiological responses of seaweeds to elevated atmospheric CO2concentrations // Seaweeds and their Role in Globally Changing Environments. Netherlands: Springer, 2010: 115- 126.
[7] Beardall J, Beer S, Raven J A. Biodiversity of marine plants in an era of climate change: some predictions based on physiological performance. Botanica Marina, 1998, 41: 113- 123.
[8] 邹定辉, 陈雄文. 高浓度CO2对条浒苔(Enteromorphaclathrata)生长和一些生理生化特征的影响. 海洋通报, 2002, 21(5): 38- 45.
[9] Mercado J M, Niell F X, Figueroa F L. Regulation of the mechanism for HCO3- use by the inorganic carbon level inPorphyraleucosticathus in Le Jolis (Rhotophyta). Planta, 1997, 201(3): 319- 325.
[10] Mercado J M, Javier F, Gordillo L, Niell F X, Figueroa F L. Effects of different levels of CO2on photosynthesis and cell components of the red algaPorphyraleucosticta. Journal of Applied Phycology, 1999, 11(5): 455- 461.
[11] Kübler J E, Davison I R. High-temperature tolerance of photosynthesis in the red algaChondruscrispus. Marine Biology, 1993, 117(2): 327- 335.
[12] Davison R I. Environmental effects on algal photosynthesis: temperature. Journal of Phycology, 1991, 27(1): 2- 8.
[13] Zou D H, Xia J, Yang Y. Photosynthetic use of exogenous inorganic carbon in the agarphyteGracilarialemaneiformis(Rhodophyta). Aquaculture, 2004, 237(1/4): 421- 431.
[14] Fu F X, Warner M E, Zhang Y H, Feng Y Y, Hutchins D A. Effects of increased temperature and CO2on photosynthesis, growth, and elemental ratios in marineSynechococcusandProchlorococcus(Cyanobacteria). Journal of Phycology, 2007, 43(3): 485- 496.
[15] Fu F X, Zhang Y H, Warne M E, Feng Y Y, Sun J, Hutchins D A. A comparison of future increased CO2and temperature effects on sympatricHeterosigmaakashiwoandProrocentrumminimum. Harmful Algae, 2008, 7(1): 76- 90.
[16] Zou D H, Gao K S. Effects of elevated CO2on the red seaweedGracilarialemaneiformis(Gigartinales, Rhodophyta) grown at different irradiance levels. Phycologia, 2009, 48(6): 510- 517.
[17] Zou D H, Gao K S, Luo H J. Short- and long-term effects of elevated CO2on photosynthesis and respiration in the marine macroalgaHizikiafusiformis(Sargassaceae, Phaeophyta) grown at low and high N supplies. Journal of Phycology, 2011, 47(1): 87- 97.
[18] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248- 254.
[19] Kochert G. Carbohydrate determination by phenol-sulfuric acid method // Hellebust J A, Craigie J S, eds. Handbook of Physiological and Biochemical Methods. London: Cambridge University Press, 1978: 95- 97.
[20] Beer S, Eshel A. Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae. Australian Journal of Marine and Freshwater Research, 1985, 36(6): 785- 792.
[21] Jensen A. Chlorophylls and carotenoids // Hellebust J A, Craigie J S, eds. Handbook of Phycological Methods: Physiological and Biochemical Methods. Cambridge, UK: Cambridge University Press, 1978: 61- 69.
[22] Kitajima M, Butler W. Quenching of chlorophyll fluorescence and primary photochemistry in chloroplasts by dibromothymoquinone. Biochimica et Biophysica Acta, 1975, 376(1): 105- 115.
[23] Jasby A D, Platt T. Mathematical formulation of the relationship between photosynthesis and light for phytoplankton. Limnology and Oceanography, 1976, 21(4): 540- 547.
[24] Young, E B, Berges J A, Dring M J. Physiological responses of intertidal marine brown algae to nitrogen deprivation and resupply of nitrate and ammonium. Physiologia Plantarum, 2009, 135(4): 400- 411.
[25] Xia J R, Gao K S. Impacts of elevated CO2concentration on biochemical composition, carbonic anhydrase, and nitrate reductase activity of fresh water green algae. Journal of Integrative Plant Biology, 2005, 47(6): 668- 675.
[26] Ralph P J. Photosynthetic response of laboratory-culturedHalophilaovalisto thermal stress. Marine Ecology Progress Series, 1998, 171: 123- 130.
[27] Davison I R. Adaptation of photosynthesis in laminaria saccharina (phaeophyta) to changes in growth temperature. Journal of Phycology, 1987, 23(2): 273- 283.
[28] Larcher S. Photosynthesis as a tool for indicating temperature stress events // Schulze E D, Caldwell M M, eds. Ecophysiology of Photosynthesis. Berlin: Springer-Verlag, 1994: 261- 277.
[29] 何平. 温室效应与植物光合作用——大气CO2浓度升高对植物光合机理影响的分析. 中南林学院学报, 2001, 21(1): 1- 4.
[30] Luo H B, Ma L, Xi H F, Duan W, Li S H, Loescher W, Wang J F, Wang L J. Photosynthetic responses to heat treatments at different temperatures and following recovery in grapevine (VitisamurensisL.) Leaves. PLos One, 2011, 6(8): e23033.
[31] Wu B G, Han Z G, Zang R B. Effects of heat stress in marine red and green algae by chlorophyll fluorescence method. Journal of Jinan University: Natural Science, 2002, 23(1): 108- 112.
[32] Zou D H, Liu S X, Du H, Xu J T. Growth and photosynthesis in seedlings ofHizikiafusiformis(Harvey) Okamura (Sargassaceae, Phaeophyta) cultured at two different temperatures. Journal of Applied Phycology, 2012, 24(5): 1321- 1327.
[33] Berry J, Björkman O. Photosynthetic response and adaptation to temperature in higher plants. Annual Review of Plant Physiology, 1980, 31: 491- 543.
[34] 彭长连, 林植芳, 林桂珠. 高温对生长在加富CO2条件下水稻离体叶片叶绿素荧光的影响. 热带亚热带植物学报, 2000, 8(2): 91- 96.
Effect of climate change on the growth and photosynthetic thermal tolerance in the marine macroalgaGracilarialemaneiformis
DING Liuli1, ZOU Dinghui1,2,*, LIU Lu1, DENG Yayun1
1CollegeofEnvironmentandEnergy,SouthChinaUniversityofTechnology,Guangzhou510006,China2TheKeyLaboratoryofPollutionControlandEcosystemRestorationinIndustryClusters,MinistryofEducation,Guangzhou510006,China
It was predicted that the atmospheric CO2concentrations in the end of this century would be twice as much as the present level, and as a consequence of this the mean global temperature would elevate 4—5 ℃. At present, there are many researches on seaweeds in response to elevated atmospheric CO2concentrations or temperature alone. However, the investigations concerning the impacts of combined effects of elevated atmospheric CO2concentrations and temperature on seaweeds is very limited. The marine red macroalgaGracilarialemaneiformishas been cultivated on large scales in both the southern and the northern parts of China. It is essential to evaluate how the climate change (such as the elevated atmospheric CO2concentrations and global warming) affect this economically important species. In this study,G.lemaneiformiswas cultured under the following four different conditions: 1) ambient control (390 μL/L CO2+ 20 ℃); 2) elevated CO2(700 μL/L CO2+ 20 ℃); 3) elevated temperature (390 μL/L CO2+ 24 ℃); and 4) greenhouse effect (700 μL/L CO2+ 24 ℃). After cultured for 10 d, the growth and biochemical compositions were examined. At the same time, the changes of maximum photochemical quantum yield (Fv/Fm), light use efficiencies (α), net photosynthetic rate (Pn) and dark respiratory rate (Rd) under high-temperature stresses (32 ℃, 36 ℃ and 40 ℃) were explored. The results showed that elevated CO2, elevated temperature, or greenhouse effect all enhanced the growth ofG.lemaneiformis, with the highest relative growth rate occurring under the culture treatment with greenhouse effect. The growth condition treated with greenhouse effect increased the rates ofPnandRdin situ, but decreased the contents of solution protein (SP) and soluble carbohydrate (SC) in algal thalli. Elevated CO2in culture increased the rate ofPnin situ, but the growth condition treated with elevated temperature had hardly affected thePnin situ. Both chlorophyll a (Chl a) and carotenoid (Car) were increased with elevated temperature in culture, but their contents were unaltered with high CO2. Elevated CO2or elevated temperature alone had no significant effects on the contents of phycoerythrin (PE) and phycocyanin (PC) of the algal thalli. The changes ofFv/Fmandαof the algal thalli under high-temperature stresses displayed the same tendency, i.e: their values all increased slightly under 32 ℃-stress, but decreased under 36 ℃-stress, and declined fiercely under 40 ℃-stress. In the course of 6 h of 32 ℃-stress, the rates ofPnin elevated temperature-grown algae and greenhouse effect-grown algae were much higher than those in the algae grown under control condition. In the course of 6 h of 36 ℃-stress, the rates ofPnin greenhouse effect-grown algae displayed the highest levels relative to the algae grown with other three treatments. It was shown that the high-temperature tolerance limit of photosynthesis in 20 ℃ grown algae was between 32 ℃ and 36 ℃, while that of 24 ℃-grown algae was between 36 ℃ and 40 ℃. Taken together, our results suggested that growth ofG.lemaneiformiswould benefit from elevated CO2and/or elevated temperature. Moreover, the greenhouse effect (combined with elevated CO2and elevated temperature) would improve the photosynthetic thermal tolerance to high temperature forG.lemaneiformis.
CO2; temperature;Gracilarialemaneiformis; biochemical compositions; chlorophyll fluorescence; photosynthesis; respiration.
国家自然科学基金项目(41076094,41276148)
2013- 07- 06;
2014- 05- 30
10.5846/stxb201307061846
*通讯作者Corresponding author.E-mail: dhzou@scut.edu.cn
丁柳丽, 邹定辉, 刘露, 邓亚运.气候变化对海藻龙须菜生长与光合作用耐热特性的影响.生态学报,2015,35(10):3267- 3277.
Ding L L, Zou D H, Liu L, Deng Y Y.Effect of climate change on the growth and photosynthetic thermal tolerance in the marine macroalgaGracilarialemaneiformis.Acta Ecologica Sinica,2015,35(10):3267- 3277.
