高山栎天然林土壤酶活性与土壤理化性质和微生物数量的关系1)
2015-02-08赵维娜王艳霞陈奇伯
赵维娜 王艳霞 陈奇伯
(西南林业大学,昆明,650224)
高山栎天然林土壤酶活性与土壤理化性质和微生物数量的关系1)
赵维娜 王艳霞 陈奇伯
(西南林业大学,昆明,650224)
以云南省玉溪市磨盘山国家森林公园内的高山栎天然林土壤为研究对象,运用通径分析方法,对土壤酶活性与土壤理化因子、微生物数量之间的关系进行了分析。结果表明:土壤脲酶、过氧化氢酶、转化酶活性都是随着土壤深度的加深而逐渐减小;土壤脲酶、过氧化氢酶、转化酶活性均与土壤理化性质、微生物数量之间有着密切的相关关系;影响脲酶和过氧化氢酶活性程度最大的是有机质;影响转化酶活性最重要的因子是土壤有机质、速效钾和碱解氮。
高山栎天然林;土壤酶活性;土壤理化性质;土壤微生物数量;通径分析
土壤理化性质、酶活性和微生物是土壤生态系统的重要组成成分。土壤酶能够促进土壤中物质转化与能量交换,催化土壤中的一切生物化学反应和物质循环,反映土壤中进行的各种生物化学过程的强度和方向,同时,土壤酶易受环境中物理、化学、生物因素的影响[1-3]。土壤理化性质直接影响植物的生长发育,土壤理化因子已经成为判断土壤质量的常规指标。土壤微生物种类繁多,在土壤物质转化中具有多种重要作用,与土壤肥力和植物营养有密切关系[4-6]。土壤酶活性与土壤微生物是构成土壤微生态环境的两个重要组分,并且是决定土壤功能的两个关键性因素[7-8]。因此,对土壤酶活性的研究有助于我们更全面地评价森林土壤生态系统内部影响机制。前人对土壤理化性质、酶活性、微生物的研究不少,在研究中常见的有脲酶、过氧化氢酶、蔗糖酶、蛋白酶、磷酸酶、纤维素酶,这几种酶活性与土壤有机质、全氮、水解氮、全磷、速效磷等肥力因素均存在不同程度的相关关系,细菌、放线菌、真菌数量与土壤理化性质也存在不同程度的相关性。目前,对于他们之间关系的研究多数仅止于特定林分中各种因素之间相关性的研究,而简单的相关系数并不能完全反映一个变量对另一个变量的直接作用。通径分析能全面考查变量间的相互关系,消除变量间的混淆,真实的表现出各个自变量和因变量之间的关系[9]。因此,采用相关分析与通径分析相结合的方法,分析土壤酶活性与理化性质、微生物数量的关系,为探究森林生态系统中土壤理化性质、酶活性、微生物数量之间关系的建立提供数据支撑。
高山栎(Quercusaquifolioides)的环境适应性、抗干扰能力强,具备旺盛的萌蘖能力,是重要的水土保持和水源涵养林[10]。地上植被对其土壤酶活性及理化性质、微生物数量有较深刻的影响,土壤性质的不同对酶活性产生的影响不同。本文选取高山栎天然林土壤作为研究对象,研究不同土层土壤酶活性的差异,探讨酶活性与土壤理化性质、微生物数量之间的关系,为全面评价高山栎林土壤质量提供依据。
1 研究区概况
磨盘山国家森林公园地处我国云贵高原、横断山地和青藏高原三大自然地理区域的结合部,地理位置为北纬23°46′~23°54′,东经101°16′06″~101°16′12″,海拔1 260.0~2 614.4 m,立体气候明显。磨盘山国家森林公园地处低纬度高原,是云南亚热带北部与亚热带南部的气候过渡地区,有着典型的山地气候特点。磨盘山海拔高差大,气候垂直变化明显。年平均气温15 ℃,年平均降水量1 050 mm。极端最高气温33.0 ℃,极端最低气温-2.2 ℃,全年日照时间2 380 h。磨盘山国家森林公园内土壤以第三纪古红土发育的山地红壤和玄武岩红壤为主,高海拔地区有黄棕壤分布。
样地的基本概况为林龄60~70 a的高山栎天然林,海拔2 460 m,坡度15°,坡向南偏西45°,郁闭度1,土壤类型黄棕壤。林下植被主要有白栎(QuercusfabriHance)、白杜鹃(Exochordaracemosa)、地檀香(Gaultheriaforrestii)、厚皮香(Ternstroemiagymnanthera(Wight Arn.) Sprague)、南烛(VacciniumbracteatumThunb)、铁籽(EuryapyracanthifoliaP. S. Hsu)、越桔(Vacciniumvitis-idaeaLinn)、云南含笑(MicheliayunnanensisFranch. ex Finet & Gagnep)、云南山茶(CamelliareticulataLindl)、珍珠花(SpiraeathunbergiiSieb)、柃木(EuryajaponicaThunb)、马缨杜鹃(RhododendrondelavayiFranch)、白瑞香(DaphnepapyraceaWall. ex Steud)、桤木(AlnuscremastogyneBurk)、新樟(Neocinnamomumdelavayi)等。
2 研究方法
2.1 采样方法
2014年11月对磨盘山国家森林公园进行了全面踏查,并选择现存的60~70 a的高山栎天然林林地土壤作为研究对象。在研究区内分别设置3个20 m×20 m的标准地,调查高山栎树龄、树高、胸径及各种伴生植物,并在标准样地内沿对角线设置3个典型采样点,每个采样点去除表层枯枝落叶,挖掘土壤剖面,分别在0~20、>20~40、>40~60 cm的土层采集土壤样品,鲜土采集后立即放在冰箱内4 ℃保存,其余土样带回实验室后经过阴干研磨,分别过1.00、0.25 mm筛,装袋待测。
2.2 测定方法
环刀法测定土壤密度和田间持水量,烘干法测定土壤含水率;土壤有机质采用K2Cr2O7外加热法测定,土壤全氮采用扩散法测定,碱解氮采用碱解—扩散法测定,土壤全磷、速效磷采用钼锑抗比色法测定,土壤全钾、速效钾采用火焰光度法测定,土壤pH采用电位法测定[11]。脲酶活性采用苯酚钠比色法测定,过氧化氢酶活性采用容量法(高锰酸钾滴定法)测定,蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,蛋白酶活性采用茚三酮比色法测定[12]。土壤微生物数量采用稀释平板分离计数法测定,细菌数量采用牛肉膏蛋白胨培养基培养法测定,放线菌数量采用高氏1号培养基培养法测定,真菌数量采用孟加拉红培养基培养法测定[13]。
2.3 数据处理
采用Excel对数据进行整理,运用SPSS22.0软件进行数据分析,采用单因素方差分析检验4种土壤酶活性的显著性,对所有数据进行正态性与方差齐性检验,采用回归模型拟合土壤酶活性、微生物数量与土壤理化性质的相关关系并进行通径分析。通径分析是通过直径通径系数和间接通径系数表示的相关变量之间原因对结果的直接效应和间接效应,间接通径系数为直接通径系数与各因子之间相关关系的乘积[14]。
3 结果与分析
3.1 土壤理化性质
高山栎土壤理化性质见表1~2。由表1~2可知,高山栎天然林土壤呈酸性,且pH随着土层深度的增加而增大。土壤密度、全钾质量分数随着土层深度的增加而增大,土壤自然含水率、田间持水量、有机质、碳氮比、全氮、碱解氮、全磷、速效磷、速效钾质量分数均是随着土层深度的增加而减少。
由表1~2可知,有机质质量分数在0~20、>20~40、>40~60 cm各土层间的差异极显著(p>0.01);自然含水率、田间持水量、全磷、速效磷、全钾质量分数在0~20、>20~40、>40~60 cm各土层间的差异均未达到显著水平(p>0.01);
土壤密度、碳氮比在0~20、>20~40 cm土层间的差异均未达到显著水平(p>0.01),但在0~40 cm土层与>40~60 cm土层间的差异极显著(p>0.01);
pH、全氮质量分数在>20~40、>40~60 cm土层间的差异不显著(p>0.01),但在0~20 cm土层与>20~60 cm土层间的差异极显著(p>0.01);
碱解氮质量分数在0~20、>20~40 、>40~60 cm土层间的差异不显著;
速效钾质量分数在0~20、>20~40 cm土层间的差异不显著(p>0.01),在>20~40、>40~60 cm土层间的差异不显著(p>0.01),但在0~20、>40~60 cm土层间的差异极显著(p>0.01)。
由此可知,土壤的理化性质随着土层深度的增加,各指标在表层土壤的质量分数变化要比深层土壤的质量分数变化显著,并在>40~60 cm土层趋于稳定。
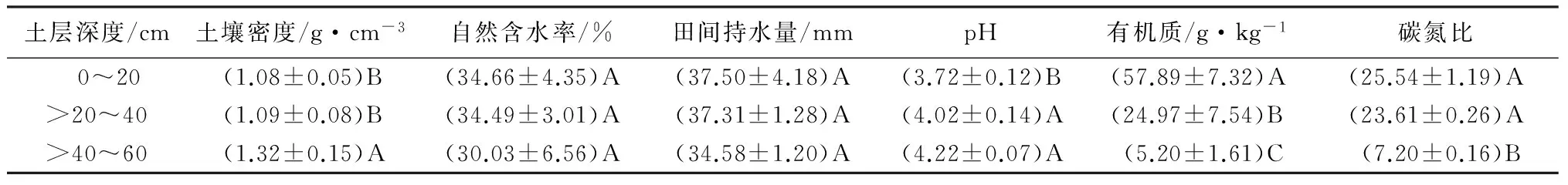
表1 高山栎土壤物理性质、pH、有机质、碳氮比
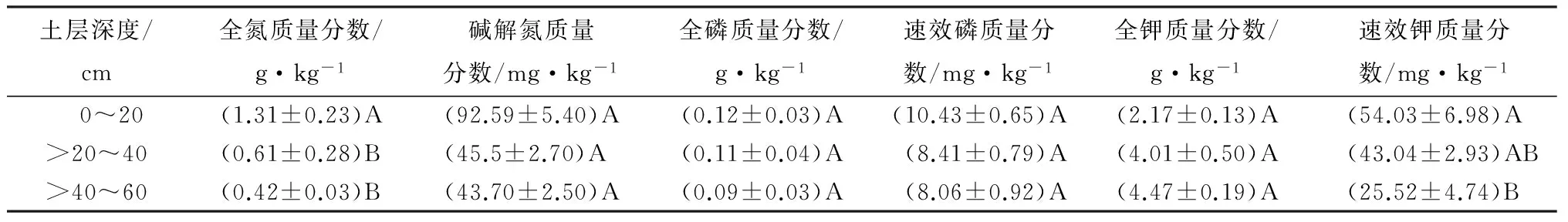
表2 高山栎土壤全氮、碱解氮、全磷、速效磷、全钾、速效钾质量分数
3.2 土壤酶活性及微生物数量
3.2.1 土壤酶活性
高山栎土壤酶活性见表3。由表3可知,脲酶活性在0~20、>20~40、>40~60 cm土层间的差异不显著(p>0.01);
过氧化氢酶活性与转化酶活性分别在0~20、>20~40 cm土层间的差异和在>20~40、>40~60 cm土层间的差异不显著(p>0.01),而在0~20、>40~60 cm土层间的差异显著(p>0.01)。可见,过氧化氢酶、转化酶活性都是随着土壤深度的加深而逐渐减小,但在0~20与>20~40 cm土层间差异不明显,在土壤表层与土壤深层差异明显。
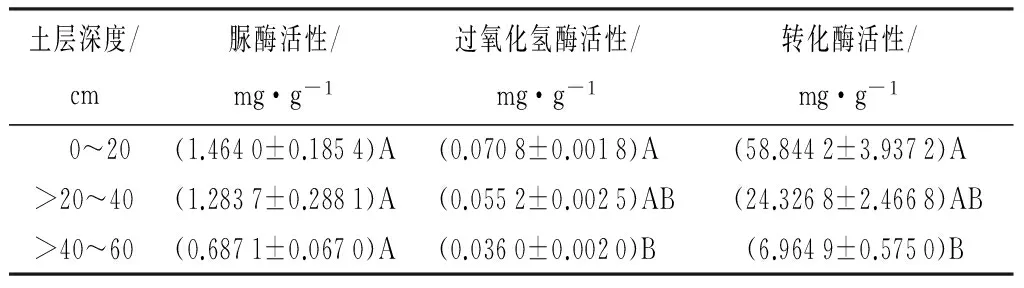
表3 高山栎天然林土壤酶活性
3.2.2 土壤微生物数量
土壤微生物数量见表4。由表4可知,在0~20、>20~40、>40~60 cm的土壤中三种微生物的数量都是呈现出相同的规律:细菌>放线菌>真菌。随着土壤深度的增加,土壤中细菌、放线菌、真菌、微生物总数量都是逐渐减少的,3种微生物数量在0~20、>20~40 cm土层间的差异均未达到显著水平(p>0.01),而这3种土壤微生物数量在土壤表层(0~40 cm)与土壤深层(>40~60 cm)之间差异显著(p>0.01)。
由表4可知,土壤细菌占总微生物数量的比例随着土层加深呈先增大后减小的趋势,放线菌、真菌比例随着土层加深呈先减小后增大的趋势且于土壤深层的比例要比土壤表层的比例大,真菌与细菌数量之比也是随着土层加深呈先减小后增大的趋势。细菌、放线菌比例及真菌细菌之比在0~40 cm土层与>40~60 cm土层均达到显著差异水平;真菌比例在0~20、>20~40、>40~60 cm土层间的差异未达到显著水平(p>0.01)。
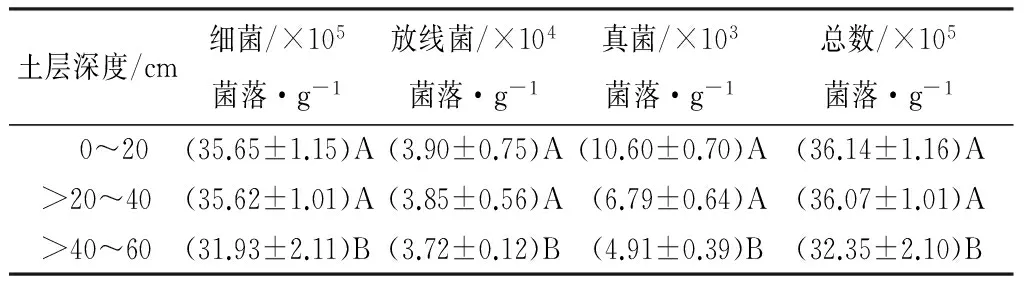
表4 磨盘山国家森林公园高山栎天然林土壤微生物数量
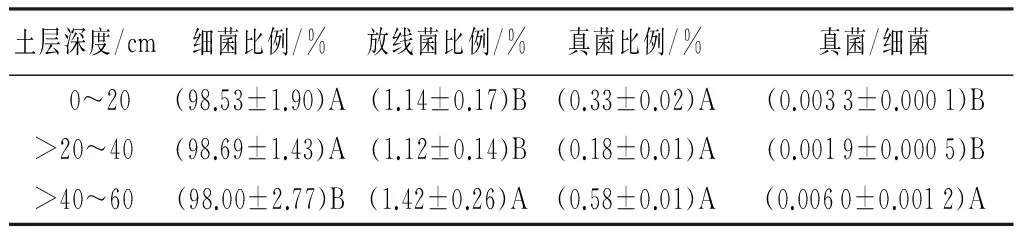
表5 高山栎土壤微生物比例及真菌/细菌
3.3 土壤酶活性、微生物数量与理化因子的通径分析
3.3.1 土壤理化因子与土壤酶活性及微生物数量的相关性
土壤理化性质与土壤脲酶、过氧化氢酶、转化酶活性之间有密切的相关关系(见表6)。由表6可知,土壤脲酶活性与土层深度、土壤pH呈显著负相关关系,与碱解氮质量分数呈显著正相关关系,与土壤有机质、速效磷质量分数呈极显著正相关关系。土壤过氧化氢酶活性与土层深度、土壤pH呈极显著负相关关系,与土壤密度呈显著负相关关系,与土壤有机质和碱解氮质量分数呈极显著正相关关系,与土壤全氮和速效磷质量分数呈显著正相关关系。土壤转化酶活性与土层深度呈极显著负相关关系,与土壤密度呈显著负相关关系,与土壤有机质和全氮质量分数呈极显著正相关关系,与碱解氮质量分数呈显著正相关关系。此外,脲酶还与转化酶有显著的正相关关系,过氧化氢酶与转化酶呈极显著的正相关关系。

表6 高山栎天然林土壤酶活性与土壤理化性质、微生物数量的相关系数
3.3.2 土壤理化性质、微生物数量对土壤酶活性的通径分析
将土壤理化性质、土壤酶活性、微生物数量进行多元回归分析,得到标准化回归方程:
U1=1.060X1-0.237X2+0.180X3+0.223X4-0.112X5-
0.226X6;
U2=0.763X1+0.316X2-0.214X3-0.153X4+0.135X5+
0.175X6;
U3=0.492X1+0.163X2-0.132X3-0.003X4-0.192X5+
0.041X6。
式中:U1为脲酶活性,U2为过氧化氢酶活性,U3为转化酶活性,X1为有机质,X2为碱解氮,X3为pH,X4为速效磷,X5为速效钾,X6为真菌比例。
由表7可知,土壤理化性质及生物学特性的各因子对土壤脲酶活性的直接作用系数的由大到小的顺序为:有机质、碱解氮、真菌比例、速效磷、pH、速效钾。有机质对土壤脲酶活性具有较大的直接正效应(1.060),碱解氮、真菌比例、速效磷、pH、速效钾等对土壤脲酶活性有一定的直接负效应。土壤有机质对脲酶活性的直接作用比其他因素产生的间接作用都大。因此,影响土壤脲酶的主要影响因子是土壤有机质;其次是土壤碱解氮、速效磷、真菌比例的直接作用。
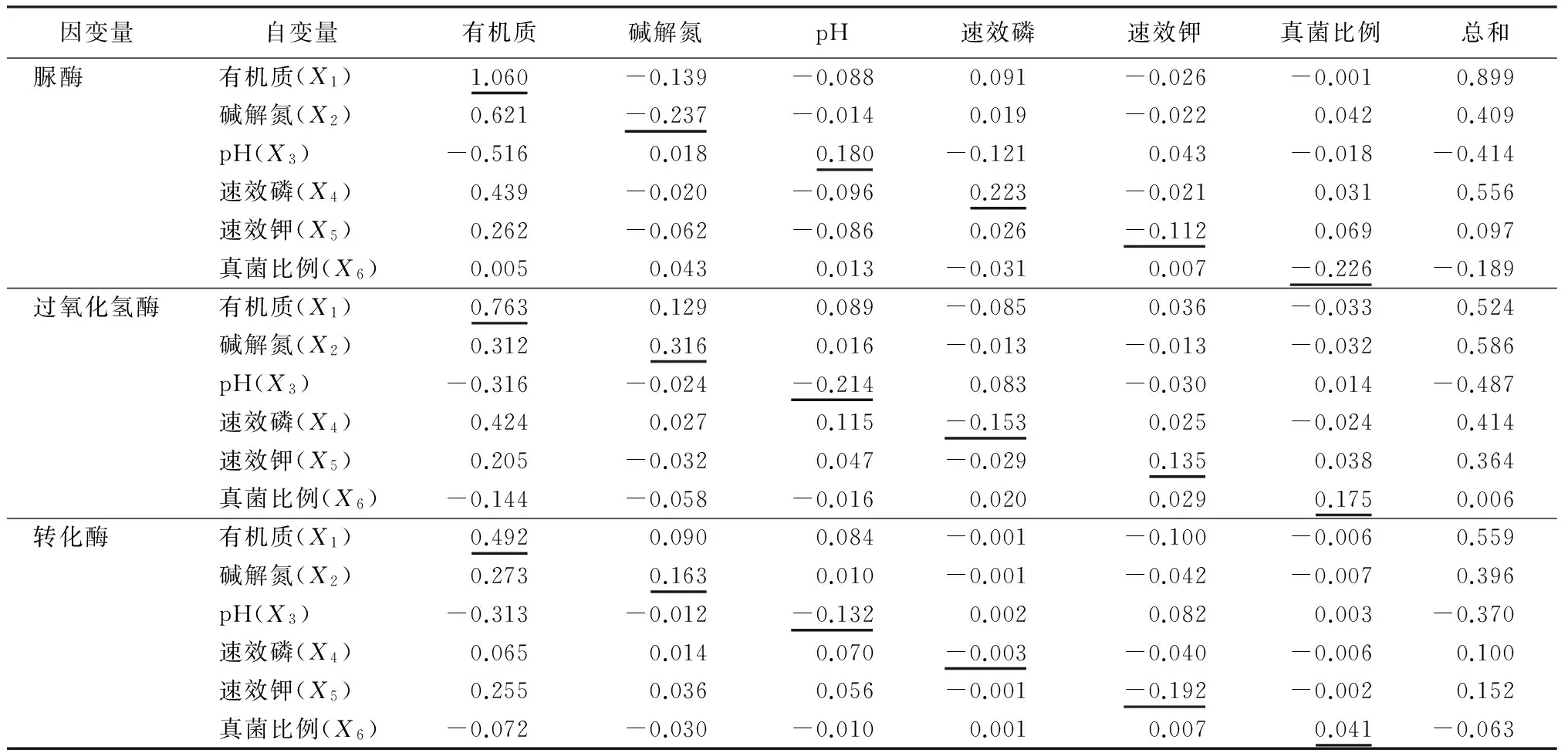
表7 磨盘山高山栎天然林土壤酶活性受理化性质、微生物数量影响的通径系数
土壤中过氧化氢酶活性受土壤中各因子直接作用系数的由大到小的顺序为:有机质、碱解氮、pH、真菌比例、速效磷、速效钾。土壤有机质对土壤过氧化氢酶活性的影响要远大于其他因子的间接效应;土壤碱解氮对土壤过氧化氢酶活性的影响与有机质的作用相差不大,土壤其他因子间接效应影响较低;土壤pH和对有机质的负效应,构成了对土壤过氧化氢酶活性的负效应;土壤速效磷通过对脲酶活性的正效应抵消了通过其自身和对其他因子影响的负效应,从而表现出对土壤过氧化氢酶活性的正效应;速效钾主要是通过自身和对有机质影响的正效应对过氧化氢酶活性产生正效应;土壤中真菌比例自身对过氧化氢酶活性影响的直接作用较大,但是由于被真菌比例对脲酶活性产生的负效应抵消,最终表现出的相关性较小。
因此,影响过氧化氢酶的主要影响因子是土壤有机质对过氧化氢酶活性的直接和间接作用及土壤碱解氮、pH、速效磷、速效钾、真菌比例的直接作用。
土壤转化酶活性受土壤理化因子及微生物数量的直接影响作用的由大到小的顺序依次为:有机质、速效钾、碱解氮、pH、真菌比例、速效磷。土壤有机质对土壤酸碱性产生的直接作用远大于其通过其他因子产生的间接效应。土壤碱解氮通过有机质对转化酶的间接作用及对转化酶的直接作用比其他因子产生的间接作用要大。土壤酸碱性通过有机质对转化酶产生的间接效应和直接效应较大。土壤速效磷对转化酶的直接作用和间接作用相对其他因子来说都较小。土壤速效钾通过土壤有机质对转化酶产生的间接作用和直接作用较大。土壤真菌比例对土壤转化酶的直接和间接作用相对其他因子小。
因此,影响转化酶活性的主要因子是土壤有机质的直接作用及速效钾、碱解氮、酸碱性、真菌比例产生的间接作用;其次是土壤碱解氮、酸碱性、速效钾的直接作用;土壤酸碱性通过对土壤速效钾的影响产生间接作用,土壤碱解氮通过对土壤速效钾的影响也产生间接作用。
4 讨论与结论
高山栎天然林土壤呈酸性,且酸碱性随着土层深度的增加而增大。高山栎土壤表面枯枝落叶较多,土壤表层积累的有机酸较多,因此,表层土壤呈酸性,而随着土壤深度的增加,土壤酶活性增加,土壤中的枯枝落叶分解产物在酶的作用下参加反应,使得土壤酸性逐渐减弱。土壤密度、全钾质量分数随着土层深度的增加而增大,土壤含水率、田间持水量、碳氮比等随着土层深度的增加而减少,有机质、全氮、碱解氮、全磷、速效磷、速效钾等质量分数也随着土层深度的增加而减少。这与于洋等[15]、何斌等[16]对河北省木兰围场华北落叶松林土壤理化性质研究的结果一致。土壤的理化性质随着土层深度的增加,各指标在表层土壤的变化要比深层土壤的变化显著,在>40~60 cm土层趋于稳定。主要的原因是土壤表层枯落物、根系、微生物较多,由土壤酶和微生物参加的生化反应较多,土壤、空气、水这三个界面之间的交换使得土壤孔隙丰富,而深层土壤相对来说根系数量、酶活性与微生物数量较小,化学性质也相对稳定,反应的频率和速率较表层土壤小。
土壤脲酶、过氧化氢酶、转化酶活性都是随着土壤深度的加深而逐渐减小,在土壤深层趋于稳定。在0~20、>20~40、>40~60 cm的土壤中3种微生物的数量都是呈现出相同的规律(细菌>放线菌>真菌)。随着土壤深度的增加,土壤中细菌、放线菌、真菌数量都是逐渐减少的。与郑诗樟等[17]、漆良华等[18]研究结果一致。主要是因为随着土壤深度增加,土壤中的空气、水分及养分的减少,使得土壤中生化反应速率受限、酶活性降低,土壤中枯枝落叶等动植物残体的减少也使得土壤中微生物数量减少。
土壤理化性质与土壤脲酶、过氧化氢酶、转化酶活性之间有密切的相关关系。这与陈礼清等[19]的研究结果一致。土壤酶主要有植物根系分泌、土壤动物排泄物、微生物分泌物3个来源,土壤密度、自然含水量、田间持水量等物理性质能体现土壤通气性、水分的大小,土壤有机质等养分是土壤酶促反应的底物、产物或是催化物,因而土壤中酶活性的大小与这些因素紧密相关。由此可见,不同的植被类型、管理方式、土壤发育母质、生长环境都会造成土壤系统中酶活性的不同,进而影响整个土壤生态系统。这就需要对不同类型植被、不同地区土壤的理化性质、酶活性和微生物做更深入、全面的研究。
影响脲酶的主要因子是有机质的直接作用及有机质通过对碱解氮、pH、速效磷的影响产生的间接作用。这是因为土壤脲酶分解底物为尿素,而尿素的重要来源为有机质和碱解氮,因此,有机质和碱解氮在土壤中的质量分数是影响脲酶活性的主要因子。有机质产生的间接作用是有机质分解影响pH值,而脲酶属于蛋白质,活性受酸碱性影响较大;而有机质通过速效磷产生的间接作用,可能是因为有机质分解影响速效磷质量分数(在脲酶的酶促反应中,需要含磷的催化物,而影响脲酶反应速率),进而影响脲酶活性。
影响过氧化氢酶的主要因子是土壤有机质对过氧化氢酶活性的直接和间接作用,及土壤碱解氮、pH、速效磷、速效钾、真菌比例的直接作用。原因可能是土壤有机质和碱解氮的分解产物或是伴生产物促进过氧化氢酶的生成及过氧化氢酶酶促反应的进行,而酸碱性则是通过过氧化氢酶的反应环境pH值来影响其活性,速效磷、速效钾、真菌比例可能是通过影响土壤中根系和微生物的生长发育来影响过氧化氢酶活性的。
影响转化酶活性的主要因子是土壤有机质的直接作用,及其通过速效钾、碱解氮、酸碱性、真菌比例产生的间接作用;其次是土壤碱解氮、酸碱性、速效钾的直接作用,土壤酸碱性通过对土壤速效钾的影响产生的间接作用以及土壤碱解氮通过对土壤速效钾的影响产生的间接作用。转化酶主要是分解土壤蔗糖的酶,而土壤中有机质分解产物中有蔗糖,因此,有机质的直接作用可能是通过影响转化酶底物数量来影响土壤转化酶的活性;通过速效钾产生的间接作用,可能是因为速效钾有利于根部吸收,而根系是转化酶生成的重要来源,这表明土壤有机质通过影响速效钾影响转化酶的生成过程,进而影响其活性;而土壤有机质通过碱解氮产生的间接作用,可能是因为转化酶的蛋白质结构中含有氮,通过影响组成转化酶构成元素的质量分数来影响转化酶的活性;有机质通过酸碱性产生的间接作用,是因为影响了转化酶的酶促反应的环境pH值来影响其活性;有机质通过真菌比例产生的间接作用,可能是因为土壤中有机质影响真菌的数量,而真菌的分泌物中有构成转化酶的重要物质,进而影响的转化酶的活性。
此外,脲酶与转化酶有显著的正相关关系,过氧化氢酶与转化酶呈极显著的正相关关系,这一结果与陆梅等[20]在对滇池西岸4种针叶林的土壤微生物和酶活性的研究结果一致。土壤酶之间的相关关系表明土壤脲酶、过氧化氢酶、转化酶之间有着很复杂的联系,有待进一步深入的研究。
综上所述,高山栎天然林根系集中在土壤表层0~40 cm左右,土壤养分、水分主要集中在土壤表层,且随着土壤深度的增加,土壤养分质量分数逐渐减少。>40~60 cm的土层由于根系少、养分质量分数低,土壤理化性质比较稳定。由于高山栎天然林受人为干扰少,其土壤理化性质及酶活性较好。土壤酶活性与微生物数量均随着土壤深度的增加而降低,高山栎天然林土壤脲酶、过氧化氢酶、转化酶活性受土壤理化性质影响较大,受土壤微生物数量影响程度较小。影响脲酶活性的主导因子是有机质;影响过氧化氢酶活性的主要因子是有机质和碱解氮的直接作用,及有机质通过对碱解氮、pH、速效磷等产生的间接作用;土壤有机质、速效钾和碱解氮是影响土壤转化酶活性重要的因素。
[1] Abdul K S, Katayama A, Kimura M. Activities of some soil enzymes in different land use system after deforestation in hilly areas of west Lampung, South Sumatra, Indonesia[J]. Soil Science and Plant Nutrition,1998,40(1):93-103.
[2] Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semiarid tropical regions[J]. Applied Soil Ecology,2001,18(3):229-238.
[3] 邱莉萍,刘军,王益权,等.土壤酶活性与土壤肥力的关系研究[J].植物营养与肥料学报,2004,10(3):227-280.
[4] 孟庆英,张春峰,于忠和,等.根瘤菌对大豆根际土壤微生物及大豆农艺性状的影响[J].大豆科学,2012,31(3):498-500.
[5] Li F L, Liu M, Li Z P, et al. Changes in soil microbial biomass and functional diversity with a nitrogen gradient in soil columns[J]. Applied Soil Ecology,2013,34:1-6.
[6] 黄从德,张健,杨万勤,等.四川人工林生态系统碳储量特征[J].应用生态学报,2008,19(8):1644-1650.
[7] 刘曼,辛颖,赵雨森.氯氟氰菊酯对水源涵养林土壤微生物及酶活性的影响[J].东北林业大学学报,2013,41(6):80-83.
[8] 宫占元,张国庆,于文莹,等.哈茨木霉菌对水稻幼苗根际土壤微生物和酶活性的影响[J].干旱地区农业研究,2013,31(4):167-171.
[9] 杨敬天,苏智先,胡进耀,等.珙桐林土壤有机质与酶活性的通径分析[J].应用与环境生物学报,2010,16(2):164-167.
[10] 王国严,徐阿生.川滇高山栎研究综述[J].四川林业科技,2008,29(2):23-29.
[11] 中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1978:36-42.
[12] 关松荫.土壤酶及其研究方法[M].北京:农业出版社,1986:4-6.
[13] 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985.
[14] 杨晓娟,廖超英,李晓明,等.榆林沙区樟子松林土壤酶活性与土壤化学性质的通径分析[J].干旱区资源与环境,2013,27(9):109-112.
[15] 于洋,王海燕,丁国栋,等.华北落叶松人工林土壤微生物数量特征及其与土壤性质的关系[J].东北林业大学学报,2011,39(3):76-80.
[16] 何斌,温远光,袁霞,等.广西英罗港不同红树植物群落土壤理化性质与酶活性的研究[J].林业科学,2002,38(2):21-26.
[17] 郑诗樟,肖青亮,吴蔚东,等.丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J].中国生态农业学报,2008,16(1):57-61.
[18] 漆良华,张旭东,彭镇华.湘西北小流域植被恢复区土壤酶活性及养分相关性[J].东北林业大学学报,2011,39(3):83-88.
[19] 陈礼清,罗承德,宫渊波,等.炼山对巨桉人工幼土壤酶活性和有效养分的影响[J].东北林业大学学报,2014,42(3):89-92.
[20] 陆梅,卫捷,韩智亮.滇池西岸4种针叶林的土壤微生物与酶活性[J].东北林业大学学报,2011,39(6):56-59.
Relationships between the Soil Enzyme Activity, Physical Chemical Properties and Microorganism Quantity inQuercusaquifolioidesForest//
Zhao Weina, Wang Yanxia, Chen Qibo
(Southwest Forestry University, Kunming 650224, P. R China)//Journal of Northeast Forestry University,2015,43(9):72-77.
WithQuercusaquifolioidesforest soil in the Mill Mountain National Forest Park in Yuxi City, Yunnan Province, by path analysis, we studied the relationships between the soil enzyme activity, physical chemical properties and microorganism quantity. The soil urease, catalase, and invertase activities were gradually decreased with the increasing of soil depth. There were close relationships between soil urease, catalase, invertase activity, soil physical-chemical properties, and microbial quantity. Urease and catalase activity were largely affected by the organic matter. The most important influencing factors on invertase activities were organic matter, available K and alkali-hydrolyzale N.
Quercusaquifolioidesforest; Soil enzymes activities; Soil physical-chemical properties; Soil microbial quantity; Path analysis
1)林业公益性行业科研专项(201204101-10);云南省高校优势特色重点学科(生态学)建设项目资助(05000511311)。
赵维娜,女,1988年10月生,西南林业大学环境科学与工程学院,硕士研究生。E-mail:zhao_wei_na2007@126.com。
王艳霞,西南林业大学环境科学与工程学院,副教授。E-mail:65653584@qq.com。
2015年5月25日。
S792.18;Q948.113
责任编辑:王广建。
