叶酸缺乏协同保罗样激酶1小干扰RNA抑制胃癌细胞株生长的研究
2015-02-07查小应杨木清欧敬民陈大伟费哲为
查小应,黄 磊,杨木清,欧敬民,陈大伟,费哲为
(1.上海交通大学医学院附属新华医院,上海 200092;2.上海交通大学医学院附属新华医院崇明分院,上海 202150)
叶酸缺乏协同保罗样激酶1小干扰RNA抑制胃癌细胞株生长的研究
查小应1,黄 磊2,杨木清1,欧敬民1,陈大伟2,费哲为1
(1.上海交通大学医学院附属新华医院,上海 200092;2.上海交通大学医学院附属新华医院崇明分院,上海 202150)

目的 探讨叶酸缺乏和保罗样激酶1(PLK-1)小干扰RNA(siRNA)的联合作用对胃癌肿瘤细胞的影响。方法 PLK-1 siRNA用LipofectamineTM 2000作载体转染胃癌细胞株SGC7901和BGC823,real-time PCR和Western blot验证转染效果;然后将转染的 SGC7901和BGC823细胞株,继续在叶酸缺乏和正常叶酸浓度培养基中培养72 h,检测细胞增殖、凋亡、周期和蛋白Bcl-2的变化情况。结果 叶酸缺乏与PLK-1 siRNA具有协同抑制SGC7901、BGC823细胞增殖,促进凋亡和使细胞周期停滞在G2/M期的作用,二者能协同抑制SGC7901、BGC823 Bcl-2蛋白表达。结论 叶酸缺乏和PLK-1 siRNA均能抑制胃癌细胞SGC7901、BGC823的生长,两者具有协同效应。该效应可能与Bcl-2蛋白的抑制有关。
叶酸;胃癌细胞;保罗样激酶1;小干扰RNA
胃癌发病率在国内和国际上都排在恶性肿瘤的第二位,国际上每年大约有1 000 000个新发病例[1-2]。肿瘤的发生是多靶点、多环节调控失衡的结果,进一步探讨肿瘤发生、发展的分子机制,针对不同肿瘤个体,采用个体差异、多靶点联合治疗是提高肿瘤治疗疗效的关键。保罗样激酶(polo-like kinase, PLK)是一类高度保守的与果蝇保罗丝氨酸/苏氨酸激酶结构和功能类似的蛋白[3]。已经有研究证实,PLK-1在各种恶性肿瘤包括胃癌组织中存在着过表达且与肿瘤的预后密切相关[4],抑制肿瘤的PLK-1可以有效抑制肿瘤细胞增殖并诱导凋亡,是近年来肿瘤基因治疗的又一个新的候选靶点[5]。在抑制蛋白的表达方法中,小干扰RNA(small interfering RNA, siRNA)即原细胞内的或外源性导入的双链RNA(dsRNA)被切割成有效的RNA,其与RNA诱导沉默复合体结合,将与该RNA配对的mRNA相应序列切除而降低基因的表达[6]。已有研究表明,PLK-1 siRNA能抑制胃癌细胞生长[7]。临床中许多胃癌患者,尤其是老年患者叶酸缺乏。既往研究多关注叶酸缺乏后如何导致肿瘤的再生等问题,对于已有叶酸缺乏的患者,叶酸水平的不同对于肿瘤患者预后以及对肿瘤治疗的影响鲜有研究。本研究通过观察胃癌细胞系经PLK-1 siRNA干扰后在不同浓度叶酸培养基中培养情况,探讨叶酸缺乏对PLK-1 siRNA抑制肿瘤作用的影响,现报道如下。
1 实验资料
1.1 实验材料 胃癌细胞株SGC7901(由吴克瑾教授赠送)和BGC823(购自博古生物科技有限公司,上海)。叶酸缺乏的RPMI 1640培养基、胎牛血清(FBS)等细胞培养相关产品,除特殊说明外,均购自Invitrogen公司。叶酸购自Sigma-Aldrich公司。PLK-1 siRNA由Genechem公司设计合成,其序列为:5’-CAACCAAAGTCGAATATGA-3’。 LipofectamineTM 2000 购自Invitrogen 公司。CCK-8购自同仁化学。Real-time PCR试剂盒购自Takara公司。Anexin V凋亡检测试剂盒购自BD公司。兔抗人PLK-1、p53、Bcl-2、GAPDH一抗购自CST公司。RIPA裂解液等蛋白提取、浓度测定等产品购自碧云天生物研究所。其他药品为国产分析纯。
1.2 实验分组 按事先转染的成分不同以及后续培养基不同分为先行PLK-1 siRNA干扰然后在无叶酸培养基中培养72 h组(Null + PLKS组)、先行PLK-1 siRNA干扰然后在正常叶酸浓度培养基中培养72 h组(Control + PLKS组)、无PLK-1 siRNA而用PBS作对照的转染然后在无叶酸培养基中培养72 h组(Null + PBS组)、无PLK-1 siRNA而用PBS作对照的转染然后在正常叶酸浓度培养基中培养72 h组(Control + PBS组)。
1.3 实验方法
1.3.1 PLK-1 siRNA LipofectamineTM 2000的转染 转染过程严格按照说明书施行。其基本步骤为:转染前24h,在每块6孔板的每个孔内用2 mL不含双抗的RPMI 1640培养基接种对数生长期的肿瘤细胞5×105个。经过24h,细胞融合度为40%。用250 μL Opti-MEM 培养基稀释siRNA (siRNA的量为100 pmol) ,混匀。用250 μL Opti-MEM稀释5.0 μL LipofectamineTM 2000,混匀,室温下静置5 min。 将以上混合转染试剂和siRNA稀释液混匀,室温下静置20 min。转染复合物加入到6孔细胞板中,前后轻摇细胞板混合均匀。转染6 h后换新鲜培养基。
1.3.2 Real-time PCR和Western blot验证PLK-1 siRNA干扰的效果 细胞置于37 ℃、5% CO2培养箱中培养72 h,然后用RIPA和Trizol分别提取蛋白和RNA。蛋白以GAPDH为内参,用Western blot检验其表达差别。siRNA经反转录成cDNA后行Real-time检测PLK-1 siRNA的转录水平差别。PLK-1和GAPDH的引物由上海生工合成,引物序列见表1。
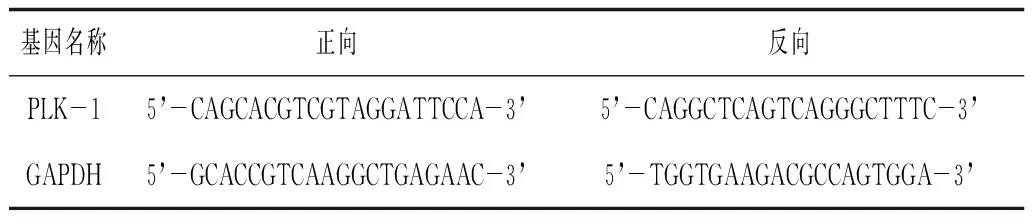
表1 Real-time PCR 引物序列
1.3.3 CCK-8检测细胞增殖情况 经不同PLK-1 siRNA干扰或者PBS作为对照的干扰组,6 h后,胰酶消化收集细胞,将其按96孔板每个孔2 000个细胞的密度接种,每次取5复孔,按4组要求分别加入正常叶酸浓度的培养基和不含叶酸的培养基后,分别培养72 h,然后弃去培养基,分别加入上述对应的培养基100 mL和CCK-810 μL的混合液,在培养箱内孵育 3 h,检测吸光度,观察细胞增殖情况。
1.3.4 流式细胞仪检测细胞凋亡和增殖情况 在6孔板转染后,经不同PLK-1siRNA干扰或者PBS作为对照的干扰组,干扰6 h后吸去干扰液,按4组要求分别加入正常叶酸浓度的培养基和不含叶酸的培养基,培养72 h。收取上清液中的悬浮细胞+胰酶消化后的细胞,离心,PBS洗2次。然后按Annexin V试剂盒操作流程染色。实验总共设一个阴性对照管、AnnexinV和PI单染管和实验管,每管细胞约1×106。室温避光孵育15 min,流式上机检测细胞凋亡情况。对于周期,收集的各组细胞加入70%(PBS稀释)-20 ℃无水乙醇2~3 mL,4℃固定6 h以上。1 500 r/min去上清,1 mL PBS 1 500 r/min 5 min清洗1遍,加入200 μL PBS重新悬浮,调整细胞浓度为106~107,加入1%的Rnase60 μL, 37 ℃摇床水浴30 min。加入20 μL 250 μg/mL的PI,室温避光孵育10 min上机检测。
1.3.5 Western blot检测Bcl-2表达情况 RIPA提取蛋白后,BCA蛋白浓度测定试剂盒(碧云天生物研究所)测定蛋白浓度,调整浓度后用SDS上样缓冲液加热变性后,蛋白电泳检测蛋白表达差异。

2 结 果
2.1 各组PLK-1 mRNA水平和蛋白表达情况 转染72 h后检测PLK-1 mRNA和蛋白的表达情况。Real-time PCR检测发现胃癌细胞系SGC7901和BGC823,PLK-1 mRNA在用PLK-1 siRNA干扰的PLKS组较PBS干扰的PBS组明显降低,见图1。同样,在蛋白表达水平上,Western blot显示经PLK-1 siRNA干扰,胃癌细胞系SGC7901和BGC823的PLK-1蛋白水平也明显降低,见图2及图3。
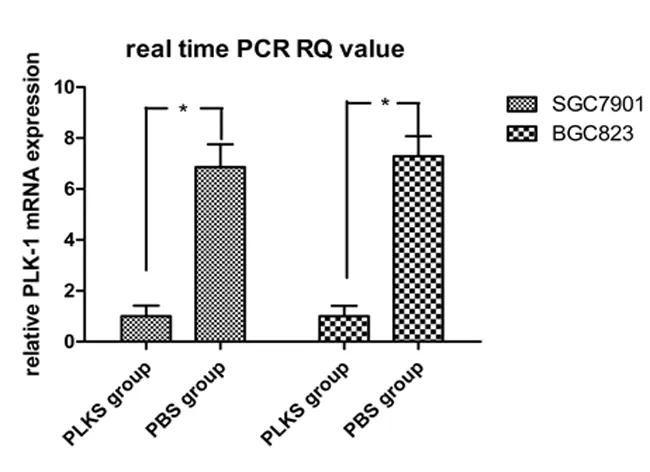
图1 SGC7901及BGC823 Real-time PCR结果
2.2 各组SGC7901和BGC823细胞增殖情况比较 在接种相同数目细胞的前提下,细胞数目少反映PLKS组细胞增殖较慢。析因方差分析显示叶酸缺乏和PLK-1 siRNA对SGC7901和BGC823细胞增殖均有明显影响,且叶酸缺乏和PLK-1 siRNA对胃癌细胞系SGC7901和BGC823有交互作用(P值分别为0.046和0.006)。因Null-PLKS组均数< Null-PBS组均数+Control-PLKS均数-Control-PBS组均数(SGC7901和BGC823细胞系计算值分别为0.227<0.316和0.309<0.485),所以叶酸缺乏和PLK-1对胃癌细胞系SGC7901和BGC823的增殖抑制具有协同作用。见表2。
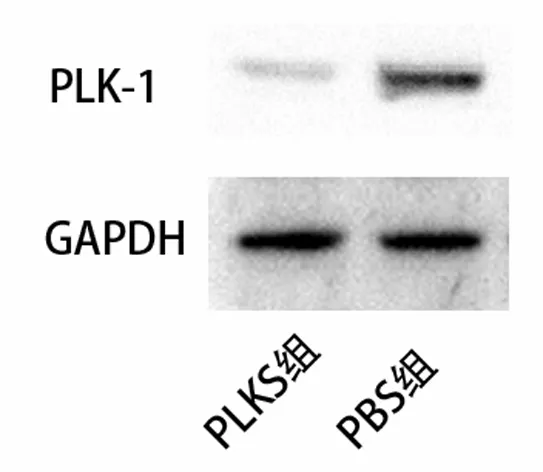
图2 SGC7901 Western blot检测结果

图3 BGC823 Western blot检测结果

表2 各组SGC7901和BGC823细胞增殖情况比较
2.3 各组SGC7901和BGC823细胞凋亡情况比较 Annexin V检测细胞凋亡情况,流式图横坐标为标FITC的Annexin V,纵坐标为PI。SGC7901的早期凋亡(Q4象限)在Null-PLKS组、Null-PBS组、Control-PLKS组和Control-PBS组分别为(26.42±1.50)%,(5.13±1.24)%,(10.17±1.76)%和(6.17±2.47)%。BGC823的早期凋亡(Q4象限)在Null-PLKS组、Null-PBS组、Control-PLKS组和Control-PBS组分别为(24.28±2.90)%,(6.88±2.05)%,(13.30±2.58)%和(5.80±3.01)%。析因方差分析得出,PLK-1 siRNA能促进凋亡,但叶酸缺乏对凋亡影响不大;叶酸缺乏与PLK-1siRNA之间有交互效应。因Null-PLKS组均数< Null-PBS组均数+Control-PLKS均数-Control-PBS组均数(SGC7901和BGC823细胞系计算值分别为:26.42>9.13和24.28>14.38),所以叶酸缺乏能增强PLK-1对胃癌细胞系SGC7901和BGC823的促凋亡作用。见图4和图5。
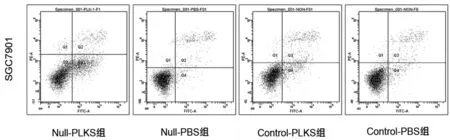
图4 SGC7901细胞凋亡情况

图5 各组BGC823细胞凋亡情况
2.4 各组SGC7901和BGC823细胞周期情况 SGC7901 G2/M比例在Null-PLKS组、Null-PBS组、Control-PLKS组和Control-PBS组分别为(20.88±2.55)%,(8.32±2.18)%,(19.49±1.98)%和(7.48±1.68)%;BGC823 G2/M比例在各组分别为(22.95±2.71)%,(11.61±2.66)%,(22.01±2.94)%和(10.03±2.47)%。对数据进行统计,发现PLK-1 siRNA能提高G2/M比例(P<0.05),但叶酸缺乏不能,而且叶酸缺乏和PLK-1 siRNA之间也无交互作用(P>0.05)。见图6及图7。
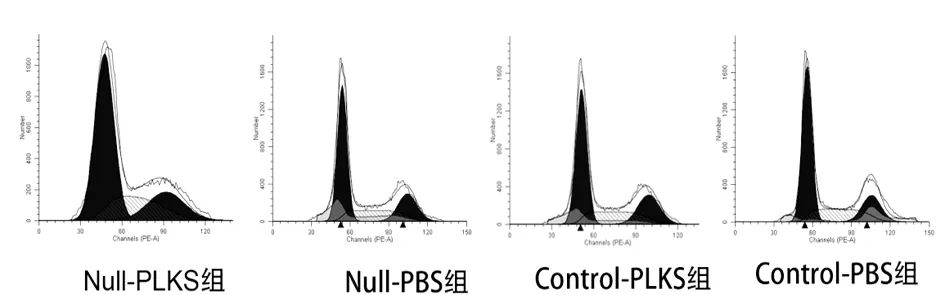
图6 各组SGC7901细胞同期分布
2.5 各组SGC7901和BGC823细胞Bcl-2蛋白表达情况 叶酸缺乏和PLK-1 siRNA均能降低Bcl-2的表达,而且叶酸缺乏和PLK-1 siRNA对BCL-2的表达有交互效应(P<0.05)。鉴于两者Null-PLKS组均数 >Null-PBS组均数+Control-PLKS均数-Control-PBS组均数,叶酸缺乏和PLK-1 siRNA具有拮抗作用。见图8~10。
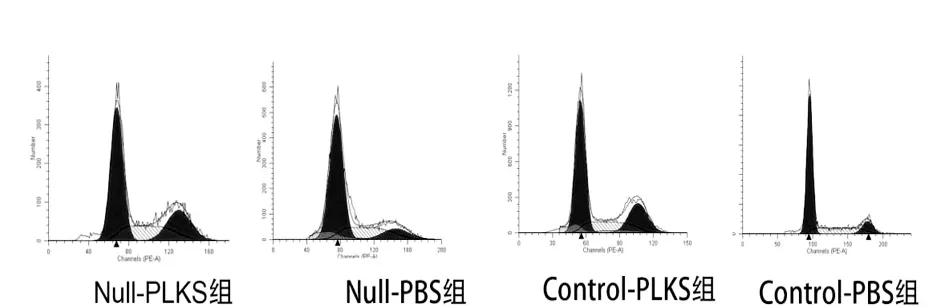
图7 各组BGC823细胞同期分布
3 讨 论
肿瘤是一个全身性疾病,手术对肿瘤尤其是中晚期肿瘤尤其是胃癌治疗效果有限。基于肿瘤发生、发展机制的综合治疗,尤其是联合治疗有其特有的优势。

图8 各组SGC7901细胞Bcl-2蛋白表达情况
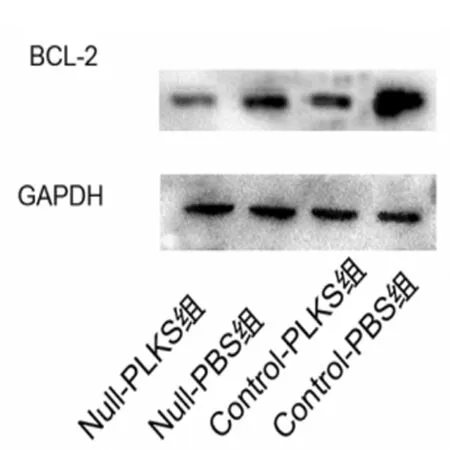
图9 各组BGC823细胞Bcl-2蛋白表达情况
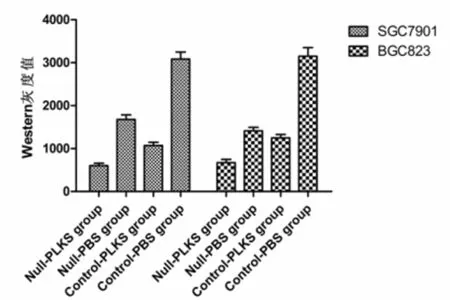
图10 SGC7901和BGC823 Bcl-2蛋白Western blot条带灰度值柱状图
PLK-1作为PLK家族中被研究最多的一员,不仅在很多肿瘤中表达升高[8],而且它的升高还对诸如胃癌、结直肠癌的预后判断具有价值[9]。PLK-1参与了数个至关重要的有丝分裂步骤,如激活CDC25 c磷酸化酶[10]、调节有丝分裂过程[11]等。PLK-1具有参与多个肿瘤发生、发展步骤的特点。所以,PLK-1被认为是重要的分子靶标,并被广泛关注[12]。Bcl-2是一个经典的抗凋亡蛋白,降低Bcl-2能促进肿瘤凋亡,抑制肿瘤生长[13]。本实验运用PLK-1的siRNA敲低PLK-1后,胃癌细胞系SGC7901和BGC823的增殖降低,凋亡增加,细胞阻滞在G2/M期, 且叶酸缺乏联合PLK-1 siRNA能抑制Bcl-2的表达,提示降低PLK-1可能通过Bcl-2途径起作用,这与其他研究的结果类似[5]。
叶酸是生物体代谢重要的一碳单位,叶酸类似物如甲氨蝶呤被用作肿瘤的治疗[14]。本研究证实PLK-1 siRNA能抑制胃癌细胞增殖,促进细胞凋亡,叶酸缺乏也能抑制肿瘤的增殖,且叶酸能协同PLK-1 siRNA抑制肿瘤细胞增殖和促进细胞凋亡。但在抑制胃癌细胞Bcl-2的表达上有拮抗作用。笔者认为,这可能与蛋白的作用往往不是与浓度呈线性关系有关,该结果有待进一步研究。
叶酸缺乏和PLK-1 siRNA协同抑制肿瘤的意义在于,使用PLK-1抑制剂时补充叶酸,尤其是大量补充应慎重。不仅如此,PLK-1抑制剂联合临床使用的抗叶酸制剂,如甲氨蝶呤、普拉曲沙(pralatrexate)等,能否达到更好治疗肿瘤的目的也值得深入研究。
[1] Kamangar F,Dores GM,Anderson WF.Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24:2137-2150
[2] 邹小农,孙喜斌,陈万青,等.2003—2007年中国胃癌发病与死亡情况分析肿瘤[J].肿瘤,2012, 32(2):109-114
[3] Graham TM,Tait A,Hide G.Characterisation of a polo-like protein kinase gene homologue from an evolutionary divergent eukaryote,Trypanosoma brucei[J].Gene,1998,207:71-77
[4] Kanaji S,Saito H,Tsujitani S,et al.Expression of polo-like kinase 1 (PLK1) protein predicts the survival of patients with gastric carcinoma[J].Oncology,2006,70:126-133
[5] Liu X,Erikson RL.Polo-like kinase (Plk)1 depletion induces apoptosis in cancer cells[J].Proc Natl Acad Sci USA,2003,100:5789-5794
[6] Tomari Y,Zamore PD.Perspective: machines for RNAi[J].Genes Dev,2005,19:517-529
[7] 兰斌,刘炳亚,陈雪华,等.保罗样激酶1表达抑制导致胃癌MKN45细胞有丝分裂停滞[J].中华肿瘤杂志,2006,28(3):164-168
[8] Strebhardt K.Multifaceted polo-like kinases:drug targets and antitargets for cancer therapy[J].Nat Rev Drug Discov,2010,9:643-660
[9] Yuan J,Horlin A,Hock B,et al.Polo-like kinase, a novel marker for cellular proliferation[J].Am J Pathol,1997,150:1165-1172
[10] Cogswell JP,Brown CE,Bisi JE,et al.Dominant-negative polo-like kinase 1 induces mitotic catastrophe independent of cdc25C function[J].Cell Growth Differ,2000,11:615-623
[11] Burkard ME,Randall CL,Larochelle S,et al.Chemical genetics reveals the requirement for Polo-like kinase 1 activityin positioning RhoA and triggering cytokinesis in human cells[J].Proc Natl Acad Sci USA,2007,104:4383-4388
[12] McInnes C,Wyatt MD.PLK1 as an oncology target: current status and future potential[J].Drug Discov Today,2011,16:619-625
[13] Davids MS,Letai A.Targeting the B-cell lymphoma/leukemia 2 family in cancer[J].J Clin Oncol,2011,30(25):3127-3135
[14] Green JM.Glucarpidase to combat toxic levels of methotrexate in patients[J].Ther Clin Risk Manag,2012,8:403-413
Study on folate deficiency and Polo-like kinase 1 (PLK-1) siRNA in synergistically inhibiting the growth of gastric carcinoma cell lines
ZHA Xiaoying1, HUANG Lei2, YANG Muqing1, OU Jingmin1, CHEN Dawei2, FEI Zhewei1
(1.Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China; 2.Xinhua Hospital Chongming Branch Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai 202150, China)
Objective It is to approach the influence of the combination of folate deficiency and PLK-1 siRNA on the growth of gastric cancer cell lines.Methods After constructing PLK-1 siRNA in vitro, gastric carcinoma cell lines of SGC7901 and BGC823 were transfected with LipofectamineTM 2000.The PLK-1 transfected effect by siRNA was evaluated through detecting messenger RNA and protein of PLK-1 by real-time PCR and Western-blot, respectively.In addition, after transfecting with PLK-1 siRNA, these cell lines of SGC7901 and BGC823 were cultured in media with normal concentrations of folate or folate deficiency for 72 hours.Then, the changes of cell proliferation, apoptosis, cell cycle and the protein expressions of Bcl-2 were analyzed.Results Folate deficiency and PLK-1 siRNA inhibited the cell lines proliferation of SGC7901 and BGC823, induced apoptosis and made the cell cycle arrest at G2/M phase, synergistically.They could down regulate the Bcl-2 expression of SGC7901 and BGC823.Conclusions Folate deficiency and PLK-1 siRNA can inhibit the growth of SGC7901 and BGC823 synergistically.The effects may result from inhibiting the expression of BCL-2.
folate; gastric cancer cell lines; PLK-1; siRNA
查小应,男,住院医师,从事胃肠外科临床及实验研究工作。
费哲为,E-mail:zheweifei@xinhuamed.com.cn
上海市卫生局重点课题(20114030)
10.3969/j.issn.1008-8849.2015.09.002
R-33
A
1008-8849(2015)09-0917-04
2014-10-10
