IL-28B基因多态性与HBeAg阳性的慢性乙型肝炎患者干扰素病毒学应答相关性的meta分析
2015-02-07滕巍崔巍刘沛
滕巍,崔巍,刘沛
(中国医科大学附属第一医院传染科,沈阳 110001)
·论著·
IL-28B基因多态性与HBeAg阳性的慢性乙型肝炎患者干扰素病毒学应答相关性的meta分析
滕巍,崔巍,刘沛
(中国医科大学附属第一医院传染科,沈阳 110001)
目的研究白细胞介素28B(IL-28B)基因多态性与HBeAg阳性的慢性乙型肝炎患者应用干扰素病毒学应答的相关性。方法计算机检索PubMed、Web of Science、China Bio Medicine(CBM)、万方数据库等,由2名评价员独立检索和提取资料并交叉核对,纳入相关病例对照试验。采用Cochrane协作网提供的RevMan 5.3软件进行meta分析,应用Stata11.0软件进行发表偏倚检验。结果共纳入文献7篇,包括1 345例患者,经过meta分析后发现与rs8099917 TG/GG等位基因相比,rs8099917 TT等位基因对于HBeAg阳性的慢性乙型肝炎患者应用干扰素的病毒学应答无明显差异(P=0.20)。rs12979860 CC与CT/TT等位基因相比对于病毒学应答的发生没有差异(P=0.75)。结论IL-28B(rs8099917、rs12979860)的基因多态性与HBeAg阳性慢性乙型肝炎患者应用干扰素达到持续病毒应答无相关性。
乙型肝炎;抗病毒治疗;白细胞介素28B;基因多态性;meta分析
乙型肝炎病毒由于其传播性强,传播面广且发病率高,而成为世界危害性很大的传染病之一。根据世界卫生组织的调查,全球每年约有100万人死于乙型肝炎病毒的感染,我国是乙型肝炎流行的高发区,感染率高达55.6%[1]。目前应用干扰素是治疗慢性乙型肝炎的有效方法之一。国内外学者针对干扰素疗效的应答因素做了大量的研究,包括性别、年龄、肝脏纤维化程度、病毒水平等,为患者应用干扰素个性化治疗提供循证学依据。近年来,有学者研究表明[2]白细胞介素28B(interleukin-28B,IL-28B)基因多态性与丙肝患者应用干扰素治疗的应答高度相关。随着进一步的研究[3]还发现IL-28B基因多态性与丙肝病毒感染后的病毒自发清除及预后相关。但是IL-28B基因多态性与慢性乙型肝炎患者应用干扰素应答的关系目前尚无统一结论,有些研究结果甚至矛盾[4,5]。本研究运用Cochrane系统评价方法,选取国内外发表的IL-28B与HBeAg阳性的慢性乙型肝炎患者应用干扰素应答的相关文献进行meta分析,旨在阐明两者之间的关系。
1 材料与方法
1.1 检索策略
计算机检索PubMed、Web of Science、China Bio Medicine(CBM)、万方数据库等,并追查所有检出文献的参考文献。检索年限从建库至2014年10月。
英文文献检索策略:(1)(il28b)AND hepatitis b virus;(2)(IL28B)OR ifn lambda OR genomics AND hepatitis b virus AND interferon。中文文献检索策略:(IL-28B OR白细胞介素28b)AND乙型肝炎
1.2 纳入及排除标准
1.2.1 纳入标准:(1)文献内容涉及IL-28B与HBeAg阳性的慢性乙肝患者应用干扰素疗效相关性的对照研究或横断面研究;(2)所有诊断为HBeAg阳性的慢性乙肝患者必须符合国际诊断标准;(3)所有文献观察终点为应用干扰素抗病毒治疗48周时的病毒载量;(4)检测多态性位点的实验方法科学,如PCR,探针监测法等国际公认的基因监测方法;(5)研究位点符合Hardy-Weinberg平衡;(6)可获得详细的数据。
1.2.2 排除标准:(1)不符合纳入标准;(2)样本资料交代不清或不全;(3)无法获取全文;(4)重复发表;(5)文献类型为会议记录、说明书、综述、荟萃分析等。
1.3 文献提取
由2人独立进行文献质量评价,意见不一致时通过讨论解决分歧。数据提取由2位研究者独立完成。
1.4 统计学方法
应用Cochrane协作网提供的RevMan 5.3软件进行meta分析。以优势比(odds rate,OR)表示,并给出95%可信区间(confidence interval,CI)。当试验存在统计学异质性时,用随机效应模型(random effects model,REM)进行合并分析,反之用固定效应模型(fixed effects model,FEM)计算。
应用Stata11.0软件进行Begg’s检验,明确是否存在发表偏倚。
2 结果
2.1 纳入研究的一般特征和质量评价
初检得到478篇文献,通过阅读标题和摘要进行初筛,排除不符合纳入标准的文献。最终纳入7篇[4~10]。7篇文献共包括1 345例患者。
质量评价采用Cochrane协作网推荐的非随机对照试验质量评价量表进行。质量评价的项目包括研究基线相似性、诊断标准、分组方法、病例纳入情况及混杂因素的控制,每个项目为0~2分,记分为0~10分,1~5分为低质量研究,6~10分为高质量研究。纳入研究的特征见表1。
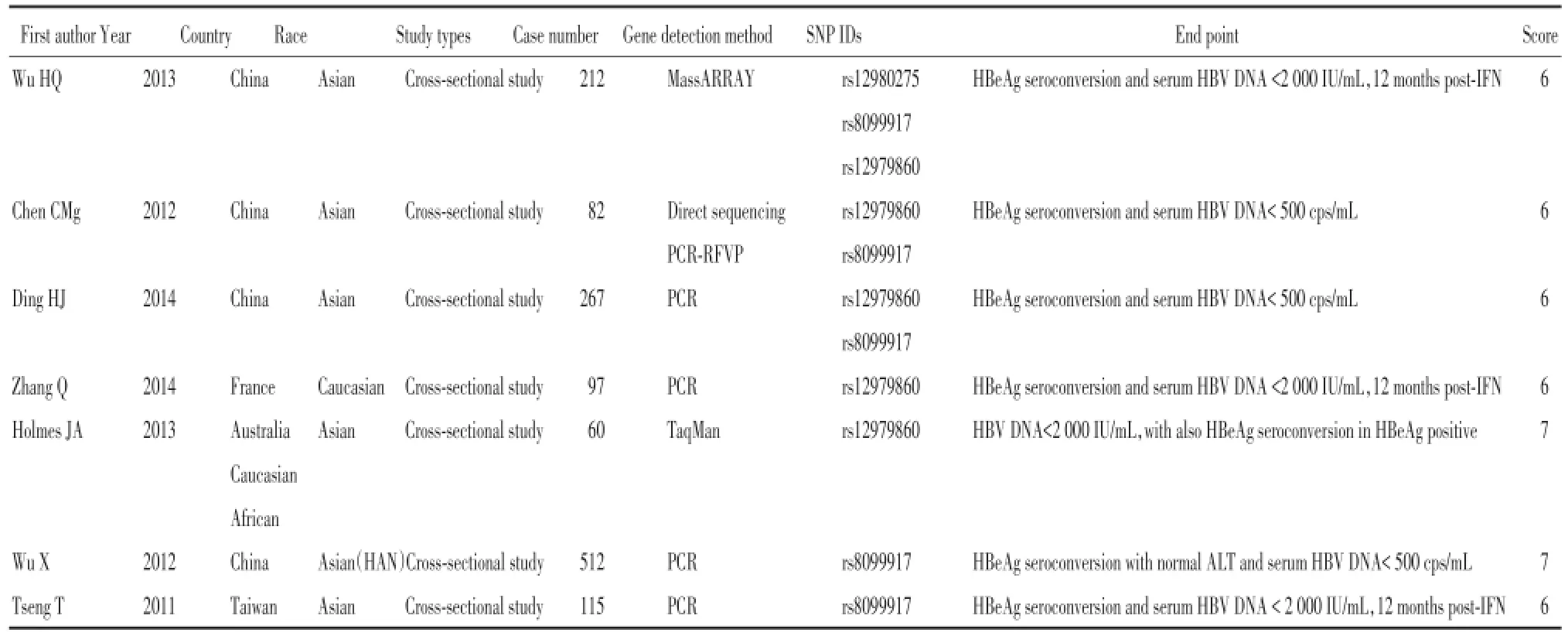
表1 纳入研究的基本特征Tab.1 General characteristics of the included studies
2.2 Meta分析结果
2.2.1 rs8099917基因多态性与HBeAg阳性的慢性乙型肝炎患者应用干扰素病毒学应答的相关性:在纳入的7篇文献中,有5篇是针对rs8099917位点,异质性结果提示各研究间存在异质性(I2=84%)。应用随机效应模型进行分析,与rs8099917TG/GG等位基因相比,rs8099917TT等位基因对于HBeAg阳性的慢性乙型肝炎患者应用干扰素获得持续病毒应答无明显差异(OR=0.46,95%CI 0.14~1.52,P= 0.20),见图1。
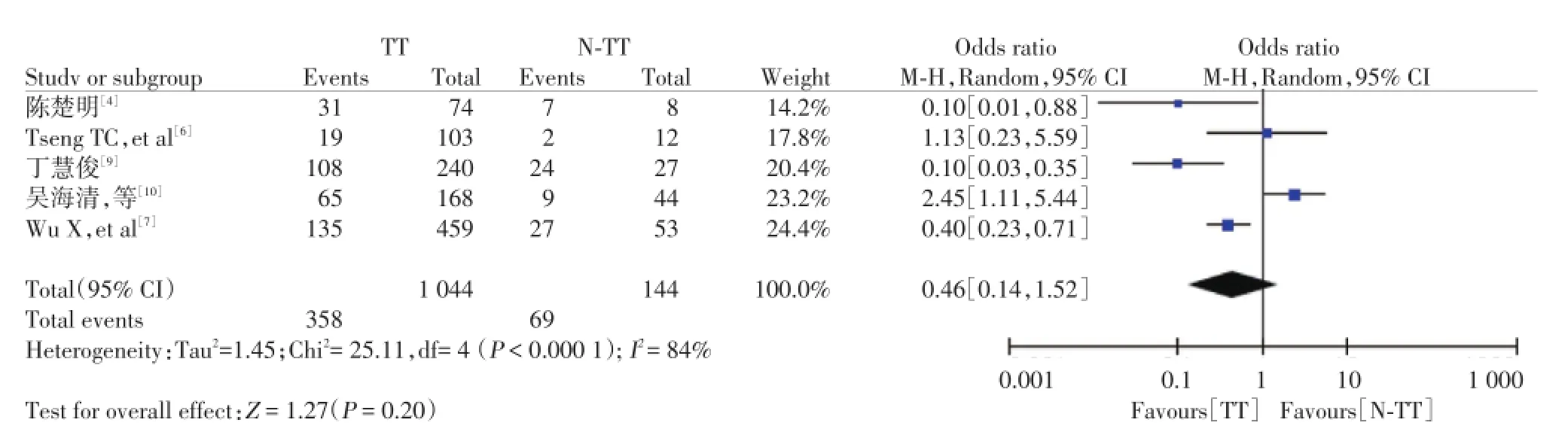
图1 rs8099917基因多态性与HBeAg阳性的慢性乙型肝炎患者应用干扰素病毒学应答的相关性Fig.1 The association between the polymorphism in rs8099917gene and the interferon virological response in HBeAg-positive chronic hepatitis B
2.2.2 rs12979860基因多态性与HBeAg阳性的慢性乙型肝炎患者应用干扰素病毒学应答的相关性:对纳入文献中涉及rs12979860的5篇文献进行异质性检验后提示各研究存在异质性(I2=65%),应用随机效应模型进行分析后得出结论:rs12979860CC与CT/TT等位基因相比对于病毒学应答的发生没有差异(OR=0.88,95%CI 0.41~1.91,P=0.75),见图2。
2.3 发表偏倚评估
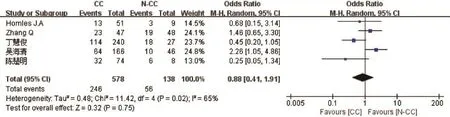
图2 rs12979860基因多态性与HBeAg阳性的慢性乙型肝炎患者应用干扰素病毒学应答的相关性Fig.2 Association between the polymorphism in rs12979860 gene and the interferon virological response in HBeAg-positive chronic hepatitis B
观察纳入Meta分析的各组文献漏斗图发现,漏斗图对称性较好,提示相关研究发表偏倚较小。采用Begg法分别对各相关研究对称性进行检验,rs8099917组文献及rs12979860组文献P值分别为0.462、0.221,见图3、4。
3 讨论
人IL-28B基因最早由Zymo Genetics公司于2003年发现,位于染色体19q13.13的ACO11445.6基因群上,属于Ⅲ行干扰素家族,编码IFN-λ3[11]。2009年9月,美国杜克大学人类基因组变异中心的Ge等[12]研究人员首次报道了患者IL-28B基因多态性与HCV清除之间的关系。此后大量研究表明IL-28B基因多态性不仅可以作为HCV病毒清除及HCV标准疗法与三联疗法治疗效果的预测指标,而且可能在HBV感染及治疗领域存在重大价值。
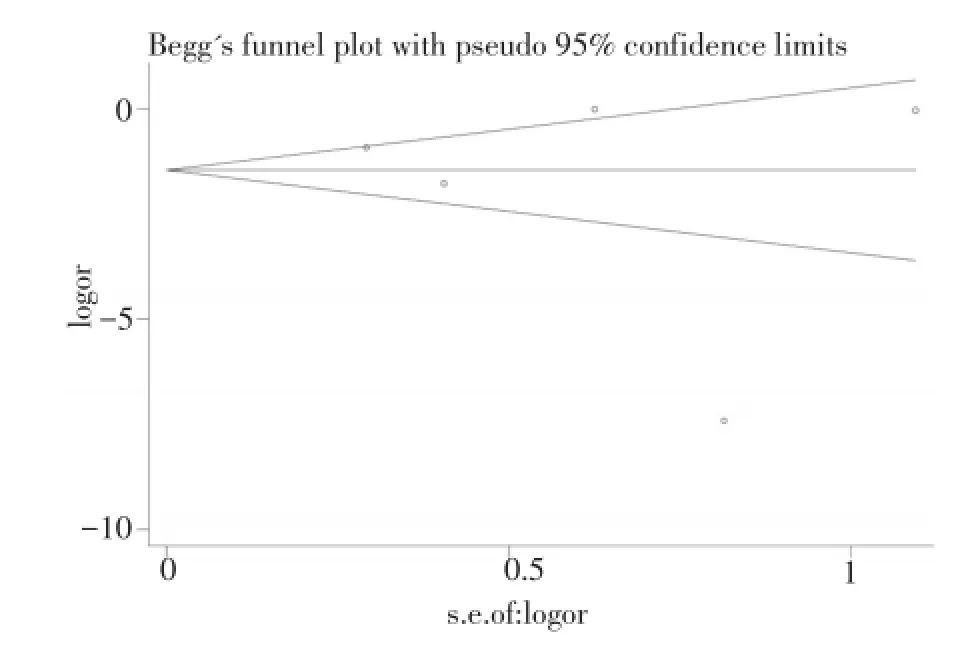
图3 rs8099917组文献发表偏倚评价Fig.3 Publication bias of the rs8099917 group
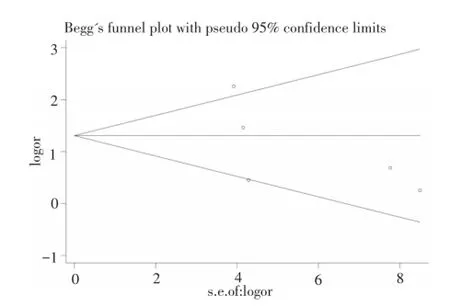
图4 rs12979860组文献发表偏倚评价Fig.4 Publication bias of the rs12979860 group
本文共纳入文献7篇,结果显示IL-28B(rs12979860,rs8099917)与HBeAg阳性的慢性乙肝患者对干扰素的反应无明显相关性。这一结果提示IL-28B(rs12979860,rs8099917)基因多态性对慢性乙肝患者干扰素应答无预测作用,不能以此为依据给予患者个体化治疗。本次meta分析过程中文献检索尽量保证全面,严格遵循纳入及排除标准,且各研究中等位基因的检测均要求准确,极大程度地减少了各种偏倚的发生。但由于部分国外文献所观察的指标与国内文献存在差异,仍存在原始文献数据获取失败所造成的偏倚。同时各实验室之间的检测水平及检测仪器的不同可能造成研究内偏倚。本研究由于样本量较小,纳入文献数目有限,可能存在此meta分析结果的局限性。另外,本研究只针对IL-28B的2个位点进行分析,并未对其他位点(如rs10853728、rs12980275、rs4803219等)进行分析,因而存在一定局限性。
发表偏倚对于meta分析结果的真实性和可靠性有很大的影响,故现在有很多种方法来进行发表偏倚的检验,例如Egger’s检验,Begg’s检验等。由于本研究纳入文献数目较少,上述检验方法都存在局限性。有文献表明[13]当meta分析纳入研究的样本含量明显呈非正态分布时,Begg’s检验比Egger’s检验的结果更稳健,更加接近真实情况。故本研究综合考虑实际情况,选用Begg’s检验进行发表偏倚的检验。通过结果分析,以α=0.05检验,P>0.05,在一定程度上可以认为无明显发表偏倚。
综上所述,IL-28B(rs12979860,rs8099917)基因多态性与HBeAg阳性的慢性乙肝患者应用干扰素病毒学应答无明显相关性。由于本次纳入文献文献数量有限,存在一定的局限性。故需要纳入更多设计严格、样本量大,多地区、多中心的研究,以获得更明确的结论。
[1]陈建新.关于对乙型肝炎流行病学的分析研究[J].中国卫生产业,2012(21):171.
[2]徐辉,郭丽琳,何伶俐,等.宿主白介素28B基因多态性与慢性丙型肝炎抗病毒疗效的研究分析[J].四川大学学报(医学版),2012(6):855-859.
[3]许刚,任浩.IL-28B基因多态性在丙型肝炎患者治疗中的作用[J].世界华人消化杂志,2011(7):661-666.
[4]陈楚明.IL28B基因多态性与慢性乙型肝炎患者对干扰素应答的关系[D].南方医科大学,2012.
[5]Holmes JA,Nguyen T,Ratnam D,et al.IL28B genotype is not useful for predicting treatment outcome in Asian chronic hepatitis B patients treated with pegylated interferon-alpha[J].J Gastroenterol Hepatol,2013,28(5):861-866.
[6]Tseng TC,Yu ML,Liu CJ,et al.Effect of host and viral factors on hepatitis B e antigen-positive chronic hepatitis B patients receiving pegylated interferon-alpha-2a therapy[J].Antivir Ther,2011,16(5):629-637.
[7]Wu X,Xin Z,Zhu X,et al.Evaluation of susceptibility locus for response to interferon-alpha based therapy in chronic hepatitis B patients in Chinese[J].Antiviral Res,2012,93(2):297-300.
[8]Zhang Q,Lapalus M,Asselah T,et al.IFNL3(IL28B)polymorphism does not predict long-term response to interferon therapy in HBeAg-positive chronic hepatitis B patients[J].J Viral Hepat,2014,21(7):525-532.
[9]丁慧俊.IL-28B单核苷酸基因多态性与CHB干扰素疗效的相关性[J].中国医药科学,2014(17):9-11.
[10]吴海清,赵钢德,钱方兴,等.IL28B基因多态性与HBeAg阳性慢性乙型肝炎患者聚乙二醇化干扰素α应答的关系[J].肝脏,2013(6):359-364.
[11]Sheppard P,Kindsvogel W,Xu W,et al.IL-28,IL-29 and their class II cytokine receptor IL-28R[J].Nat Immunol,2003,4(1):63-68.
[12]Ge D,Fellay J,Thompson AJ,et al.Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance[J].Nature,2009,461(7262):399-401.
[13]石修权,王增珍.Egger’s test与Begg’s test的功效差异比较与原因分析[J].华中科技大学学报(医学版),2009(01):91-93.
(编辑 武玉欣)
Meta Analysisofthe Association ofPolymorphism in IL-28B Gene and VirologicalResponse to Interferon in HBeAg-positive Chronic Hepatitis B
TENG Wei,CUIWei,LIUPei
(DepartmentofInfectious Disease,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
Objective To explore the association between the polymorphism in IL-28B gene and the interferon virologicalresponse in HBeAg-positive chronic hepatitis B patients.MethodsA literature search was performed on PubMed,Web of Science,China Bio Medicine(CBM)and Wan-Fang database.The references was screened with the inclusion and exclusion criteria,and then data were extracted and methodological quality of the studies was judged.Statistical analysis was carried out with RevMan 5.3 and STATA 11.0.ResultsTotally 7 publications were recruited for the study,including 1 345 patients.The meta-analysis showed that there was no significant difference of interferon response between HBeAg-positive chronic hepatitis B patients with rs8099917TG/GG alleles and rs8099917TT alleles(P=0.20).There was no statistical difference between Rs12979860CC and CT/TT allele for the sustained virological response(P=0.75).ConclusionOur current meta-analysis suggests that there was no correlation of rs8099917,rs12979860 polymorphism in IL-28B with the sustained virological response to interferon in HBeAg-positive chronic hepatitis b.
hepatitis B;antiviral therapy;IL-28B;gene polymorphism;meta analysis
R512.6
A
0258-4646(2015)08-0749-04
滕巍(1987-),女,医师,硕士研究生.
刘沛,E-mail:syliupei2013@163.com
2015-03-18
网络出版时间:
