油樟幼苗对马尾松林窗面积的光合响应特征
2015-02-06宋会兴杨万勤
刘 辉, 宋会兴,,*, 杨万勤, 张 健
1 四川农业大学 风景园林学院, 成都 611130 2 四川农业大学 生态林业研究所, 成都 611130
油樟幼苗对马尾松林窗面积的光合响应特征
刘 辉1, 宋会兴1,2,*, 杨万勤2, 张 健2
1 四川农业大学 风景园林学院, 成都 611130 2 四川农业大学 生态林业研究所, 成都 611130
为了解马尾松人工林窗对伴生树种的影响,为马尾松人工纯林的团块状混交提供科学依据,研究了10 m×10 m(T1)、15 m×15 m(T2)、20 m×20 m(T3)、25 m×25 m(T4)、30 m×30 m(T5)、35 m×35 m(T6)和40 m×40 m(T7)马尾松人工林窗中油樟(Cinnamomumlongepaniculatum)幼苗叶片形态和光合生理特征的变化,探讨马尾松林窗斑块对混生树种生长的影响。结果表明:1)林窗面积低于20 m×20 m时,油樟幼苗叶片最大净光合速率显著低于旷地对照;2)叶片比叶重随着林窗面积的增大显著升高;林窗内油樟幼苗叶氮含量在小林窗中(10 m×10 m)显著低于旷地对照,但在大林窗中(如20 m×20 m)显著高于对照;林窗内幼苗叶磷含量则与旷地无显著性差异;3)叶氮在光合组分中的总分配系数随着林窗面积的增加而增大,其中叶氮在羧化组分中的分配系数升高尤为明显,而捕光组分的分配系数在林窗面积10 m×10 m—20 m×20 m范围内随林窗面积的增加而显著降低。可见,当马尾松林窗面积低于20 m×20 m时,林窗环境会显著影响油樟幼苗的光合能力,油樟幼苗可以通过调节比叶面积、叶氮含量以及叶氮在光合组分中的分配等形态、生理适应特征来适应林窗环境的变化。
油樟; 人工林窗; 叶氮分配; 光合能力; 马尾松
林窗是森林群落中常见的干扰现象之一[1]。林窗的形成改变了林地的光热水肥等环境条件,增加森林生态系统的环境异质性和微生境的多样性,从而成为森林生态系统长期维持和循环更新的重要驱动力[2- 3]。近年来,为提高低效人工林的经营与管理水平,科研人员模拟天然林中林窗在森林更新中的作用,逐步开展了人工纯林的团块状改造实践[4- 5]。然而,存在的问题是:究竟多大的林窗“斑块”最有利于混交树种的生长?这需要研究林窗梯度对混交树种生长特征的影响。
马尾松(Pinusmassoniana)是我国尤其是长江流域及其以南地区重要的造林先锋树种和主要用材林树种[6- 7]。单一树种形成的大面积马尾松纯林存在生物多样性贫乏、土壤酸化与供肥能力不足、病虫害发生风险高、林分生产力低下等林业生态问题[8- 9]。在马尾松纯林的团块状改造过程中,我们研究了不同大小林窗对混交树种油樟幼苗光合生理特征的影响,以期为低效马尾松人工林的改造提供一定的科学依据。
1 材料与方法
1.1 研究区概况
研究地点位于四川省宜宾市高县来复镇毛颠坳林区(104°32′—104°34′E,28°34′—28°36′N,海拔412—567 m),该区属亚热带湿润季风气候,年降水量1500 mm左右,年均气温18.1 ℃,最高气温36.8 ℃,最低气温7.8 ℃,土壤类型为山地黄壤,土壤基本理化性质见表1。地带性植被类型为亚热带常绿阔叶林。现有林地分别是1972年和1997年人工造林后形成的马尾松人工纯林,行间距2.5 m×2.5 m,郁闭度0.6—0.8。林下植被盖度约30%,主要灌木有青冈(Quercusserrata)、铁仔(Myrsineafricana)、梨叶悬钩子(Rubuspirifolius)、野桐(Mallotusjaponicus)、展毛野牡丹(Melastomanormale)等;主要草本有商陆(Pokeberryroot)、蕨(Pteridiumaquilinum)、芒(Miscanthussinensis)、芒萁(Dicranopterisdichotoma)、皱叶狗尾草(Setariaplicata)等[10]。

表1 研究样地土壤基本理化性质(均值±标准差)Table 1 Basic indicators of soil physical and chemical properties(mean ± SD)
1.2 研究材料
油樟(Cinnamomumlongepaniculatum(Gamble)N. Chao ex H. W. Li)系樟科樟属常绿乔木,是中国特有树种,主要分布在四川宜宾,在湖北、湖南、陕西、云南、江西、广西、广东等地均有分布。油樟具有生长速度快、萌蘖强,叶片多,病虫少,树形美观等特点,是当地造林和四旁绿化的重要乡土树种。
1.3 样地设置及处理
试验于2011年冬季选取年龄相同(1997年造林,平均株高9.3 m)、环境条件(坡向、坡度等)一致的马尾松纯林样地,随机设置10 m×10 m(T1)、15 m×15 m(T2)、20 m×20 m(T3)、25 m×25 m(T4)、30 m×30 m(T5)、35 m×35 m(T6)和40 m×40 m(T7)的人工采伐林窗各4个,每两林窗间距10 m以上。2012年春季按照2.5 m×2.5 m的造林密度在各梯度林窗中栽植2年生油樟幼苗,常规管理:栽植时每株施加尿素20 g,夏末幼树周围除草抚育1次。以相邻环境条件一致的全伐旷地为对照处理(CK)。
1.4 研究方法
2013年4月初,对各林窗油樟幼苗生长状况进行调查。选择林窗中央位置油樟幼苗中上部向光生长的当年生健康成熟叶片1片进行相关参数测定,作为该林窗特征值。
1.4.1 油樟幼苗叶片光合参数的测定
采用LI- 6400便携式光合仪测定植株叶片光响应曲线及CO2响应曲线。测定时为晴朗天气的9:00—12:00。其中光响应测定条件控制在:空气流速为500 μmol/s,温度设置为(25±1)℃,相对湿度为(60±5)%,CO2浓度为380 μmol/mol。在测定不同光合有效辐射(PAR)梯度下的净光合速率(Pn)时,每个PAR梯度平衡180 s。依据Farquhar[11]的方法拟合Pn-PAR曲线求得接近饱和光强;CO2响应曲线的测定控制条件与光响应曲线一致,以接近饱和光强为测定光强,CO2浓度梯度从400、300、200、150、100、50、20、0 μmol/mol,然后再按400、600、800、1000、1200 μmol/mol递增,按照各点测得的Pn与胞间二氧化碳浓度(Ci)值绘制Pn-Ci曲线求得饱和光强下叶片最大净光合速率(Pmax)。最大羧化速率(Vcmax)与暗呼吸速率(Rd)计算方法参照Farquhar和Sharkey的方法[12],最大电子传递速率(Jmax)参照Tenhunen的方法计算[13]。试验于2013年4月中旬完成。
1.4.2 油樟幼苗叶片比叶重、光合色素、叶氮及磷含量的测定
完成光合参数测定后,取同一叶片测定叶面积后80 ℃烘干至恒重,称重并计算比叶重(LMA),比叶面积(SLA)为LMA的倒数;光合色素含量采用浸提法[14];用凯氏定氮法测定叶片总氮含量(N)[15- 16];磷含量(P)用钼锑抗比色法测定[17]。
1.4.3 油樟幼苗叶氮在光合机构中的分配系数
叶氮在羧化系统(主要是Rubisco)中的分配系数PC按照如下公式计算[18]:
PC=Vcmax/(6.25×Vcr×NA)
叶氮在生物力能学组份(光合电子传递和光合磷酸化载体蛋白组份)中的分配系数PB按照如下公式计算[19]:
PB=Jmax/(8.06×Jmc×NA)
叶氮在捕光色素蛋白复合体(PSⅠ、PSⅡ、LHCⅡ)中的分配系数PL按如下公式计算[20]:
PL=Cc/(NM×CB)
叶氮在光合机制中的分配系数PT按公式PT=PC+PB+PL计算。
式中,NA是叶片单位面积的N含量(g/m2);Cc为叶绿素浓度(mmol/g);NM是叶片单位质量的N含量(mg/g);CB是结合在捕光色素蛋白复合体中的叶绿素,为5.79 mmol/gN;Vcr是Rubisco比活,即单位Rubisco蛋白的固定活性;Jmc为单位细胞色素f(Cyt f)的最大电子传递速率;Vcr与Jmc的测定参见Ninnemets和Tenhunen[21]。
1.5 数据处理
采用单因素方差检验(One-way ANOVA)比较不同林窗梯度环境之间油樟幼苗光合参数、叶氮含量、光合氮分配等特征参数。T-检验方法测试其差异显著性。所有分析统计应用SPSS17.0及EXCEL2003进行数据处理。
2 结果与分析
2.1 林窗中油樟幼苗的最大净光合速率Pmax和比叶重特征
从T1林窗到T5林窗,随着林窗面积的增大,油樟幼苗最大净光合速率呈明显的升高趋势。与对照旷地环境中的油樟幼苗相比,仅有T1、T2林窗中的幼苗最大净光合速率显著低于对照,T3及更大林窗中的油樟幼苗最大净光合速率与对照没有显著性差异(图1)。
在最小林窗T1中,油樟幼苗具有最低的比叶重LMA,LMA值随着林窗面积的增大显著升高,旷地内的油樟幼苗具最大的LMA值,并显著高于T6及更小林窗中的LMA值(图1)。
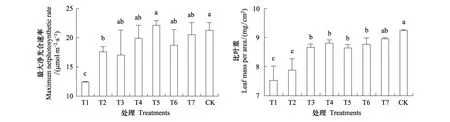
图1 不同林窗中油樟幼苗叶片的比叶重与最大净光合速率(均值±标准差)
2.2 不同林窗中油樟幼苗叶片氮、磷含量特征
无论是以单位质量表示的叶氮含量还是以单位面积表示的叶氮含量均表现出相同的变化趋势。从林窗T1到林窗T3,氮含量随林窗增大显著增加;但从林窗T3到林窗T7以及旷地对照,幼苗叶片氮含量呈下降趋势,其中T3与T4林窗中显著高于对照(图2)。
与叶氮含量变化不同,尽管从林窗T1到林窗T3油樟幼苗叶片磷含量呈升高的趋势,但并没有达到显著性水平。与对照相比,各林窗内油樟幼苗叶片磷含量无显著性变化(图2)。
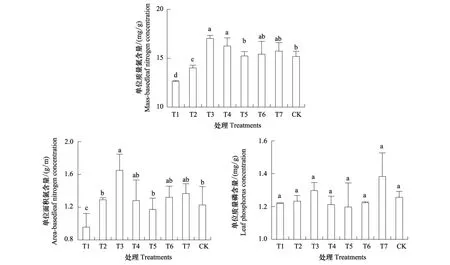
图2 不同林窗中油樟幼苗叶片氮、磷含量
2.3 不同林窗中油樟幼苗光合氮分配特征
油樟幼苗叶片在光合机制中的氮分配系数PT随着林窗面积的增大而增加,旷地内的幼苗叶片光合氮分配系数显著高于所有林窗内油樟幼苗(图3)。叶氮在羧化系统中的分配系数PC表现出与PT基本一致的变化趋势,与PT不同的是最小林窗T1中幼苗PC显著低于林窗T3、T4和T5(图3)。
与PC、PT的变化趋势一致,随着林窗面积的增大,油樟幼苗在叶片光合机制生物力能学组份中的分配系数PB表现为上升的趋势,与PC、PT的变化趋势不同的是,尽管旷地内植株的PB值显著高于林窗内植株,但不同林窗之间PB值并无显著性差异(图3);叶氮在捕光色素中的分配系数PL在林窗中的动态则表现出了与PT、PC和PB值完全不同变化趋势,从T1林窗到T3林窗PL值随着林窗面积的增大显著降低,而T3林窗到T7林窗一直到旷地,PL值无显著性差异(图3D)。
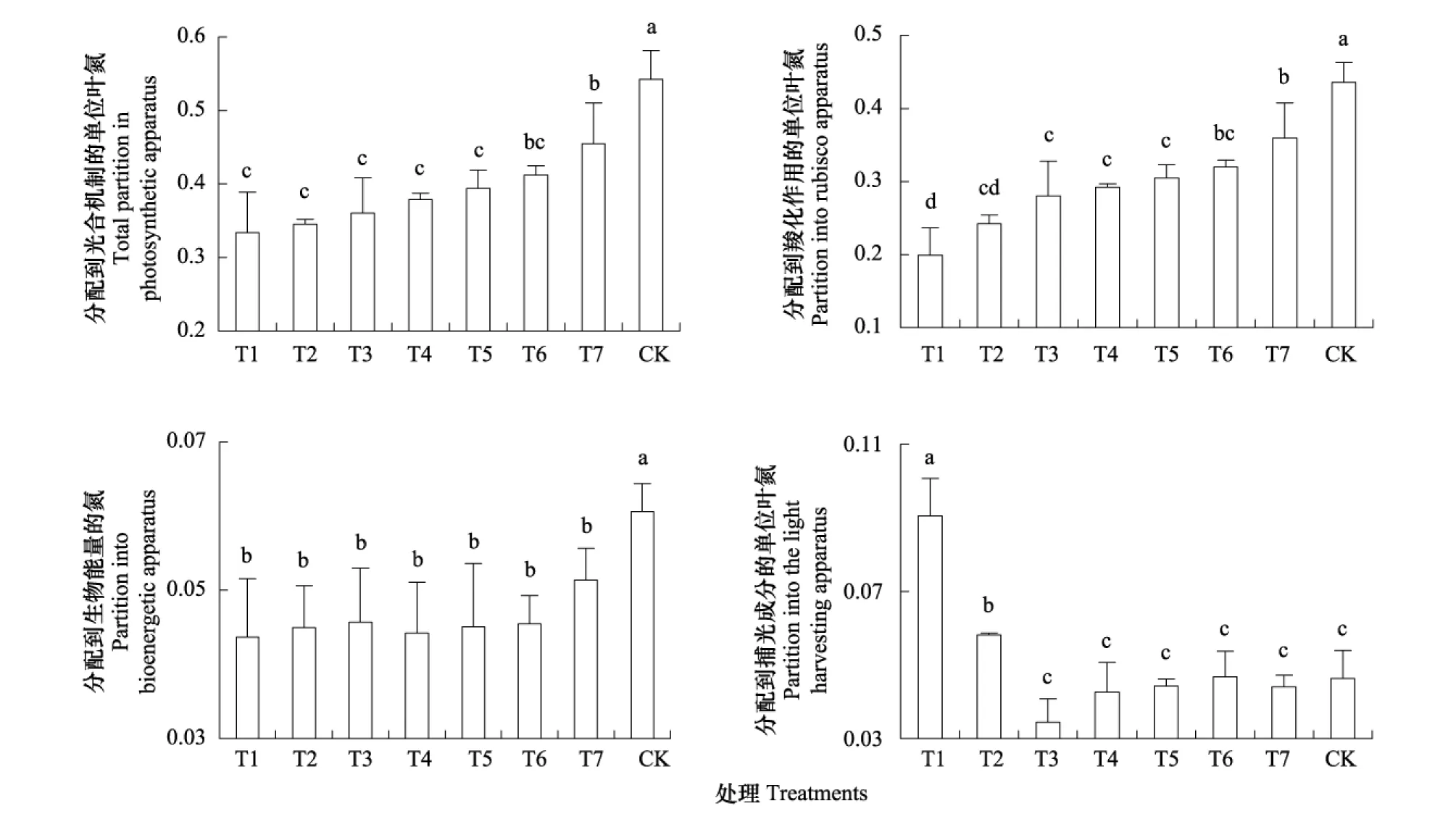
图3 不同林窗中油樟幼苗叶片光合氮分配特征
2.4 油樟幼苗光合能力与比叶面积、氮含量及光合氮分配之间的关系
Pearson相关性分析表明,林窗内油樟幼苗叶片光合潜力与NA、NM、PB、磷含量、PC呈极显著的正相关关系(P≤0.01),与叶氮光合总氮分配系数PT呈显著性正相关关系(P≤0.05),与比叶面积、PL呈极显著的负相关关系(P≤0.01)(表2)。
3 讨论
林窗形成后,林窗内的光照、温度和水分等环境因子均发生变化,使得物质和能量环境明显不同于林地、林外旷地环境[22]。林窗中环境因子的变化规律与格局因林窗大小的变化而不同[23];林窗内小气候的变化会直接影响乔木幼苗生长[24]。本研究中,10 m×10 m(T1)林窗中油樟幼苗最大净光合速率最低。随着林窗面积的增大,油樟幼苗叶片最大净光合速率增加。在林窗面积增加至20 m×20 m(T3)时,林窗内幼苗最大净光合速率与旷地没有显著性差异。
植物叶片的最大净光合速率与植物叶片结构特征、化学计量特征密切关联。叶片比叶重LMA和氮、磷含量能在一定程度上代表植物对环境资源的利用方式和能力[25]。LMA是叶片厚度与密度的乘积,能够在一定程度上反映植物对资源获取和利用的制衡关系[26- 27],是植物碳获取策略的关键叶特征之一[28]。弱光环境中,植物叶片细胞内储藏物质减少,叶肉细胞变大、细胞壁次生结构弱化[29- 30],叶片同化组织对输导组织和结构组织的相对比例升高[31],导致林窗内植物叶片可能具有更高的氮含量,并认为这是植物叶片对弱光环境的形态生理适应特征,本文研究与多数结果相一致[32- 33],在面积大于15 m×15 m(T2)的林窗内的油樟幼苗叶片氮含量通常高于旷地对照。但在较小林窗(10 m×10 m,T1)中油樟幼苗叶氮含量显著低于旷地对照。在对常绿
表2 马尾松林窗中油樟幼苗叶片光合生理参数之间的相关性分析
Table 2 Correlation analysis of photosynthetic characteristics in seedlings ofC.longepaniculatumunder forest gap in the masson pine plantation

Pmax: 最大光合速率Maximum net photosynthetic rate; SLA: 比叶面积Specific leaf area; NA: 单位面积氮含量Specific leaf area; NM:单位质量氮含量mass-based leaf nitrogen concentration; P磷含量:Mass-based leaf phosphorus concentration; PC:分配到羧化作用上的氮partition into Rubisco apparatus; PB:分配到生物能量上的氮partition into bioenergetic apparatus; PL:分配到捕光成分氮partition into the light harvesting apparatus; PT:分配到光合机制的氮Total partition in the photosynthetic apparatus; * P≤0.05;** P≤0.01
树种Rhododendronponticum与Ilexaquifolium[34]、焕镛木(Woonyoungiaseptentrionalis)[35]的研究中也发现类似现象。这可能是油樟幼苗在极端环境中维持体内化学元素相对稳定有关系。在光资源严重不足的环境内植物生长缓慢,叶片内限制磷含量的核糖体(特别是rRNA)对磷的需求降低[36],叶磷含量随之降低。在本研究中,叶磷含量并没有因林窗面积的变化而发生显著性变化,这可能与弱光环境下成熟叶片生命活动周期延长有关[25,32]。
叶氮在不同光合组份中的分配情况更能反映环境变化条件下的植物种群适应对策[37- 38]。叶氮在捕光组分和能量转化组分(包括电子传递、腺嘌呤核苷三磷酸合成和CO2同化组分)中的分配取决于生长光强和氮的利用[20]。本文的研究结果表明,当林窗面积大于20 m×20 m(T3)时,高光强促进了油樟幼苗叶氮在羧化系统PC和生物力能学组分PB中的投资与利用,这与油樟叶片在面积大于20 m×20 m(T3)林窗时具有较高的最大净光合速率相一致。在较小林窗内(低于20 m×20 m),油樟叶氮在捕光组分的分配系数PL显著升高,以增加结合在光系统Ⅰ、光系统Ⅱ和捕光叶绿素a/b蛋白复合体的数量。然而,PL的增加是以减少叶氮在羧化组分和电子传递体中的分配为代价的,与小林窗内油樟幼苗叶片具较低的最大净光合速率相吻合。
以上分析表明,当面积低于20 m×20 m时,马尾松林窗显著影响了油樟幼苗叶片的光合能力。油樟幼苗可以通过调节比叶面积、叶氮含量以及叶氮在光合组分中的分配系数等形态、生理适应特征来适应林窗环境的变化。
[1] Runkle J R. Synchrony of regeneration, gaps, and latitudinal differences in tree species diversity. Ecology, 1989, 70(3): 546- 547.
[2] 臧润国, 王伯荪, 刘静艳. 南亚热带常绿阔叶林不同大小和发育阶段林隙的树种多样性研究. 应用生态学报, 2000, 11(4): 485- 488.
[3] Sherman R E, Fahey T J, Battles J J. Small-scale disturbance and regeneration dynamics in a neotropical mangrove forest. Journal of Ecology, 2000, 88(1): 165- 178.
[4] Ashton P M S, Gamage S, Gunatilleke I A U N, Gunatilleke C V S. Restoration of a Sri Lankan rainforest: using Caribbean pinePinuscaribaeaas a nurse for establishing late-successional tree species. Journal of Applied Ecology, 1997, 34(4): 915- 925.
[5] Duncan R S, Chapman C A. Consequences of plantation harvest during tropical forest restoration in Uganda. Forest Ecology and Management, 2003, 173(1/3): 235- 250.
[6] 杨会侠, 汪思龙, 范冰, 张伟东, 韦翠娥. 马尾松人工林发育过程中的养分动态. 应用生态学报, 2010, 21(8): 1907- 1914.
[7] 杨会侠, 汪思龙, 范冰, 张伟东. 不同林龄马尾松人工林年凋落量与养分归还动态. 生态学杂志, 2010, 29(12): 2334- 2340.
[8] 包维楷, 张镱锂, 王乾, 摆万奇, 郑度. 大渡河上游林区森林资源退化及其恢复与重建. 山地学报, 2002, 20(2): 194- 198.
[9] 王乾, 吴宁, 罗鹏, 易绍良, 包维楷, 石福孙. 青藏高原东缘亚高山针叶林和采伐迹地中藓类生长速率及其影响因子. 植物生态学报, 2007, 31(3): 464- 469.
[10] 谭波, 吴福忠, 杨万勤, 张健, 徐振锋, 刘洋, 苟小林. 不同林龄马尾松人工林土壤节肢动物群落结构. 应用生态学报, 2013, 24(4): 1118- 1124.
[11] Farquhar G D, Ehleringer J R, Hubick K T. Carbon isotope discrimination and photosynthesis. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 503- 537.
[12] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317- 345.
[13] Tenhunen J D, Yocum C S, Gates D M. Development of a photosynthesis model with an emphasis on ecological applications. Oecologia, 1976, 26(2): 89- 100.
[14] 黄帆, 郭正元, 徐珍. 测定浮萍叶绿素含量的方法研究. 实验技术与管理, 2007, 24(5): 29- 31.
[15] 吕伟仙, 葛滢, 吴建之, 常杰. 植物中硝态氮、氨态氮、总氮测定方法的比较研究. 光谱学与光谱分析, 2004, 24(2): 204- 206.
[16] 雷泽湘, 徐德兰, 谢贻发, 刘正文. 太湖水生植物氮磷与湖水和沉积物氮磷含量的关系. 植物生态学报, 2008, 32(2): 402- 407.
[17] 李会娟. 2种植物磷含量的检测方法比较研究. 现代农业科技, 2012, (11): 16- 17.
[18] Friend A D. PGEN: an integrated model of leaf photosynthesis, transpiration, and conductance. Ecological Modelling, 1995, 77(2/3): 233- 255.
[19] Evans J R. Photosynthesis-the dependence on nitrogen partitioning //Causes and Consequences of Variation in Growth Rate and Productivity of Higher Plants. The Hague: SPB Academic Publishing, 1989: 158- 174.
[20] Hikosaka K, Terashima I. A model of the acclimation of photosynthesis in the leaves of C3plants to sun and shade with respect to nitrogen use. Plant, Cell & Environment, 1995, 18(6): 605- 618.
[21] Niinemets Ü, Tenhunen J D. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant speciesAcersaccharum. Plant, Cell & Environment, 1997, 20(7): 845- 866.
[22] 谭辉, 朱教君, 康宏樟, 胡理乐. 林窗干扰研究. 生态学杂志, 2007, 26(4): 587- 594.
[23] Ritter E, Dalsgaard L, Einhorn K S. Light, temperature and soil moisture regimes following gap formation in a semi-natural beech-dominated forest in Denmark. Forest Ecology and Management, 2005, 206(1/3): 15- 33.
[24] Powers M D, Pregitzer K S, Palik B J, Webster C R. Water relations of pine seedlings in contrasting overstory environments. Forest Ecology and Management, 2009, 258(7): 1442- 1448.
[25] Niinemets Ü. Global-scale climatic controls of leaf dry mass per area, density, and thickness in trees and shrubs. Ecology, 2001, 82(2): 453- 469.
[26] Wilson T D. Models in information behaviour research. Journal of Documentation, 1999, 55(3): 249- 270.
[27] Long W X, Zang R G, Schamp B S, Ding Y. Within- and among-species variation in specific leaf area drive community assembly in a tropical cloud forest. Oecologia, 2011, 167(4): 1103- 1113.
[28] Wright I J, Westoby M, Reich P B. Convergence towards higher leaf mass per area in dry and nutrient-poor habitats has different consequences for leaf life span. Journal of Ecology, 2002, 90(3): 534- 543.
[29] Niinemets Ü. Components of leaf dry mass per area-thickness and density-alter leaf photosynthetic capacity in reverse directions in woody plants. New Phytologist, 1999, 144(1): 35- 47.
[30] Yamashita N, Koike N, Ishida A. Leaf ontogenetic dependence of light acclimation in invasive and native subtropical trees of different successional status. Plant, Cell & Environment, 2002, 25(10): 1341- 1356.
[31] Feng Y L, Auge H, Ebeling S K. InvasiveBuddlejadavidiiallocates more nitrogen to its photosynthetic machinery than five native woody species. Oecologia, 2007, 153(3): 501- 510.
[32] 胡启鹏, 郭志华, 李春燕, 马履一. 不同光环境下亚热带常绿阔叶树种和落叶阔叶树种幼苗的叶形态和光合生理特征. 生态学报, 2008, 28(7): 3262- 3270.
[33] 王玉平, 陶建平, 刘晋仙, 何泽. 不同光环境下6种常绿阔叶林树种苗期的叶片功能性状. 林业科学, 2012, 48(11): 23- 29.
[34] Niinemets ü, Valladares F, Ceulemans R. Leaf-level phenotypic variability and plasticity of invasiveRhododendronponticumand non-invasiveIlexaquifoliumco-occurring at two contrasting European sites. Plant, Cell & Environment, 2003, 26(6): 941- 956.
[35] 孙谷畴, 赵平, 曾小平, 彭少麟. 不同光强下焕镛木和观光木的光合参数变化. 植物生态学报, 2002, 26(3): 355- 362.
[36] 程滨, 赵永军, 张文广, 安树青. 生态化学计量学研究进展. 生态学报, 2010, 30(6): 1628- 1637.
[37] 张亚杰, 冯玉龙. 不同光强下生长的两种榕树叶片光合能力与比叶重、氮含量及分配的关系. 植物生理与分子生物学学报, 2004, 30(3): 269- 276.
[38] 张亚杰, 冯玉龙. 喜光榕树和耐荫榕树光适应机制的差异. 植物生理与分子生物学学报, 2004, 30(3): 297- 304.
Responses of photosynthetic traits inCinnamomumlongepaniculatumseedlings to forest gap size in a Masson pine plantation
LIU Hui1, SONG Huixing1,2,*, YANG Wanqin2, ZHANG Jian2
1SchoolofLandscapeArchitecture,SichuanAgriculturalUniversity,Chengdu611130,China2InstituteofEcologicalForestry,SichuanAgriculturalUniversity,Chengdu611130,China
Forest gaps are one of the most common phenomena in forest communities that provide a variety of microhabitats. The formation of forest gaps can change the environmental microsite conditions of forested land such as affecting the availability of light, heat, water and influencing soil fertility. Gaps can increase environmental heterogeneity and the diversity of microhabitats present in forested ecosystems, thus becoming an important driving force for the long-term maintenance of forest ecosystems while aiding in cycling and regeneration. For the past few years, with the goal of improving the operational efficiency and management of plantations, researchers have simulated the function of gaps in natural forest during forest regeneration, and have gradually developed a mass transformation practice of artificial pure forest. However, the question remains; what size of forest gap patches is most conducive to the growth of mixed species forests? Additional work is needed to study the impact of forest gap gradients on the growth characteristics of mixed species forests.Pinusmassonianais an important afforestation pioneer species and the main fiber-producing species in China, especially in the Yangtze River basin and in southern China. The planting of large areas of single-species Masson pine forest has created many problems related to forest ecology, such as reduced biodiversity, soil acidification and poor soil fertility, along with an increased risk of forest diseases and insect pests, low forest productivity and so on. This study was designed to help land managers understand the impacts of forest gaps in Masson pine plantations on associated tree species in light of the extensive use of such plantations. The goal was to provide a scientific basis for the use of various sized gaps in Masson pine plantations and to analyze the effects of gaps on other forest species. The effects of gaps on mixed species seedlings were studied by comparing the changes of leaf morphology and photosynthetic physiological characteristics of an important indigenous broad-leaved tree species,Cinnamomumlongepaniculatum, in forest gaps of different sizes. The main results follow. First, when the size of forest gaps was less than 20 m × 20 m, the maximum net photosynthetic rate of the leaves ofC.longepaniculatumseedlings was significantly lower than that in open land. Second, with an increase of forest gap size, leaf mass per unit area increased significantly. Compared with the control, although the leaf nitrogen content ofC.longepaniculatumseedlings decreased significantly in small forest gaps (e.g., 10 m × 10 m), it increased significantly in large gaps (e.g., 20 m × 20 m). Nevertheless, no significant difference was observed in the phosphorus content of leaves of seedlings grown in either forest gaps or in open land. Third, with an increase in forest gap size, total partition coefficients of leaf nitrogen in the photosynthetic apparatus increased, especially the partition coefficients of leaf nitrogen in carboxylation components. Nevertheless, the coefficient of leaf nitrogen partitioning into the light harvesting apparatus decreased significantly with an increase in the size of forest gaps (10 m × 10 m—20 m × 20 m). The results demonstrated that if the gap size is less than 20 m × 20 m forest gaps have marked effects on the photosynthetic capacity ofC.longepaniculatumseedlings. Seedlings may adapt to changes in the forest gap environment by adjusting a number of morphological and physiological characteristics, e.g., specific leaf area, leaf nitrogen content and the distribution of leaf nitrogen in the photosynthetic apparatus.
Cinnamomumlongepaniculatum; forest gap; partition for leaf nitrogen; photosynthetic capability;Pinusmassoniana
国家科技部“十二五”科技支撑计划项目(2011BAC09B05); 中国博士后基金项目(2013M531976)
2013- 09- 22;
2014- 07- 02
10.5846/stxb201309222326
*通讯作者Corresponding author.E-mail: Huixingsong@aliyun.com
刘辉, 宋会兴, 杨万勤, 张健.油樟幼苗对马尾松林窗面积的光合响应特征.生态学报,2015,35(12):4089- 4096.
Liu H, Song H X, Yang W Q, Zhang J.Responses of photosynthetic traits inCinnamomumlongepaniculatumseedlings to forest gap size in a Masson pine plantation.Acta Ecologica Sinica,2015,35(12):4089- 4096.
