金银花容器苗对干旱胁迫下接种根际促生细菌的生理响应
2015-02-05刘方春马海林杜振宇马丙尧井大炜邢尚军
刘方春,马海林,杜振宇,马丙尧,井大炜,邢尚军
1 山东省林业科学研究院,山东省森林植被生态修复工程技术研究中心,济南 250014 2 德州学院,德州 253023
金银花容器苗对干旱胁迫下接种根际促生细菌的生理响应
刘方春1,马海林1,*,杜振宇1,马丙尧1,井大炜2,邢尚军1
1 山东省林业科学研究院,山东省森林植被生态修复工程技术研究中心,济南 250014 2 德州学院,德州 253023
在盆栽试验条件下,以金银花容器苗为试材,研究了不同干旱强度下接种蜡样芽孢杆菌(Bacilluscereus)L90对植物生理特征的影响。结果表明:随着干旱胁迫强度的增加,金银花容器苗的光合速率和气孔导度逐渐降低;而干旱环境下接种L90可显著提高气孔导度,缓解干旱胁迫对净光合速率的抑制;且干旱强度增加,缓解效果增强。接种B.cereusL90可显著抑制干旱胁迫下金银花容器苗PSⅡ最大光化学效率、实际光化学效率和光化学猝灭系数的降低,抑制非光化学猝灭系数的升高。虽然L90并没有提高对照处理中光合色素的绝对含量,但可显著抑制干旱环境下金银花叶片中光合色素的分解。干旱显著降低了金银花叶片中细胞分裂素含量,增加了脱落酸(ABA)的含量;在干旱胁迫下,接种L90可显著提高叶片中细胞分裂素的含量,并可促使根部产生的ABA运输到叶片中。干旱胁迫程度较轻时,L90对金银花容器苗的相对含水量和相对电导率影响不显著;而在重度干旱时,同对照相比,干旱及接种L90处理的相对含水量分别降低20.56%和10.21%,相对电导率分别提高31.42%和16.08%,接种L90处理的变化幅度明显较小。因此,干旱生境下接种B.cereusL90,可增加叶片中细胞分裂素含量,抑制光合色素的分解及光合能力的下降,提高金银花容器苗在干旱环境中的适应能力。
干旱胁迫;金银花;植物根际促生细菌;蜡样芽孢杆菌;生理响应
世界水资源的不足和时空分布的不均成为限制植物生长发育的重要因子[1]。干旱严重影响着植物的形态结构、光合生长和代谢水平[2]。有研究表明,干旱胁迫会使植物受到气孔因素或者非气孔因素限制,降低植物光合速率,从而严重影响植物正常生长及干物质积累[3]。也有研究表明,干旱会导致叶片中细胞分裂素降低和叶绿素的流失,从而引起水分吸收能力和光合能力下降[4]。许多植物经过长期的自然选择和协同进化已经形成了许多响应水分亏缺的适应机制和策略[5],如何使植物更好地应对干旱环境已成为当前急需解决的问题之一。
植物根际促生细菌(PGPR)是指生存在植物根圈范围中,对植物生长有促进或对病原菌有拮抗作用的有益细菌[6- 7]。国内外对 PGPR 的研究很多,主要集中在促进植物生长、活化土壤养分、减少化肥施用、提高植物诱导系统抗性等[8- 9]。然而,通过接种PGPR来提高植物在干旱环境中的适应能力,已经成为近年来国内外PGPRR的研究热点[10]。研究表明,具有ACC脱氨酶活性的PGPR可提高西红柿、辣椒[11]和小麦[12]等植物的干旱适应能力。产植物激素,尤其是细胞分裂素是根际促生细菌(PGPR)促进植物生长的重要机理之一。细胞分裂素与植物的叶绿素含量、气孔开闭等密切相关[4],因此,研究产细胞分裂素的PGPR对植物干旱适应能力的影响同样具有重要意义。
金银花(LonicerajaponicaThunb.)为多年生半常绿藤本植物,适应性强,对土壤要求不严,繁殖能力极强。刘志梅等人的研究结果认为,红花金银花具有较强的干旱适应能力[13]。因此,本研究以红花金银花的无纺布容器苗作为供试植物,研究了其对干旱胁迫下接种PGPR的生理响应,以期为如何提高植物在干旱逆境下的适应能力提供新的思路和科学依据。
1 材料和方法
1.1 试验材料
1.1.1 苗木及土壤
2012年3—7月,试验于山东省林业科学研究院的温室内进行,供试植物为山东省林业科学研究院培育的1年生红花金银花的无纺布容器苗。供试土壤类型为潮土,其碱解氮、速效磷和速效钾含量分别为31.5、33.4 mg/kg和76.8 mg/kg,pH值为7.82,田间持水量为32.13%。
1.1.2 植物根际促生细菌
参考Abbasi等[8]的生物法从植物根际土壤中筛选出一株可产生细胞分裂素的PGPR,综合其生理生化特征和16S rRNA基因序列分析,将其鉴定为蜡样芽孢杆菌(Bacilluscereus)L90,已保存于中国微生物菌种保藏管理委员会普通微生物中心(保藏号:CGMCC No. 7069)。L90不产生ACC脱氨酶,但可产生反式玉米素(612.09 ng/mL)和激动素(246.59 ng/mL),分泌吲哚乙酸的能力为12.17 μg/mL。将L90接入牛肉膏蛋白胨培养基中,于37 ℃,180 r/min条件下振荡培养48 h。发酵液 6000 r/min下离心5 min,润洗菌体3次后调节有效活菌数(2.0×108cfu/mL)制成菌悬液,将菌悬液稀释250倍制成接种剂。
1.2 试验设计及方法
采用盆栽试验,随机区组设计。盆高25 cm,宽30 cm,每盆装土11.2 kg,2012年3月24日,将事先育好的的金银花容器苗定植,每盆一株。参考杨玉珍[10]等人划分水分的标准,干旱设计分为4个试验梯度,分别为正常水分处理(CK,土壤相对含水量为70%—75%)、轻度胁迫(LD,土壤相对含水量为55%—60%)、中度胁迫(MD,土壤相对含水量为40%—45%)和重度胁迫(SD,土壤相对含水量为25%—30%)。每种干旱梯度均设接种(L90)和不接种(NP)B.cereusL90两个处理。金银花容器苗定植时,连同育苗容器一起置于细砂盘上(细砂盘铺满滤纸),向细砂盘中分别加入稀释好的L90接种剂或蒸馏水,利用毛细作用将接种剂或蒸馏水吸附到育苗基质中至饱和持水量,然后置于盆中定植。缓苗后按照自然干旱的方式进行干旱胁迫。每天9:00—10:00,利用英国产便携式HH2型(WET-2-K1型探头)土壤水分/盐分/温度计测量土壤含水量,如水分含量低于试验处理设置的下限,则浇水至处理的上限,使土壤水分含量始终保持在干旱设计的范围内。在胁迫30 d后,分别采集金银花地上部和地下部分,进行相关生理指标的测定。
1.3 测定指标及方法
干旱胁迫第30天的10:00—10:30测定光合作用和叶绿素荧光参数。利用LI-6400便携式光合作用仪(LI-COR, USA)测定叶片净光合速率(Pn),气孔导度(gs)和胞间二氧化碳浓度(Ci)等,使用FMS-2叶绿素荧光仪(Hansatech, UK)测定叶绿素荧光动力学参数[14]。利用高效液相色谱(HPLC)测定菌液中细胞分裂素和植物内源激素的含量,使用仪器为美国Agilent HP 1100 series型液相色谱仪,紫外检测波长254 nm,过C18柱(250 mm×4.6 mm,5 μm),流动相为45%甲醇∶55%(含0.5%醋酸)水,进样量20 μL,流速1 mL/min,柱温40 °C,外标法定量[15]。参考Sandhya等人的方法,采用重量法测定相对含水量[16];参考Huang等人的方法测定叶片的相对电导率[17]。光合色素含量的测定采用欧立军等人的方法。取不同处理的新鲜叶片0.2 g,用95%的乙醇提取色素,定容至25 mL,用7230G 型分光光度计测定665、649、470 nm 的光吸收值,每个样品重复3次,取其平均值[3]。
1.4 数据分析
采用Excel 2007和SPSS 13.0分析软件进行相关统计分析,比较不同处理组数据的差异(P<0.05),结果为3次重复试验的平均值。
2 结果与分析
2.1 光合特征
在试验期间,金银花容器苗的Pn和gs的变化规律基本一致(表1)。随着胁迫强度的增加,各处理的Pn和gs均呈下降趋势。在重度干旱时,同对照相比,NP处理的Pn和gs分别下降16.65%和35.14%,L90处理下降11.08%和26.83%,差异显著(P<0.05)。在不同的胁迫强度下,Ci呈现出不同的变化规律。NP处理在轻度胁迫下最低,而后开始升高;而L90处理中度胁迫下最低,重度胁迫时有所升高。以上分析表明,在本研究的干旱强度下,金银花容器苗受到了一定的干旱胁迫,接种B.cereusL90并不能改变金银花光合能力下降的趋势。
方差分析结果显示,无论处于何种水分状态,L90处理的Pn和gs均显著高于NP。4种不同水分处理下,同NP处理相比,L90处理的Pn分别增加7.84%、9.04%、12.49%和15.04%,gs分别增加10.81%、13.89%、21.43%和25.01%。光合速率增加幅度有随干旱胁迫增加逐渐增加的趋势。在正常水分条件下,NP和L90处理的Ci差异不显著,且在轻度干旱时均有一定程度下降。中度干旱胁迫下,NP处理的Ci开始显著升高,而L90处理仍然持续下降。重度干旱时,L90处理的Ci也开始显著升高(P<0.05)。以上分析说明,干旱生境下接种L90可显著提高金银花叶片的光合能力,且对金银花的环境适应能力产生了一定影响。
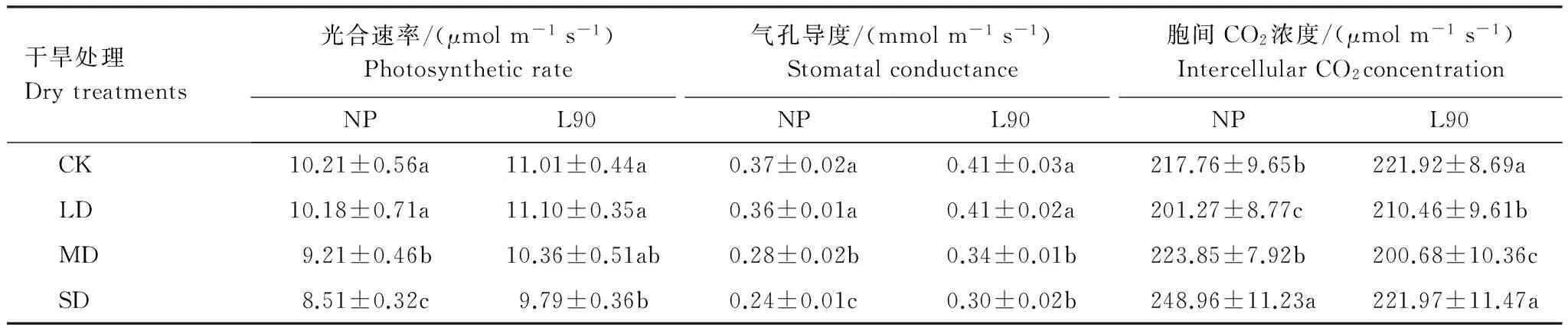
表1 干旱胁迫下不同试验处理对金银花容器苗光合特征的影响Table 1 Effect of different treatments on photosynthetic characteristics of Lonicera japonica container seedlings under drought stress
CK: 对照 Control; 轻度干旱: LD light drought; MD: 中度干旱moderate drought; SD: 重度干旱severe drought;同列不同小写字母表示差异显著(P<0.05)
2.2 叶绿素荧光
不同强度的干旱胁迫对金银花容器苗的PSⅡ产生显著影响(表2)。同对照相比,干旱胁迫后PSⅡ最大光化学效率(Fv/Fm)显著降低(P<0.05),且下降幅度随干旱胁迫强度的增加逐渐增大。这说明干旱胁迫使金银花叶片光能转换效率下降,能用于光化学反应的光能比例降低。同对照相比,金银花容器苗的实际光化学效率(ФPSⅡ)和光化学猝灭系数(qP)均显著降低,而非光化学猝灭系数(qN)呈现不同的规律。轻度和中度干旱下,NP处理的qN较CK明显升高,而在重度干旱条件下又开始下降;3种干旱胁迫强度下,同对照相比,L90处理的qN分别增加8.89%、15.56%和22.22%,随干旱胁迫强度增加呈上升趋势。

表2 干旱胁迫下金银花容器苗叶片的叶绿素荧光参数Table 2 Chlorophyll fluorescence parameters in leaves of Lonicera japonica seedlings under drought stress
常规水分处理下,接种L90对Fv/Fm、ФPSⅡ、qP和qN均无显著影响。3种不同干旱强度下,同NP处理相比,接种L90处理的Fv/Fm分别显著增加5.26%、10.15%和15.25%(P<0.05)。在干旱胁迫强度较轻时,接种L90和NP处理的ФPSⅡ和qP差异不显著,但随着干旱胁迫强度的增加,两者之间的差异逐渐达到显著水平。在中度干旱时,L90处理ФPSⅡ显著高于NP,在重度干旱时,ФPSⅡ和qP分别比NP处理显著增加25.49%和21.13%(P<0.05)。中度干旱时,同NP处理相比,接种L90显著降低了金银花叶片的qN(P<0.05),而在重度干旱时两者差异不显著。
2.3 光合色素含量
正常浇水条件下,接种L90对金银花容器苗中的光合色素含量影响差异不显著(表3)。随着干旱胁迫强度的增加,NP处理的光合色素含量均有一定程度的降低。其中叶绿色a和叶绿素b的含量在重度干旱时显著降低,同对照相比,分别降低了9.76%和12.61%(P<0.05);而类胡萝卜素在中度干旱胁迫强度下即有一定程度的下降。接种L90处理中,仅有类胡萝卜素在重度干旱胁迫强度显著降低23.42%(P<0.05)。此外,在重度干旱胁迫强度下,同NP处理相比,3种光合色素的含量分别显著增加6.45%、6.72%和30.11%(P<0.05)。以上分析可知,虽然L90并没有增加正常水分处理下的光合色素含量,但显著抑制了干旱环境下色素的分解或降低。
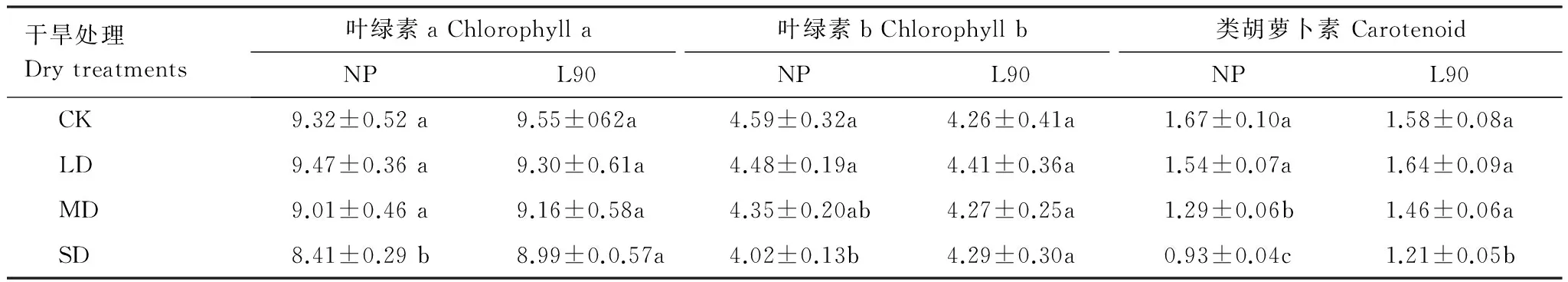
表3 干旱胁迫下不同处理对金银花叶片光合色素含量的影响Table 3 Effect of different treatments on photosynthetic pigment content of Lonicera japonica leaves under drought stress
2.4 细胞分裂素及脱落酸(ABA)含量
正常浇水时,同NP处理相比,L90处理叶片中细胞分裂素的含量增加48.43%(P<0.05),根系中细胞分裂素含量差异较小(表4)。随干旱胁迫强度增加,无论是否接种L90,叶片中细胞分裂素含量逐渐减少。在3种不同强度干旱胁迫条件下,NP处理叶片中细胞分裂素含量分别降低6.71%、34.72%和80.16%,L90处理分别降低13.42%、34.50%和64.25%。虽然如此,在3种不同干旱强度下,同NP处理相比,L90处理叶片细胞分裂素含量分别提高37.75%、53.95%和78.03%,差异显著(P<0.05);根系中的细胞分裂素含量在重度干旱时显著下降,但NP和L90处理之间差异不显著。
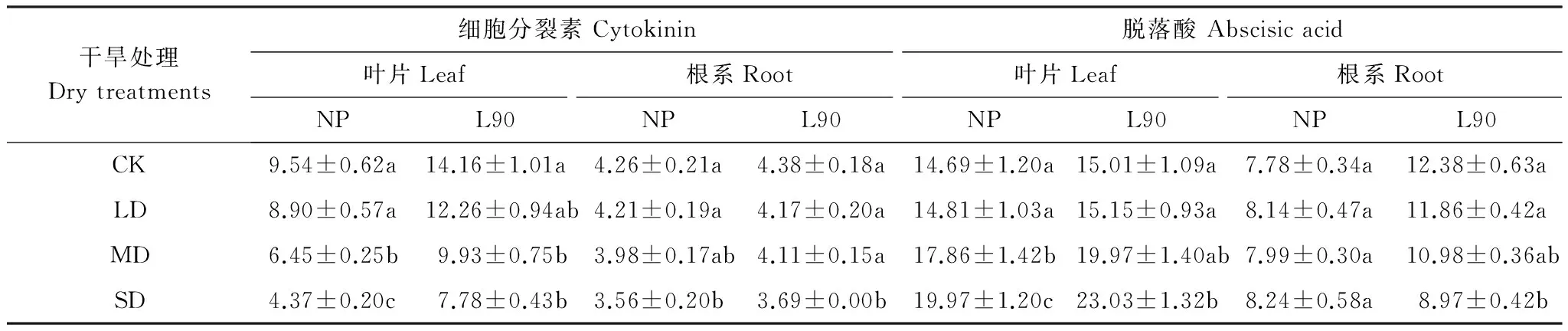
表4 干旱胁迫下不同试验处理对金银花细胞分裂素和脱落酸含量影响Table 4 Effect of different treatments on Cytokinins and ABA concentrations of Lonicera japonica under drought stress
同NP处理相比,正常浇水时,接种L90对叶片中的ABA含量影响差异不显著,但使根系中ABA含量显著增加59.12%(P<0.05)。随着干旱胁迫强度增加,无论是否接种L90,叶片中ABA含量均逐渐增加。同对照相比,在中度和重度干旱胁迫强度下,NP处理叶片的ABA含量分别增加21.58%和35.94%,L90处理则分别增加33.04%和53.43%,干旱胁迫对NP处理的ABA含量影响较小;而L90处理中,根系中ABA含量随着干旱胁迫增加有所降低。在重度干旱时,同对照相比,ABA的含量显著降低27.54%(P<0.05)。

图1 不同试验处理对金银花叶片相对含水量和相对电导率的影响 Fig.1 Effects of different treatment on the relative water content and relative electrolyte leakage of Lonicera japonica leaves 数据为平均值±标准差,不同小写字母表示差异显著(P<0.05)
2.5 相对含水量和相对电导率
叶片相对含水量和相对电导率是评价植物受逆境胁迫强度的重要指标。干旱胁迫显著降低了金银花叶片的相对含水量,增加了相对电导率(图1)。随着干旱胁迫强度的增加,金银花叶片的相对含水量逐渐降低。NP处理中,在轻度干旱时即开始显著下降;而L90处理中,轻度干旱时同CK处理差异不显著,在中度干旱时,叶片相对含水量显著降低;在重度干旱时,同各自对照相比,NP和L90处理的叶片相对含水量分别降低20.56%和10.21%(P<0.05)。同相对含水量变化规律相类似,轻度干旱时,无论是否接种L90,叶片相对电导率同对照差异不显著。在中度干旱时,NP处理的叶片相对含水量开始显著增加,而L90处理在重度干旱时开始显著高于对照(P<0.05)。在重度干旱时,同CK相比,金银花叶片的相对电导率分别增加31.42%(NP)和16.08%(L90),差异显著(P<0.05)。以上分析可知,干旱生境下接种L90虽然不能改变叶片相对含水量和相对电导率的变化趋势,但有效降低了其变化幅度。
3 结论和讨论
3.1 金银花容器苗的光合特征
干旱胁迫严重影响植物生长和代谢,其中对光合作用的影响尤为突出[10, 18]。大量研究表明,在正常环境下,植物根际促生细菌可提高光合速率,促进干物质的积累[6- 7, 19]。本研究在干旱环境下接种可产细胞分裂素的PGPR,结果发现B.cereusL90虽然没有改变金银花容器苗Pn和gs的下降趋势,但可显著抑制其下降幅度,且植物生长环境越是干旱,接种L90越是容易发挥其功效。影响植物光合作用的因素可分为气孔因素和非气孔因素,气孔限制使Ci降低,而非气孔限制使Ci升高[20- 21]。本研究发现,在轻度干旱时,无论是否接种L90,其gs和Ci均较正常供水处理有所降低,说明此时金银花叶片Pn的下降与气孔因素关系密切。随着干旱胁迫强度的增加,在中度干旱时,伴随着gs的降低,NP处理的Ci开始显著升高,这表明Pn的下降除了受气孔因素限制外,逐渐开始受到非气孔因素的限制,其叶肉细胞光合活性下降,光合器官结构受到一定的伤害。而在重度干旱时,L90处理Ci开始显著升高,其Pn的下降开始遭受非气孔因素的限制。因此,接种L90处理的金银花在重度干旱时受到了较轻的干旱胁迫,干旱环境下接种PGPR对植物的干旱适应能力产生了较大影响。本研究选用的L90可产生不同浓度和种类的细胞分裂素,细胞分裂素可促使气孔开张,提高植物的光合能力[4]。接种L90对叶片中细胞分裂素含量的有益效果,可能是其提高金银花光合速率的原因之一。
3.2 金银花容器苗的叶绿素荧光特征
叶绿体在正常情况下吸收的光能主要通过光合电子传递、叶绿素荧光和热耗散3种途径来消耗,这3种途径存在着此消彼长的关系[3]。本研究中,随着干旱胁迫强度的增加,Fv/Fm、ФPSⅡ、qP与Pn、gs的下降幅度不断增大。说明在干旱环境下,PSⅡ最大光化学效率与PSⅡ实际量子产量的下降,阻碍了PSⅡ反应中心的电子传递,降低了天线色素捕获的光能用于光化学反应的份额,PSⅡ反应中心的光化学活性降低,从而导致Pn的降低。细胞分裂素可抑制叶片中叶绿素的流失。本研究中,干旱环境下接种L90提高了叶片细胞分裂素含量,虽然并没有提高光合色素绝对含量,但却显著抑制了重度干旱时叶绿色a、叶绿素b和类胡萝卜素的分解或降低,其中对类胡萝卜素的影响最为明显。干旱条件下植物叶片内类胡萝卜素含量的升高有助于缓解氧胁迫对其光系统的伤害[22],同时还参与光反应中心中过剩光能的耗散,保护光合机构[3, 23]。同NP处理相比,干旱生境下接种L90不同程度的提高了Fv/Fm、ФPSⅡ和qP,而qN却显著下降,并维持在一个相对稳定的水平。说明干旱环境下接种L90可减缓干旱胁迫对PSⅡ反应中心的破坏,使金银花容器苗的叶片保持较高的PSⅡ光化学效率。此外,qN下降还说明干旱环境下接种L90促使植物将吸收的光能更多的用于光合作用,降低了用于非光化学耗散的比例,干旱环境下L90处理的光合速率均有一定程度提高也证明了这一点。由此可见,干旱生境下接种L90可通过非光化学猝灭降低干旱胁迫对金银花造成的伤害。
3.3 激素含量
本研究结果发现,同正常水分处理相比,干旱胁迫导致金银花叶片中的细胞分裂素含量大幅降低,而干旱环境下接种B.cereusL90可显著提高细胞分裂素的含量。本研究选择的B.cereusL90可产不同浓度和种类的细胞分裂素,一方面L90本身分泌的细胞分裂素可通过根系运输到地上部植物组织中,另一方面也可能刺激植物本身产生更高浓度的细胞分裂素,这可能是L90提高金银花叶片细胞分裂素含量的主要原因。Arkhipova等人证实,细胞分裂素可通过调节气孔开张提高植物光合速率[4],叶片中细胞分裂素含量的大幅降低是干旱导致植物光合速率大幅降低的原因之一。叶片中细胞分裂素含量的增加,可促进气孔开张,从而有效抑制了干旱环境下植物叶片光合速率的过度降低。研究证实,ABA 在干旱条件下作为一种激素应激信号存在于木质部中,可从根部运输到茎干的各个部位,调节蒸腾水分损失与叶片生长[4, 24- 25]。本研究结果发现,在正常水分条件下,接种L90促使金银花容器苗根系的ABA含量显著增加,这可能是Arkhipova等人报道PGPR对植物根系生长有一定抑制作用的主要原因[4]。在干旱生境下,接种L90处理的根系ABA含量大幅减少,而叶片中ABA含量显著增加。因此,干旱生境下接种L90,可增加根对水的透性或增加离子向木质部的输送,促使根部产生的ABA随水分运输到叶片中,导致气孔开度减小甚至完全关闭。以上分析可知,干旱生境下接种B.cereusL90,可通过影响植物体内激素含量来调节气孔运动,从而对植物的干旱适应能力产生一定影响。
以上分析可知,干旱生境下B.cereusL90可通过调节植物体内的激素含量,减少干旱胁迫下光合色素的分解或流失,通过增强PSⅡ反应的中心活性提高Pn,降低干旱对金银花造成的伤害。PGPR可产生不同浓度和种类的细胞分裂素是提高植物干旱适应能力的主要机理之一。
[1] Mouillon J M, Gustafsson P, Harryson P. Structural investigation of disordered stress proteins. Comparison of full-length dehydrins with isolated peptides of their conserved segments. Plant Physiology, 2006, 141(2): 638- 650.
[2] Seki M, Umezawa T, Urano K, Shinozaki K. Regulatory metabolic networks in drought stress responses. Current Opinion in Plant Biology, 2007, 10(3): 296- 302.
[3] 欧立军, 陈波, 邹学校. 干旱对辣椒光合作用及相关生理特性的影响. 生态学报, 2012, 32(8): 2612- 2619.
[4] Arkhipova T N, Prinsen E, Veselov S U. Martinenko E V, Melentiev A I. Cytokinin producing bacteria enhance plant growth in drying soil. Plant and Soil, 2007, 292: 305- 315.
[5] Bacelar E A, Santos D L, Moutinho-Pereira J M, Gonçalves B C, Ferreira H F, Correia C M. Immediate responses and adaptative strategies of three olive cultivars under contrasting water availability regimes: changes on structure and chemical composition of foliage and oxidative damage. Plant Science, 2006, 170(3): 596- 605.
[6] Verma J P, Yadav J, Tiwari K N, Lavakush, Singh V. Impact of plant growth promoting rhizobacteria on crop production. International Journal of Agricultural Research, 2010, 5(11): 954- 983.
[7] 刘方春, 邢尚军, 马海林, 丁延芹, 陈波, 杜秉海. 根际促生细菌(PGPR)对冬枣根际土壤微生物数量及细菌多样性影响. 林业科学, 2013, 49(8): 75- 80.
[8] Abbasi M K, Sharif S, Kazmi M, Sultan T, Aslam M. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth, yield and nutrient uptake of plants. Plant Biosystems, 2011, 145(1): 159- 168.
[9] Carvalhais L C, Dennis P G, Fedoseyenko D, Hajirezaei M R, Borriss R, Von Wirén N V. Root exudation of sugars, amino acids, and organic acids by maize as affected by nitrogen, phosphorus, potassium, and iron deficiency. Journal of Plant Nutrition and Soil Science, 2011, 174(1): 3- 11.
[10] 杨玉珍, 张云霞, 彭方仁. 干旱胁迫对不同种源香椿苗木光合特性的影响. 北京林业大学学报, 2011, 33(1): 44- 48.
[11] Mayak S, Tirosh T, Glick B R. Plant growth-promoting bacteria that confer resistance to water stress in tomatoes and peppers. Plant Science 2004, 166(2): 525- 530.
[12] Kasim W A, Osman M E, Omar M N, El-Daim I A A, Bejai S, Meijer J. Control of drought stress in wheat using plant-growth-promoting bacteria. Journal of Plant Growth Regulation, 2013, 32(1): 122- 130.
[13] 刘志梅. 3种金银花的光合生理特性及耐旱性研究[D]. 杭州: 浙江农林大学, 2012.
[14] Demmig-Adams B, Adams III W W, Barker D H, Logan B A, Bowling D R, Verhoeven A S. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiologia Plantarum, 1996, 98(2): 253- 264.
[15] Hussain A, Hasnain S. Phytostimulation and biofertilization in wheat by cyanobacteria. Journal of Industrial Microbiology & Biotechnology, 2011, 38(1): 85- 92.
[16] Sandhya V, Ali S Z, Grover M, Reddy G, Venkateswarlu B. Effect of plant growth promotingPseudomonasspp. on compatible solutes, antioxidant status and plant growth of maize under drought stress. Plant Growth Regulation, 2010, 62(1): 21- 30.
[17] Huang M, Guo Z. Responses of antioxidative system to chilling stress in two rice cultivars differing in sensitivity. Biologia Plantarum, 2005, 49(1): 81- 84.
[18] Guerfel M, Baccouri O, Boujnah D, Chaibi W, Zarrouk M. Impacts of water stress on gas exchange, water relations, chlorophyll content and leaf structure in the two main Tunisian olive (OleaeuropaeaL.) cultivars. Scientia Horticulturae, 2009, 119(3): 257- 263.
[19] Flexas J, Ribas-Carbó M, Bota J, Galmés J, Henkle M, Martínez-Caellas S, Medrano H. Decreased rubisco activity during water stress is not induced by decreased relative water content but related to conditions of low stomatal conductance and chloroplast CO2concentration. New Phytologist, 2006, 172(1): 73- 82.
[20] Johnson J D, Tognetti R, Paris P. Water relations and gas exchange in poplar and willow under water stress and elevated atmospheric CO2. Physiologia Plantarum, 2002, 115(1): 93- 100.
[21] Lichtenthaler H K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Methods in Enzymology, 1987, 148: 349- 382.
[22] 钱永强, 孙振元, 韩蕾, 巨关升, 刘俊祥, 曹丽. 野牛草叶片活性氧及其清除系统对水分胁迫的响应. 生态学报, 2010, 30(7): 1920- 1926.
[23] Hartung W, Sauter A, Hose E. Abscisic acid in the xylem: where does it come from, where does it go to?. Journal of Experimental Botany, 2002, 53(366): 27- 32.
[24] 李燕, 薛立, 吴敏. 树木抗旱机理研究进展. 生态学杂志, 2007, 26(11): 1857- 1866.
[25] Davies W J, Kudoyarova G, Hartung W. Long-distance ABA signaling and its relation to other signaling pathways in the detection of soil drying and the mediation of the plant′s response to drought. Journal of Plant Growth Regulation, 2005, 24(4): 285- 295.
Physiological responses ofLonicerajaponicacontainer seedlings to plant growth-promoting rhizobacteria inoculation under drought stress
LIU Fangchun1, MA Hailin1,*, DU Zhenyu1, MA Bingyao1, JING Dawei2, XING Shangjun1
1ShandongAcademyofForest,ShandongEngineeringResearchCenterforEcologicalRestorationofForestVegetation,Jinan250014,China
2DezhouUniversity,Dezhou253023,China
Plant growth-promoting rhizobacteria (PGPR) are rhizosphere inhabitants that promote plant growth and suppress diseases. One of the proposed mechanisms through which PGPR enhance plant growth is the production of plant growth regulators, especially cytokinin. However, little information is available about the effects of cytokinin-producing PGPR inoculation on the drought stress response. Soil water availability is a crucial determining factor of plant yield, because drought stress inhibits stem elongation, leaf expansion, and stomatal movement. Therefore, a strain of rhizobacteria with a high rate of cytokinin production,BacilluscereusL90, was selected for use in this investigation. The bacteria were obtained from the rhizosphere of a walnut tree, where water is limited and frequent dry periods occur. Serial dilution and a bioassay for the detection of cytokinin production were both used to isolate and screen the bacterial strain from the soil sample. This study investigated how PGPR affects the physiological characteristics ofLonicerajaponicaThunb. under different drought stress treatments (light, moderate, severe, and a control). The combined effects ofB.cereusL90 inoculation and various levels of drought stress on the photosynthetic characteristics, chlorophyll fluorescence parameters, photosynthetic pigment, cytokinin and ABA(abscisic acid) concentrations, relative water content, and relative electrolyte leakage were studied using the pot method. The results showed that the net photosynthetic rate and stomatal conductance decreased with increasing drought stress. However,B.cereusL90 inoculation was associated with an increase in stomatal conductance and net photosynthetic rate in plants under drought stress.B.cereusL90 inoculation reduced the negative impact of drought stress on the maximum photochemical efficiency of PSⅡ, the actual photochemical efficiency of PSⅡ, and the photochemical quenching coefficient.B.cereusL90 inoculation also prevented the non-photochemical quenching coefficient from increasing. Although no significant difference was observed under well-watered conditions, the leaves of inoculated drought-stressedL.japonicaseedlings had higher photosynthetic pigments contents compared to those of non-inoculated seedlings. The roots of inoculatedL.japonicaseedlings had higher ABA content compared to non-inoculated seedlings. The elevated levels of cytokinins inL.japonicaleaves and the higher concentration of ABA are both associated with drought stress.B.cereusL90 inoculation significantly increased the cytokinin content of drought-stressedL.japonicaleaves, and improved the rate of transportation of ABA from the roots to the leaves. No significant differences in relative water content and relative electrical conductance were observed between inoculated and non-inoculated seedlings under light drought stress. Compared to the irrigated control, under severe drought stress, the relative water content of non-inoculated seedlings decreased by 20.56%, while that of inoculated seedlings decreased by 10.21%. However, the relative electrical conductance of inoculated and non-inoculated seedlings under severe drought stress increased by 31.42% and 16.08%, respectively. These results demonstrate that inoculation ofB.cereusL90 under drought stress increases the cytokinin content ofL.japonicaleaves, and interferes with the suppression of photosynthetic pigments and net photosynthetic rate. Thus,B.cereusL90 inoculation could improve the adaptability ability ofL.japonicaseedlings to drought conditions. In conclusion, inoculation of cytokinin-producing PGPR could be used to alleviate drought stress and interfere with the suppression of physiological processes, showing real potential for practical use in arid environments as a drought stress inhibitor.
drought stress;LonicerajaponicaThunb.; plant growth-promoting rhizobacteria;Bacilluscereus; physiological responses
山东省科技发展计划专项资助(2010GSF10621, 2014GNC113006)
2014- 02- 18;
日期:2015- 04- 14
10.5846/stxb201402180282
*通讯作者Corresponding author.E-mail: mahlin@163.com
刘方春,马海林,杜振宇,马丙尧,井大炜,邢尚军.金银花容器苗对干旱胁迫下接种根际促生细菌的生理响应.生态学报,2015,35(21):7003- 7010.
Liu F C, Ma H L, Du Z Y,Ma B Y, Jing D W,Xing S J.Physiological responses ofLonicerajaponicacontainer seedlings to plant growth-promoting rhizobacteria inoculation under drought stress.Acta Ecologica Sinica,2015,35(21):7003- 7010.
