树干皮层光合作用
——生理生态功能和测定方法
2015-02-05蔡锡安曾小平陈远其
蔡锡安,曾小平,陈远其,2
1 中国科学院华南植物园,中国科学院退化生态系统植被恢复与管理重点实验室,广州 510650 2 中国科学院大学, 北京 100049
树干皮层光合作用
——生理生态功能和测定方法
蔡锡安1,*,曾小平1,陈远其1,2
1 中国科学院华南植物园,中国科学院退化生态系统植被恢复与管理重点实验室,广州 510650 2 中国科学院大学, 北京 100049
大部分植物的树干(枝条)等部位含有能进行光合作用的绿色组织,树皮叶绿素含量最高可达750 mg/m2。这些绿色组织能够再固定树干内部的CO2(来源于自身组织呼吸或者木质部液流运输),使树干向大气排放的CO2量减少60%—90%皮层光合作用是树干生理活动的重要组成部分,其与树干呼吸和液流速率之间均有密切关系,对植物的碳平衡有重要作用。概述了皮层光合作用的生理生态功能;介绍了皮层光合作用测定和计算方法;讨论了皮层光合作用研究存在的问题;通过加入皮层光合作用的测量修正质量平衡法,以减少树干呼吸测定的不确定性。建议综合运用稳定碳同位素示踪、CO2和O2微传感器、树干液流技术等,准确地区分树干内部CO2的来源及比例,分析各个组分与影响因素的关系。同时,在微观上揭示皮层光合作用的基因组调控功能,在宏观上探讨尺度扩展、模型模拟,并与涡度协方差技术和遥感技术相融合以提高区域尺度估算的精度。
皮层光合作用;树干呼吸;CO2释放;树干液流;测定方法
森林是陆地生态系统的主要组成部分,森林生态系统碳储量占全球陆地生态系统的56%[1],其独特的碳汇功能对稳定大气中温室气体浓度起重要作用,增加和保护森林植被已成为国际公认的减缓气候变暖的有效措施。为应对全球气候变化日益加剧的问题,人们在陆地生态系统碳通量方面开展了大量的研究工作,其中,森林呼吸是陆地生态系统碳循环研究的重要一环。研究表明,冷温带森林自氧呼吸约占总光合生产量的40%—60%,热带雨林可达90%以上[2]。树干(包括枝条)呼吸约占森林生态系统总自养呼吸的5%—42%[3-4]。树干呼吸是一个复杂的生物学过程,一般认为树干呼吸产生的CO2有3个去处:一部分直接释放到大气中;另一部分溶解于树干液流中,并随液流向上传输到更高的枝和冠层;其余部分以气态存在于树干中[5]。由此可见,树干内部的CO2来源和去向都十分复杂,任何影响上面3个过程的因素都会改变树干体内CO2的含量,进而影响其向大气释放过程。影响树干呼吸的因素包括生物因素,如树干氮含量、树干生长速率、树干液流密度、树干光合作用和树干对CO2透性等,以及非生物因素,如树干内氧气含量、树干温度、大气CO2浓度、土壤含水量和土壤养分等[6-7]。通常认为影响呼吸最主要的因子是温度,因为温度主导着参与呼吸作用酶的活性,对树干呼吸速率的影响呈指数关系,同时温度影响CO2的溶解度,提高CO2气体的扩散系数,促进树干CO2释放通量[7]。但研究表明树干绿色组织(树干的皮层光合作用)同样也起到重要作用[8]。
事实上,大部分植物的枝条、树干,以及一些花、果和根等部位含有能进行光合作用的绿色组织(Chlorenchyma)[8-10]。在树干(或枝)截面不同部分,如木栓附近的形成层、内皮层的韧皮部、木射线和木髓等均含有叶绿体[11-12],这些叶绿体有完全发育的类囊体基粒和淀粉粒[13]。嫩枝上叶绿素的含量可达邻近叶片含量的50%—70%[14-15]。对这些绿色组织部位施加光照后其释放到大气的CO2明显减少,表明这些绿色组织进行了CO2同化作用[14]。根据绿色组织吸收CO2的途径可把非叶片绿色组织分为两类:一类是利用大气中CO2进行净光合同化的器官,如绿色树茎、绿色不育花器官等,它们有完善的光捕获和光合同化的组织结构[16]。另一类是利用呼吸释放的CO2进行光合的器官(内部CO2循环),如含叶绿素的树皮和木质部,大多数的果实、根和能育花器官等[16]。植物树干(枝)绿色组织没有严格的定义,并有多种称谓,如树皮光合、皮层光合等[10]。根据其结构和CO2扩散到组织内叶绿体的生理途径分可为茎光合作用、皮层光合作用和CAM茎光合作用(CAM stem photosynthesis; CAM: crassulacean acid metabolism)(表1)[16-17]。1963年Strain和Johnson首次把树皮组织的光合作用称为皮层光合作用,之前称为树皮光合作用[17]。后来,皮层光合作用特指新梢树皮、乔灌木的木射线薄壁细胞和木本树皮等的光合作用[13]。对于高大的乔木来说,大部分树干绿色组织的光合作用为皮层光合[8]。皮层光合作用广泛存在于各种生境植物中,但记录最多的是温带树种,或许皮层光合是温带针叶树种最常见的特性,因为皮层光合可减少冬季呼吸带来的碳损耗[17]。然而在沙漠地区、热带亚热带地区很多树种也具有这种功能[14,16- 18]。皮层光合作用主要功能是再利用非光合组织呼吸产生的CO2[17]。

表1 树干绿色组织光合作用特征*Table 1 Characteristics of photosynthesis for chlorophyllous stem tissue
已有的研究显示树干呼吸的测定有很大的不确定性,不同树种间以及同种不同个体间都有很大的差异,这种差异随着时间和季节的变化而变化,很难准确地预测[5,22- 25]。这种测量的不确定性除了环境因素外,很大程度来源于对树干本身固有的生理特性认识不足,特别是对树干呼吸、皮层光合作用和液流运输CO2等生理过程的认识存在局限性,从而导致计算的理论假设不完善[8,26-27]。目前国内对皮层光合的研究较少,在树干呼吸估算中往往忽略皮层光合作用和液流运输的作用。因此,本文以皮层光合作用为出发点,综述其生理生态特性、测定的理论和方法以及生态学意义,为系统地认识树干皮层光合作用的功能特征,更深入地开展相关研究提供参考。
1 皮层光合作用的重要性
1.1 皮层光合的必要条件
植物树干皮层光合作用是一个古老特征,其存在可追溯到陆生植物的起源时期[17]。植物为了适应从水生到陆生的环境,假茎逐步演化为真茎,假茎的绿色组织并没有在进化过程中完全消失,仍保留在茎的各个组织中,因此植物的树干至今仍保留着这种古老的光合功能[14,17]。树干皮层能够光合作用必须具备一些必要条件,如具有功能结构的叶绿体,必要的酶促反应器、养分、水分、光和二氧化碳等[14]。一些学者在多个层面对树干皮层光合作用的必要条件和功能作了评述,这里略作简单回顾[8-9,14,16-17,28]。
植物树干或枝的皮层等组织里广泛存在叶绿素。Pfanz等的统计表明,树皮、射线薄壁组织、木栓形成层、韧皮部、甚至髓附近的组织都含有叶绿素,树皮叶绿含量从100—524 mg/m2不等(表2),细胞中叶绿体的数量在树干外表皮最高,随着树干深度的增加而明显减少[14]。王文杰等统计表明树干叶绿素含量在52—673 mg/m2之间,树干叶绿素总量相当于对应叶片的10%—165%,树干叶绿素a/b值相当于对应叶片的49%—74%[9]。表2中Pfanz、王文杰和任芳菲等的数据来源于不同植物种类[29],他们都采用提取的方法测定,数值范围相差不远。Dima等是采用外部荧光显微法测定20种植物枝条,数值范围约在20—100 mg/m2之间,比提取的方法低(表2)[30]。部分其他学者用单位鲜重表示叶绿素含量,数值范围约在0.4—3.5 mg/g之间,这与Pfanz等测定的19种数值范围相似(0.27—3.24 mg/g)(表2)。Levizou等用反射光谱法连体测定24种木本植物枝条光合色素指数表明,枝条叶绿素含量比叶片低,同时有高的胡萝卜素/叶绿素比值,但其未给出真实的叶绿素含量[31]。任芳菲等对东北10个树种3年生的树枝测定表明阔叶树树皮内叶绿素含量高于针叶树,落叶树树皮内叶绿素含量高于常绿树,被子植物树皮内叶绿素含量高于裸子植物[29]。可见叶绿素在树干内组织广泛存在,一般情况下树干的叶绿素含量比叶片低,叶绿素a/b比值也较低。

表2 部分树种枝条的叶绿素含量Table1 Chlorophyll contents of some tree twigs
利用荧光、免疫金标记和14CO2同位素标记等技术对木质部叶绿体的超微结构,PSII活性(PSII: photosystem II),二磷酸核酮糖羧化酶活性和以及捕光叶绿素/蛋白复合体等的研究结果显示,茎内组织的叶绿体结构完善,具功能性[14,33,35- 37]。对10种30—35a树龄3年生枝条的研究表明,它们枝条都含有光合色素,具一定的光合能力,但其速率明显低于同一枝条的叶片[29]。测定水曲柳(Fraxinusmandshurica)和樟子松(Pinussylvestris)的光合和光强响应曲线获得的光补偿点和光饱和点亦明显比叶片低,但树皮内绿色组织的表观量子效率则高于叶片,显示树皮内绿色组织有较强的耐阴和光能转化能力[29]。激光共聚焦显微技术研究毛竹(Phyllostachyspubescens)茎秆表明,在表皮以下的基本组织中包括维管束鞘周围存在大量的叶绿体,此特征类似于C4植物的花环结构[38]。同时其测定毛竹茎秆中核酮糖-1,5-二磷酸羧化酶/加氧酶、磷酸烯醇式丙酮酸羧化酶和NADP-苹果酸酶活性也较高[38]。Cleve等利用免疫金标记和14CO2同位素标记技术证明,美洲山杨(Populustremuloides)枝条髓部细胞具备光合作用的叶绿体[36]。欧洲山毛榉(Fagussylvatica)、橡树(Quercuscoccifera)和白桦(Betulaplatyphylla)等树种的研究也表明,枝条中不仅存在核酮糖-1,5-二磷酸羧化酶/加氧酶,也存在磷酸烯醇式丙酮酸羧化酶等C4途径酶系统[19]。虽然这些研究清楚地表明,叶绿体存在于植物茎组织中,且具有光合功能,但这种光合是何种途径,目前还存在不同看法 (1.4节中讨论)[39]。
光照是光合作用的重要条件。研究表明光照的透射量和光质受到绿色组织外面组织层的厚度、结构、皮孔特点、树皮的湿度,以及枝条的年龄等影响[7,40 ]。光的透射量随着年龄的增长剧减,当年生的小枝木质部甚至髓部可以接受到6%光照,而年老树枝仅能够获得0.1%的光照[16]。多数的研究结果显示树皮的透光率在0—20%之间[9,14]。光照能透过周皮或落皮层进入树干,同时光可在植物茎内的导管、木纤维、管胞和薄壁细胞轴向传导[40]。然而光照是如何透过表皮、绿色组织、韧皮部等进入到更深层木质部中目前还很少资料,深层叶绿体如何利用光源开展光合作用,及其与树干轴向导光和光质的相关性如何,还需要进一步的研究[9]。
CO2也是光合作用必需条件。树干内部CO2主要来源于树干组织(周皮、韧皮部、木栓形成层、木射线等)呼吸产生和液流向上运输(主要包括根活细胞呼吸产生CO2以及根吸收根际间的CO2)[8]。研究表明皮层活细胞可占树干总活细胞的56%,针叶树木射线细胞约占木质部体积的5%—9%,阔叶树占5%—34%,木质部木射线细胞比例随着木质部深度的增加而减少,并且这种活细胞所占比例依不同种类和树干的大小都有较大的变化[23,41]。研究显示,温带针叶和阔叶树的木质部边材可容18%和26%体积的CO2,温带针叶树和阔叶树的心材可容50%和26%体积的CO2[42]。由于树干的外皮层和形成层等组织的不易透气性,树干组织呼吸产生的CO2很难释放到大气中,树干内部形成了高CO2浓度和低氧的环境,其CO2浓度可达到1%—26%,是外界空气的500—800倍,类似C4植物维管束鞘细胞内的环境[14]。树干内部的CO2和O2浓度还随着时间、季节和树种的不同而变化,同时受到树干液流和环境等因素的影响[7-8]。
温度也是光合作用的必要条件。树干温度除主要受到环境温度的影响外,还受到树皮的形态和冠层结构等的影响。例如:密闭的冠层结构能减少树干的光照度,从而降低树干的温度;光滑和薄的皮层比粗糙和厚的树皮温度梯度更小[14];白色的树皮会反射更多的光照,从而使树皮温度更低些[14]。树干温度的变化直接影响树干呼吸作用酶的活性、呼吸速率和CO2气体的扩散系数,也会影响到叶绿体的光合功能。在综合考虑树干的各种环境因素后,Pfanz指出树干光合作用适宜温度约为20—30 ℃[14]。
1.2 皮层光合对树干CO2再固定和释放的作用
自从20世纪初记录有关树皮绿色组织研究以来,许多学者在多个层次上开展了相关研究[8-9,13-14,16]。资料表明最少36科植物具有皮层光合功能[17]。Rosell等统计6个不同气候类型90个树种,其中94%种类的树皮具有光合功能[43]。树干和枝条的主要光合部位在皮层,木射线和髓部的光合速率远比皮层小[16]。例如:去除美洲黑杨(Populusdeltoides)叶片后,液流中的99.6%的14C被叶脉固定[27]。13CO2标记表明,美洲黑杨树干和枝条皮层是固定液流CO2最多的地方,叶片仅固定少量的液流CO2[44]。通常幼枝的光合速率比年老的大,夏季光合速率比冬季大,但也有相反的结果[21,45]。
皮层光合作用是树木组织的重要生理功能,其再循环利用树干内部的CO2,可减少组织器官向外界释放CO2的量,使得植物在C利用上更加经济[8,46]。特别是在胁迫环境下,皮层光合对植物的生存具有重要的作用,如当植物受到水分限制,或受到害虫和病菌危害时,在落叶到重新长叶期间皮层光合作用可改善茎的碳平衡,作为回补碳平衡的一种手段[8,10,13,47-48]。蓝桉(Eucalyptusglobulus)落叶后,其皮层光合作用增强,皮层再固定CO2能力提高(最大可达96%)[47]。对非洲猴面包树(Adansoniadigitata)和蓖麻(Ricinuscommunis)的研究表明,当屏蔽树干光照后其芽的干物质产量明显减少,同时芽和皮层的13C的含量增加,反证了皮层光合作用的存在[49]。对Eucalyptusminiata枝条铝箔遮光4a后其木质部δ13C 增加0.5‰,δ18O也增加0.5‰,研究者通过这些数据推算出非遮光枝条有11%的碳来自皮层光合作用,皮层光合作用平均再固定比率为0.71[46]。另皮层光合作用的放氧过程还可以缓解树干内普遍存在的缺氧状态(组织缺氧症, hypoxia),减少厌氧产生酒精或乳酸毒害[9,14]。
目前技术条件下,树干再固定速率很难独立测定,多数以减少树干CO2排放百分比来表示,即以树干在暗条件下的释放通量和光照条件下的差值比来估算[8]。Teskey等统计44种植物的皮层再固定CO2率在19%—126%之间,黄玮等统计21种在5%—126%(表3)[7-8]。王文杰统计表明树枝的光合速率(暗呼吸与饱和光照下呼吸之差)约在0—10 μmol m-2s-1之间,大多数树干光合作用能够再固定60%—80%呼吸所释放的CO2[9]。任芳菲等通过放氧法测定10种3年生枝条的离体净光速率为0.21—2.06 μmol m-2s-1之间[29]。任芳菲等测定的数值稍偏小,这可能与测定方法不同有关(表3)。5—7年生的美洲山杨年平均可减少树干呼吸损失16%—18%CO2量(24h计),如果只按日间计算可减少29%[50]。夏季美洲山杨树皮光合组织每年可合成59% CO2呼吸量,在个体水平上,树皮每年能提供约10%—15%碳[48]。树枝(干)和叶片的光合速率对比研究表明幼嫩树干的瞬间光合速率可以达到叶片光合速率的8%—19%[51]。可见,不同种类不同地域的植物皮层光合速率(再固定率)差异较大,同一种类在不同季节其再固定率也不同。
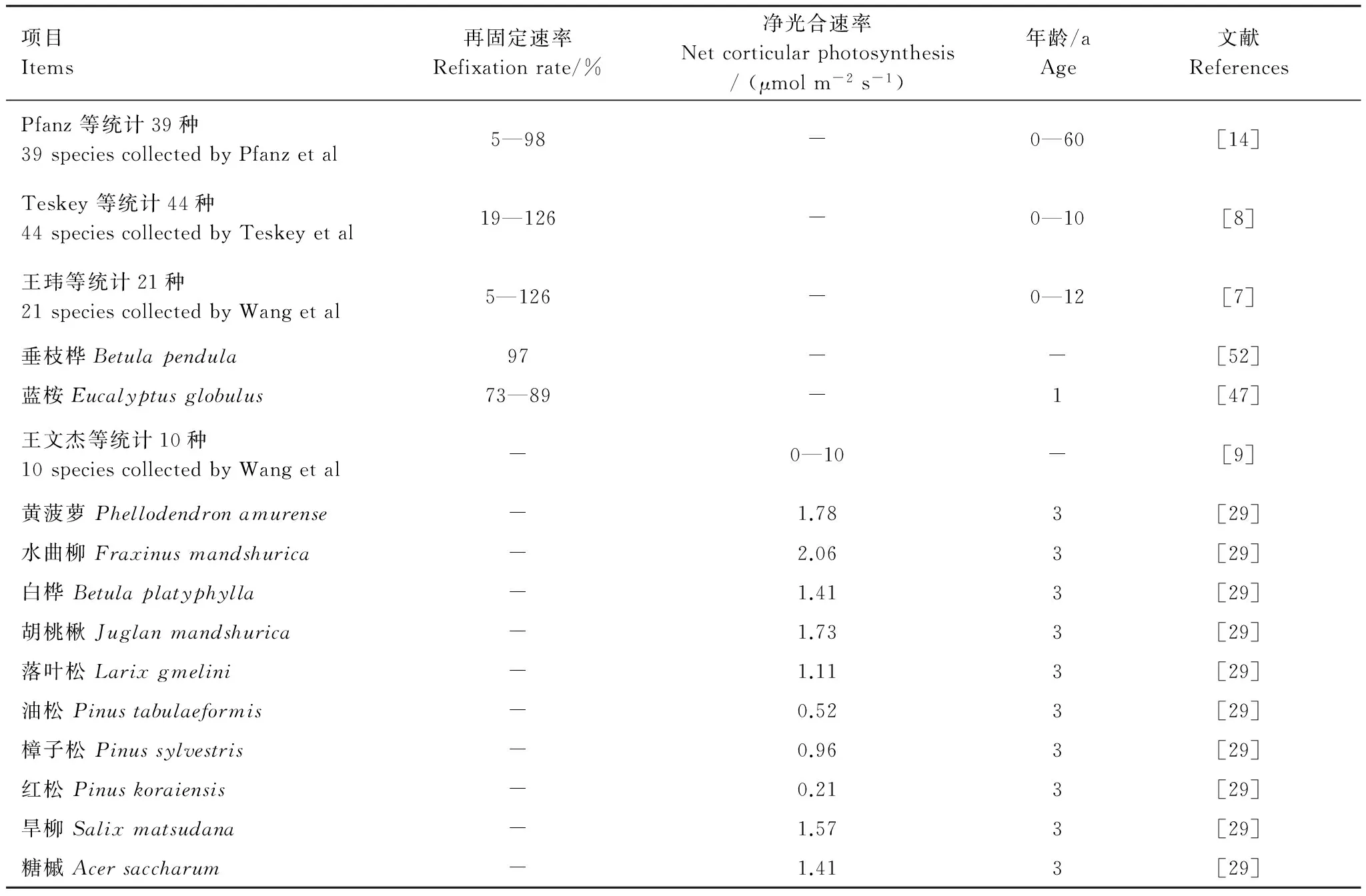
表3 树干皮层再固定CO2率和净光合速率Table 3 Reported values of stem CO2 refixation rates and Net corticular photosynthesis
由于皮层光合的再固定作用,从而减少树干向大气释放CO2量。有资料显示皮层光合作用可减少树干向大气排放50%—100%,甚至大于100%的CO2量[8]。皮层光合作用固定CO2量可补偿60%—90%呼吸造成的潜在碳损失,有时可超过其CO2释放量[8,45]。但通过13C标记发现只有约6%—17%的标记碳被枝条和叶柄绿色组织光合利用,其余大部都释放到大气中[44]。由此可见,皮层光合对树干CO2再固定和释放的作用存在着个体和种间的差异,并与测定的季节和方法有关,现有的技术条件还很难准确地区分树干呼吸的各个分量。
1.3 树干液流对树干CO2释放通量和皮层光合作用影响
树干液流密度通过改变树干木质部液流中的CO2浓度,改变树干韧皮部和形成层的代谢活动等从而影响树干CO2释放通量和皮层光合作用。白天树干液流密度较高时,树干组织呼吸产生大量CO2随着树干液流向上运输,导致局部测定法测定树干呼吸的数值夜间高白天低。另外,由于土壤溶液和根木质部液流CO2浓度低于树干液流CO2浓度,白天树干液流具稀释作用,也可导致白天树干CO2释放通量比晚上小[7,53-54]。另一方面,由于白天冠层蒸腾作用的影响,韧皮部和形成层等细胞因缺水膨压下降,其细胞的代谢活动也下降,夜间通过根吸水和树干贮水,水分回流到韧皮部和形成层,因而树干代谢活动增强,从而导致夜间树干CO2释放通量增大[7,55]。
Levy等研究指出液流与树干呼吸之间存在正相关关系,对呼吸的影响可以占呼吸速率高峰值的12%,液流中CO2的运输速度可以达到0.03—0.035 mol m-2s-1,皮层光合相当于叶片光合作用的0.5%—7.1%[56]。Angert等通过测定O2气法估算约有40%的CO2溶解在液流中,这部分溶解的CO2被是树干光合或随着液流向上运输[57]。在野外或控制温度条件下的树干液流速率与木质部液流CO2浓度有很好的负耦合关系,当晚上(雨天或去掉树叶后)树干液流逐渐减少时,木质部的CO2浓度随之上升,当白天液流上升时刚好有相反的结果,木质部的CO2浓度随之下降[24,58]。在校正液流运输CO2量后,24H有66%的活细胞呼吸产生的CO2被扩散到大气中[8]。对木荷(Schimasuperba)的研究显示白天树干液流密度明显影响树干CO2释放通量,二者显著负相关,并且由于液流的影响,树干CO2释放通量对树干温度的敏感性会下降[22]。可见,由于树干液流运输CO2的作用,引起树木组织的CO2含量发生变化,从而导致皮层光合和树干CO2释放通量的改变,同时也影响到它们与其它环境因子的关系。
1.4 皮层光合的其它重要生理特性
有关皮层光合作用的途径目前还没有一致的结论。有研究认为树皮绿色组织和其叶片一样是C3光合途径,有些研究则认为典型的C3叶片植物的茎和叶柄绿色组织存在C4光合碳固定途径[20,33,39]。早期Nilsen认为CAM植物的叶片多是C3途径,但其茎光合多为CAM途径,其它植物茎光合为C3途径[9,17]。Bervieler等通过欧洲山毛榉树皮组织的光合酶动力学特性测定,认为其光合途径为C3途径[19]。Ivanov等对欧洲赤松C4酶的研究认为树皮绿色组织可能和其叶片一样是C3光合途径[59]。后来有些研究显示树干皮层光合途径介于C3和C4之间,或类似于C4的途径[60],如毛竹茎光合色素含量以及光合酶活性类似于C4光合途径[38],烟草(Nicotianatabacum)和芹菜(Apiumgraveolens)的茎也存在类似C4光合途径的特征[20,38]。Wang等对杨树(Populusalba×P.berolinensis)枝和树皮等绿色组织的色素和光合酶研究表明,盐碱胁迫能够调节C3木本植物树皮、树枝和叶片内C4相关酶的活性,通过C4酶识别植物光合途径时,需考虑环境规律和单位表达方式的差异[21]。因此,不同种类树干皮层光合途径可能不同,同时环境因子也可能会影响皮层光合途径。虽然某些研究证明皮层光合有区别于C3途径的特征,但是这种特征并不是典型的C4途径特征,且直接的证据并不多,今后还需要更多更深入的研究[9]。

皮层光合在利用资源和产物分配等方面的研究目前还很少。同位素示踪栎树(Quercusgeminata)实验发现,尽管在一个生长季内地上部分的13C水平就能与外界空气的13C相平衡,但是地下生物量整合这一新13C的过程却异常缓慢,根系取样发现33%的新形成根系并不是新近形成的光合产物所形成的[9,63]。对植物遮光处理表明树皮的皮层光合产物对芽,甚至新叶的发育有贡献,同时皮层光产物对整个植物的碳平衡有重要作用[47,49,64]。根据光合产物的形成时间和储藏状态,可以分为新形成碳水化合物和储藏碳水化合物,或者根据光合产物形成的部位不同,可以分为叶片形成的光合产物和非叶片形成的光合产物。这些光合产物的差异可能会影响到其它器官,包括根系、树干呼吸等特征[9]。
2 皮层光合作用的测定方法
目前对于如何测定皮层光合作用并没有标准方法。当前技术条件下,树干再固定速率很难独立测定,应用最多的方法是以减少树干CO2排放百分比来表示,即树干在暗条件下的释放通量和光照条件下释放通量的差占暗条件下释放通量的百分比来估算[8]。因此,树干呼吸的测定方法在很大程度上就是皮层光合作用的测定方法。
2.1 CO2气体交换法
树干呼吸的测定方法有多种,目前应用最多的是气体交换法。这种方法通常在树干(枝)一定部位(或全部)的表面借助仪器或装置形成一个封闭的气室,测定该气室的CO2通量[23]。CO2通量的测定可用碱液直接吸收,气相色谱仪,或连接CO2气体分析仪等方法测定。这种气体交换法又可根据气路结构的不同分为开路系统和闭路系统,或根据样品分为离体测定法和原位测定法(活体测定法),具体方法可参阅王文杰等的论述[28]。特别是原位气体交换法不伤害组织,操作简便经济,并可对同一样品进行连续快速的重复测定,测定的结果往往可信度较高,也是当今研究的主流方法[28],但这种气体交换法必需依赖于气室取样,其弊端在于气室内微气候会发生改变,不适于长期测定,也很难应用于高大的整株乔或大范围长时间连续的测量[65]。当然,离体法也有其优点,可测定不同组织(如韧皮部、皮材和心材等)的呼吸CO2释放量和光合量,这点目前原位测定还无法做到。

图1 树干内部CO2的源和汇图解[8] Fig.1 Schematic of important sources and sinks of CO2 inside a stem segment of a tree[8] 1. CO2从内皮层(1a)、形成层(1b)、木射线细胞(1c)和液流运移过程(1d)向外扩散;2. 皮层光合作用固定CO2(CO2来源于a、b、c、d等部位);3. CO2扩散到液流中并随液流向上运输(3a、3b、3c)
2.2 改良质量平衡法
质量平衡法也是基于气体交换法,它把气体交换法与树干体内CO2测定,以及液流速率测定等方法组合,从而更准确地估算树干呼吸的方法。以前人们认为木质组织呼吸产生的CO2几乎立即释放到大气中,假定局部释放CO2的通量起源于相应组织的呼吸,组织的呼吸速率与通过树皮释放出的CO2通量相等[8]。基于这种理论的认识采用局部质量法测定的结果差别很大[23,66- 68]。新的研究显示树木内部CO2以多种形式存在,且树木内部的CO2来源至少包括树木组织本身产生的CO2,和木质部液流从更低部位向上运输的CO2(包括根系从土壤中吸收的CO2)[8]。这两个来源的CO2混合在一起后,有一部分被树干释放到大气中(称为树干CO2释放通量),一部分被皮层叶绿体光合利用(称为皮层光合作用),一部分继续随液流传输到更高的部位(称为液流运输通量),还有部分以气态形式存留树干中(称为树干储存通量)(图1)[5,7,23]。基于这种新的认识,McGuire等提出了考虑树干CO2所有通量的质量平衡假说和质量平衡测定法[5],毛子军等曾将该理论介绍到国内[23]。该理论认为,树干的呼吸量是树皮的CO2释放通量与液流中溶解的CO2和一定时间内液流中CO2浓度的平均升高或降低量(储存通量)之和:
Rs=EA+FT+ΔS
(1)
式中,Rs为该段树干的呼吸速率(μmol m-2s-1),即单位体积木本组织单位时间呼吸产生的CO2;EA为树干表面积的树皮释放的CO2释放通量(μmol m-2s-1),FT为运移通量(μmol m-2s-1);ΔS为一定时间内液流中CO2浓度的平均升高或降低量(储存通量) (μmol m-2s-1)(图2)。
通过公式(1)的各分量测量,能较好地估算树干的呼吸量,但这公式还无法解释树干直径的影响以及液流运输CO2浓度梯度等问题。因此,Bowman等对此公式修正为[27]:
Rs=β× EA+FT+ΔS
(2)
式中,β为树干表面积(m2)与边材体积(m3)比,EA,FT,ΔS与上面相同。
与McGuire等的质量平衡方程相比,Bowman等的新方程(2)对Rs的估算不仅考虑了边材的体积,还考虑到了树干表面积与边材体积之比对树干CO2的影响。然而其方法计算树干呼吸分配时仍然把皮层光合作用对呼吸的影响归到树干CO2储存通量(ΔS)中。根据相关的研究结果[8-9,16,22-23],该计算方法依然不够完善,无法解释当液流CO2达到饱和时,树干液流仍可输送CO2的机理,同时计算树干液流CO2浓度垂直分布时会产生很大的误差。因此,需要将ΔS进一步分解为:
ΔS=ΔSS+Pc
(3)

图2 树干内部和向外输出CO2通量的概念模式(根据文献[20]改编) Fig.2 Conceptual model of CO2 flux from and within a stem segment (modified after reference [20])EA: 树干表面积的树皮释放的CO2释放通量;ET: CO2流出量;CO2流入通量IT;ΔS: 储存通量,ΔSS: 真正的树干CO2储存通量,Pc: 皮层光合作用通量
这里ΔSS为真正的树干CO2储存通量,一定时间内液流中CO2浓度的平均升高或降低量,Pc为皮层光合作用通量(图2)。
把ΔS分解后,ΔSS才是真正与液流和树干体积相关的储存通量,Pc则与树干的光合表面积相关的皮层光合作用通量。修正后的结果可以减少树干液流CO2垂直梯度计算的误差,也解决了当液流CO2达到饱和时树干液流仍可输送CO2的问题。由于Pc能够用仪器直接测出,因此可减少树干呼吸计算的不确定性。

图3 树干呼吸测定装置示意图Fig.3 A device of Stem respiration measurement 1: 液流探针sapflow sensor;2,5,8: 温度传感器temperature sensor;3: 出气管 gas outlet;4,9: CO2传感器 CO2 sensor,6: 辐射传感器 PAR sensor;7: 气室 gas chamber;10: 气体缓冲瓶 gas inlet buffer bottle
根据以上的修正,我们设计了一套用于野外测定的装置(图3)。测定系统由气室和红外CO2分析仪、热扩散式探针、固态非色散红外CO2传感器、微型有效光合辐射仪和热电偶等组成。本系统可在野外自然状况下实时同步测定树干CO2释放通量、树干液流、树干温度、树干接收光照强度和树干木质部CO2浓度的数据。可计算出树干的皮层光合作用强度,树干的CO2呼吸通量,树干液流运输CO2通量,树干CO2贮存通量。这样可将树干液流、木质部CO2浓度和皮层光合作用三者进行有机整合来研究树干呼吸产生CO2的分配,克服以往3个环节单独分开研究而无法建立相关关系的缺点。当然由于这种方法还是基于气体交换测量CO2的方法,仍然无法测量组织内的PEP羧化酶合成苹果酸途径对CO2的影响。
2.3 同位素标记法
稳定同位素技术具有示踪、整合和指示等多项功能,及其检测快速、结果准确等特点,常应用在生态系统中研究生物与环境的关系,整合不同时间和空间尺度生态过程与机制。目前,利用稳定碳同位素技术研究植物个体与环境的关系,探讨生态系统的气体交换机制,特别是土壤呼吸方面已有较多的报道[28,65]。同位素标记技术在树干呼吸、皮层光合作用以及树干液流研究中的应用难度较大,如何将标记同位素CO2导入液流中一直是难点。目前有两种方法,一种是在野外树干基部直接注入13CO2溶液的方法来量化示踪树干液流中的CO2去向[44,69]。另一种是用离体枝条基部放进预先制好的13CO2溶液中,通过改变VPD来调节蒸腾速率等方法研究树干液流中的CO2去向[70]。这两种方法思路一致,都是向树干液流中导入溶解有标记的13CO2溶液后,研究它们在植物体被光合、运输和释放的过程。这种方法具有成本低、相对简单、便于野外操作等特点,同时能较好地区分碳在树干内的分配和内循环过程,也可甄别呼吸作用对新形成碳水化合物和储藏碳水化合物资源利用情况[69]。但是植物皮层光合作用可能存在同位素生化分馏,目前尚不清楚植物皮层光合的生化分馏会导致多大程度的重同位素富集或亏损。当然还有其它的同位素技术,如Ubierna等提出的树干闭路平衡气室方法,这种方法能更简便准确地测定树干呼吸CO2δ13C的比值,减少非平衡气室法带来的误差,但该方法需(15±2) h的平衡时间,不能测定快速变化以及树干受伤有丰富树脂的种类[71]。另还有14C、11C等技术和方法,Epron等已作过详细的介绍[72]。在生态系统水平上,Wingate等采用的激光稳定同位素分析仪基于可调谐式二极管激光器的吸收光谱法结合涡度协方差技术和树干液流技术测量森林生态系统碳同位素组分,这种方法能较好地在林分水平上测定CO2同位素甄别[73],具有广阔的应用前景,但这种测定系统复杂,成本高。
3 问题与展望
皮层光合作用是植物长期进化过程中保留下来的古老功能。皮层光合过程中皮孔不参与活动,不会导致水分散失,同时木质部内部高的CO2浓度和低的光呼吸,CO2浓度是非限制因子,它是树干内部CO2再固定、释放等内循环过程的重要部分[8]。皮层光合作用可以减少维持和构建木材所需要的叶片光合产物供应,减少器官呼吸向外界释放CO2,使植物在C利用上更加经济,是叶片光合的重要补充[4,9,16]。特别是在受到环境胁迫时植物再循环利用呼吸释放出来的CO2,有助于植物延长生命[12]。
由于与皮层光合作用相关的生理生态因素十分复杂,皮层光合作用与树干呼吸和液流速率之间的关系和机制还不清楚,很多问题还需深入研究,主要有如下几个方面:1) 皮层光合作用的测定在理论和方法上还存在很多尚未解决的难题。目前树干呼吸和光合作用的测定有诸多困难,其主要原因是树干内部的CO2来源复杂,不同深度的CO2浓度也不相同,并且还没有方法能准确区分CO2来源各个组分的比例。如何简捷准确地测定树干内部各组分的CO2浓度,以及不同深度的CO2浓度,方便快速地计算皮层光合作用,目前还没有理想的技术支持。2) 溶解在液流中CO2最终去向何处?它能否进入叶片组织?或者在到达叶片之前就释放到大气中,还是被树干(枝)绿色组织同化?如果溶解于液流中的CO2运输到叶片并被叶片同化,那么当前CO2气体交换方法测定的叶片光合速率可能被低估了。3)皮层光合作用的光合途径是何种类型?其光合产物如何在液流中运输?其光合产物对植物的生长有何影响等等目前都还不了解。4)树干内部CO2的产生、运输和释放的过程和机理我们了解得还很不够。在树干内部CO2内循环过程中,树干(枝)组织结构以及外界环境因素如温度、光照、pH值等对CO2内循环的影响也还不清楚。
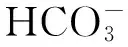
[1] Dixon R K, Solomon A M, Brown S, Houghton R A, Trexier M C, Wisniewski J. Carbon pools and flux of global forest ecosystems. Science, 1994, 263(5144): 185- 190.
[2] Larcher W. Physiological Plant Ecology. New York: Springer, 2003.
[3] Damesin C, Ceschia E, Goff N L, Ottorini J M, Dufrêne E. Stem and branch respiration of beech: from tree measurements to estimations at the stand level. New Phytologist, 2002, 153(1): 159- 172.
[4] Cernusak L A, Hutley L B, Beringer J, Tapper N J. Stem and leaf gas exchange and their responses to fire in a north Australian tropical savanna. Plant, Cell & Environment, 2006, 29(4): 632- 646.
[5] McGuire M A, Teskey R O. Estimating stem respiration in trees by a mass balance approach that accounts for internal and external fluxes of CO2. Tree Physiology, 2004, 24(6): 571- 578.
[6] 严玉平, 沙丽清, 曹敏. 西双版纳热带季节雨林优势树种树干呼吸特征. 植物生态学报, 2008, 32(1): 23- 30.
[7] 黄玮, 朱锦懋, 阮宏华, 黄儒珠, 王健, 郑怀舟. 树干CO2释放速率影响因素研究进展. 生态学杂志, 2010, 29(4): 790- 797.
[8] Teskey R O, Saveyn A, Steppe K, McGuire M A. Origin, fate and significance of CO2in tree stems. New Phytologist, 2008, 177(1): 17- 32.
[9] 王文杰, 祖元刚, 王慧梅. 林木非同化器官树枝(干)光合功能研究进展. 生态学报, 2007, 27(4): 1583- 1595.
[10] Pfanz H. Bark photosynthesis. Trees, 2008, 22(2): 137- 138.
[11] Schaedle M, Brayman A A. Ribulose- 1,5- bisphosphate carboxylase activity ofPopulustremuloidesMichx. bark tissues. Tree Physiology, 1986, 1(1): 53- 56.
[12] Pfanz H, Aschan G. The existence of bark and stem photosynthesis in woody plants and its significance for the overall carbon gain. An eco-physiological and ecological approach. Progress in Botany, 2001, 62: 477- 510.
[13] Schaedle M. Tree photosynthesis. Annual Review of Plant Physiology, 1975, 26: 101- 115.
[14] Pfanz H, Aschan G, Langenfeld H R, Wittmann C, Loose M. Ecology and ecophysiology of tree stems: corticular and wood photosynthesis. Naturwissenschaften, 2002, 89(4): 147- 162.
[15] Schmidt J, Batic F, Pfanz H. Photosynthetic performance of leaves and twigs of evergreen holly (IlexaquifoliumL.). Phyton, 2000, 40(1): 179- 190.
[16] Aschan G, Pfanz H. Non-foliar photosynthesis-a strategy of additional carbon acquisition. Flora, 2003, 198: 81- 97.
[17] Nilsen E T. Stem photosynthesis extent, patterns and role in plant carbon economy // Gartner B. Plant Stems: Physiology and Functional Morphology. San Diego: Academic Press, 1995: 223- 240.
[18] Muthuchelian K. Photosynthetic characteristics of bark tissues of the tropical treeBombaxceibaL. Photosynthetica, 1992, 26: 633- 636.
[19] Berveiller D, Vidal J, Deqrouard J, Ambard-Bretteville F, Pierre J N, Jaillard D, Damesin C. Tree stem phosphoeno/pyruvate carboxylase (PEPC): lack of biochemical and localization evidence for a C4-like photosynthesis system. New Phytologist, 2007, 176(4): 775- 781.
[20] Hibberd J M, Quick W P. Characteristics of C4photosynthesis in stems and petioles of C3flowering plants. Nature, 2002, 415(6870): 451- 454.
[21] Wang H M, Wang W J, Wang H Z, Wang Y, Xu H N, Zu Y G. Effect of inland salt-alkaline stress on C4enzymes, pigments, antioxidant enzymes, and photosynthesis in leaf, bark, and branch chlorenchyma of poplars. Photosynthetica, 2013, 51(1): 115- 126.
[22] 朱丽薇, 赵平, 蔡锡安, 曾小平, 邹绿柳. 荷木树干CO2释放通量与木质部液流和CO2浓度的关系. 生态学杂志, 2009, 28(11): 2227- 2232.
[23] 毛子军, 王秀伟, 赵甍. 质量平衡法估测树干呼吸的理论与应用. 林业科学, 2007, 43(10): 106- 111.
[24] Teskey R O, McGuire M A. Carbon dioxide transport in xylem causes errors in estimation of rates of respiration in stems and branches of trees. Plant, Cell & Environment, 2002, 25(11): 1571- 1577.
[25] Lavigne M B, Franklin S E, Hunt E R J. Estimating stem maintenance respiration rates of dissimilar balsam fir stands. Tree Physiology, 1996, 16(8): 687- 695.
[26] Ryan M G, Lavigne M B, Gower S T. Annual carbon cost of autotrophic respiration in boreal forest ecosystems in relation to species and climate. Journal of Geophysical Research, 1997, 102(D24): 28871- 28883.
[27] Bowman W P, Barbour M M, Turnbull M H, Tissue D T, Whitehead D, Griffin K L. Sap flow rates and sapwood density are critical factors in within- and between-tree variation in CO2efflux from stems of matureDacrydiumcupressinumtrees. New Phytologist, 2005, 167(3): 815- 828.
[28] 王文杰. 林木非同化器官CO2通量的测定方法及对结果的影响. 生态学报, 2004, 24(9): 2056- 2067.
[29] 任芳菲, 孙广玉, 胡彦波, 樊传辉, 蔡淑燕. 几种树木的树皮中绿色组织的光合特性初探. 植物生理学通讯, 2009, 45(3): 249- 252.
[30] Dima E, Manetas Y, Psaras G K. Chlorophyll distribution pattern in inner stem tissues: evidence from epifluorescence microscopy and reflectance measurements in 20 woody species. Trees, 2006, 20(4): 515- 521.
[31] Levizou E, Manetas Y. Photosynthetic pigment contents in twigs of 24 woody species assessed by in vivo reflectance spectroscopy indicate low chlorophyll levels but high carotenoid/chlorophyll ratios. Environmental and Experimental Botany, 2007, 59(3): 293- 298.
[32] Girma A, Skidmore A K, Bie C A J M, Bonngers F, Schlerf M. Photosynthetic bark: Use of chlorophyll absorption continuum index to estimateBoswelliapapyriferabark chlorophyll content. International Journal of Applied Earth Observation and Geoinformation, 2013, 23: 71- 80.
[33] 王莹, 王文杰, 许慧男, 郑广宇, 孙伟, 祖元刚. 3 种C3木本植物绿色组织C4酶活性、色素含量及叶绿素荧光参数的比较. 植物研究, 2011, 31(4): 461- 466.
[34] Saveyn A, Steppe K, Ubierna N, Dawson T E. Woody tissue photosynthesis and its contribution to trunk growth and bud development in young plants. Plant, Cell & Environment, 2010, 33(11): 1949- 1958.
[35] Buns R, Acker G, Beck E. The plastids of the Yew Tree (TaxusbaccataL.): ultrastructure and immunocytochemical examination of chloroplastic enzymes. Botanica Acta, 1993, 106(1): 32- 41.
[36] Cleve B V, Forreiter C, Sauter J J, Apel K. Pith cells of poplar contain photosynthetically active chloroplasts. Planta, 1993, 89: 70- 73.
[37] Langenfeld-Heyser R. CO2fixation in stem slices ofPiceaabies( L). Karst: microautoradiographic studies. Trees, 1989, 3(1): 24- 32.
[38] 王星星, 刘琳, 张洁, 王玉魁, 温国胜, 高荣孚, 高岩, 张汝民. 毛竹出笋后快速生长期内茎杆中光合色素和光合酶的变化. 植物生态学报, 2012, 36(5): 456- 462.
[39] 王文杰, 许慧男, 王莹, 于兴洋, 郑广宇, 祖元刚. 盐碱地土壤改良对银中杨叶片、树枝和树皮绿色组织色素和C4光合酶的影响. 植物研究, 2010, 30(3): 299- 304.
[40] Sun Q, Yoda K, Suzuki M, Suzuki H. Vascular tissue in the stem and roots of woody plants can conduct light. Journal of Experimental Botany, 2003, 54(378): 1627- 1635.
[41] Ceschia E, Damesin C, Lebaube S, Pontailler J Y, Dufrene E. Spatial and seasonal variations in stem respiration of beech trees (Fagussylvatica). Annals of Forest Science, 2002, 59(8): 801- 812.
[42] Gartner B L, Moore J R, Gardiner B A. Gas in stems: abundance and potential consequences for tree biomechanics. Tree Physiology, 2004, 24(11): 1239- 1250.
[43] Rosell J A, Gleason S, Mendez-Alonzo R, Chang Y, Westoby M. Bark functional ecology: evidence for tradeoffs, functional coordination, and environment producing bark diversity. New Phytologist, 2014, 201(2): 486- 497.
[44] Bloemen J, McGuire M A, Aubrey D P, Teskey R O, Steppe K. Transport of root-respired CO2via the transpiration stream affects aboveground carbon assimilation and CO2efflux in trees. New Phytologist, 2013, 197(2): 555- 565.
[45] Aschan G, Wittmann C, Pfanz H. Age-dependent bark photosynthesis of aspen twigs. Trees, 2001, 15(7): 431- 437.
[46] Cernusak L A, Hutley L B. Stable isotopes reveal the contribution of corticular photosynthesis to growth in branches ofEucalyptusminiata. Plant Physiology, 2011, 155(1): 515- 523.
[47] Eyles A, Pinkard E A, O′Grady A P, Worledge D, Warren C R. Role of corticular photosynthesis following defoliation inEucalyptusglobulus. Plant, Cell & Environment, 2009, 32(8): 1004- 1014.
[48] Foote K C, Schaedle M. The contribution of aspen bark photosynthesis to the energy balance of the stem. Forest Science, 1978, 24(4): 569- 573.
[49] Simbo D J, Bilcke N V D, Samson R. Contribution of corticular photosynthesis to bud development in African baobab (AdansoniadigitataL.) and Castor bean (RicinuscommunisL.) seedlings. Environmental and Experimental Botany, 2013, 95: 1- 5.
[50] Foote K C, Schaedle M. Diurnal and seasonal patterns of photosynthesis and respiration by stems ofPopulustremuloidesMichx. Plant Physiology, 1976, 58(5): 651- 655.
[51] Wittmann C, Aschan G, Pfanz H. Leaf and twig photosynthesis of young beech (Fagussylvatica) and aspen (Populustremula) trees grown under different light regime. Basic and Applied Ecology, 2001, 2(2): 145- 154.
[52] Wittmann C, Pfanz H, Loreto F, Centritto M, Pietrini F, Alessio G. Stem CO2release under illumination: corticular photosynthesis, photorespiration or inhibition of mitochondrial respiration. Plant, Cell and Environment, 2006, 29(6): 1149- 1158.
[53] Teskey R O, McGuire M A. Measurement of stem respiration of sycamore (PlatanusoccidentalisL.) trees involves internal and external fluxes of CO2and possible transport of CO2from roots. Plant, Cell and Environment, 2007, 30(5): 570- 579.
[54] Moore D J P, Miquel A, Mele G, Taneva L, Pippen J S, Kim H S, DeLucia E H. The effect of carbon dioxide enrichment on apparent stem respiration fromPinustaedaL. is confounded by high levels of soil carbon dioxide. Oecologia, 2008, 158(1): 1- 10.
[55] Saveyn A, Steppe K, McGuire M A, Lemeur R, Teskey R O. Stem respiration and carbon dioxide efflux of youngPopulusdeltoidestrees in relation to temperature and xylem carbon dioxide concentration. Oecologia, 2008, 154(4): 637- 649.
[56] Levy P E, Meir P, Allen S J, Jarvis P G. The effect of aqueous transport of CO2in xylem sap on gas exchange in woody plants. Tree Physiology, 1999, 19(1): 53- 58.
[57] Angert A, Sherer Y. Determining the relationship between tree-stem respiration and CO2efflux byδO2/Ar measurements. Rapid Communication in Mass Spectrometry, 2011, 25(12): 1752- 1756.
[58] McGuire M A, Cerasoli S, Teskey R O. CO2fluxes and respiration of branch segments of sycamore (PlatanusoccidentalisL.) examined at different sap velocities, branch diameters, and temperatures. Journal of Experimental Botany, 2007, 58(8): 2159- 2168.
[59] Ivanov A G, Krol M, Sveshnikov D, Malmberg G, Gardestrom P, Hurry V Oquist G, Huner N P A. Characterization of the photosynthetic apparatus in cortical bark chlorenchyma of Scots pine. Planta, 2006, 223(6): 1165- 1177.
[60] Berveiller D, Damesin C. Carbon assimilation by tree stems: potential involvement of phosphoenolpyruvate carboxylase. Trees, 2008, 22(2): 149- 157.
[61] 罗红艺. 光合碳同化中的两个重要酶RuBP羧化酶和PEP羧化酶. 高等函授学报: 自然科学版, 1999, (3): 49- 52.
[62] Trumbore S E, Angert A, Kunert N, Muhr J, Chambers J Q. What′s the flux? Unraveling how CO2fluxes from trees reflect underlying physiological processes. New Phytologist, 2013, 197(2): 353- 355.
[63] Langley J, Drake B G, Hungate B. Extensive belowground carbon storage supports roots and mycorrhizae in regenerating scrub oaks. Oecologia, 2002, 131(4): 542- 548.
[64] Wittmann C, Pfanz H. Antitranspirant functions of stem periderms and their influence on corticular photosynthesis under drought stress. Trees, 2008, 22(2): 187- 196.
[65] 马晔, 刘锦春.δ13C在植物生态学研究中的应用. 西北植物学报, 2013, 33(7): 1492- 1500.
[66] 曾小平, 彭少鳞, 赵平. 广东南亚热带马占相思林呼吸量的测定. 植物生态学报, 2000, 24(4): 420- 424.
[67] Matyssek R, Goerg M S G, Maurer S, Christ R. Tissue structure and respiration of stems ofBetulapendulaunder contrasting ozone exposure and nutrition. Trees Structure and Function, 2002, 16(6): 375- 385.
[68] 姜丽芬, 石福臣, 祖元刚, 王文杰, 小池孝良. 不同年龄兴安落叶松树树干呼吸及其与环境因子关系的研究. 植物研究, 2003, 23(3): 296- 301.
[69] Powers E M, Marshall J D. Pulse labeling of dissolved13C-carbonate into tree xylem: developing a new method to determine the fate of recently fixed photosynthate. Rapid Communication in Mass Spectrometry, 2011, 25(1): 33- 40.
[70] Bloemen J, McGuire M A, Aubrey D P, Teskey R O, Steppe K. Assimilation of xylem-transported CO2is dependent on transpiration rate but is small relative to atmospheric fixation. Journal of Experimental Botany, 2013, 64(8): 2129- 2138.
[71] Ubierna N, Marshall J D, Cernusak L A. A new method to measure carbon isotope composition of CO2respired by trees: stem CO2equilibration. Functional Ecology, 2009, 23(6): 1050- 1058.
[72] Epron D, Bahn M, Derrien D, Lattanzi F A, Pumpanen J, Gessler A. HÖgberg P, Maillard P, Dannoura M, Gérant D, Buchmann N. Pulse-labelling trees to study carbon allocation dynamics: a review of methods, current knowledge and future prospects. Tree Physiology, 2012, 32(6): 776- 798.
[73] Wingate L, Oge′e J, Burlett R, Bosc A, Devaux M, Grace J, Loustau D, Gessler A. Photosynthetic carbon isotope discrimination and its relationship to the carbon isotope signals of stem, soil and ecosystem respiration. New Phytologist, 2010, 188(2): 576- 589.
[74] 蒋春云, 马秀灵, 沈晓艳, 李燕, 赵彦修. 植物碳酸酐酶的研究进展. 植物生理学报, 2013, 49(6): 545- 550.
[75] Wang M, Guan D X, Han S J, Wu J L. Comparison of eddy covariance and chamber-based methods for measuring CO2flux in a temperate mixed forest. Tree Physiology, 2010, 30(1): 149- 163.
[76] Damesin C. Respiration and photosynthesis characteristics of current-year stems ofFagussylvatica, from the seasonal pattern to an annual balance. New Phytologist, 2003, 158(3): 465- 475.
[77] Levy P E, Jarvis P G. Stem CO2fluxes in two sahelian shrub species (GuierasenegalensisandCombretummicranthum). Functional Ecology, 1998, 12(1): 107- 116.
[78] Cernusak L A, Marshall J D. Photosynthetic refixation in branches of western white pine. Functional Ecology, 2000, 14(3): 300- 311.
[79] Ryan MG. Growth and maintenance respiration in stems ofPinuscontortaandPiceaengelmanii. Canadian Journal of Forestry Research, 1990, 20(1): 48- 57.
[80] Hansen L D, Hopkin M S, Rank D R, Anekonda T S, Breidenbach R W, Criddle R S. The relation between plant growth and respiration: a thermodynamic model. Planta, 1994, 194(1): 77- 85.
[81] Reich P B, Tjoelker M G, Pregitzer K S, Wright I J, Oleksyn J, Machado J L. Scaling of respiration to nitrogen in leaves, stems and roots of higher land plants. Ecology Letters, 2008, 11(8): 793- 801.
[82] Jagermeyr J, Gerten D, Lucht W, Hostert P, Migliavacca M, Nemani R. A high-resolution approach to estimating ecosystem respiration at continental scales using operational satellite data. Global Change Biology, 2014, 20(4): 1191- 1210.
[83] 郑秋红, 王兵. 稳定性同位素技术在森林生态系统碳水通量组分区中的应用. 林业科学研究, 2009, 22(1): 109- 114.
Stem corticular photosynthesis: ecophysiological functions and their measurement
CAI Xi′an1,*, ZENG Xiaoping1, CHEN Yuanqi1,2
1KeyLaboratoryofVegetationRestorationandManagementofDegradedEcosystems,SouthChinaBotanicalGarden,ChineseAcademyofSciences,Guangzhou510650,China
2UniversityofChineseAcademyofSciences,Beijing100049,China
It is currently widely accepted that, aside from green leaves, other plant organs are able to assimilate carbon via the reductive carboxylic acid cycle. Branches, stems, and even roots often have chloroplast-containing cells. The bark of some trees contains up to 750 mg/m2of chlorophyll. Photosynthetic activity in trees, bushes, and shrubs has been recorded in the living bark of young twigs, branches and main stems, in addition to the living cells of wood, and sometimes even in the pith. Chlorophyll-containing bark and wood tissue are principally subordinated to non-photosynthetic functions, but typically perform effective internal CO2recycling using CO2released from respiration. Chloroplast-containing tissues may re-fix 60%—90% of internal CO2that has respired from woody tissues or has been transported from xylem sap. Many different terms are used to describe “nonfoliar” CO2fixation in twigs, branches, and stems; including, bark photosynthesis, corticular photosynthesis, chlorenchymal CO2-reduction, stem-internal CO2-fixation, chlorenchymal CO2-refixation, and stem photosynthesis. It is hypothesized that corticular photosynthesis is driven by stem-internal CO2derived from mitochondrial respiration and maybe also gaseous xylem efflux. Corticular photosynthesis is an essential physiological process in the trunk that positively contributes to total plant carbon, due to its close relationship with stem respiration and sap flow. First, our review summarized the main physiological and ecological functions of corticular photosynthesis. As corticular photosynthesis works in the same way as leaf photosynthesis, photosynthetic carbon reduction is driven by a combination of effective chloroplast structure, essential enzymatic functions, water, light, and carbon dioxide. We showed that these main factors are present in sufficient quantities within the chlorenchymal bark tissues of trees. Corticular photosynthesis, sap flux velocity, and the CO2concentration of xylem sapwood all influence stem CO2efflux. Observations of the relationship between sap flux and CO2efflux may help explain why CO2efflux changes with stand age or tree size, in addition to differences between similar trees growing in different environments. Second, we described the principal methods used to measure and calculate corticular photosynthesis. It is now evident that standard measurements of CO2efflux to the atmosphere, such as a flux chamber covering a segment of tree stem to estimate the rate of woody tissue respiration, do not adequately account for internal fluxes in CO2. The new mass balance approach of measuring corticular photosynthesis may provide a more accurate way of estimating the rate of woody tissue respiration. A more complete assessment of internal CO2fluxes in stems will improve our understanding about the carbon balance of trees. Third, we discuss the problems and challenges associated with the study of corticular photosynthesis. The unpredictability of stem respiration measurements could be reduced by incorporating corticular photosynthesis measurements into the mass balance correction. We propose that the combined approach of using stable carbon isotope tracing, CO2and O2micro-sensors, and sap-flow techniques should be used in future so that the fraction of each source of internal CO2in the stem-and the respective determinant-may be accurately determined. In addition, we propose that the genomic regulatory mechanisms that influence corticular photosynthesis should be investigated to understand this important process at the gene level. Finally, we suggest that it is important to integrate scaling and model-fitting with eddy covariance and remote sensing techniques to improve estimation accuracy at a regional scale.
corticular photosynthesis; stem respiration; CO2efflux; sap flow; measurement
国家自然科学基金资助项目(31070363);广东省自然科学基金博士科研启动基金资助项目(10451065005004290)
2013- 10- 30;
日期:2015- 04- 14
10.5846/stxb201310302614
*通讯作者Corresponding author.E-mail: xncai@scib.ac.cn
蔡锡安,曾小平,陈远其.树干皮层光合作用——生理生态功能和测定方法.生态学报,2015,35(21):6909- 6922.
Cai X A, Zeng X P, Chen Y Q.Stem corticular photosynthesis: ecophysiological functions and their measurement.Acta Ecologica Sinica,2015,35(21):6909- 6922.
