金沙江干热河谷滇榄仁开花物候与繁育系统
2015-02-05刘方炎王小庆张志翔廖声熙
刘方炎,王小庆,陈 敏,张志翔,廖声熙,李 昆
1 中国林业科学研究院资源昆虫研究所,昆明 650224 2 西南林业大学生命科学学院,昆明 650224 3 北京林业大学生物科学与技术学院,北京 100083
金沙江干热河谷滇榄仁开花物候与繁育系统
刘方炎1,王小庆1,陈 敏2,*,张志翔3,廖声熙1,李 昆1
1 中国林业科学研究院资源昆虫研究所,昆明 650224 2 西南林业大学生命科学学院,昆明 650224 3 北京林业大学生物科学与技术学院,北京 100083
通过野外定点观测,并利用套袋实验、解剖实验以及花粉形态特征观察与活力检测、柱头可受性检测、花粉/胚珠比以及异交指数等,研究了金沙江干热河谷滇榄仁自然群体花部形态特征与开花进程、繁育系统特征以及传粉媒介与环境的适应性等内容。结果表明,滇榄仁始花期在每年4月上旬,群体花期持续时间为30d左右,开花同步性高,呈典型的“集中开花模式”。单花开放时,柱头先伸长和膨大,约4d后雄蕊伸出,具有雌雄异熟的特征,一定程度上避免了自交的发生。单花开放进程可划分为花蕾期、柱头伸长期、雄蕊始露期、盛开期、盛开后期、花谢期等6个时期。除了花蕾期外,整个开花期的花粉均具有活力。花粉活力与柱头可受性之间避开了最适授粉期,但也有部分重叠。滇榄仁可能同时具有风媒和虫媒传粉。繁育系统以异交为主,部分自交亲和,需要传粉者。滇榄仁花部特征、开花物候和繁育系统为其适应干热河谷恶劣气候环境提供了一定的生殖保障和进化潜力。良好的群落环境有助于促进滇榄仁异花传粉,产生更多有效的种子,从而促进林下自然更新。
金沙江;干热河谷;滇榄仁;开花物候;繁育系统
植物的开花物候通常是由遗传和环境两方面因子来控制的,是植物重要的生活史特征之一,对植物生殖成功有重要的影响[1- 3]。由于受气候条件、生境破碎化程度以及种群密度等因子的影响,开花物候的变异存在于各种不同的空间尺度中[4- 5]。同一植物在不同生境和微环境条件下,其开花物候以及开花的持续时间和花寿命均存在显著差异[2, 6- 7]。植物的开花物候可以分解成多个变量,包括始花期、盛花期、开花末期以及开花持续时间等指标,不同指标受环境条件的影响程度存在较大差异,因此,将某一指标,如始花期作为开花物候的单一指标使用,其有效性值得怀疑[8- 9]。
开花物候与环境条件之间的相互作用直接影响着植物传粉及交配系统(繁育系统),如开花太早或太晚均会因为缺少有效的传粉者而不能有效结实[10]。通常,植物个体开花同步性高的时候,传粉者的访问频率、花粉贡献-沉积率、异交潜力等均会得到相应的增加和提高。特别是在受干扰的生境中,植物的开花同步性被看作是控制果实形成和调节异交水平的一个辅助因子,是影响植物群体传粉成功的重要因子[1, 4, 11]。
滇榄仁(Terminaliafranchetii)为使君子科(Combretaceae)榄仁树属落叶小乔木,是我国西南金沙江干热河谷区一级标志种植物[12],以其为优势种形成的群落类型更是金沙江干热河谷区仅有的几种重要天然植被类型之一。由于生境破坏和人为干扰等因素的影响,目前,滇榄仁结果量大,但种子败育率极高,林下更新不良,幼苗、幼树缺乏。有关该种群的物种多样性与幼苗更新特征、种子扩散与种子库特征以及谱系地理与种系分异等方面内容已有研究[13- 15],但其繁殖生物学方面的研究尚未见报道。本文研究分析了滇榄仁自然群体的花部形态特征与开花进程、繁育系统特征以及传粉媒介与环境的适应性等内容,旨在通过进一步了解滇榄仁的生殖生态学和生活史特征,为金沙江干热河谷天然植被管理和保育策略的制定提供理论依据。
1 研究地概况和方法
1.1 研究地概况
研究区位于金沙江干热河谷的典型地段元谋盆地(25°23′—26°06′N,101°35′—102°06′E)。平均海拔1100—1300 m,是我国气候干旱、热量条件丰富的一个特殊自然气候区域,也是金沙江流域最具代表性的干热河谷地区之一。该区域为北热带和南亚热带季风河谷气候,光照充沛,干湿季分明,炎热干旱,降雨量少。年平均气温21.9 ℃,最热月均温27.1 ℃,最冷月均温14.9 ℃,10 ℃的年积温8003 ℃,年均降雨量613.9,其中,6—10月的雨季(湿季)降雨量占全年总降雨量的92%,旱季(干季)长达7—8个月(11月—翌年5月),但降雨量极为稀少;年均蒸发量3847.8 mm,年均空气相对湿度53%,年均干燥度2.08[16]。
土壤类型主要是燥红土,该土壤风化程度低,层次分化不明显,质地粘重,保水性能差[17]。整个干热河谷荒漠化程度较高,水土流失严重,地表沟壑纵横,土地质量严重下降,“土林”面积分布较广[18]。
植被类型以“稀树灌草丛”为主,即以中草的禾草为背景构成的大片草地植被,在此草丛上散生稀疏的乔木(高2—5 m为主)和灌木(高0.5—2.0 m为主),在人为干扰作用下可成为“稀树草丛”、“稀灌草丛”或“草丛”等外貌状态。木本植物优势种有滇榄仁、锥连栎(Quercusfranchetii)、车桑子(Dodonaeaviscosa)、疏序黄荆(Vitexnegundof.laxipaniculata)、石山羊蹄甲(Bauhiniaesquirolii)等。草本植物优势种有扭黄茅(Heteropogoncontortus)、孔颖草(Bothriochlorapertusa)、双花草(Dichanthiumannulatum)等[19]。
1.2 研究方法
1.2.1 开花物候与花部综合征观察
2010—2012年期间,在滇榄仁开花前,每年标记人为影响小、个体大小(胸径、树高)基本一致和开花数量较多的植株6株。开花物候观察时,在每棵植株东、南、西、北4个方向各选择3个花序,并进行标记。其中,2010年,对其单花形态特征与开花进程进行了观察,即在每一花序基部、中部、顶端各选3朵花进行标记和观察其花部特征和开放进程。每天8:00—9:00、12:00—13:00和17:00—18:00各观察1次,直到花朵完全萎蔫。观察和记录内容包括:单花结构、花直径、花瓣颜色、柱头伸长与膨大情况、雄蕊伸展情况、苞片是否掉落等。同时,2010—2012年期间,每年4月1日开始对种群开花物候进行了观察。即每天早晨8:00—9:00观察1次,直到花朵全部凋谢。观察并记录每一花序上所有花朵的开花进程,内容包括:始花期(5%的花序中,每一花序均有5%的花朵开放)、盛花期(50%的花序中,每一花序均有50%的花朵开放)、开花末期(95%的花序中,每一花序均有95%的花朵开放)、花期持续时间。
用开花同步性指数(flowering synchrony index(Xi))检测开花同步性高低,具体方法根据文献[3, 20]。
式中,ej表示个体i和j花期重叠时间(d)(j≠i),fi表示个体i开花的总时间(d),n表示群体中所调查个体的总数。Xi的变异范围为0—1,当个体的开花时间完全错开时X=0;当个体的开花时间完全重叠时X=1。一个群体中所有个体X的平均值为一个群体的开花同步性指数。在计数时间时,以4月1日为第1天(计为1),4月2日为第2天(计为2),依次类推。
1.2.2 套袋实验与传粉者观察
在以上实验选择的6棵滇榄仁植株上,随机标记大小一致的花序150个,进行以下处理:(1)对照,不去雄、不套袋、开放式传粉,统计自然条件下的传粉结实情况;(2)开花前套网袋(网眼大小为1 mm ×1 mm,完全隔离可能的昆虫传粉),统计可能的风媒传粉及自花传粉的结实情况;(3)开花前套自制硫酸纸袋(5 cm×10 cm),统计其自花传粉的结实情况[20- 21]。2个月后采种,统计结实率。
在观察昆虫活动时,选择滇榄仁稀树林、滇榄仁纯林等不同类型群落,在晴朗天气的早晨、中午和傍晚,分别进行访花昆虫的观察。对访花昆虫的类型与访花行为、访花频率、花间运动式样等进行观察与比较,初步判断滇榄仁的常见访花昆虫和传粉者[22]。
1.2.3 花粉活力与柱头可受性
参照 Dafni的实验方法[23],采用TTC(2,3,5-triphenyl tetrazolium chloride)法分别测定滇榄仁单花开放进程中不同时期花粉活力,每一时期设置6个重复,即随机选择6个花朵。具体方法是:采集不同开花进程中的花药,用石蜡纸包好置于室温干燥1—2d,待花粉散出后,将散出的花粉撒在载玻片上,滴加1—2滴浓度为0.5% TTC的蔗糖溶液,迅速盖上盖玻片,置入内有湿滤纸的培养皿中,保持湿度,连同培养皿放置在室温黑暗条件下培养12 h。在显微镜下观察染色情况(×10),并计数染色花粉粒数目(×40)。被染为红色的为有活力花粉,若红色很浅或无变化或变黑色、黄色的则表明为无活力花粉。以染色率表示花粉的活力百分率,即有活力花粉的比率=红色花粉数/观察花粉总数×100%。
柱头可受性的检测采用联苯胺-过氧化氢法(联苯胺∶过氧化氢∶水=4∶11∶22(体积分数))进行。随机选择不同发育时期柱头,每一时期选择柱头数为6个,并将其置于6个凹面载玻片上,分别滴加少许联苯胺-过氧化氢反应液后,盖玻片并在光学显微镜下观察其柱头的可受性。若柱头周围呈现蓝色或浅蓝色并产生气泡则具可受性,并根据气泡数的多少确定其柱头可受性的强弱;反之,则不具可受性。
1.2.4 花粉形态特征观测
在扫描电镜下观察滇榄仁花粉形态特征,取有代表性的赤道面和极面拍照,观察花粉的赤道面观、极面观以及花粉外壁纹饰,测量花粉粒极轴长(P)、赤道轴长(E)、花粉粒萌发结构等。花粉大小以P×E的值表示,花粉形状以P/E表示,其中P/E> 2为超长球形,1.14
1.2.5 单花花粉量、胚珠数及P/O比的测算
随机选取部分花朵已开放的花序10个,并在FAA固定液中固定后带回实验室。每一花序取1朵还未开放花朵用玻璃棒捣碎制成1.0 mL花粉悬浊液,用吸管吸取悬浮液在显微镜(×10)下用血球计数器统计花粉量,每朵重复计数4次,计算单花花粉总量P。胚珠的计数是将每朵花的子房在体视解剖镜下用解剖针划开心皮,统计每个子房内的胚珠数目,记为O。计算公式为:P/O=花粉量/胚珠数。按Cruden的理论[25],P/O为2.7—5.4时其繁育系统为闭花受精,P/O为18.1—39.0时繁育系统为专性自交,P/O为31.9—396.0时繁育系统为兼性自交,P/O为244.7—2588.0时繁育系统为兼性异交,P/O为2108.0—195525.0时繁育系统为专性异交。P/O值的降低意味着近交程度的升高,而P/O值的升高伴随着异交程度的上升[25]。
1.2.6 异交指数OCI的估算
按照Dafni的标准[23],通过花或花序直径、性器官空间位置与成熟情况等进行繁育系统的评判。具体方法是:(1)花直径<1 mm记为0,1—2 mm记为1,2—6 mm记为2,>6 mm记为3;(2)花药开裂时间与柱头可受期之间的时间间隔,两性器官同时成熟或雌蕊先熟记为0,雄蕊先熟记为1;(3)柱头与花药的空间位置,同一高度记为0,空间分离记为1。三者之和为异交指数(OCI)。异交指数越大,植物的异交程度越大,越需要传粉者。根据Dafni提出的异交指数(OCI)的评判标准[23]:OCI=0时,繁育系统为闭花受精;OCI=1时,为专性自交;OCI=2时,为兼性自交;OCI=3时,为自交亲和,有时需要传粉者;OCI=4时,为部分自交亲和,异交,需要传粉者。
1.3 数据处理
采用EXCEL 2003整理数据,Sigmaplot 11.0作图,SPSS 11.5进行单因素方差分析(One-way ANOVA analysis)。
2 结果与分析
2.1 物候与开花进程
滇榄仁穗状花序腋生或顶生,花期通常在每年4月上旬到5月上旬,在水湿条件相对较好的区域,其花期会提前10—15 d。滇榄仁开花物候呈“集中开放模式”,不同个体开花同步性较高,一般在进入始花期后6—10 d时间内即有大量花朵盛开,群体花期持续时间在30 d左右(表1)。
滇榄仁为两性花,单花较小,只有淡绿色花萼,无花瓣,无花梗,有少许花香。单花开放时,通常在花冠未展开时,柱头先伸长和膨大,而后雄蕊开始外展,1—2个花药先露出,花丝先弯曲位于柱头下方,逐渐伸展,同时花冠开始慢慢打开。待花朵完全开放时,花药比柱头稍高((0.94±0.07)mm)(图1: A—E)。
根据滇榄仁单花开放物候特征,可以将其单花开放进程划分为6个时期,即①花蕾期:花蕾形成到柱头伸出之前,持续时间约22 d;②柱头伸长期:柱头伸出、膨大到雄蕊伸出之前,持续时间约4 d;③雄蕊始露期:少

表1 滇榄仁开花物候特征Table 1 Flowering phenology characteristics of T. franchetii

图1 滇榄仁花朵开放进程中花形态特征及部分访花昆虫Fig.1 The floral morphological characteristics observed during flowering of T. franchetii and some pollinatorsA:花蕾期花朵形态;B—C:柱头伸长期花朵形态;D:雄蕊始露期花朵形态;E:盛开期花朵形态;F:盛开后期花朵形态;G:蜜蜂;H:隧蜂;I:蝇类
量雄蕊(1—2 个)伸出花冠,持续时间约2 d;④盛开期:2 个以上雄蕊露出花冠到雄蕊全部伸出,持续时间约3d;⑤盛开后期:雄蕊全部伸出到花药全部枯黄前,持续时间约6 d;⑥花谢期:花药全部枯黄到凋落前,持续时间约15 d。从整个单花开放进程来看,滇榄仁单花开放过程中,从柱头伸出花蕾到花药出现枯黄的时间在15 d左右。
根据开花同步性指数计算结果可知,2010年观察到的花期重叠期为最高,其平均花期同步指数为0.85;2011年观察到的花期重叠期为最低,平均花期同步指数为0.79;2012年观察到的花期重叠期居中,平均花期同步指数为0.82。方差分析结果表明,滇榄仁开花同步性在不同年份之间差异不显著(F=0.346,df=2,P>0.05)。
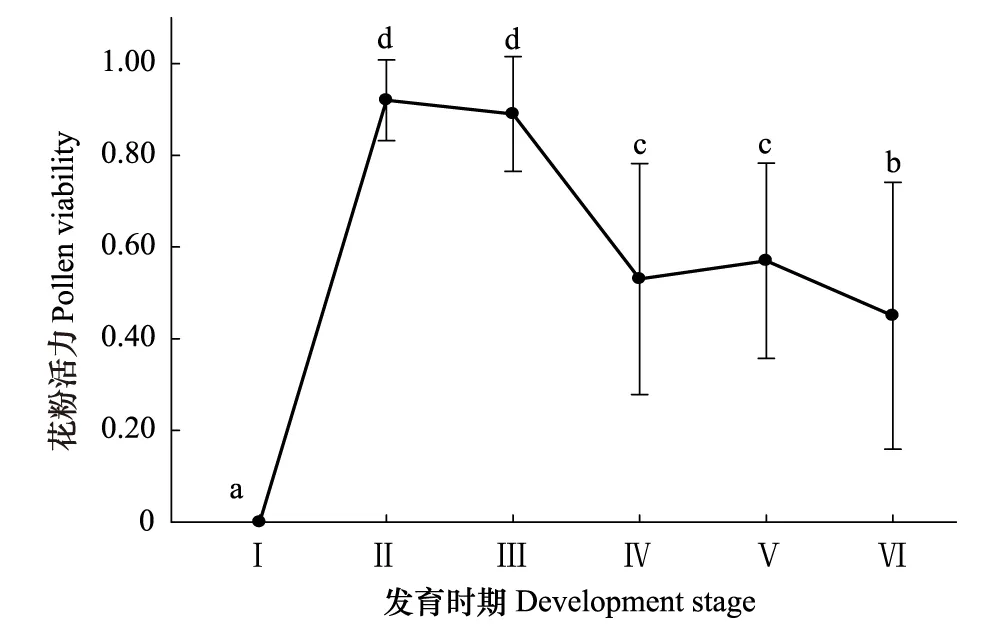
图2 滇榄仁植株的花粉活力动态变化曲线Fig.2 Dynamic curves of pollen viability of T. franchetii Ⅰ:花蕾期;Ⅱ:柱头伸长期;Ⅲ:雄蕊始露期;Ⅳ:盛开期;Ⅴ:盛开后期;Ⅵ:花谢期;图中不同字母表示差异显著(P<0.05)
2.2 花粉活力与柱头可受性
从图2可以看出,在花粉活力方面,花蕾期时,花粉不具有活力。进入柱头伸长期后,此时雄蕊虽未露出,但花粉已经具有较强的活力(90%左右),并且,花粉的高活力特性一直维持到雄蕊始露期。进入盛开期后,大部分雄蕊逐渐从花冠内伸展出来,此时花粉活力已出现逐渐下降趋势(50%左右)。在花谢期,雄蕊完全外展,花药已经出现枯黄,但此时仍有少数花粉存在活力(图2)。
在柱头可受性方面(表2),花蕾期时,花苞未开裂,柱头、雄蕊均未露出,柱头不具可受性。在柱头伸长期,花苞开裂,柱头伸出花苞约5—6 mm时,柱头可受性极强,但此时雄蕊仍未露出。进入雄蕊始露期后,柱头可受性仍然较强,但已开始下降。在盛开期和盛开后期,柱头可受性一直呈下降趋势。到花谢期时,柱头已不具可受性。

表2 滇榄仁植株柱头可受性检测结果Table 2 Test results for stigma receptivity of T. franchetii
+示柱头具可受性;++示柱头可受性较强;+++示柱头可受性极强;++/-示大部分柱头具可受性,少部分不具可受性;+/―示部分柱头具可受性,部分不具可受性;-示柱头不具可受性
2.3 传粉媒介
对滇榄仁传粉媒介的观察发现,食蚜蝇(Episyrphussp.)、大头金蝇(Chrysomyiamegacephaia)等蝇类是滇榄仁花朵之间穿梭最为频繁的昆虫(图1:G—I)。同时,实验期间还发现了少量中华蜜蜂(Apiscerana)、黄犀猎蝽(Sycanuscroceus)、锈色华丽蜾赢(Deltaconoideum)等昆虫在花间访问。但大多昆虫在花间访问时间较短,仅2—10 s,仅发现大头金蝇访问时间较长,约为35 s。
套袋实验结果发现(表3),开花前套网袋、开花前套硫酸纸袋以及自然状态下,滇榄仁花序上的花朵均能全部形成果实,即坐果率均为100%,3种处理下不存在差异。但在结实率上,三者之间均存在显著差异(P<0.05)。其中,开花前套硫酸纸袋处理下,结实率最低,仅有6.725%;其次是开花前套网袋,结实率为12.04%;结实率最高的是自然状态下(对照),达到16.42%。表明套袋对滇榄仁结实率存在显著影响。由此可知,滇榄仁可能同时存在着风媒传粉和虫媒传粉两种形式,且同花序、异花序均能相互授粉,但异花序授粉的结实率显著高于同花序授粉果实。

表3 套袋试验的结实情况Table 3 Seed-set of bagged experiments for T. franchetii
平均值±标准差(Mean±SD),不同字母表示在0.05水平上差异显著
2.4 繁育系统特征
2.4.1 花粉粒形态、花粉量、胚珠数及花粉胚珠比(P/O)
滇榄仁花粉粒较小,呈超长球形,极轴长为(18±1.1)μm,赤道轴长为(8±0.6)μm(图3)。极面观呈六裂圆形。6条萌发沟以等间距分布。表面光滑,黏着性不强。
单花的花粉数量为(121750±31524)粒,胚珠数量1 个;花粉胚珠比(P/O)为121 750。依据Cruden的标准,滇榄仁的繁育系统为专性异交。
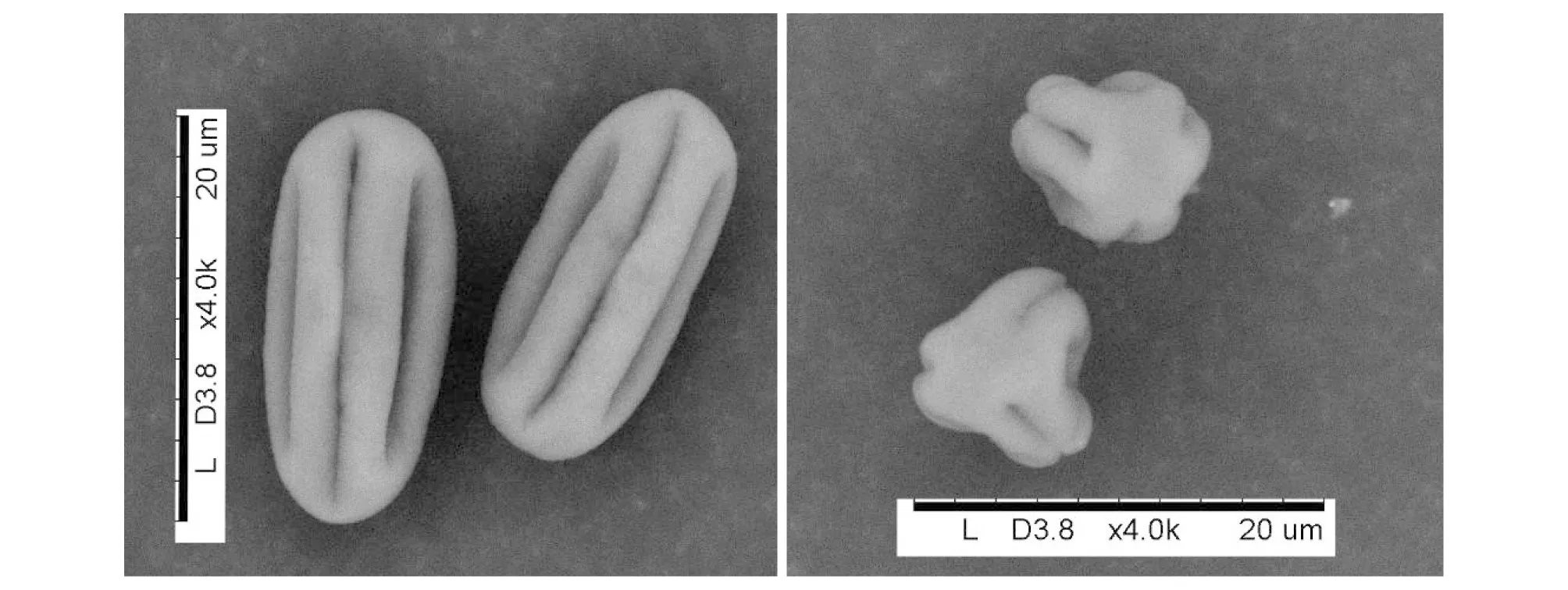
图3 滇榄仁花粉粒形态特征Fig.3 Pollen morphology of T. franchetii
2.4.2 异交指数OCI
滇榄仁单花直径约为(6.74±0.83)mm;雌雄异熟(dichogamy),且雌蕊先熟。在雄蕊未展开前柱头先伸出,之后雄蕊开始展露,待雄蕊完全展开时,花药约比柱头高(0.94±0.07)mm,即雌雄异位(herkogamy)。根据Dafni异交指数的计算规则和标准[23],滇榄仁的异交指数为4,繁育系统以异交为主,部分自交亲和,需要传粉者。
3 结论与讨论
3.1 滇榄仁花部特征与繁育系统的关系
从滇榄仁花部特征来看,其花朵具有芳香味,花盘基部具有腺体能够分泌花蜜等特征均具有吸引昆虫传粉的作用,表现出了对虫媒传粉的适应。另一方面,滇榄仁花小,无花瓣;花粉粒较小,表面光滑,黏着性不强,无刺状突起(图3),花粉易于在空气流动中散出,且花粉粒数量极大(约为121 750粒/花);花药外展于空中,与花丝接连不紧密,雌蕊柱头较长等均是适合风媒传粉的特征,也表现出了对风媒传粉的适应性。由此推测,滇榄仁的传粉过程可能同时存在着虫媒传粉和风媒传粉的形式。这在套袋实验中得到了进一步证实。套袋实验发现,无套袋花朵(自然状态下)和开花前套网袋的花朵所产生的果实,其饱满率存在着显著差异,前者饱满率远高于后者。表明昆虫等生物因子在滇榄仁传粉系统中具有一定贡献,对传粉效率的提高起到了较大作用。另外,开花前套网袋(可能受风力作用影响)和硫酸纸袋(无外界作用影响)的花朵产生的果实也存在着显著差异,前者果实饱满率远高于后者,表明风力因子在滇榄仁传粉过程中也起到了积极的作用。
传粉的成功依赖于较强活力的花粉与较高可受性柱头的相遇,生境不同,花粉活力与柱头可受性及二者的相遇期都会随之而变化[26]。从滇榄仁不同花期花粉活力与柱头可受性研究结果可以看出,滇榄仁单花表现为雌雄异熟,且雌性先熟的特征。其单花柱头生长进入柱头伸长期末期时(柱头伸出花苞部分长约5—6 mm),可受性达到最强,已经准备接受外来花粉,而此时单花内部花粉虽具有较强活力,但由于雄蕊未露出,无法完成自花授粉。而当雄蕊露出花苞后,柱头可受性已经出现下降。由此可知,滇榄仁具有避免自交的典型特征。需要指出的是,在雄蕊露出后,直到花朵凋谢前,其花粉仍具有一定的活力,柱头也具有部分可受性,表明滇榄仁不排除自交的可能,在异花授粉不成功时可能会进行一定程度的自交。这个结论在繁育系统特征方面的研究上得到了证实。在繁育系统研究中,花粉量与胚珠的比值,即P/O比通常用来判断植物繁育系统的交配类型。按Cruden的理论[25],滇榄仁的繁育系统特征为专性异交。但根据Dafni提出的异交指数(OCI)的评判标准[23],滇榄仁OCI值为4,其繁育系统特征为以异交为主,部分自交亲和,需要传粉者。综合上述研究结果并结合本研究的实验观察,可以认为,滇榄仁繁育系统特征应属于以异交为主的方式,但在异交受阻时,也表现为自交亲和。这种繁育系统特征为滇榄仁适应干热河谷复杂多变且极为恶劣的环境提供了一定生殖保障和进化潜力。但是,良好的群落环境有助于促进滇榄仁异花传粉,从而产生更多有效的种子。
3.2 滇榄仁开花物候对传粉模式的适应
从开花同步性特征可以看出,不同年份观察到的滇榄仁花期重叠期均较高,平均花期同步指数均在0.79以上,表明滇榄仁群体中个体开花同步性较高,呈现出了典型的“集中开花模式(mass flowering)”。这种开花模式也存在于Silenescutifolia[9]、长柄双花木(Disanthuscercidifoliusvar.longipes)[3]和夏腊梅(Sinocalycanthuschinensis)[11]等植物中。一般认为,这种“集中开花模式”将有助于物种吸引更多的传粉昆虫,从而有利于传粉成功。目前,由于生境的破坏和人为的干扰,干热河谷区滇榄仁植株数量有限,且分布区域狭窄,但滇榄仁个体却有着较高的结果率,由此推测,滇榄仁的这种“集中开花模式”可能有助于其吸引更多的传粉昆虫,有利于传粉成功。但有研究表明,这种有助于传粉成功的开花模式,又可能增加花粉在个体内或邻近个体间的传递,从而导致广泛的自交或近交衰退[27]。因此,滇榄仁的这种开花模式也可能是其结果量大,但种子败育率极高的重要原因之一。
在季节性的生境中,植物的开花和结果时间通常与气候条件相联系,在长期的进化过程中其选择的时间对后代的生存是最有利的[28]。大多数植物的生殖活动都倾向于春季,因为春季有充足的水分、适宜的温度和丰富的昆虫为植物的生殖成功提供良好的条件[29]。但在金沙江干热河谷区,一年中四季并不分明,旱季和雨季的特征明显[16]。大多数植物通常在雨季时开花。从滇榄仁花朵的开放进程来看,其花期在4—5月。此时正处于干热河谷最为干旱和风力较大的时期,与其伴生的其它植物均没有进入开花期,传粉昆虫的数量也相对较少。因而,滇榄仁形成大量、集中的开花模式,具有风媒传粉的适应特征。同时,也具有吸引更多的传粉者、获得更多传粉机会,从而达到生殖成功的作用。这种特征应是滇榄仁长期适应干热河谷环境的一种表现。但由于其花期正处于旱季,传粉昆虫的数量可能会受到群落环境的严重制约。在片断化生境中,传粉昆虫的种类、数量和访花频率均可能会降低[30]。因此,随着人为干扰的加剧和群落破碎化程度的增加,这种开花模式也可能成为滇榄仁传粉失败的重要因素。这一点在野外观察实验中得到了进一步证实。在破碎化程度较高的滇榄仁稀树林中仅发现大头金蝇等少数蝇类昆虫在其花朵之间穿梭,其它昆虫极为罕见,而在滇榄仁植株分布较为均匀的林分内不仅发现大头金蝇、食蚜蝇等蝇类,还发现中华蜜蜂、黄犀猎蝽、锈色华丽蜾赢等多种昆虫种类。但是,不同群落环境条件下,滇榄仁的传粉特征和有效性是否存在显著差异,还需要进一步实验来证明。
致谢:感谢国家林业局云南元谋荒漠生态系统观测站谢清海、刘昆友等对野外调查和取样的帮助。
[1] Fuchs E J, Lobo J A, Quesada M. Effects of forest fragmentation and flowering phenology on the reproductive success and mating patterns of the tropical dry forest treePachiraquinata. Conservation Biology, 2003, 17(1): 149- 157.
[2] Tarasjev A. Flowering phenology in natural populations ofIrispumila. Ecography, 1997, 20(1): 48- 54.
[3] 肖宜安, 何平, 李晓红. 濒危植物长柄双花木开花物候与生殖特性. 生态学报, 2004, 24(1): 14- 21.
[4] Herrerías- Diego Y, Quesada M, Stoner K E, Lobo J A. Effects of forest fragmentation on phenological patterns and reproductive success of the tropical dry forest treeCeibaaesculifolia. Conservation Biology, 2006, 20(4): 1111- 1120.
[5] 陈波, 达良俊, 宋永昌. 常绿阔叶树种栲树开花物候动态及花的空间配置. 植物生态学报, 2003, 27(2): 249- 255.
[6] English-Loeb G M, Karban R. Consequences of variation in flowering phenology for seed head herbivory and reproductive success inErigeronglaucus(Compositae). Oecologia, 1992, 89(4): 588- 595.
[7] Olsson K, Ågren J. Latitudinal population differentiation in phenology, life history and flower morphology in the perennial herbLythrumsalicaria. Journal of Evolutionary Biology, 2002, 15(6): 983- 996.
[8] Dieringer G. Variation in individual flowering time and reoproductive sucess ofAgalinisstrictifolia(Scrophulariaceae). American Journal of Botany, 1991, 78(4): 497- 503.
[9] Buide M L, Díaz-Peromingo J A, Guitián J. Flowering phenology and female reproductive success inSileneacutifoliaLink ex Rohrb. Plant Ecology, 2002, 163(1): 93- 103.
[10] Ollerton J, Diaz A. Evidence for stabilising selection acting on flowering time inArummaculatum(Araceae): the influence of phylogeny on adaptation. Oecologia, 1999, 119(3): 340- 348.
[11] 张文标, 金则新. 濒危植物夏蜡梅 (Sinocalycanthuschinensis)的开花物候与传粉成功. 生态学报, 2008, 28(8): 4037- 4046.
[12] 金振洲, 杨永平, 陶国达. 华西南干热河谷种子植物区系的特征、性质和起源. 云南植物研究, 1995, 17(2): 129- 143.
[13] 刘方炎, 张志翔, 王小庆, 李昆, 陈梅, 邓小京. 金沙江干热河谷滇榄仁种子扩散与种子库特征研究. 热带亚热带植物学报, 2012, 20(4): 333- 340.
[14] Zhang T, Sun H. Phylogeographic structure ofTerminaliafranchetii(Combretaceae)in southwest China and its implications for drainage geological history. Journal of Plant Research, 2011, 124(1): 63- 73.
[15] 王小庆, 刘方炎, 李昆, 陈友根. 元谋干热河谷滇榄仁群落林下物种多样性与幼苗更新特征. 浙江农林大学学报, 2011, 28(2): 241- 247.
[16] 云南省气象局. 云南省农业气候资料集. 昆明: 云南人民出版社, 1984.
[17] 张信宝, 杨忠, 张建平. 元谋干热河谷坡地岩土类型与植被恢复分区. 林业科学, 2003, 39(4): 16- 22.
[18] 张建平. 元谋干热河谷区土地荒漠化研究. 云南地理环境研究, 2000, 12(1): 1- 8.
[19] 金振洲, 欧晓昆. 干热河谷植被. 昆明: 云南大学出版社, 2000.
[20] Mcintosh M E. Flowering phenology and reproductive output in two sister species ofFerocactus(Cactaceae). Plant Ecology, 2002, 159(1): 1- 13.
[21] 吴雪莲, 谭敦炎. 异果芥的花部综合征及其繁育系统. 植物分类学报, 2007, 45(4): 538- 550.
[22] 任明迅. 雄蕊合生植物半边莲的花部综合征与繁育系统. 植物生态学报, 2009, 33(2): 361- 368.
[23] Dafni A. Pollination Ecology: a Practical Approach. Oxford: IRL Press Ltd., 1992.
[24] 王开发, 王宪曾. 孢粉学概论. 北京: 北京大学出版社, 1983: 1- 25.
[25] Cruden R W. Pollen-ovule ratios: a conservative indicator of breeding systems in flowering plants. Evolution, 1977, 31(1): 32- 46.
[26] 刘林德, 张洪军, 祝宁, 申家恒. 刺五加花粉活力和柱头可授性的研究. 植物研究, 2001, 21(3): 375- 379.
[27] Melampy M. Flowering phenology, pollen flow and fruit production in the Andean shrubBefariaresinosa. Oecologia, 1987, 73(2): 293- 300.
[28] Hamann A. Flowering and fruiting phenology of a Philippine submontane rain forest: climatic factors as proximate and ultimate causes. Journal of Ecology, 2004, 92(1): 24- 31.
[29] Pías B, Guitián P. Flowering phenology and pollen-to-ovule ratio in coastal dune communities near Eurosiberian-Mediterranean border in the NW Iberian peninsula. Flora, 2001, 196(6): 475- 482.
[30] 张金菊, 叶其刚, 姚小洪, 张胜菊, 黄洪文. 片断化生境中濒危植物黄梅秤锤树的开花生物学, 繁育系统与生殖成功的因素. 植物生态学报, 2008, 32(4): 743- 750.
Flowering phenology and breeding system ofTerminaliafranchetii(Combretaceae) in the dry-hot valley of the Jinsha River, China
LIU Fangyan1, WANG Xiaoqing1, CHEN Min2,*, ZHANG Zhixiang3, LIAO Shengxi1, LI Kun1
1ResearchInstituteofResourcesInsects,ChineseAcademyofForestry,Kunming650224,China
2CollegeofLifeScience,SouthwestForestryUniversity,Kunming650224,China
3CollegeofBiologicalSciencesandBiotechnology,BeijingForestryUniversity,Beijing100083,China
Flowering phenology and breeding system characteristics are the most important fitness factors of plants, and have an important influence on plant reproductive success. For example, plants that blossom too early or too late are unable to fruit effectively because of changes to environmental factors or due to the absence of effective pollinators.Terminaliafranchetiiis a characteristic plant in the dry-hot valley of the Jinsha River, southwest China. The community formed byT.franchetiirepresents a limited and important type of natural vegetation that grows in this region. However, today, habitat destruction and human disturbance factors are having adverse effects onT.franchetii. Although the plant produces large amounts of fruit, the seed abortion rate is extremely high, resulting in few seedlings and saplings being produced, and, consequently, poor forest regeneration. A number of studies have been conducted on the population diversity of this species, along with studies on the regeneration characteristic of seedlings, seed dispersal and seed bank characteristics, phylogeography, species differentiation, and other aspects. However, studies on the reproductive biology of this plant have not been reported. We conducted a fixed-point field investigation of the floral syndrome, flowering process, breeding system, and adaptability of pollinators to the environment of a natural population ofT.franchetiiin the dry-hot valley of the Jinsha River, China. The results showed that, each year,T.franchetiibegins to bloom in early April, and that the flowering duration of the population is approximately 30 days. The plant has the characteristics of high flowering synchrony, and is a typical “mass flowering” species. When single flowers bloom, the stigma initially elongates and expands. Then, approximately 4 days later, the stamens protrude. Because of this dichogamy, the plant, to a certain extent, avoids self-pollination. Flowering is divided into 6 stages; namely, the bud stage, stigma elongation stage, early stamen showing stage, blooming stage, late blooming stage, and flower withering stage. In addition to the bud stage, the pollen is viable throughout the entire flowering period; although, the strongest vitality of the pollen occurs during the early stamen showing and blooming stages. Optimum pollination is avoided due to the asynchrony between pollen vitality and stigma receptivity; however, there is a certain degree of overlap between the two stages.T.franchetiimight be adapted to both wind and insect pollination. In the breeding system of this species, out-crossing is predominant and, although partially self-compatible, it requires pollinators. The main pollinators are flies, such asEpisyrphussp.,Chrysomyiamegacephaia,Apiscerana,Sycanuscroceus, andDeltaconoideum. The floral characteristics, flowering phenology, and breeding system ofT.franchetiiprovide some reproductive assurance and evolutionary potential for its ability to adapt to the complex and extremely harsh environment of dry-hot valleys; however, a favorable community environment contributes to the promotion of cross pollination ofT.franchetiiand more effective seed production; thus, promoting natural forest regeneration.
Jinsha River; dry-hot valley;Terminaliafranchetii; flowering phenology; breeding system
林业公益性行业科研专项(201304202);中国林业科学研究院基本科研业务费专项资金(CAFYBB2014MA008)
2014- 01- 13;
日期:2015- 04- 14
10.5846/stxb201401130096
*通讯作者Corresponding author.E-mail: mccm909@163.com
刘方炎,王小庆,陈敏,张志翔,廖声熙,李昆.金沙江干热河谷滇榄仁开花物候与繁育系统.生态学报,2015,35(21):7043- 7051.
Liu F Y, Wang X Q, Chen M, Zhang Z X, Liao S X, Li K.Flowering phenology and breeding system ofTerminaliafranchetii(Combretaceae)in the dry-hot valley of the Jinsha River, China.Acta Ecologica Sinica,2015,35(21):7043- 7051.
