血清miRNAs作为食管鳞癌新的生物标志物
2015-02-04李迎迎刘志广王丽袁园园刘平王林嵩
李迎迎,刘志广,王丽,袁园园,刘平,王林嵩
血清miRNAs作为食管鳞癌新的生物标志物
李迎迎1,刘志广2,王丽1,袁园园1,刘平2,王林嵩1
1. 河南师范大学生命科学学院,新乡 453007; 2. 河南省新乡市中心医院肿瘤科,新乡 453000
食管鳞癌是我国最常见的恶性肿瘤之一。由于缺乏有效的早期诊断方法,大多数食管鳞癌患者在确诊时已到中晚期并预后不良。MicroRNAs(miRNAs)是一类可通过抑制其特异性靶基因表达从而调控食管鳞癌发生发展的非编码内源性小RNA。相比于传统的生物标志物(例如mRNA和蛋白质),miRNAs更加稳定并易于筛选及精确地定量分析,从而成为理想的新一代癌症早期诊断和预后评估的生物标志物。近来的研究结果显示,食管鳞癌病人血清中的一些miRNAs表达水平的变化与病情诊断及预后的结果显著相关。文章综述了食管鳞癌病人血清中miRNAs的变化规律,讨论了检测这些miRNAs的表达水平变化作为一种新的方法应用于食管鳞癌的早期诊断和预后评估的可能性。值得注意的是,不同的血清miRNAs的检测方法所产生的结果是不完全一致的,文章还对这些差异产生的原因进行了讨论。
血清;miRNA;食管鳞癌
在世界范围内,食管癌的死亡率高居癌症死亡率的第六位[1],而男性的发病率是女性的3~4倍[2]。食管鳞癌(Esophageal squamous cell carcinoma, ESCC)发生在食管中部或上部1/3,是亚洲食管癌的主要病理亚型,约占食管癌的90%以上[3]。由于我国地处“食管癌带”[2],食管鳞癌的发病率和死亡率均居世界首位。在临床上,食管鳞癌的早期诊治可以显著地改善病人的预后并降低死亡率,但目前尚缺乏食管鳞癌特异性的生物标志物及有效的微创早期诊断方法[4]。故食管鳞癌患者在确诊时已有50%以上为中晚期[5],其5年生存率在淋巴结无转移时为20%~30%,而有淋巴结转移时仅为13%[6]。尽管传统的血清肿瘤标志物,如癌胚抗原、鳞状细胞癌抗原已经被用来早期诊断和检测某些肿瘤的动态变化[7,8],但这些血清肿瘤标志物与食管鳞癌之间缺乏足够的灵敏度和特异性。因此,寻找敏感、特异的食管鳞癌早期检测的生物标志物既是降低发病率和死亡率的迫切需求,也成为当前研究的一个活跃 领域。
1 血清miRNAs作为食管鳞癌诊断的生物标志物
食管鳞癌的发病机制尚不清楚[9,10],到目前为止,虽然有报道发现基因突变存在于食管鳞癌患者中[11],但这些基因突变与肿瘤的发生和发展之间的因果关系并不明了,而且人们还尚未发现特异地诱发食管鳞癌病变的基因突变[10]。MicroRNAs(miRNAs)是一类在序列上高度保守的内源性非编码单链小RNA,长约19~25个核苷酸[12,13]。miRNAs在许多基因的转录后调控中发挥重要的作用[12,14]。每一个miRNA可以识别数百个靶基因的mRNAs,单个miRNA的失调可以影响整个基因网络[14,15]。miRNAs基因总数远少于mRNAs,是易于筛选和验证的生物标志物[15]。不同的癌症类型具有特异miRNAs表达谱[16]。此外,在癌症的发生、发展、转移和治疗中miRNAs异常变化可以阐明癌症的演变机理。因此,越来越多的研究人员正在将研究重点转向miRNA和肿瘤之间的关系上。由于血清miRNA容易获得,是一个相对无创的采样方式[6,16],同时由于血清miRNA非常稳定,重现性好,可以抵抗RNase A的消化和苛刻的环境(如反复冻融、长时间室温放置、过酸过碱、极端pH等)[17],所以自2008年首次报道循环miRNA可作为潜在的肿瘤诊断工具后[18],关于血清miRNAs作为诊断、预后和早期预测人类疾病的科学文献呈现指数增长[19]。其中一些研究发现,血清miRNAs含量具有肿瘤特异性改变,说明血清miRNAs具有作为癌症生物标志物的潜能[20]。
到目前为止,相对于血清miRNAs在其他癌症类型的广泛研究,它们在食管鳞癌中的研究匮乏。张春妮课题组以miR-25、miR-100、miR-193-3p、miR-194、miR-223、miR-337-5p、miR-483-5p为一组,在111例ESCC病人和111例正常人中检测它们的含量变化和以miR-22、miR-100、miR-10a、miR-148b、miR-223、miR-133a、miR-127-3p为另一组,在290例ESCC病人和140例正常人中检测它们的含量变化,结果发现这些血清miRNAs在ESCC病人中含量均显著高于正常人,而在其他肿瘤中无此变化,从而提出这两种组合可作为食管鳞癌的诊断标志物[6,21]。此外,许多研究对血清miRNAs受试者工作特征曲线(Receiver operating characteristic curve, ROC)进行分析,并计算ROC曲线下面积(Area under curve, AUC)来评估候选的血清/血浆miRNAs对食管鳞癌的预测能力。对20种miRNAs ROC曲线分析表明,AUC范围在0.593~1.000,敏感性在47.1%~88.6%,特异性在70%~100% (详见表1)。AUC越接近1,准确性越高[22],相关文献中AUC大多数都显示较高的准确性,而同一实验室测定相同血清miRNA的AUC,有时差别很大[21]。一种血清miRNA作为肿瘤诊断标志物往往特异性较低,若测定多种miRNAs组合和miRNA表达谱可提高诊断的准确性,但是后者测定费时且费用较高,影响其广泛应用。因此,选择适当的miRNA测定其比率变化则可以用较少的测定获得较高的准确性。Komatsu等[7]研究结果显示,用血浆中miR-21和miR-375含量的比率变化作观测指标,可以改善血浆的miRNA用作诊断的生物标志物的灵敏度和特异性。相对单个miRNA的AUC,miR-21和miR-375含量比率的AUC值为0.816。在血浆中,miR-21 和miR-375含量的比率可以区分健康人和食管癌患者,具有88%的敏感性和70%的特异性。
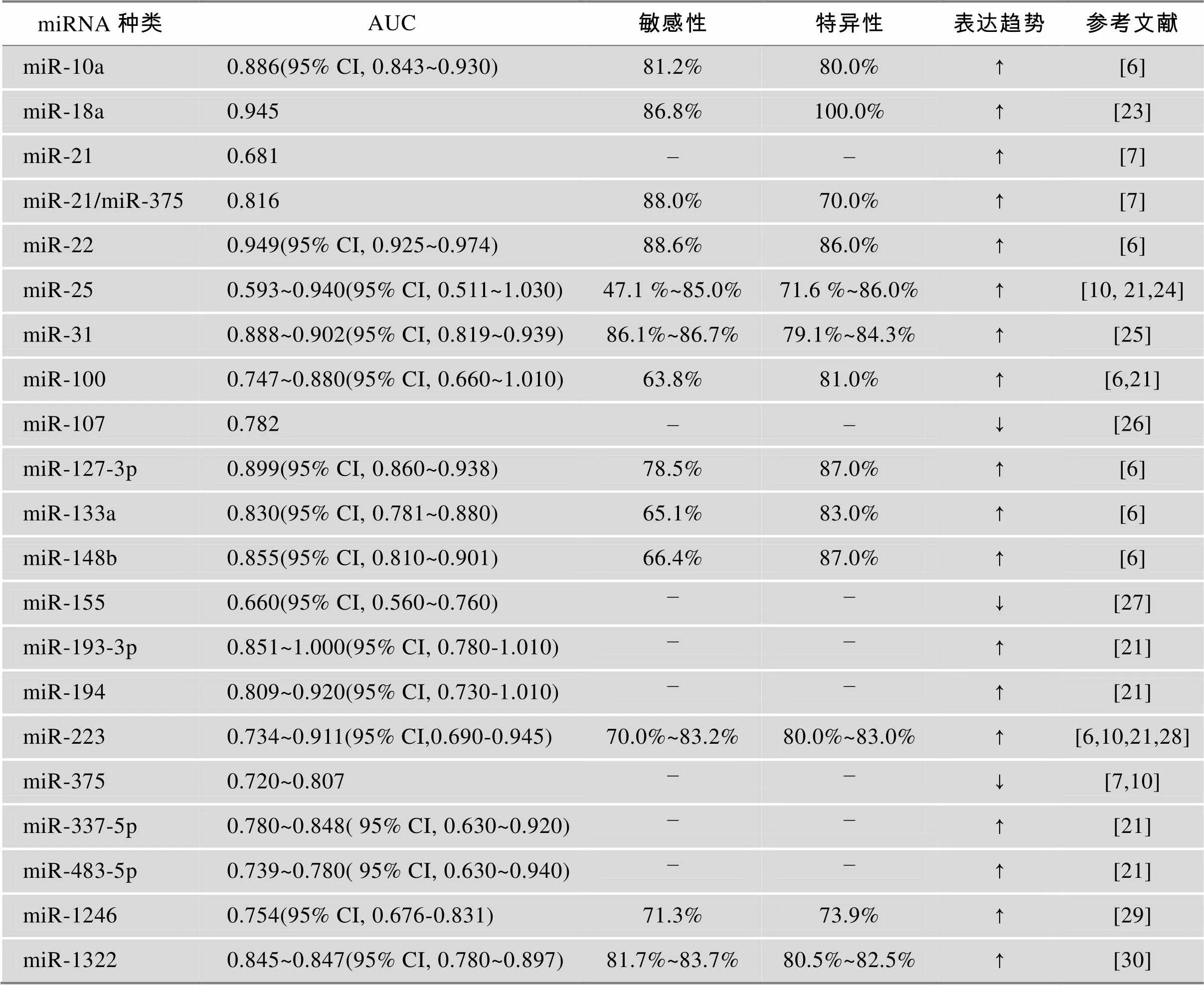
表1 ESCC血清miRNA ROC曲线相关数据分析
注:“–”表示数据未详细显示;表达趋势:食管癌病人与正常人血清miRNA相比含量增高(↑)或含量下降(↓)。
Wang等[31]用Meta-analysis方法进行分析后认为:食管鳞癌血清miRNAs可以作为一种新的微创、具有优越诊断特性的生物标志物。相比于唾液miRNAs,血浆/血清miRNAs具有更好的诊断特性。
2 血清miRNAs作为食管鳞癌预后的生物标志物
食管鳞癌是一种预后不良的疾病。最近的研究表明,血清miRNAs与食管鳞癌预后相关,这表明它们也可作为预后分类的潜在标志物,有助于在食管鳞癌早期筛选出适当的治疗方法[5]。如miR-25可作为抑癌基因,抑制结肠直肠癌和甲状腺未分化癌的细胞增殖。然而miR-25也可以抑制和的表达,从而促进肿瘤细胞迁移和侵袭[10]。miR-375也是一个肿瘤抑制基因,其表达水平在各种癌症中经常下调[10]。此外,miR-223和miR-375的表达水平不受新辅助放化疗的影响[10]。血清miR-25、miR-223和miR-375异常变化也存在于食管癌患者。食管鳞癌的预后与血清miR-25、miR-223和miR-375的异常变化有关。在血清中,高水平的miR-223、低水平的miR-375患者预后差[10]。血清miR-223和miR-375的异常变化与食管癌患者的性别、饮酒史和临床病理特征之间无显著关联[10]。而miR-155与年龄无相关性,与家族史、饮酒、抽烟史和淋巴细胞介导的免疫功能有关,其在癌组织中含量增高,血清中含量下降[27]。miR-1246含量在血清中增加,在食管鳞癌组织中不增加。
晚期食管癌(T-Ⅲ、Ⅳ期)血清miR-1246含量高于T-Ⅰ、Ⅱ期,在近端淋巴结含量也增高[29]。miR-31也有病理阶段差异,Ⅲ期高于Ⅰ期,77.8%病例癌组织中含量增高,手术后miR-31含量下降[25]。miR-18a含量在血清、癌组织、癌细胞株均增高,手术后显著下降[23]。血清miR-21含量与肿瘤组织大小呈正相关,晚期肿瘤时其含量显著增高。比较手术前后和化疗敏感者化疗前后miR-21的含量变化,手术后和化疗后miR-21含量下降的病例预后较好[32]。血清miRNA既可来自癌组织,也可来自正常组织。在血清中miRNA与蛋白质、脂类、外分泌体等形成复合物,从而保持较高的稳定性。有些来自正常组织的血清miRNA可以作用于肿瘤细胞,补充癌细胞内下降的miRNA。一旦这种作用不能发挥,肿瘤细胞将进入转移阶段。因此,血清miRNA的高低可以反映肿瘤发展的动力学变化,对肿瘤的诊断治疗和预后提供生物标志物[3]。
3 血清miRNAs在检测方法上的挑战
血清miRNAs的主要检测方法有:芯片技术、RT-qPCR、Northern杂交、原位杂交、高通量测序等。当用低密度、Solexa、美国昂飞、安捷伦、Toray 3D-Gene microRNA高通量检测食管鳞癌的血清/血浆miRNA表达谱[6,21,24,29,33,34]时,所检测到的miRNAs的差异数量从11~219个不等,而且重复率极低。不同实验室用相同的芯片技术或同一实验室用不同的芯片技术检测时,miRNAs表达差异数量不大,但种类差异较大[6,21,33,34]。由此可见,实验操作是一个关键因素。同样,同一个实验室将芯片实验结果用RT-qPCR进行验证,也不能得到完全一致的结果[33,35],不同实验方法之间存在明显不一致性。
血清miRNA检测结果缺乏一致性的主要原因在于miRNA提取方法、量化和数据分析。血清miRNAs提取的方法影响miRNAs的最终检测结果。有71%的报道支持提取血清/血浆总的miRNAs,5%的文献支持提取富集的miRNAs,而至今为止没有统一的定论[19]。比较酚、Trizol和试剂盒提取方法,不难发现,除酚提取方法外,其他方法对血清都进行一定比例的稀释,尤其是试剂盒的稀释倍数最大,这样有利于减低血清蛋白含量[36]。另外,Trizol和试剂盒的蛋白质主要变性剂除酚外,还有异硫氰酸胍,能更有效地使蛋白质变性。试剂盒中加入层析方法回收miRNAs有利于提高miRNAs的纯度。由于血液中存在相当大量的蛋白质、脂质、细胞碎片和污染组分会覆盖样品间的差异,从而影响血清miRNAs的提取效率和富集程度[19]。静脉血周围的许多变量也影响血清miRNAs的定量检测,如抗凝剂类型[19]、溶血[37]、个体空腹状态[19]等。最后,血液采集方法和处理时间不同时也会影响miRNA的检测效果。
数据的标准化和规范化是准确定量分析血清miRNAs的关键。虽然血清miRNA检测采用了不同的规范化方法,包括使用单位体积血清miRNA浓度、外参基因等,但至今尚未达到共识[29]。小RNA包括U6、5S、RUN44、RUN48等,经常被用作外参基因,但它们在血清中不稳定,变化相当显著[6,29,38]。一些内源miRNAs,如miR-16也用作外参基因[10,39,25,32]。为了克服量化问题,大多数学者建议用单位体积血清中miRNAs含量作为标准[6,7]或通过合成非人类miRNAs(如)作为校正手段[13,19,40]。虽然血清miRNAs的研究历史相对较短,作为一个肿瘤的诊断与预后的生物标志物,还存在许多问题,但是作为一种微创生物标志物应用于临床只是时间问题。
[1] Fu WB, Pang LJ, Chen YZ, Yang L, Zhu JB, Wei YT. The microRNAs as prognostic biomarkers for survival in esophageal cancer: a meta-analysis., 2014, 2014: 523979.
[2] Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics., 2011, 61(2): 69–90.
[3] Hong L, Han Y, Zhang HW, Zhao QC, Wu KC, Fan DM. Prognosis-related microRNAs in esophageal cancer., 2014, 14(4): 483–489.
[4] Zhou SL, Wang LD. Circulating microRNAs: novel biomarkers for esophageal cancer., 2010, 16(19): 2348–2354.
[5] Zhang C, Xue GL, Bi JW, Geng M, Chu HL, Guan YP, Wang J, Wang BC. Cytoplasmic expression of the ELAV-like protein HuR as a potential prognostic marker in esophageal squamous cell carcinoma., 2014, 35(1): 73–80.
[6] Zhang CN, Wang C, Chen X, Yang CH, Li K, Wang JJ, Dai JC, Hu ZB, Zhou XJ, Chen LB, Zhang YN, Li YF, Qiu H, Xing JC, Liang ZC, Ren BH, Yang C, Zen K, Zhang CY. Expression profile of microRNAs in serum: a fingerprint for esophageal squamous cell carcinoma., 2010, 56(12): 1871–1879.
[7] Komatsu S, Ichikawa D, Takeshita H, Tsujiura M, Morimura R, Nagata H, Kosuga T, Iitaka D, Konishi H, Shiozaki A, Fujiwara H, Okamoto K, Otsuji E. Circulating microRNAs in plasma of patients with oesophageal squamous cell carcinoma., 2011, 105(1): 104–111.
[8] Tanaka K, Yano M, Motoori M, Kishi K, Miyashiro I, Shingai T, Gotoh K, Noura S, Takahashi H, Ohue M, Yamada T, Ohigashi H, Yamamoto T, Yamasaki T, Doki Y, Ishikawa O. CEA-antigen and SCC-antigen mRNA expression in peripheral blood predict hematogenous recurrence after resection in patients with esophageal cancer., 2010, 17(10): 2779–2786.
[9] 蔡晓波, 李庆, 郭俊明, 徐进, 季林丹. MicroRNA与食管癌的研究进展. 中国细胞生物学学报, 2013, 35(9): 1405–1411.
[10] Wu CH, Li MJ, Hu C, Duan HB. Clinical significance of serum miR-223, miR-25 and miR-375 in patients with esophageal squamous cell carcinoma., 2014, 41(3): 1257–1266.
[11] Song YM, Li L, Ou YW, Gao ZB, Li EM, Li XC, Zhang WM, Wang JQ, Xu LY, Zhou Y, Ma XJ, Liu LY, Zhao ZT, Huang XL, Fan J, Dong LJ, Chen G, Ma LY, Yang J, Chen LY, He MH, Li M, Zhuang XH, Huang K, Qiu KL, Yin GL, Guo GW, Feng Q, Chen PS, Wu ZY, Wu JY, Ma L, Zhao JY, Luo LH, Fu M, Xu BN, Chen B, Li YR, Tong T, Wang MR, Liu ZH, Lin DX, Zhang XQ, Yang HM, Wang J, Zhan QM. Identification of genomic alterations in oesophageal squamous cell cancer., 2014, 509(7498): 91–95.
[12] Finnegan EF, Pasquinelli AE. MicroRNA biogenesis: regulating the regulators., 2013, 48(1): 51–68.
[13] Yu H, Duan BS, Jiang L, Lin M, Sheng HH, Huang JX, Gao HJ. Serum miR-200c and clinical outcome of patients with advanced esophageal squamous cancer receiving platinum-based chemotherapy., 2013, 6(1): 71–77.
[14] Badal SS, Danesh FR. MicroRNAs and their applications in kidney diseases., 2014, doi: 10.1007/s00467-014-2867-7.
[15] Lu J, Getz G, Miska EA, Alvarez-Saavedra E, Lamb J, Peck D, Sweet-Cordero A, Ebert BL, Mak RH, Ferrando AA, Downing JR, Jacks T, Horvitz HR, Golub TR. MicroRNA expression profiles classify human cancers., 2005, 435(7043): 834–838.
[16] Ashby J, Flack K, Jimenez LA, Duan YK, Khatib AK, Somlo G, Wang SE, Cui X, Zhong W. Distribution profiling of circulating microRNAs in serum., 2014, 86(18): 9343–9349.
[17] Chen X, Ba Y, Ma LJ, Cai X, Yin Y, Wang KH, Guo JG, Zhang YJ, Chen JN, Guo X, Li QB, Li XY, Wang WJ, Zhang Y, Wang J, Jiang XY, Xiang Y, Xu C, Zheng PP, Zhang JB, Li RQ, Zhang HJ, Shang XB, Gong T, Ning G, Wang J, Zen K, Zhang JF, Zhang CY. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases., 2008, 18(10): 997–1006.
[18] Lawrie CH, Gal S, Dunlop HM, Pushkaran B, Liggins AP, Pulford K, Banham AH, Pezzella F, Boultwood J, Wainscoat JS, Hatton CSR, Harris AL. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma., 2008, 141(5): 672–675.
[19] Jarry J, Schadendorf D, Greenwood C, Spatz A, van Kempen LC. The validity of circulating microRNAs in oncology: five years of challenges and contradictions., 2014, 8(4): 819–829.
[20] Komatsu S, Ichikawa D, Takeshita H, Morimura R, Hirajima S, Tsujiura M, Kawaguchi T, Miyamae M, Nagata H, Konishi H, Shiozaki A, Otsuji E. Circulating miR-18a: a sensitive cancer screening biomarker in human cancer., 2014, 28(3): 293–297.
[21] Wu CY, Wang C, Guan XC, Liu YX, Li DM, Zhou XJ, Zhang YN, Chen X, Wang JJ, Zen K, Zhang CY, Zhang CN. Diagnostic and prognostic implications of a serum miRNA panel in oesophageal squamous cell carcinoma., 2014, 9(3): e92292.
[22] Zou KH, O’Malley AJ, Mauri L. Receiver-operating characteristic analysis for evaluating diagnostic tests and predictive models., 2007, 115(5): 654–657.
[23] Hirajima S, Komatsu S, Ichikawa D, Takeshita H, Konishi H, Shiozaki A, Morimura R, Tsujiura M, Nagata H, Kawaguchi T, Arita T, Kubota T, Fujiwara H, Okamoto K, Otsuji E. Clinical impact of circulating miR-18a in plasma of patients with oesophageal squamous cell carcinoma., 2013, 108(9): 1822–1829.
[24] Komatsu S, Ichikawa D, Hirajima S, Kawaguchi T, Miyamae M, Okajima W, Ohashi T, Arita T, Konishi H, Shiozaki A, Fujiwara H, Okamoto K, Yagi N, Otsuji E. Plasma microRNA profiles: identification of miR-25 as a novel diagnostic and monitoring biomarker in oesophageal squamous cell carcinoma., 2014, 111(8): 1614–1624.
[25] Zhang TF, Wang QM, Zhao D, Cui YL, Cao BR, Guo LP, Lu SH. The oncogenetic role of microRNA-31 as a potential biomarker in oesophageal squamous cell carcinoma., 2011, 121(10): 437–447.
[26] Sharma P, Saraya A, Gupta P, Sharma R. Decreased levels of circulating and tissue miR-107 in human esophageal cancer., 2013, 18(4): 322–330.
[27] Liu R, Liao J, Yang M, Shi YJ, Peng Y, Wang Y, Pan EC, Guo W, Pu YP, Yin LH. Circulating miR-155 expression in plasma: a potential biomarker for early diagnosis of esophageal cancer in humans., 2012, 75(18): 1154–1162.
[28] 张燕妮, 李艳芳, 王成, 管晓翠, 陈熹, 曾科, 张辰宇, 张春妮. 食管鳞状细胞癌患者血清全基因组microRNA测序和分析. 临床检验杂志, 2012, 30(9): 641–644.
[29] Takeshita N, Hoshino I, Mori M, Akutsu Y, Hanari N, Yoneyama Y, Ikeda N, Isozaki Y, Maruyama T, Akanuma N, Komatsu A, Jitsukawa M, Matsubara H. Serum microRNA expression profile: miR-1246 as a novel diagnostic and prognostic biomarker for oesophageal squamous cell carcinoma., 2013, 108(3): 644–652.
[30] Zhang TF, Zhao D, Wang QM, Yu XY, Cui YL, Guo LP, Lu SH. MicroRNA-1322 regulates ECRG2 allele specifically and acts as a potential biomarker in patients with esophageal squamous cell carcinoma., 2013, 52(8): 581–590.
[31] Wang YY, Wang QX, Zhang N, Ma H, Gu YH, Tang HM, Xu ZG, Gao Y. Identification of microRNAs as novel biomarkers for detecting esophageal squamous cell carcinoma in Asians: a meta-analysis., 2014, 35(11): 11596–11604.
[32] Kurashige J, Kamohara H, Watanabe M, Tanaka Y, Kinoshita K, Saito S, Hiyoshi Y, Iwatsuki M, Baba Y, Baba H. Serum microRNA-21 is a novel biomarker in patients with esophageal squamous cell carcinoma., 2012, 106(2): 188–192.
[33] 彭学宏, 陈暖, 李克, 郑邦希. 食管癌外周血miRNA的研究. 中国校医, 2013, 27(5): 353–355.
[34] 曹波, 张红涛, 朱亚婷, 马媛媛. 新疆哈族食管癌血清microRNA初步筛查. 科技视界, 2014, (20): 62–63.
[35] 彭学宏, 陈暖, 李克, 郑邦希. 实时荧光定量PCR检测食管癌循环miRNA的研究. 中国实用医刊, 2014, 41(6): 1–2.
[36] Kroh EM, Parkin RK, Mitchell PS, Tewari M. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR (qRT-PCR)., 2010, 50(4): 298–301.
[37] Kirschner MB, Kao SC, Edelman JJ, Armstrong NJ, Vallely MP, van Zandwijk N, Reid G. Haemolysis during sample preparation alters microRNA content of plasma., 2011, 6(9): e24145.
[38] Hunter MP, Ismail N, Zhang XL, Aguda BD, Lee EJ, Yu LB, Xiao T, Schafer J, Lee MLT, Schmittgen TD, Nana-Sinkam SP, Jarjoura D, Marsh CB. Detection of microRNA expression in human peripheral blood microvesicles., 2008, 3(11): e3694.
[39] Tanaka Y, Kamohara H, Kinoshita K, Kurashige J, Ishimoto T, Iwatsuki M, Watanabe M, Baba H. Clinical impact of serum exosomal microRNA-21 as a clinical biomarker in human esophageal squamous cell carcinoma., 2013, 119(6): 1159–1167.
[40] Tanaka K, Miyata H, Yamasaki M, Sugimura K, Takahashi T, Kurokawa Y, Nakajima K, Takiguchi S, Mori M, Doki Y. Circulating miR-200c levels significantly predict response to chemotherapy and prognosis of patients undergoing neoadjuvant chemotherapy for esophageal cancer., 2013, 20(S3): 607–615.
(责任编委: 吴晨)
Serum miRNAs as new biomarkers for esophageal squamous cell carcinoma
Yingying Li1, Zhiguang Liu2, Li Wang1, Yuanyuan Yuan1, Ping Liu2, Linsong Wang1
Esophageal squamous cell carcinoma (ESCC) is one of the most common types of malignancies in China. Most ESCC patients are diagnosed at middle to late stages with poor prognosis due to the lack of an effective method for early diagnosis. MicroRNAs (miRNAs) are a family of endogenous small non-coding RNAs that can regulate ESCC development and progression by repressing their specific target genes’ expression. Compared to traditional biomarkers (e.g., mRNAs and proteins), miRNAs are more stable and can be readily screened and accurately quantitated and analyzed, making them ideal new-generation of biomarkers for early cancer detection and prognostic evaluation. Recent studies have shown that the changes of the expression levels of some serum miRNAs from ESCC patients significantly correlate with their diagnostic and prognostic outcome. In this review, we summarize the trend of the expression changes of miRNAs in ESCC patients’ serum and discuss the possibility of detecting these miRNAs’ expression changes as a novel method for ESCC early diagnosis and prognostic evaluation. Notably, the results of serum miRNAs from different detection methods are not completely consistent. Thus, we also discuss several possible reasons for such inconsistency.
serum; miRNA; esophageal squamous cell carcinoma
2014-12-15;
2015-01-21
新乡市重大科技攻关项目(编号:ZG13002)资助
李迎迎,在读硕士研究生,专业方向:生物化学与分子生物学。E-mail: liyingly47@163.com
王林嵩,博士,教授,研究方向:生物化学与分子生物学。E-mail: wls@htu.cn
10.16288/j.yczz.14-441
2015-3-11 9:21:32
http://www.cnki.net/kcms/detail/11.1913.R.20150311.0921.006.html
