白蛾黑基啮小蜂寄生对杨小舟蛾蛹血细胞包囊反应的影响及其毒液对蛹的毒性研究
2015-02-03于艳华郭加忠郭同斌宋明辉颜学武徐州市森林病虫防治检疫站江苏徐州009高邮市京杭运河管理处江苏高邮5600湖南省林业科学研究院湖南长沙40004
于艳华,郭加忠,郭同斌*,宋明辉,颜学武(.徐州市森林病虫防治检疫站,江苏 徐州 009;.高邮市京杭运河管理处,江苏 高邮 5600;.湖南省林业科学研究院,湖南 长沙 40004)
白蛾黑基啮小蜂寄生对杨小舟蛾蛹血细胞包囊反应的影响及其毒液对蛹的毒性研究
于艳华1,郭加忠2,郭同斌1*,宋明辉1,颜学武3
(1.徐州市森林病虫防治检疫站,江苏徐州221009;2.高邮市京杭运河管理处,
江苏高邮225600;3.湖南省林业科学研究院,湖南长沙410004)
摘要:测定了白蛾黑基啮小蜂(Tetrastichus nigricoxae)的寄生对寄主杨小舟蛾(Micromelalopha troglodyta)蛹血细胞包囊反应的影响及其毒液对蛹的毒性。结果表明,杨小舟蛾蛹血细胞具有很强的包囊异物能力,而在白蛾黑基啮小蜂毒液的作用下这种能力会丧失,因而白蛾黑基啮小蜂的卵能在寄主蛹中顺利完成世代发育,而不被包囊。Sephadex A-25珠被注入蛹内24 h后的被包囊率高达94.00%。白蛾黑基啮小蜂寄生早期(寄生0~2 h后)不影响寄主蛹的血细胞免疫反应,寄生后期(寄生24,48 h后)杨小舟蛾蛹的血细胞免疫反应受到较大影响。γ射线辐射处理的白蛾黑基啮小蜂寄生蛹包囊能力的变化与正常白蛾黑基啮小蜂寄生蛹相似,随着寄生后时间延长而下降。白蛾黑基啮小蜂毒液对杨小舟蛾蛹的血细胞免疫反应有抑制作用,且具有一定的毒性。
关键词:白蛾黑基啮小蜂;杨小舟蛾;包囊反应;毒液
Effect of parasitism of Tetrastichus nigricoxae Yang on the encapsulation response of its host,Micromelalopha troglodyta Graeser pupae and toxicity of its venom to pupal host
YU Yan-hua1,GUO Jia-zhong2,GUO Tong-bin1*,SONG Ming-hui1,YAN Xue-wu3
(1.Forest Pest Management and Quarantine Station of Xuzhou,Xuzhou 221009,China; 2.Gaoyou Administration Office of Grand Canal,Gaoyou 225600,China;3.Hunan Academy of Forestry,Changsha 410004,China)
Abstract:Experiments were made to determine the effect of parasitism of Tetrastichus nigricoxae Yang on the encapsulation response of its host,Micromelalopha troglodyta Graeser pupae and toxicity of its venom to pupal host.We found out that the hemocyte-mediated encapsulation towards the injected Sephadex A-25 beads in the pupae of M.troglodyta was as high as 94.00%.This ability would lose after being parasitised by T.nigricoxae Yang.Parasitism did not affect in vivo encapsulation response of pupae to injected Sephadex A-25 beads in early stage (0~2 h after parasitism),but did affect the response in later stage (24 and 48 h after parasitism).Pseudoparasitism trigged by C60-γ ray irradiation influenced host’s encapsulation in a similar way as normal parasitism,and the parsitized and pseudoparasitized pupae both died about 48 h after parasitism.The injection of venom could lead the recipient pupae to death,confirming a toxic action of venom.
Key words:Tetrastichus nigricoxae Yang;Micromelalopha troglodyta Graeser;Encapsulation response;Venom
寄生蜂与寄主在长期协同进化过程中形成一系列复杂的相互作用,其中以寄主和寄生蜂之间的防御与反防御作用尤为重要,寄主昆虫清除体内一些较大入侵物(如寄生蜂卵)时,主要采取包囊反应形式[1]。当侵入昆虫血腔内的外源物太大不能被血细胞吞噬时,昆虫血细胞常会在外源物外形成一层或多层鞘状物包囊外源物。非生物性物质如玻璃、尼龙、Parafilm膜、塑料、胶体金颗粒和生物性物质
如原生生物、细胞、真菌、线虫、寄生蜂卵等都可激发昆虫血细胞包囊[2]。本研究的寄生体系是白蛾黑基啮小蜂(Tetrastichus nigricoxae Yang)和杨小舟蛾(Micromelalopha troglodyta Graeser)。白蛾黑基啮小蜂是1种群聚性抑性蛹寄生蜂,是杨忠岐等报道的中国1新种记录,主要寄生杨小舟蛾、美国白蛾(Hyphantria cunea)和杨毒蛾(Stilpnotia candida)等,其生物学与繁殖利用研究已有报道[3-6],但对其与寄主间相互关系的研究尚未见报道。为此,笔者研究了白蛾黑基啮小蜂的寄生对杨小舟蛾蛹的包囊反应以及白蛾黑基啮小蜂毒液的功能,为蛹寄生体系寄主蛹的免疫反应和寄生蜂抑制因子的研究提供理论依据。
1 材料与方法
1.1供试虫源
每年3月底前从林间采集杨小舟蛾越冬蛹,采用文献[7]的方法进行室内继代饲养繁殖。从林间采集的杨小舟蛾越冬蛹中收集白蛾黑基啮小蜂,在室内以杨小舟蛾蛹为寄主进行繁殖。
1.2试验方法
1.2.1杨小舟蛾蛹对白蛾黑基啮小蜂卵的包囊反应取1~5 d龄杨小舟蛾蛹,接入交配过的白蛾黑基啮小蜂雌蜂1头让其产卵。24 h后解剖,寻找蜂卵,观察它们的包囊情况。每组解剖10头蛹,重复3次。
1.2.2毒液收集与对杨小舟蛾蛹的毒性测定将雌成蜂用5%乙醚麻醉,在JSZ20TRPT连续变倍体视显微镜(南京江南光电股份有限公司产)下,在Pringle生理盐水中用尖嘴镊夹住小蜂腹部末端,轻轻拉出生殖系统,找到毒液器官并沿与卵巢相连的导管末端小心切下,并拍照[8]。
参照Digilio等[9]的方法,解剖啮小蜂毒腺,用解剖针将毒囊全部撕破,收集到灭菌的Eppendorf管内,离心(13 000 r/min,4℃,10 min)后,放于-20℃下保存备用。白蛾黑基啮小蜂毒液储液囊中的蛋白含量按照Bradford法,用752紫外光栅分光光度计在595 nm处测OD值,以牛血清蛋白作标准曲线。用灭菌生理盐水配制成与小蜂毒液蛋白浓度相等的毒液,将0.5,0.4,0.3,0.2,0.1,0.05,0.01和0.001 μL的毒液分别注入1 d龄未寄生蛹体内。注射前用酒精棉球擦拭蛹体,注射后将蛹放入温室中,隔日观察它们的生长发育情况。对照组(CK1)注入1 μL灭菌生理盐水。每组1次注射15头,重复3次。为了证实毒液提取液的活性,再将装有毒液提取液的epperdorf管放在沸水中加热5 min,冷却后注入1 d龄蛹体内(CK2),观察蛹的生长发育情况。
1.2.3白蛾黑基啮小蜂雌蜂辐射处理和假寄生参照Stettler等[10]和蔡峻等[11]的方法,用剂量为50 Gy的Co60辐射2~3 d龄啮小蜂雌蜂30 min(简称辐射蜂),然后寄生杨小舟蛾1 d龄蛹。辐射蜂可以正常产卵并将毒液等其他因子注入寄主体内,但所产的卵不孵化,这种寄生被称为假寄生。寄生2 h后取出,用于包囊试验或观察被寄生蛹的生长发育和死亡情况。
1.2.4非生物体包囊试验参照任丹青等[1]的方法,将Sephadex A-25珠在体积分数为95%酒精中浸泡3 h,再用质量浓度为10 g/L的刚果红试剂染色1 h,然后用Pringle生理盐水清洗并在紫外灯下照射灭菌,使用时加生理盐水稀释。注射时用毛细管吸取5粒Sephadex A-25珠,从蛹腹部第2与3体节之间注入体内。注射试验的昆虫为1~5 d龄未寄生蛹、寄生蛹(啮小蜂寄生1 d龄蛹2 h后)、假寄生蛹和毒液注射蛹(注射1 d龄未寄生蛹,毒液注射量为1个毒液储液囊内的毒液蛋白质量),以生理盐水注射1 d龄未寄生蛹(注射量为1 μL)为对照。1~5 d龄未寄生蛹于注射Sephadex A-25珠24 h后在相差显微镜下解剖蛹并观察Sephadex A-25珠被包囊的情况;其余处理分别于注射Sephadex A-25珠0~2,24,48 h后解剖、观察包囊情况。每组1次注射10头蛹,重复3次。
1.2.5数据分析采用SAS统计软件多重比较重复t检验法检验各处理指标间差异的显著性[12]。
2 结果与分析
2.1杨小舟蛾蛹对白蛾黑基啮小蜂寄生卵的包囊情况
1,2,3,4 d龄杨小舟蛾蛹均不能包囊白蛾黑基啮小蜂的卵(见图1A),当蛹发育到5 d龄时,开始出现包囊现象(图1B),其包囊率可上升到30.0%,与其他日龄的包囊率之间存在极显著差异(P<0.01)。
2.2毒液对杨小舟蛾蛹的毒性
白蛾黑基啮小蜂毒腺由3根丝状腺体和1个泪滴状毒液储液囊组成,整个腺体透明、清澈,且无色(见图2),其基部与产卵器和卵巢相通。白蛾黑基
啮小蜂毒液由大量蛋白质组成,经过测定,1个白蛾黑基啮小蜂毒液储液囊的毒液蛋白含量为(2.25± 0.05)μg。
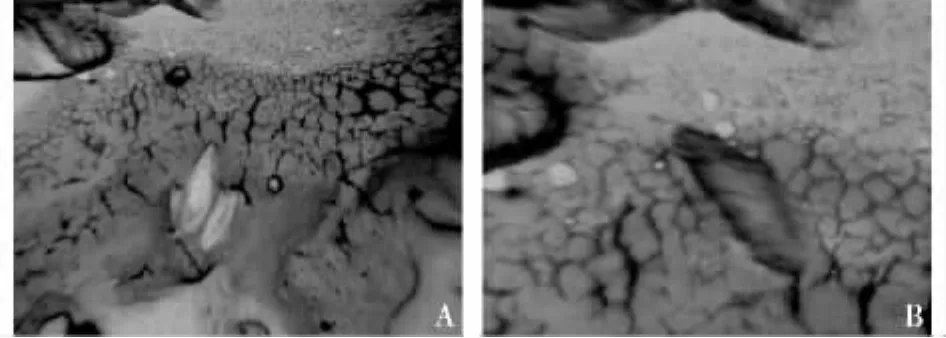
图1 杨小舟蛾蛹体内未包囊与被包囊的小蜂卵(A.未包裹,B.被包囊)
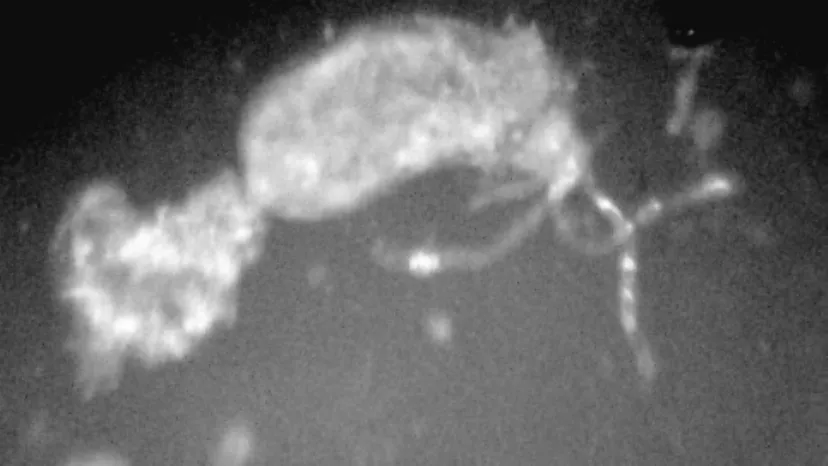
图2 白蛾黑基啮小蜂的毒腺
白蛾黑基啮小蜂毒液对杨小舟蛾蛹的毒性试验结果(见表1)表明,白蛾黑基啮小蜂毒液对杨小舟蛾蛹具有很高的致死率,注射0.3 μL以上的毒液对蛹的致死率均为100%。加热能使毒液中的蛋白成分失活,可见白蛾黑基啮小蜂毒液中存在对杨小舟蛾蛹有毒害成分。
2.3杨小舟蛾蛹的细胞免疫反应能力
被包囊的SephadexA-25珠按包囊程度可分为3个等级:表面光洁无物或有几个血细胞粘附为未包囊(图3A) ;周围明显有血细胞堆积,但没有成层现象为弱包囊(图3B) ;珠子明显被紧密的、已呈现扁平状的血细胞形成的鞘状物包围为强包囊(图3C)。
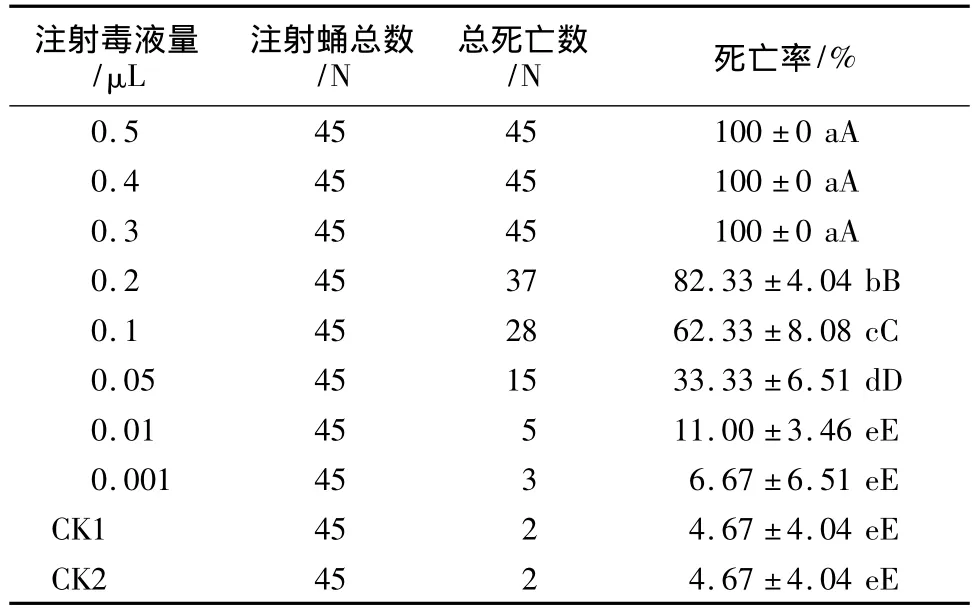
表1 白蛾黑基啮小蜂毒液对杨小舟蛾蛹的毒性

图3 Sephadex A-25珠的包囊程度(A.未包囊,B.弱包囊,C.强包囊)
1~5 d龄杨小舟蛾未寄生蛹对Sephadex A-25珠的包囊试验结果表明,Sephadex A-25珠被注入蛹内24 h后,1~3 d龄蛹的强包囊率高为80.00%~94.00%,4~5 d龄蛹的强包囊率显著下降,与1~2 d龄存在极显著差异(P<0.01),5 d龄蛹的包囊率已下降到59.33%。随着蛹日龄的增长,未包囊与弱包囊珠子所占的比率也相应增加(见表2)。因此,杨小舟蛾蛹具有较强的包囊入侵异物的能力,随着蛹日龄的增长,包囊能力呈下降趋势。
不同寄主蛹对Sephadex A-25珠的包囊情况见表3。寄生蛹的包囊率随着被寄生后时间的延长,
从0~2 h的94.00%下降到24 h的62.67%,再进一步下降到48 h的8.67%,差异均达极显著水平(P<0.01) ;假寄生蛹寄生后不同时间包囊率的变化和寄生蛹相似,包囊率之间的差异显著性水平P <0.05。被寄生0~2 h后寄生蛹的包囊率(94.00%)显著高于假寄生蛹和未寄生蛹(分别为72.67%和69.33%) (P<0.05) ;被寄生24 h后,这2种寄生蛹的包囊率均低于未寄生蛹,但差异不显著;被寄生48 h后它们的包囊率分别下降至8.67% 和28.00%,极显著低于未寄生蛹的86.67% (P<0.01),包囊能力大大减弱。因此,白蛾黑基啮小蜂寄生初期杨小舟蛾蛹仍具有较强包囊异物的能力,但寄生后期寄主血细胞免疫反应力显著下降。
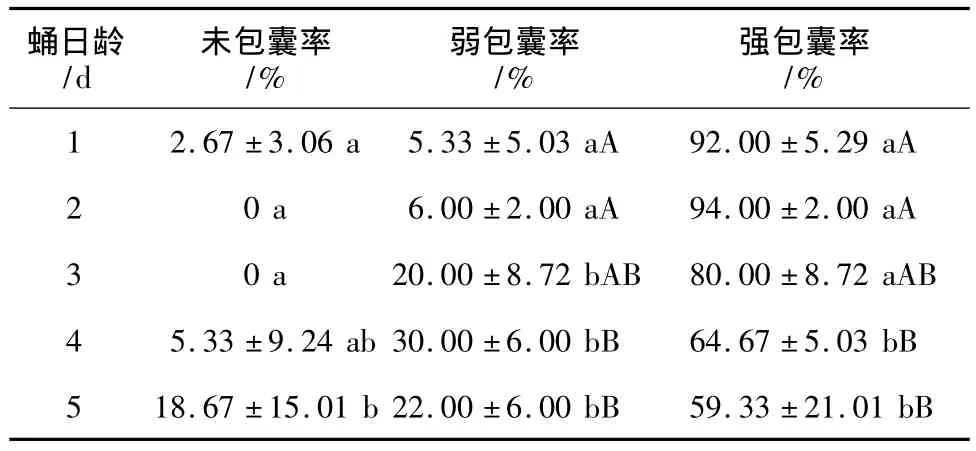
表2 1~5 d龄杨小舟蛾未寄生蛹对Sephadex A-25珠的包囊率

表3 处理后不同时间寄生蛹、假寄生蛹、毒液注射蛹和未寄生蛹包囊率 %
毒液注射蛹的包囊能力和未寄生蛹、寄生蛹、假寄生蛹的比较结果(见表3)表明,注射1个毒液储液囊毒液量0~2 h后,杨小舟蛾蛹的包囊率为94.67%,与寄生蛹的包囊率无显著差异,但显著高于假寄生蛹和未寄生蛹(P<0.05) ;注射24 h后毒液注射蛹的包囊率下降至56.00%,与0~2 h的差异不显著,与同期未寄生蛹、寄生蛹和假寄生蛹之间的包囊率也都无显著差异;注射48 h后毒液注射蛹的包囊率明显降低(34.00%),与0~2 h的差异显著(P<0.05),但高于同期2种寄生蛹[与假寄生蛹的包囊率无显著差异,与寄生蛹差异显著(P<0.05)],极显著低于同期未寄生蛹(P<0.01)。可见,毒液注射蛹注射后不同时间的包囊率变化也与上述2种寄生蛹相似,随着注射时间延长,包囊能力呈下降趋势,即注射初期的毒液注射蛹也具有较强的包囊异物能力,后期包囊能力显著减弱,减弱程度显著低于寄生蛹(P<0.05)。
3 讨论
白蛾黑基啮小蜂是蛹寄生蜂,解剖白蛾黑基啮小蜂生殖器官时发现,产卵前雌蜂的毒液储液囊透明且充满毒液,呈椭圆形,而刚产过卵的雌蜂毒液储液囊明显变得扁平。这表明白蛾黑基啮小蜂产卵时将毒液注入寄主蛹体内,毒液在这一抑性寄生体系中很可能起重要作用。在寄生的杨小舟蛾蛹中,除5 d龄蛹中有30%的啮小蜂寄生卵被包囊外,其他日龄的寄生蛹中均未发现蜂卵被包囊现象,可见白蛾黑基啮小蜂寄生可以有效地避开蛹的免疫反应。笔者在调查蛹龄对白蛾黑基啮小蜂接受寄主的影响时发现,白蛾黑基啮小蜂对杨小舟蛾蛹的寄生率由1 d龄蛹的92.59%下降至5 d龄蛹的14.81%[13],这可能与5 d龄蛹中部分蜂卵被包囊的原因有关。杨小舟蛾蛹血细胞具有很强的包囊异物能力,而在白蛾黑基啮小蜂毒液的作用下这种能力会丧失,因而小蜂的卵能在寄主蛹中顺利完成世代发育,不被杨小舟蛾蛹的血细胞包囊。1~3 d龄蛹都能较强地包囊侵入其体内的Sephadex A-25珠。至于4~5 d龄蛹包囊率下降则与它们体内血淋巴量的减少有关。
有报道认为,被寄生寄主血细胞免疫能力的变化情况大致有2种:在某些体系(Heliothis virescens-Campoletis sonorensis或者H.virescens-Cardiochiles nigriceps)[14-15]中,被寄生寄主昆虫仍可以包囊其他入侵异物;在另外一些体系(Pseudaletia separata-Microplitis mediator和Pseudoplusia includens-M.demolitor)[16-17]中,被寄生寄主昆虫的免疫能力被全面抑制,不能包囊其他异物。杨小舟蛾蛹免疫体系属于前者,它被白蛾黑基啮小蜂寄生0~2 h后,对侵入其体内的SephadexA-25珠的包囊率高达94.00%,可见白蛾黑基啮小蜂寄生并不立刻破坏或抑制杨小舟蛾蛹血细胞免疫反应;寄生24 h后蛹的包囊能力虽有所下降,但仍达62.67%;寄生48 h后降至8.67%。这一结果表明,寄生蛹的血细胞免疫反应没有被白蛾黑基啮小蜂的寄生全面破坏,早期被寄生蛹的血细胞仍具有识别并包囊其他入侵异物的能力,但不能包囊白蛾黑基啮小蜂卵,后期被寄生蛹的
血细胞免疫反应呈现下降趋势。至于这种趋势是蜂卵的发育还是其他原因所致,笔者进行了假寄生试验,结果显示,辐射蜂寄生引起的假寄生蛹包囊率变化与正常蜂寄生相似,包囊能力均随寄生时间的延长而下降,与对照未寄生蛹的变化完全不同(包囊能力随时间变化无显著差异),从而证实,白蛾黑基啮小蜂寄生时注入的毒液或其他因子是直接或间接影响寄主蛹血细胞免疫反应能力的主要因子。这一研究结论与任丹青等观察啮小蜂(Tetrastichus sp)寄生对亚洲玉米螟(Ostrinia furnacalis)蛹血细胞免疫反应能力影响的研究结果基本一致[1]。2种寄生蛹和毒液注射蛹的包囊能力在寄生或注射48 h后均出现不同程度的下降,假寄生蛹与毒液注射蛹的下降程度无显著差异,但都显著低于寄生蛹(P<0.05)。这一结果表明,除毒液或其他因子影响蛹血细胞免疫能力外,蜂卵的发育也可能对杨小舟蛾蛹血细胞免疫反应能力存在一定的影响,其原因有待进一步研究。
白蛾黑基啮小蜂的毒液对杨小舟蛾蛹有较强的毒性。注射0.3 μL以上的毒液就能使寄主蛹全部死亡,在低剂量下,致死率随着剂量减少而下降。试验过程中发现,部分毒液注射蛹的蛹期延长,但它们仍不能羽化而死亡,其体内的脂肪体和组织器官可较长时间地保持新鲜状态,为寄生蜂在寄主体内生长发育提供了良好的营养环境。早期(0~2 h)毒液注射蛹对Sephadex A-25珠的包囊率高达94.67%,而在24 h出现了明显下降,48 h又进一步下降。这也与未寄生蛹不同,但与寄生蛹、假寄生蛹均有类似的变化趋势。因此,白蛾黑基啮小蜂的毒液在控制杨小舟蛾蛹血细胞的免疫反应,保护自身所产的卵不被包囊等方面起到了十分重要的作用。
参考文献:
[1]任丹青,邱鸿贵,茅洪新,等.啮小蜂寄生对亚洲玉米螟蛹血细胞包囊反应的影响及毒液对蛹的毒性研究[J].河南农业大学学报,2004,38(4) :427-431.
[2]Gotz P,Boman H G.Insect Immunity[M]//Kerkut G A,Gilbert L I.Comprehensive Insect Physiology,Biochemistry and Pharmacology.Oxford: Pergamon Press,1985:453-485.
[3]杨忠岐,魏建荣.寄生于美国白蛾的黑棒啮小蜂中国二新种(膜翅目:姬小蜂科)[J].林业科学,2003,39(5) :67-73].
[4]颜学武,郭同斌,蒋继宏,等.白蛾黑基啮小蜂的生物学特性[J].南京林业大学学报:自然科学版,2008,32(6) :29-33.
[5]郭同斌,颜学武.黑棒啮小蜂种团(膜翅目姬小蜂科)寄生蜂研究进展[J].南京林业大学学报:自然科学版,2011,35 (6) :127-133.
[6]郭同斌,王虎诚,徐克勤,等.白蛾黑基啮小蜂的人工繁殖及其对杨小舟蛾的防治效果[J].南京农业大学学报:自然科学版,2010,33(5):81-86.
[7]郭同斌,嵇保中,诸葛强,等.转Bt基因杨树(NL-80106)对杨小舟蛾抗虫性研究[J].南京林业大学学报:自然科学版,2004,28(6) :5-9.
[8]Pringle J W S.Proprioreception in insects[J].Journal of Experimental Biology,1938(15) :101-103.
[9]Digilio M C,Pennacchio F,Tremblay E.Host regulation effects of ovary fluid and venom of Aphidius ervi (Hymenoptera: Braconidae)[J].Journal of Insect Physiology,1998,44(9) :779-784.
[10]Stettler P,Trenczek T,Wyler T,et al.Overview of parasitism associated effects on host haemocytes in larval parasitoids and comparison with effects of the egg-larval parasitoid Chelonus inanitus on its host Spodoptera littoralis[J].Journal of Insect Physiology,1998,44(9) :817-831.
[11]蔡峻,吕慧平,叶恭银,等.假寄生对菜粉蝶蛹血细胞总数和包囊能力的影响[J].浙江大学学报:农业与生命科学版,2001,27(1) :15-18.
[12]高惠璇,李东风,耿直,等.SAS系统与基础统计分析[M].北京:北京大学出版社,1995: 117-138.
[13]颜学武,郭同斌,蒋继宏,等.白蛾黑基啮小蜂寄主接受行为的研究[J].南京林业大学学报:自然科学版,2009,33(5):121-125.
[14]Davies D H,Strand M R,Vinson S B.Changes in differential haemocyte count and in vitro behavior of plasmatocytes from host Heliothis virescens caused by Campoletis sonorensis polydnavirus[J].Journal of Insect Physiology,1987,33:143-153
[15]Vinson S B.Defense reaction and hemocytic changes in Heliothis virescens in response to its habitual parasitoid Cardiochiles nigriceps [J].Journal of Invertebrate Pathology,1971,18(1) :94-100.
[16]Tanaka T.Morphological changes in haemocytes of the host,Pseudaletia separata,parasitized by Microplitis mediator or Apanteles kariyai[J].Developmental and Comparative Immunology,1987,11(1) :57-67.
[17]Strand M R,Noda T.Alteration in the hemocytes of Pseudoplusia includens after parasitization by Microplitis demolitor[J].Journal of Insect Physiology,1991,37(11) :839-850.
通信作者:*郭同斌(1967-),男,研究员级高级工程师,博士。E-mail: gtb1101@163.com。
作者简介:于艳华(1967-),女,江苏新沂人,高级工程师,从事林业有害生物防治技术推广工作。
基金项目:江苏省“333工程”科研项目(BRA2010027)
收稿日期:2015-04-20;修回日期:2015-04-28
文章编号:1001-7380(2015) 03-0001-05
中图分类号:Q968
文献标识码:Adoi:10.3969/j.issn.1001-7380.2015.03.001
