药品生产过程中偏差的分类研究
2015-02-03崔文波沈启雯东南大学成贤学院南京0088南京医药中等专业学校南京00上海市食品药品监督管理局上海009中国药科大学国际医药商学院南京0009
于 泳,梅 鑫,方 芳,崔文波,沈启雯(.东南大学成贤学院,南京 0088;.南京医药中等专业学校,南京 00;.上海市食品药品监督管理局,上海 009;.中国药科大学国际医药商学院,南京 0009)
药品生产过程中偏差的分类研究
于 泳1*,梅 鑫1,方 芳2,崔文波3,沈启雯4(1.东南大学成贤学院,南京 210088;2.南京医药中等专业学校,南京 211100;3.上海市食品药品监督管理局,上海 200439;4.中国药科大学国际医药商学院,南京 210009)
目的:研究药品生产过程中偏差的分类。方法:从显性偏差和隐性偏差两个角度,结合风险管理理论,借助不同的风险管理工具对偏差进行风险评估,以界定偏差的严重程度,并采用不同的方法进行处理。结果与结论:根据实际管理过程中偏差的可识别性,可将偏差分为显性偏差和隐性偏差。对于显性偏差,可进行深、浅两个层次的分类;在进行浅层次分类后,判断是否可以明确偏差的发生原因及预估其后果,将偏差进一步分为简单偏差和复杂偏差;对于复杂偏差,可借助风险管理工具进行评估,界定偏差的严重程度。对于隐性偏差,需要事前预防,直接借助风险管理工具进行评估以界定偏差等级,为预防措施提供依据。在偏差的管理过程中,关键在于依靠科学的方法对偏差进行识别、分类和对影响等级进行划分。而结合风险管理理论,进行风险工具的选择和使用是解决该问题的有效途径。
药品生产;偏差;分类;风险管理工具
对于药品生产企业而言,要想生产出质量稳定的产品,就必须要求员工严格按照既定标准和规程进行生产活动。然而,在实际工作中,偏离标准和规程的情况时有发生。于是,对这种偏差进行及时、有效的处理便成了确保药品质量稳定的关键因素。国际药品注册会议(ICH)制定的《原料药的优良制造规范指南》中对偏差的定义是:“偏离已批准的程序(指导文件)或规定标准的任何情况”[1]。这里的“程序”,指广义“生产”活动的程序文件,并不仅仅局限于生产车间的作业,而是指与生产有关的所有活动,即生产操作、包装和贴签、物料管理、工程维护、实验室控制、质量管理6大系统[2];这里的“标准”,指为确保药品质量生产企业所建立的各种技术与管理标准,但并不局限于分析检验标准[3]。我国2010年新修订的《药品生产质量管理规范》(简称“新版GMP”)第250条对偏差的定义是:“任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况”;第249条指出:“任何偏差都应当评估其对产品质量的潜在影响。生产企业可根据偏差的性质、范围、对产品质量潜在影响的程度将偏差进行分类”[4]。对于药品生产来说,偏差的产生是不可避免的,但如何对其进行科学分类和等级确定值得探讨。为此,笔者根据可识别的方式,将偏差分为显性偏差和隐性偏差,然后结合风险管理理论,借助不同的风险管理工具对各类偏差进行风险评估,以界定其严重程度,为偏差处理提供科学、合理的依据。
1 问题的提出
在药品生产质量管理过程中,由于硬件的日常维护不到位、人员操作不规范等原因,均可能产生各种偏离原先设定标准的偏差。这些偏差对药品质量的影响是不同的,影响较大的甚至会对药品的质量、安全性或有效性产生严重后果而导致其报废。而如何对这些偏差进行科学、有效的识别、分类与风险等级确定,是进行偏差管理的重要环节。
偏差的出现原因复杂、种类多样。如果仅仅按照GMP的要求将其分为重大偏差或次要偏差,未免显得过于简单,而且可能出现两种情况:第一,回避了处于“灰色地带”(对产品质量可能有影响,但也可能没有影响)的情况,从而回避展开正式调查[1]。由于回避“灰色地带”而错误界定偏差的严重程度,不仅会影响多个批次产品的质量,还会因整改措施延迟而不得不投入更多人力、物力和财力来进行补救。第二,由于偏差分类所依据的标准单一,无法对其产生的原因进行全面调查,从而忽略了很多不太容易发现而又长期存在的问题(如质量管理体系不完善),这将导致同类的偏差再次发生,无法从根源上得到解决。
根据可识别的方式,笔者将偏差分为两种:一种是显性偏差,也就是已经产生的偏差;另一种是隐性偏差,也就是潜在的偏差。为了避免主观臆测及草率分类,只有将定性和定量分析方法结合起来,加强事后评估和事前控制,采用风险管理工具全面衡量引起偏差的因素,才能使分类更加科学、合理。同时,也可为一些隐藏较深不易被发现的问题提供处理依据,从根源上解决偏差,防止其再次发生。
2 显性偏差的分类方法
对于已经产生的偏差,笔者认为可进行深、浅两个层面的分类研究。首先,根据偏差的影响范围和发生情况进行浅层次分类,这样不仅可缩小偏差的调查范围,减少不必要的工作量,而且还能快速地在指定范围内找出偏差出现的原因;其次,对于无法明确原因并预估后果的复杂偏差,则需进行深层次分类,但在进行深层次分类之前,需判断是否能明确偏差发生的原因并预估其后果,以此来划分简单偏差和复杂偏差。若为复杂偏差,则根据风险管理工具对其进行具体的定性定量分析,结合相应的风险等级进行分类,科学、合理地为偏差处理提供依据。
2.1 显性偏差的浅层次分类
根据显性偏差的发生范围,可分为:(1)生产偏差,指由于生产过程或结果中所涉及的人、机、料、工艺与环境条件引起的偏差;(2)检验偏差,指由于检验过程或结果引起的不符合标准的偏差;(3)趋势偏差,指由于质量回顾过程中发现的虽然没有偏离标准但出现明显不良趋势的偏差。或者根据显性偏差的发生情况,可分为:(1)偶发事故,指由于不可抗逆事件所造成的操作者无法控制的因素造成的偏差,如突然停电、原料中的异物等;(2)有意偏差,指由于某种原因无法按原有规定程序进行操作,但是经过批准造成的偏差,如发动机出现故障且在短期内无法修好、反应时间超过规定期限等;(3)无意偏差,指由于操作者的差错造成的偏差,如反应参数失控、物料配料核准失误等。在进行浅层次分类后,对于能够明确发生原因并预估其后果的简单偏差,无需进行深入调查,可立即采取纠正措施。
2.2 显性偏差的深层次分类
在实际生产过程中,若出现无法明确原因及带来潜在影响的复杂偏差时,仅进行浅层次分类是无法为纠偏措施提供合理依据的;同时,生产企业很有可能为了保证生产进度,对原因不明或后果无法预估的偏差进行草率纠偏,这在很大程度上是无法保证药品质量的,因此还需借助风险管理工具进行深层次分类。
对于复杂偏差,可采用风险排列和过滤(RRF)工具,对每个风险中复杂多样的定量及定性因素作出评估[1],这些因素被合并成一个单独的相对风险分值,以用于划分风险等级。在使用RRF工具进行风险评估时,可采用简单的矩阵来体现低、中、高风险的分类以及对应的偏差分类,其中1、2、3分别代表严重性和可能性的低、中、高程度。而在矩阵中严重性与可能性相乘所得的得分越高,代表风险级别越高,相应的偏差也就越大,具体见图1。
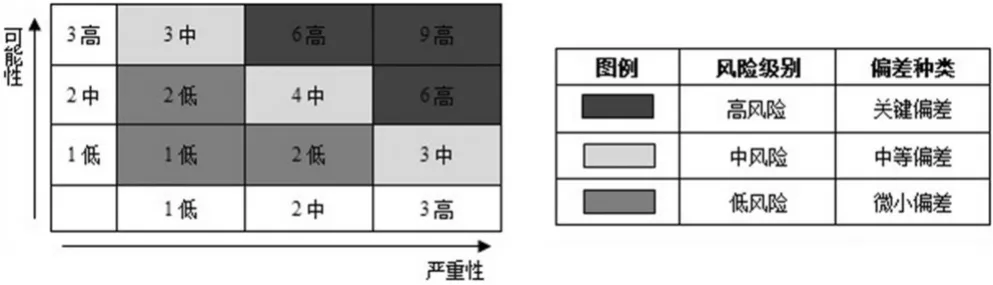
图1 用于风险评估的矩阵图以及与风险级别相对应的偏差分类Fig 1 Classification ofmatrix for risk assessment and deviation corresponded to the risk level
根据风险管理工具进行风险级别划分,可进一步将复杂偏差划分为关键偏差、中等偏差和微小偏差。在此深层次的分类基础上,可对不同风险级别的偏差采取不同的纠偏措施。为了更加具体地阐述显性偏差的分类方法,现笔者结合生产企业在日常生产过程中出现的偏差来举例说明如何对复杂偏差进行分类。
例如,某企业在清点产品A的库存时,发现其外包装袋上印刷的有效期为1年,而该产品规定的实际有效期为2年,且此时印刷错误的两批产品中已有一批进入市场,那么此时就应该意识到偏差的发生而随即进入偏差处理程序,进行风险评估和偏差级别确定,以便采取有效的纠正和预防措施。
经调查发现,产品A的外包装袋上的生产日期、批号及有效期是由生产人员打印然后进行包装的,因此排除了经仓储部门同意并领取外包装袋之前的一切可能原因,基本划定此偏差范围为生产偏差,是由于操作者的疏忽和差错造成的无意偏差。但由于已有一批产品发出,且已发出的批次无法进行返工,只能对未发出的批次依据既定程序进行返工,所以导致后续的纠偏措施比较复杂,而且很有可能发生第二次偏差,因此应该找出造成此次偏差的根本原因。
根据以上分析,此次偏差风险可分为两部分进行评估:已发出的一批产品及未发出的一批产品,并且这两部分所带来的风险并不一样。根据风险工具对这两批产品进行风险分析与评估,具体见表1。

表1 风险分析与评估Tab 1 Risk analysisand assessment
表1中的“严重性”,代表药品因包装原因导致的质量问题对消费者健康损害的程度,对严重性和可能性的赋值越高,相应的程度也就越高。将风险评估得分与图2中的风险矩阵相对比,按照矩阵中依据风险得分对偏差的分类方式,此案例中未发出的一批货存在的潜在风险属于中等风险,可将此偏差分类为中等偏差。因此,应调查此偏差发生的根本原因,并且制订具体的纠正预防措施,如对包装制订严格的清场标准操作规程(SOP)、打码双人复核制度等措施。由此不难看出,根据以上风险管理的偏差分类方法,并不仅仅解决的是当下的一次偏差,而是不断完善质量管理体系的有效手段。
3 隐性偏差的分类方法
与显性偏差相比,隐性(或称潜在)偏差的识别与防范显得更加重要和复杂。根据风险管理理论和方法,可利用失败模式和效应分析(FMEA)对隐性偏差进行风险评估和风险分级。FMEA是一种前瞻性的可靠性分析和安全性评估方法,该方法通过分析系统中每一个潜在的故障模式,确定其对系统所产生的影响,从而识别系统中的薄弱环节和关键项目,为制订改进控制措施提供依据,是一种事前预防而非事后纠正的有效方法[1]。通过对严重性(S)、可能(P)、可检测性(D)三者进行风险评估并赋值,计算风险优先指数(R)。其中,R值的大小代表风险等级高低,得分越高,风险越大。R=S×O×D。其中,3个风险因素均按5个分数级别划分(分数越高,程度越高),表2即为与相应分数级别所对应的S、O和D的具体情况[5]。
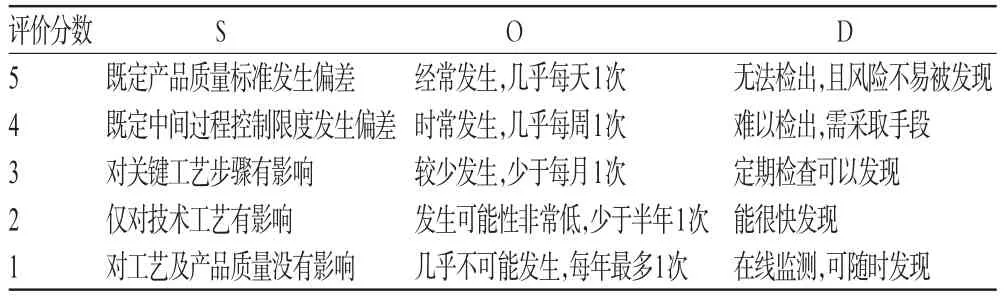
表2 FMEA风险评估参数Tab 2 Risk assessment parametersof FMEA
再依据3个风险因素不同的赋值,计算得到R值(最大为125,最小为1),确定偏差的风险级别及是否需要采取措施。表3即为不同的R值范围及所对应的偏差级别[6]。
笔者以冻干工艺为例来进行说明:根据FMEA对无菌冻干关键工艺中潜在的偏差进行分析评估,见表4。根据R值的范围进行偏差分类,筛选出关键偏差和中等偏差,针对潜在的原因制订有效的纠正预防措施。
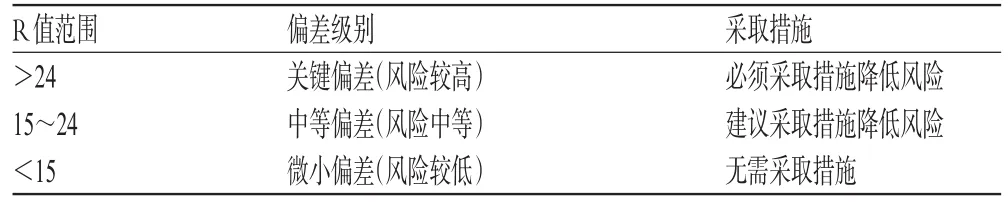
表3 与不同R值对应的偏差级别Tab 3 Deviation levels corresponded to R w ith different values

表4 冻干工艺的潜在偏差分类Tab 4 Classification of potentialdeviation in freeze-dry
以此冻干工艺为例,只是对该工艺潜在偏差的简单分析,当企业采用FMEA对工艺潜在的偏差进行分析时,应该是一个持续改进的过程,并建立相应的文件记录,以便发现更多不容易发现的偏差,降低风险,保证质量。冻干工艺的潜在偏差分类见表5。

表5 冻干关键工艺流程的FMEA风险分析Tab 5 Analysisof FM FA risk of the key process in freeze-dry
4 讨论
偏差是每个药品生产企业都会发生而且必须面对的问题。偏差管理的关键就是对偏差进行识别和分类,必须依靠科学的方法进行。风险管理工具作为一种高效的管理手段,企业应当灵活运用,将风险理念有效地注入到各个管理程序之中[7]。企业通过这种事前预防、事后评估的方式,可全面控制生产的各个环节,及时规避和降低风险,这不仅有利于企业的发展,而且能真正地保证产品质量[8]。
另外,风险管理工具的应用并非一成不变的,必须具体问题具体分析[9-10]。虽然风险管理在我国仍处于起步阶段,但是随着其重要性被越来越多的人所认识,最初的风险管理工具也逐渐被发现还存在不足之处,例如风险管理工具的使用受人为因素和经验主义影响较多。因此,风险管理工具也正在不断地完善和发展。
[1] 国家食品药品监督管理局药品认证管理中心.药品GMP指南:质量管理体系[M].北京:中国医药科技出版社,2011:389.
[2] 梁毅,陈磊.《药品生产质量管理规范》管理中偏差分类的方法研究[J].中国药房,2012,23(37):3 460.
[3] 钱亚楠.药品生产的偏差处理与持续质量改进[J].现代医学,2013,41(12):958.
[4] 卫生部.药品生产质量管理规范:2010年版[S].2011-01-17.
[5] 胡谦谦,梁毅.药品生产的偏差分析[J].上海医药,2007,28(8):366.
[6] 李泮海,李进启,范秋英,等.药品生产企业质量管理理念发展探讨[J].中国药物警戒,2011,8(2):93.
[7] 刘永丽.药品生产管理中风险管理的应用[J].中国医药导报,2010,7(5):143.
[8] 梁毅.新版GMP教程[M].北京:中国医药科技出版社,2011:217.
[9] 陈妍纯.药品生产过程中偏差处理程序[J].中国现代药物应用,2013,7(7):138.
[10] 黎阳.药品生产中偏差的制定与管理[J].中国药事,2009,23(2):198.
(编辑:杨小军)
Research on the Classification of Deviations in Drug Production
YU Yong1,MEIXin1,FANG Fang2,CUIWen-bo3,SHEN Qi-wen4(1.Chengxian College of Southeast University,Nanjing 210088,China;2.Nanjing Medicine Specialized Secondary Schools,Nanjing 211100,China;3.Shanghai Municipal Food and Drug Adm inistration,Shanghai 200439,China;4.School of International Pharmaceutical Business,China PharmaceuticalUniversity,Nanjing 210009,China)
OBJECTIVE:To study the classification of deviation in drug production.METHODS:From the perspective of dominant and hidden deviation,combining w ith the theory of risk management,risk of deviation was evaluated w ith different risk management tools to define the severity of the deviation,and itwas handled by differentmethods.RESULTS&CONCLUSIONS:According to the identifiability of deviation in actualmanagement,the deviation was divided into dom inance and hidden deviation. The dom inant deviation can be divided into deep and shallow level.Whether the causes of deviation could be cleared and the consequences could be estimates were judged after the shallow level classification,and the deviation was further divided into simple and complex deviation.As for deviation complex,it could be evaluated w ith the tools of risk management to define the deviation severity.As for hidden deviation,it needed beforehand preventing w ith the tools of risk management directly to define deviation levels and provide reference for preventivemeasures.In the process of deviationmanagement,key point is to relay on the scientificmethod to identify and classify deviation,and divide the influence levels.Combining the theory of risk management to select and use risk tools is the effectiveway to solve the problem.
Drug production;Deviation;Classification;Risk management tools
R95
A
1001-0408(2015)19-2601-04
DOI 10.6039/j.issn.1001-0408.2015.19.03
*助教,硕士研究生。研究方向:药事管理,国内外药品注册、质量管理与监督。E-mail:281307256@qq.com
2014-07-27
2015-03-20)
·药物分析与检定·
