火龙果皮原花青素提取纯化及定性分析
2015-01-30杨志娟吴晓萍
杨志娟,曾 真*,吴晓萍
(广东海洋大学食品科技学院,广东 湛江 524025)
火龙果(Hylocereus undatus),属仙人掌科(Cactaceae)量天尺属(Hylocereus)和蛇鞭柱属(Selenicereus)植物。原产于巴西、墨西哥等中美洲热带沙漠地区[1],现人工栽培遍及泰国、越南、中国台湾、哥伦比亚等20多个国家和地区。近10 a来,我国广西、贵州、广东、海南等地火龙果种植面积迅速扩大[2]。火龙果口感清香,甜而不腻,富含糖、有机酸、蛋白质,其中膳食纤维含量2.33%,高于苹果纤维含量(1.2%)[3]。常食用可具有降低血糖、胆固醇、血压、尿酸等功效[3]。
火龙果皮含有原花青素[4]。原花青素是植物中广泛存在的一类多酚类化合物的总称,具有清除自由基、抗氧化的活性,并且在抗炎症、抑制肿瘤、保护血管等方面发挥着重要的作用[5],其在功能性食品[6-8]、医药[9]、化妆品[10]行业具有广阔的应用前景。
从火龙果皮中提取所得的原花青素为粗提取物,其中含有大量杂质,需要进行纯化。大孔吸附树脂为吸附性和筛选性原理相结合的分离材料,是近10 a来发展起来的一类有机高分子聚合物吸附剂,其吸附实质为表面物理吸附现象,是氢键相互作用或范德华引力作用的结果,同时大孔吸附树脂本身的多孔结构使其对分子大小不同的物质具有筛选作用。通过这种吸附和筛选,有机化合物根据吸附力的不同及分子质量的大小,经一定溶剂洗脱而达到分离、纯化、富集、浓缩等不同目的[11]。杨青等[12]对不同极性的10种大孔吸附树脂的静吸附和解吸性能进行比较后,确定XDA-7型弱极性大孔吸附树脂为纯化山竹壳原花青素的最佳分离树脂。刘睿等[13]以高粱为原料,采用大孔吸附树脂法纯化其原花青素,得到低聚体原花青素的纯度高于95 g/100 g。
本研究采用大孔吸附树脂法纯化原花青素,建立火龙果皮中原花青素的提取纯化工艺,分离出具有生物活性的原花青素,这不但在医药和食品行业有广阔的应用前景,而且也为当地丰富的火龙果的资源开发和利用提供一条新途径,提高火龙果的利用率和经济效益。
1 材料与方法
1.1 材料与试剂
火龙果皮原花青素粗提物按前火龙果皮中原花青素提取及含量的测定实验[14]最佳条件制得。
葡萄糖、石油醚、氢氧化钠、乙醇、盐酸、硫酸钾、硫酸铜、硫酸(均为分析纯) 广州化学试剂厂;甲醇、乙腈、甲酸(均为色谱纯) 德国Merk公司;AB-8大孔树脂、DM130大孔树脂、ADS-17大孔树脂杭州普修生物科技有限公司;香草醛(分析纯)、葡萄籽原花青素标准对照品(纯度99.27%) 天津市尖峰天然产物研究开发公司。
1.2 仪器与设备
101-2 型电热鼓风干燥箱 上海浦东跃欣科学仪器厂;TD5台式离心机 长沙英泰仪器有限公司;AUY120电子天平 日本岛津公司;501s型超级恒温水槽(水浴锅) 上海跃进医疗器械厂;TDL-5-A型低离心机 海安亭科学仪器制作厂;DHL-A电脑恒流泵、智能编程层析箱 上海青浦沪西仪器厂;RE52-3旋转蒸发器 上海泸西分析仪器厂有限公司;TU-1901双束光紫外-可见光分光光度计 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 火龙果皮原花青素的纯化及定性分析实验流程
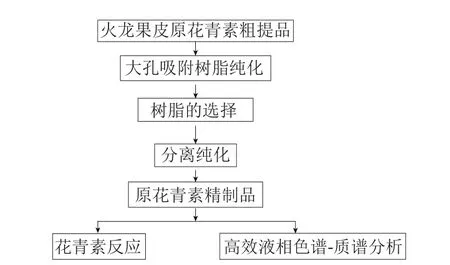
图1 实验流程图Fig.1 Flow chart of experiments
1.3.2 原花青素的测定
本实验选用灵敏度高重复性好的低质量浓度香草醛-盐酸法[15]。在酸性条件下,原花青素组成单元儿茶素上的羟基和香草醛发生缩合反应,在浓酸作用下形成的产物变成有色的正离子,可采用分光光度法在500 nm波长处检测。
配制显色剂:10 g/L香草醛溶液和8%的盐酸溶液体积比1∶1,现配现用。
原花青素标准曲线的制作:准确称取葡萄籽原花青素标准对照品20 mg,用甲醇溶解,配制成质量浓度为1 mg/mL的标准溶液。分别取1.00、2.00、3.00、4.00、5.00 mL于容量瓶(10 mL)中,用甲醇定容至10 mL。从中各取1 mL分别加入5 mL显色剂,摇匀,避光,在25℃条件下反应30 min,以甲醇为空白对照于500 nm波长处测定吸光度,绘制标准曲线。得到吸光度(Y)与原花青素质量浓度(X)的标准回归方程:Y=0.403 2X-0.009 3,R2=0.997 6。
1.3.3 大孔吸附树脂的预处理及再生
预处理:分别称取3种不同类型的大孔吸附树脂(AB-8、DM130、ADS-17型),用体积分数95%的乙醇浸泡,直至上清液用蒸馏水冲洗无白色浑浊现象为止,用蒸馏水洗至洗涤液无乙醇气味。
再生:将活性已明显下降的大孔吸附树脂用异丙醇浸泡1 d,用蒸馏水洗至流出液无醇味;用盐酸溶液(1 mol/L)浸泡1 d,用蒸馏水冲洗至流出液呈中性;用NaOH溶液(1 mol/L)浸泡1 d,用蒸馏水冲洗至流出液呈中性。
1.3.4 大孔树脂吸附量及解吸率的测定[16]
1.3.4.1 吸附量的测定
称取经预处理的树脂各1 g于250 mL的三角瓶中,准确加入质量浓度为5.92 mg/mL原花青素粗品l00 mL,使原花青素含量对吸附树脂是过量的,密封并置空气浴摇床上振荡,温度为25℃,转速为100 r/min,振荡7 h,充分吸附后,过滤,测定滤液中剩余原花青素的质量浓度,按式(1)计算各树脂的吸附量。
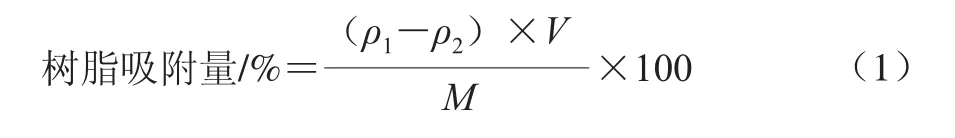
式中:ρ1为吸附前溶液质量浓度/(mg/mL);ρ2为吸附后溶液质量浓度/(mg/mL);V为溶液体积/mL;M为树脂质量/g。
1.3.4.2 解吸率的测定
取吸附后的树脂置于250 mL三角瓶中,分别精密加入70%乙醇100 mL,密封并置空气浴摇床上振荡,温度为25℃,摇床转速为100 r/min,振荡7 h,过滤,测定滤液中原花青素的质量浓度,计算解吸率。

式中:ρ为滤液中原花青素的质量浓度/(mg/mL);V为溶液体积/mL;M为树脂质量/g;m为树脂吸附量/(mg/g)。
1.3.5 上样流速的选择
处理好的树脂湿法装柱,平衡静置后,将原花青素的粗提液以1、2、3 mL/min速率分别上柱吸附,每10 mL收集1 管,用1.3.2节方法测定流出液吸光度,绘制泄漏曲线。当流出液中原花青素质量浓度达进样质量浓度的1/10时认为已达到吸附的穿透点,停止进样,计算吸附量。
1.3.6 解吸流速的选择
按照动态吸附的最佳条件准备已达最大上样量的柱子,吸附平衡后再用50%的乙醇溶液以不同流速1、2、3 mL/min洗脱,每20 mL收集1 管,用1.3.2节方法测定流出液吸光度,绘制动态解吸图并计算解吸率。
1.3.7 解吸剂体积分数的选择
按照动态吸附的最佳条件准备已达最大上样量的柱子,分别用体积分数10%、30%、50%、70%、90%的乙醇溶液,以相同的流速进行洗脱,每20 mL收集1 管,过滤后,用1.3.2节方法测定流出液吸光度,绘制动态解吸图。
1.3.8 火龙果皮中原花青素提取物的定性分析
原花青素水溶液经AB-8大孔树脂纯化后,真空旋转蒸发浓缩、用水稀释、冷冻真空干燥后,制得原花青素精制品粉末,冷藏备用。
1.3.8.1 花青素反应
准确称取适量相同质量的原花青素标准品、原花青素精制品,用60%的乙醇溶液溶解后,利用香草醇-盐酸法比色,观察溶液颜色变化,即溶液从无色变为红色或者红色加深。
1.3.8.2 高效液相色谱-质谱(high performance liquid chromatography-mass spectrometer,HPLC-MS)分析[17]
采用HPLC-MS法对原花青素精制品进行定性定量分析。准确称取10 mg火龙果皮原花青素精制物,用甲醇溶解定容至10 mL,4℃避光保存,测定时移取1.0 mL上机测定。
标准曲线制作:准确称取10 mg原花青素标准品用甲醇溶解定容至10 mL,4℃避光保存,此为标准储备液(1 mg/mL),准确吸取0、20、40、60、80、100 μL标准储备液,并用甲醇定容到1 mL,配制成质量浓度分别为0、20、40、60、80、100 mg/L的标准溶液,上机测定。
色谱条件:色谱柱:ZORBAX SB-C18(4.6 mm×150 mm,5 μm);柱温:30℃;进样量:10 μL;流动相:0.1%甲酸溶液(A)和0.1%甲酸的乙腈溶液(B);流速:0.2 mL/min。梯度洗脱程序见表1。
质谱条件:电喷雾离子源,正离子模式;离子扫描范围m/z 200~1 200;雾化气温度350℃;电喷雾电压-4 000 V;源内碎裂电压135 V。

表1 梯度洗脱程序Table1 Gradient elution procedure
2 结果与分析
2.1 不同大孔树脂对原花青素吸附、解吸性能
通常,树脂的吸附能力与其表面极性、比表面、孔结构、孔隙率等有关。本实验选择3种极性不同的大孔树脂测定原花青素吸附、解吸性能,结果如表2所示。
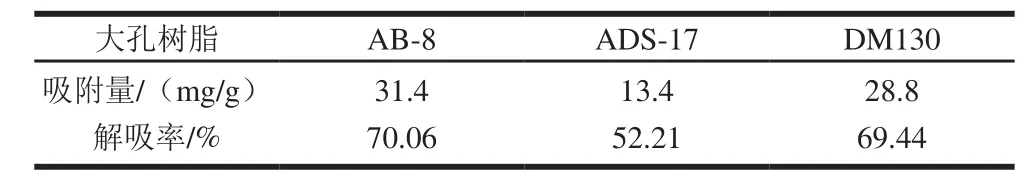
表2 不同大孔树脂对原花青素吸附、解吸性能Table2 The adsorption and desorption capacities of different macroporous adsorption resins for proanthocyanidins
不同的树脂对原花青素的吸附能力和解吸能力差异较大。AB-8吸附量最大,DM130次之。AB-8和DM130有较好的解吸率,ADS-17稍差。综合考虑吸附率和解吸率2个因素,本实验原花青素的纯化采用AB-8大孔树脂。
2.2 不同上样流速对AB-8大孔树脂吸附原花青素的影响
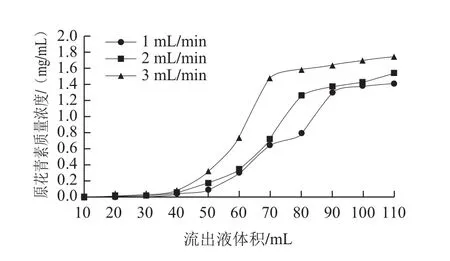
图2 上样流速对动态吸附效果的影响Fig.2 Effect of sample loading flow rate on dynamic adsorption efficiency
由图2可知,上样流速越快,泄漏点出现得越早,吸附量越小,不利于树脂吸附原花青素。1、2、3 mL/min上样流速吸附量分别为37.7、44.8、49.4 mg/g。当上样流速为1 mL/min时,虽然泄漏点出现最迟,但因为流速慢,导致循环周期延长。综合考虑,上样流速选择2 mL/min。
2.3 不同解吸流速对AB-8大孔树脂动态解吸效果的影响
由于3 根柱子上样条件相同,即样液中原花青素含量跟吸附流出液中含原花青素总量相同,解吸液中含有原花青素总量等于流出液体积与原花青素质量浓度乘积,即图中峰面积,由图3可知,1 mL/min解吸流速的解吸率最大,其次是2 mL/min,解吸液以1 mL/min的流速进行洗脱得到的峰形较窄,峰值最高;2 mL/min的洗脱峰比1 mL/min的峰形矮且拖尾比较严重;3.0 mL/min的峰形最矮,拖尾最严重。因此选择解吸流速为1 mL/min。
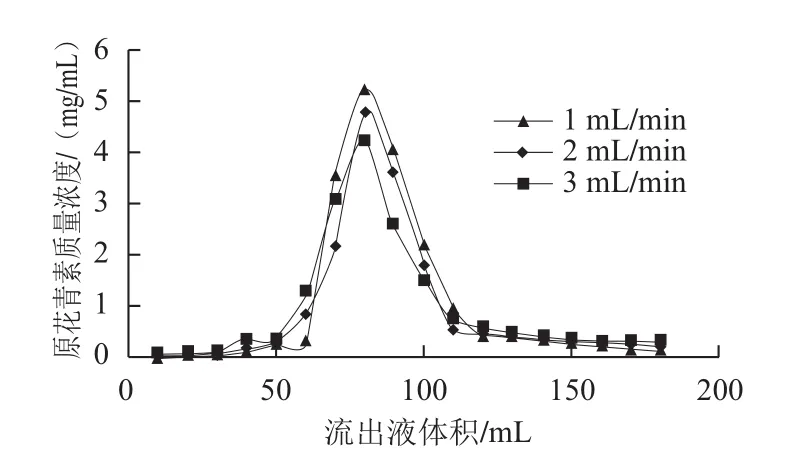
图3 不同解吸流速对动态解吸的影响Fig.3 Effect of elution flow rate on dynamic desorption
2.4 不同乙醇体积分数对动态解吸效果的影响
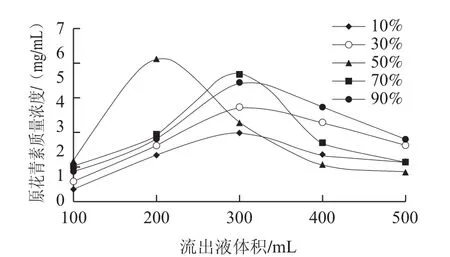
图4 不同乙醇体积分数对动态解吸效果的影响Fig.4 Effect of ethanol concentration on dynamic adsorption efficiency
由于原花青素上样质量浓度跟体积量一样,根据图4可知,乙醇体积分数为50%时,峰面积最大,即解吸率最大,且峰值最高,其次,90%乙醇解吸率较好,但拖尾严重。50%乙醇已基本可以达到较高的回收率,因此选体积分数为50%乙醇作为解吸溶液。
2.5 花青素反应
原花青素在酸性条件下加热生成红色的花青素,这一反应是原花青素最具特征的化学反应,对标准品和样品进行花青素反应实验,样品跟标准品溶液均呈红色,颜色接近,即两样品均有反应,说明样品为原花青素。
2.6 HPLC-MS分析
由图5可知,原花青素的标准品各聚体有6个峰值,分别在15.64 min(M1)、17.94 min(M2)、21.01 min(M3)、23.41 min(M4)、24.46 min(M5)、27.72 min(M6)出峰,各峰峰形良好,且分离度较高,说明HPLC-MS法能够有效分离原花青素的各聚体;火龙果皮原花青素精制品中有2个峰值,分别在21.08 min(M7)、24.31 min(M8)出峰,与标准品峰值M3、M5很接近,说明该精制品中含有原花青素或其类似物。应,说明样品为原花青素。
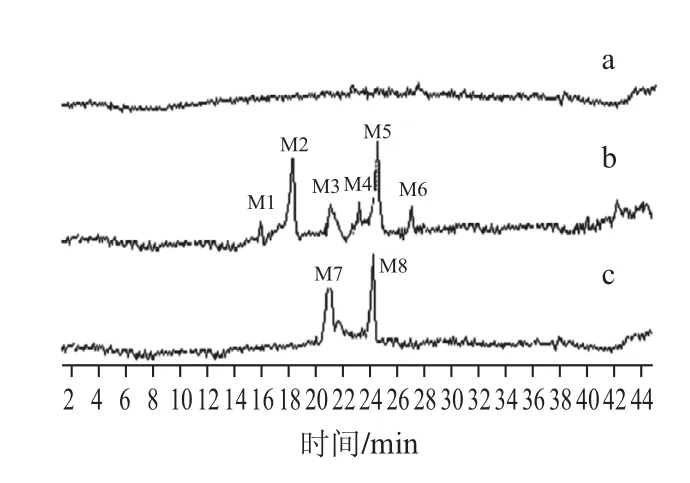
图5 空白对照(a)、原花青素标准品(b)、火龙果皮原花青素精制品(c)的总离子色谱图Fig.5 TICs of blank control (a), proanthocyanidins standard (b) and pitaya peel procyanidin extract (c)
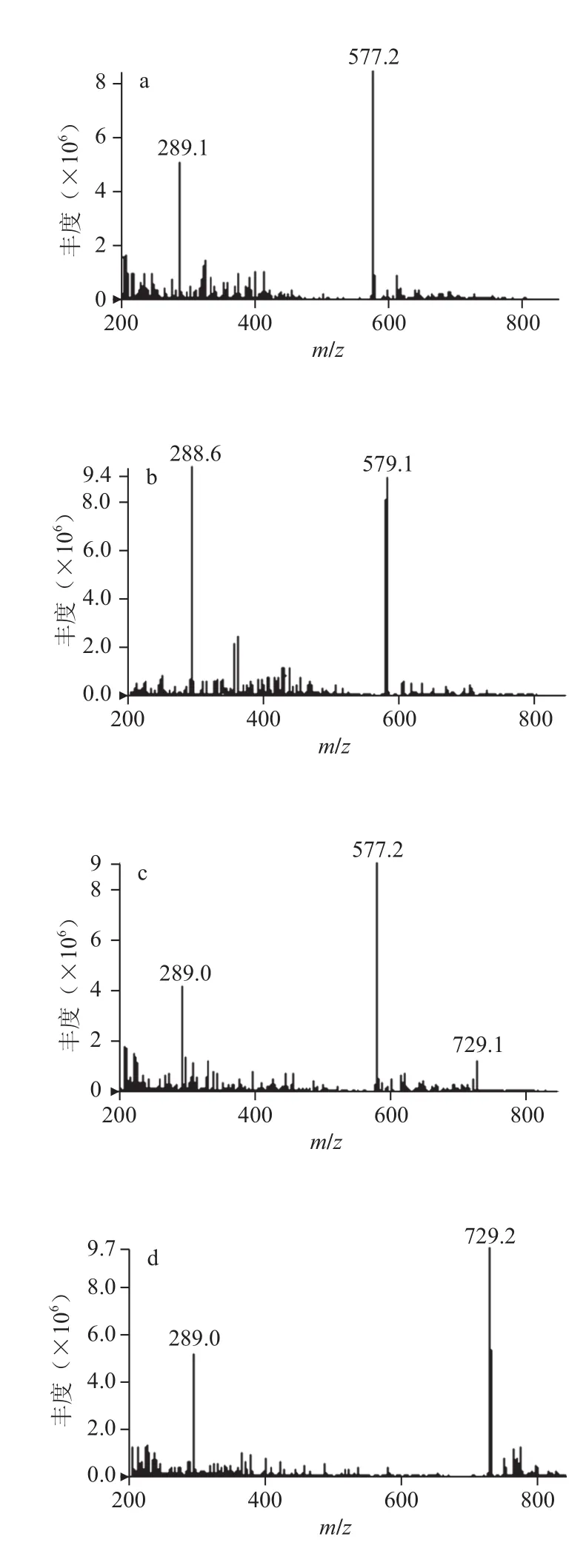
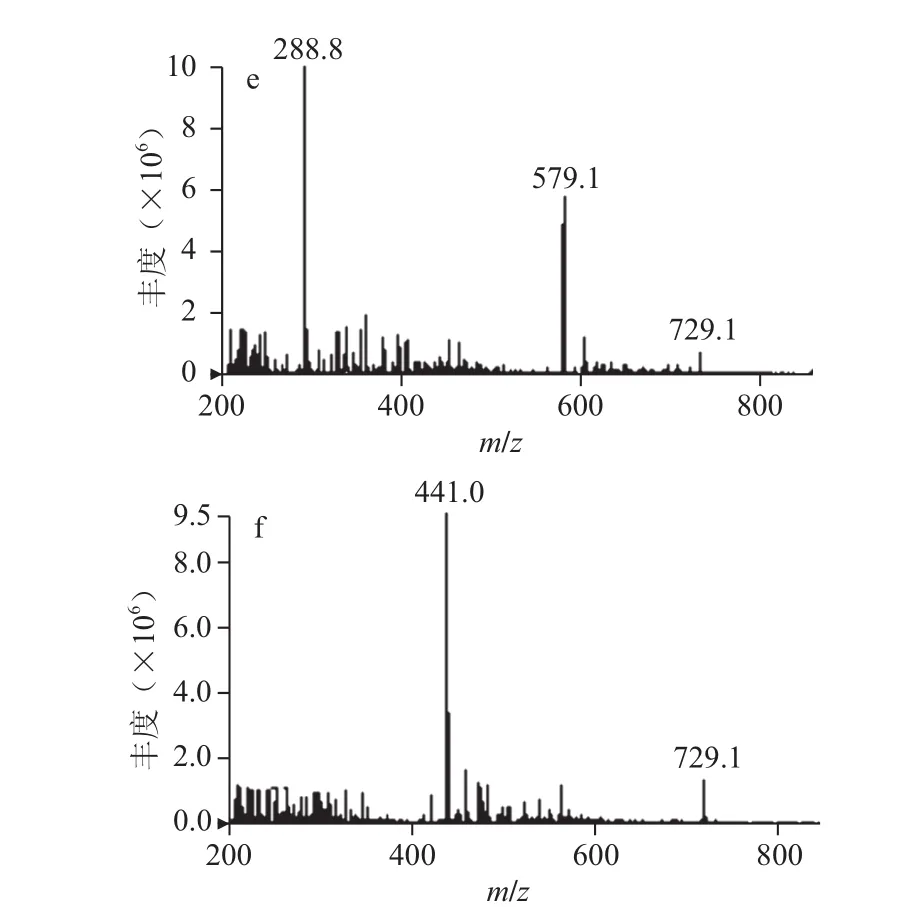
图6 原花青素标准品质谱图Fig.6 ESI-MS spectra of proanthocyanidins standard
由图6可知,原花青素标准品在负离子模式下形成的准分子离子[M-H]-有m/z 289.0、441.0、577.2、579.1、729.2,耦合离子[2M-H]-有m/z 579.2。结合图3分析,峰M1、M2、M3、M4、M5中均含有m/z 289.0,这些离子峰为儿茶素峰或表儿茶素峰或准分子离子m/z 441.0失去没食子酰基形成的离子峰;峰M1、M3均含有m/z 577.0,这些离子峰为二聚体峰;峰M2、M5均含有m/z 579.2,该离子为m/z 289.0的耦合离子;峰M6含有m/z 441.0,此离子峰为表儿茶素没食子酸酯峰;峰M3、M4、M5、M6均含有m/z 729.0,该离子为二聚单酯准分子离子。
火龙果皮原花青素精制品在相同条件下形成的离子有m/z 289.0、577.2、579.1,结果见图7,推测该精制品中含有的原花青素为儿茶素、表儿茶素和二聚体。
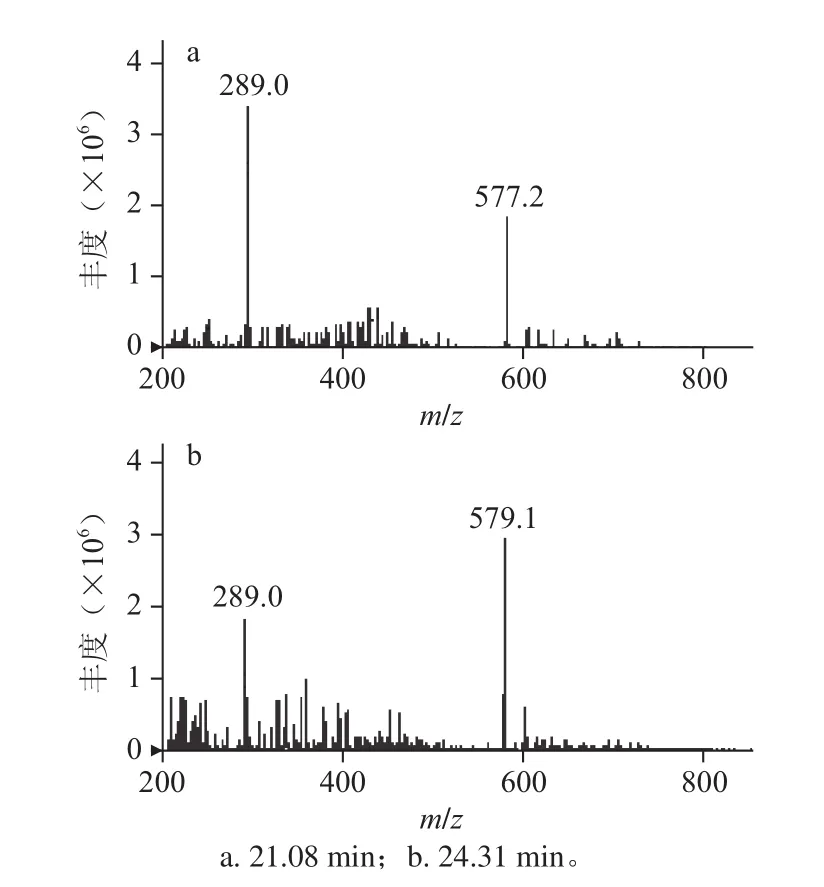
图7 火龙果皮原花青素精制品质谱图Fig.7 ESI-MS spectra of pitaya peel procyanidin extract
取10 μL 0、20、40、60、80、100 mg/L的原花青素标准溶液进样,参照1.3.8.2节的色谱条件和质谱条件,测得峰面积,以原花青素标准品的总峰面积(各个峰面积之和)(Y)对于质量浓度(X)进行回归分析,得到线性回归方程:Y=0.292 9X+0.211 4,R2=0.999 7。
线性回归方程的相关系数R2>0.99,说明原花青素的峰面积与质量浓度之间有良好的线性关系,由此计算得出样品溶液中原花青素的质量浓度为9.665 mg/mL,火龙果皮原花青素精制品纯度为96.65%。
3 结 论
通过比较3种不同的大孔树脂对原花青素的吸附和解吸能力,确定火龙果皮中原花青素粗提物的最佳纯化树脂为AB-8树脂。AB-8树脂纯化的最佳工艺为上样流速2 mL/min、解吸流速1 mL/min、解吸剂体积分数50%,在此条件下,得到火龙果皮原花青素精制品并通过原花青素反应与HPLC-MS定性分析,证实该精制品中含有的原花青素为儿茶素、表儿茶素和二聚体,且原花青素纯度为96.65%。
[1]中国科学院中国植物志编辑委员会.中国植物志: 第一分册: 第52卷[M].北京: 科学出版社, 1999: 283-284.
[2]邓仁菊, 范建新, 蔡永强.国内外火龙果研究进展及产业发展现状[J].贵州农业科学, 2011, 39(6): 188-192.
[3]蔡永强, 向青云, 陈家龙.火龙果的营养成分分析[J].经济林研究,2008, 26(4): 53-56.
[4]郑公佑, 李向阳, 叶武基.火龙果皮红色素研究[J].茂名学院学报,2005, 15(3): 5-7.
[5]WU L C, HSU H W, CHEN Y C, et al.Antioxidant and antiproliferativeactivities of red pitaya[J].Food Chemistry, 2006,95(2): 319-327.
[6]高羽, 董志.原花青素的药理学研究现状[J].中国中药杂志, 2009,34(6): 651-655.
[7]官清, 张珩, 石晓琳.原花青素药用研究进展[J].临床合理用药,2012, 5(2A): 174-175.
[8]吴春, 陆海燕, 王昊杰.低聚原花青素对草莓色素的抗氧化活性研究[J].哈尔滨商业大学学报: 自然科学版, 2003, 19(6): 681-684.
[9]孙传范.原花青素的研究进展[J].食品与机械, 2010, 26(4): 146-148.
[10]段玉清, 谢笔钧.原花青素在化妆品领域的研究与开发现状[J].香料香精化妆品, 2002(6): 23-26.
[11]尹忠平, 上官新晨, 黎冬明, 等.花青素类色素纯化技术研究进展[J].粮油加工, 2012(7): 111-115.
[12]杨青, 何传波, 魏好程, 等.大孔树脂纯化山竹壳原花青素的研究[J].热带作物学报, 2013, 34(3): 569-573.
[13]刘睿, 段玉清, 潘思轶, 等.高粱外种皮中原花青素的提取工艺及组分鉴定[J].农业工程学报, 2004, 20(1): 242-245.
[14]马冰雪, 潘腾, 任中清, 等.火龙果果皮花青素提取工艺研究[J].北京农业, 2013(12): 213-215.
[15]李春阳, 许时婴, 王璋.香草醛-盐酸法测定葡萄籽、梗中原花青素含量的研究[J].食品科学, 2004, 25(2): 157-159.
[16]卢锦花, 胡小玲, 岳红, 等.大孔吸附树脂对银杏叶黄酮类化合物吸附及解吸的研究[J].化学研究与应用, 2002, 14(2): 164-166.
[17]丁明, 钟冬莲.高效液相色谱-串联质谱法测定山茶油中黄曲霉素B1[J].分析实验室, 2012, 31(5): 26-29.
