运动干预对攻击行为大鼠大脑中5- HT的影响
2015-01-29张换鸽
张换鸽
攻击行为是一个严重的社会问题,也是重要的医学研究课题。攻击行为发生的神经生物学因素主要与大脑中的神经递质5- 羟色胺(5- HT)的水平有关,最有力的说法是‘5- HT缺乏’理论[1]。其认为较高水平的攻击行为和较低水平的5- HT神经传递活动密切相关。研究发现,5- HT是攻击行为及冲动行为改变的重要神经递质,低水平的5- 羟色胺与攻击行为和冲动行为增加紧密联系[2];5- HT也是运动性中枢疲劳发生的重要神经递质。笔者将攻击行为与运动训练结合起来探讨运动干预与攻击行为的关系,将消极因素转化为积极因素,增强运动训练的效果;另一方面,探讨运用体育运动能否降低社会攻击行为的发生。
1 研究对象与方法
1.1 研究对象
选用三月龄健康雄性SD大鼠40只,体重约160g~180g(由西安交通大学医学院实验动物中心提供)。动物在安静环境下饲养,自由饮水、进食;环境温度22~26℃;相对湿度45%~55%。
1.2 实验分组
大鼠购回后适应性喂养一周,随机分为五组:安静对照组(群居)8只、攻击模型组(单笼饲养+入侵)10只、跑台训练组8只、跑台模型组(单笼饲养+入侵+跑台训练)10只、入侵组(群居)4只。
1.3 攻击模型建立
居住者- 入侵模型[3,4]是观察攻击情绪的一种可靠性较高的模型。放置成年大鼠(4~6月)个体居住在相对较大的笼子(底面面积大约0.5m2)观察至少一周时间,使其熟悉个体居住环境;一周后,在笼中放置一只同品系且相同体重的入侵鼠,居住鼠将会攻击入侵鼠,形成一场激烈的打斗;入侵鼠入侵15min/次,1次/天。
采用开场实验评估建模情况,居住鼠主动攻击、撕咬、攀压入侵鼠[5]时,记录大鼠攻击的次数、频率、攻击潜伏期(s)、总的攻击时间(s),同时对大鼠的攻击行为进行行为评定,标准见表1。由表1看出,当大鼠的攻击行为达到“3或4”时,大鼠攻击性行为模型建模成功。开场实验是评价实验动物在新异环境中自主行为、探究行为与紧张度的一种方法。大鼠表现活跃,自主行为、探究行为较强,即为大鼠攻击行为较强[6]。

表1 攻击行为评分标准
1.3 跑台训练方案
造模成功后,对大鼠开始速度耐力训练(表1)。每次训练按强度大小分为训练初期、中期和后期。训练时间:每天17:00~20:00之间,采用杭州制造大鼠跑台,正式训练每周五天,共八周(见表2)。
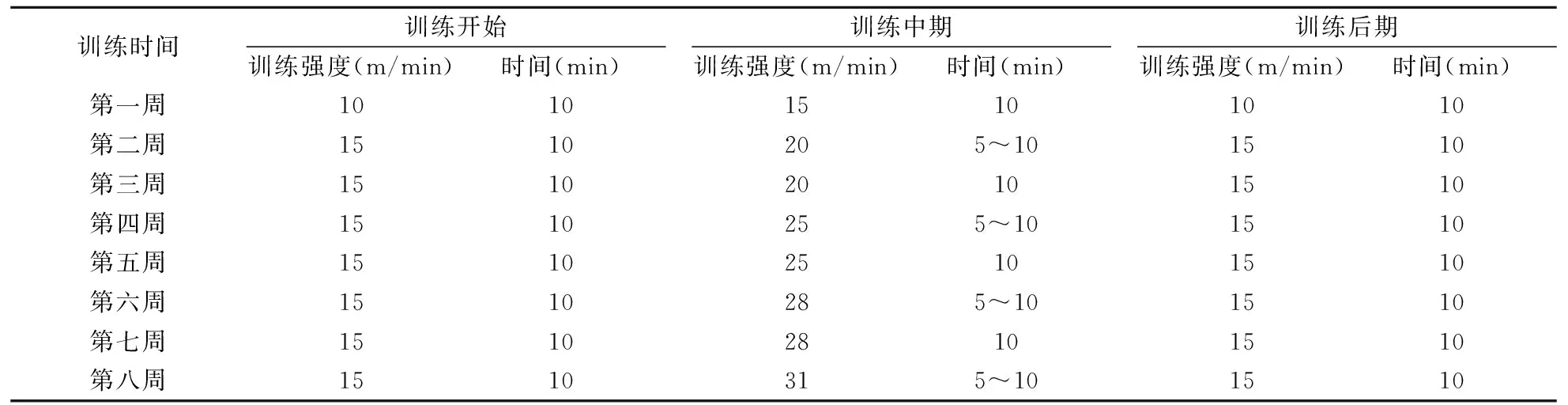
表2 大鼠速度耐力训练方案
1.4 主要试剂及仪器大鼠5- HT Elisa酶联免疫试剂盒。
低温离心机(Biofuge,Germany)、DY89- 1型电动玻璃匀浆机(宁波新芝生物科技股份有限公司)、酶标仪(Molecular Devices,USA)。
1.5 标本取材
训练周期结束后第二天上午将动物断头处死,同时在冰盘上剥离出大脑,去除小脑和脑干,液氮中冻存。实验时,取1/4匀浆、离心,按具体步骤进行操作。
1.6 实验方法
采用酶联免疫吸附实验测定大脑中5- HT的浓度水平。具体步骤:标准品稀释—加样—温育—配液—洗涤—加酶—温育—洗涤—显色—终止—测定。测定应在加终止液后15min内进行。
1.7 统计学分析
数据采用SPSS17.0软件进行处理,比较检验采用单因素方差(One- Way ANOVA)分析,结果以平均值±标准差(M±S)表示,以P<0.05为差异显著性标准,P<0.01表示有极显著性差异。
2 实验结果
2.1 大鼠行为表现
安静对照组大鼠随着时间的增加,毛发稍有发黄,比较温顺,捕捉时几乎无逃避行为;模型组大鼠随着造模时间的增加,毛发逐渐发黄,经常跳出笼后在动物房内跑动,捕捉时逃避行为明显,具有明显的攻击倾向。此外,攻击行为大鼠有较强的领地意识及占有欲。通过观察,夜间笼盖未加紧时,大鼠会爬出鼠笼将别的大鼠鼠粮偷到自己笼内,之后在笼内或其笼盖上入睡;跑台模型组经过训练后,大鼠毛发稍有发黄,比较温顺,食欲较好,通过抖动、甩动及舔舐行为,快速整理毛发,捕捉时逃避行为不明显,攻击行为降低;跑台对照组随着运动时间的推移,大鼠毛发稍有发黄,食欲正常,对外界刺激反应迅速,探究性行为较多。
2.2 大鼠运动表现
跑台对照组大鼠前几周能较轻松的完成训练任务,等到第六周跑速加至28m/min及更高强度时,大鼠完成训练任务有些困难;有时候需要声音或电刺激,甚至声音加电刺激才能完成每天的训练任务。
跑台模型组在跑台运动中,大鼠的速度、耐力逐渐增强,始终能轻松地随着跑台速度处于跑台最前位置,对电刺激和声音刺激敏感性高;随着训练时间的推移,跑台模型组去掉电刺激,仅偶尔的声音刺激足以轻松完成每天的训练任务;有些大鼠记忆能力增强。经常停止运动回头张望,等快到跑台电刺激位置时又加速跑至前方,反复进行,直至训练任务结束。
2.3 大脑组织中5- HT浓度的变化(见表3)

表3 大鼠脑组织中5- HT浓度变化
注:与安静对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P< 0.01;与跑台对照组相比,▼P<0.05,▼▼P<0.01。
与安静对照组相比,模型组大鼠大脑组织中5- HT浓度降低27.85%(P<0.01),跑台对照组大鼠大脑中5- HT浓度升高12.6%(P<0.05),跑台模型组大鼠脑组织中5- HT浓度降低6%(P>0.05);与模型组相比,跑台模型组大鼠脑组织中5- HT浓度增高30.09%(P<0.05);与跑台对照组相比,跑台模型组大脑中5- HT浓度降低16.9%(P<0.05)。
3 分析讨论
攻击行为发生的神经生物学因素主要是神经递质5- HT的缺乏引起的。频繁的冲动、高危险行为与5- HIAA的浓度降低相关,高危险性的冲动性行为与大多数的攻击行为呈正相关。在啮齿类,低水平的5- HT与高水平的攻击行为紧密联系[7]。有研究采用氯苯丙氨酸(PCPA)不可逆的结合色氨酸羟化酶,限制5- 羟色胺合成酶的速率,阻止5- HT的生成[8],采用PCPA诱导的大鼠会产生更强的自杀行为和其他的攻击行为;在单笼饲养诱导的攻击模型中,慢性的PCPA处理能促进单笼环境中大鼠的攻击行为;PCPA处理的大鼠对同种雄性的攻击比对照组更具有攻击性和速度性。同时,也反映出抑制大脑中枢5- HT的生成,使5- HT的浓度水平降低,能激发更强的攻击行为的产生。研究发现[9],在凶猛的非人类灵长类机体中,减少脑脊髓液中5- HT的代谢产物5- HIAA会引起严重的攻击行为,如身体攻击,包括咬、拍打和击打。实验证明,与安静对照组相比,模型组大鼠大脑5- HT浓度显著降低,而且是所有组别中5- HT浓度水平最低的,其攻击行为最强。大脑中低水平的5- HT浓度反映了机体具有高水平的攻击行为。人类研究也表明,脑脊液中5- HIAA的水平与冲动性和攻击性的自杀行为呈负相关。人类脑脊液中低水平的5- HT是冲动性和攻击性行为的基础。
与安静对照组相比,跑台对照组大脑中5- HT浓度显著升高,反映了长期的跑台运动使大鼠5- HT水平增加,大鼠有疲劳累积的倾向。运动引起5- HT合成、释放增多,是引发中枢疲劳和运动能力下降的一个重要原因;与安静对照组相比,跑台模型组大鼠大脑中5- HT浓度不具有显著差异,可能是运动引起的5- HT浓度增加与攻击行为大鼠自身低水平的5- HT相抵消。经过跑台运动后,跑台模型组大鼠攻击行为降低;与模型组相比,跑台模型组大鼠大脑5- HT浓度水平显著增加,反映出跑台运动干预使大鼠5- HT合成和释放水平增加,攻击行为降低。从大鼠运动的表现也可以看出,跑台模型组大鼠经过跑台训练后,其攻击行为降低。有研究采用跑台训练大鼠,速度20m/min,训练1h后,发现跑台运动增加了大鼠5- HT的合成和转换率[10]。还有研究发现,大脑5- HT含量在三周和五周的一般训练负荷和极限训练负荷后变化不大,在长时间的七周训练后才显著增加。表明训练时间的长短与脑内5- HT的浓度有一定关系,而与负荷强度的大小关系不大。提示脑内5- HT浓度的升高与长时间运动性疲劳有关[11];与跑台对照组相比,跑台模型组大脑中5- HT浓度显著降低,说明跑台模型组大鼠速度、耐力更强,运动性疲劳出现的时间推迟,其原因可能是,跑台模型组大鼠大脑中较低的5- HT水平与跑台运动干预产生的5- HT部分抵消,降低了中枢抑制性神经递质5- HT的累积,从而推迟了运动性疲劳的发生,其机理还需进一步研究。
4 研究结论
长期跑台运动干预使攻击行为大鼠大脑中5- HT浓度水平升高,大鼠的攻击行为降低;同等负荷条件下,攻击行为大鼠速度耐力较强,产生运动性疲劳的时间推迟。
[1] Scott D Lane, Kimberly L Kjome, F Gerard Moeller. Neuropsychiatry of Aggression[J].Neurol Clin.,2012(1):49~65.
[2] N Bradley Keele. The role of serotonin in impulsive and aggressive behaviors associated with epilepsy- like neuronal hyperexcitability in the amygdala [J]. Epilepsy Behavior, 2005(7):325~335.
[3] Francesco Ferrari P, Palanza P, Parmigiani S, Dealmeida R, Miczek K. Serotonin and aggressive behavior in rodentsand nonhuman primates: Predispositions and plasticity [J]. European Journal of Pharmacology, 2005(526):259~273.
[4] Rosa MM de Almeida, Pier Francesco Ferrari, Stefano Parmigiani, Klaus A Miczek. Escalated aggressive behavior: Dopamine, serotonin and GABA[J]. European Journal of Pharmacology, 2005(526):51~64.
[5] Aki Takahashi, Isabel M Quadros, Rosa MM de Almeida, Klaus A Miczek. Brain Serotonin Receptors and Transporters: Initiation vs. Termination of Escalated Aggression [J]. Psychopharmacology , 2011(9):183~212.
[6] Estrella R Montoya, David Terburg, Peter A Bos, Jack van Honk .Testosterone, cortisol, and serotonin as key regulators of social aggression: A review and theoretical perspective [J]. Motiv Emot. 2012(36):65~73.
[7] Frankle WG, Lombardo I, New AS, Goodman M, Talbot PS, Huang Y, et al. Brain serotonin transporter distribution in subjects with impulsive aggressivity : A positronemission study with [11C]McN 5652. American Journal ofPsychiatry, 2005(162):915~923.
[8] Datla KP, Curzon G. Effect of p- chlorophenylalanine at moderate dosage on 5- HT and 5- HIAA concentrations in brain regions of control and p- chloroampheta- mine treated rats [J]. Neuro pharmacology, 1996(35):315~320.
[9] Crockett MJ, Clark L, Tabibnia G, Lieberman MD, Robbins TW. Serotonin modulates behavioral reactions to unfairness [J]. Science, 2008(320):1739.
[10] Mosienko V, Bert B, Beis D, Matthes S, Fink H, Bader M, Alenina N. Exaggerated aggression and decreased anxiety in mice deficient in brain serotonin [J]. Transl Psychiatry, 2012(2):1038~1047.
[11] EJ Young, T Lipina, E Tam, A Mandel, SJ Clapcote, AR Bechard, J Chambers, HT J Mount, PJ Fletcher, JC Roder, LR Osborne. Reduced fear and aggression and altered serotonin metabolism in Gtf2ird1- targeted mice [J]. Genes Brain Behav, 2010(10):224~234.
