小鼠卵胞浆内单精子显微注射改良技术在辅助生殖技术应用中的价值
2015-01-28吴成勇杨满林梅蔡敏生王锦华温雪
吴成勇+杨满+林梅+蔡敏生+王锦华+温雪珍
[摘要] 目的 研究鼠卵胞浆内单精子显微注射(ICSI)改良技术在人类辅助生殖技术应用中的价值。 方法 将小鼠分为两组:采用固定人卵子的固定针组(C-ICSI组)和改良的喇叭型固定针组(N-ICSI组),观察两组ICSI操作后卵子存活数、卵裂情况。 结果 N-ICSI组卵子存活率为77.4%,明显高于C-ICSI组的7.8%,差异有高度统计学意义(χ2=483.183,P < 0.01);两组正常受精率及异常受精率比较,差异均无统计学意义(P > 0.05)。N-ICSI组卵裂数为97.3%,明显高于C-ICSI组的80.0%,差异有高度统计学意义(χ2=18.399,P < 0.01),桑葚胚、囊胚和孵化的胚胎比例差异无统计学意义(P > 0.05)。 结论 改良的小鼠ICSI技术,可以明显提高操作时卵子的存活率,这将为人类实验室ICSI技术的质量控制和研究提供保障,同时,该项研究成果可以分析人精子激活卵母细胞的能力和人精子的核型,因此有重要的研究价值。
[关键词] 昆明小鼠;卵胞浆内单精子显微注射;存活率
[中图分类号] R711.6 [文献标识码] A [文章编号] 1673-7210(2015)01(a)-0008-04
The value of improved ICSI technology in the mouse in the human assisted reproductive technology
WU Chengyong YANG Man LIN Mei CAI Minsheng WANG Jinhua WEN Xuezhen
Reproductive center, the People's Hospital of Meizhou City, Guangdong Province, Meizhou 514031, China
[Abstract] Objective To study the value of improved technology ICSI in the mouse in the human assisted reproductive technology. Methods The ICSI operation were divided into two groups: ICSI operation with holding pipette for holding human ova (C-ICSI group) and with improved holding pipette (N-ICSI group), ova survival and cleavage in the two groups were observed after ICSI operation. Results The rate of ova survival in the N-ICSI group was 77.4%, significantly higher than that in the C-ICSI group (7.8%), there was statistically significant (χ2=483.183, P < 0.01). About the normal fertilization rate and abnormal fertilization rate, there was no significant difference (P > 0.05). The number of cleavage in the N-ICSI group was 97.3%, significantly higher than that in the C-ICSI group (80.0%), there was statistically significant difference (χ2=18.399, P < 0.01). There was no significant difference about the morula, blastocyst and hatching embryo (P > 0.05). Conclusion The modified ICSI technique in the mouse can significantly improve the survival rate of ova, which will provide the guarantee for quality control and research of human laboratory of ICSI technology, at the same time, the research can analyze the ability of human sperm for oocyte activation and karyotype analysis of human sperm, therefore there is an important research value.
[Key words] Kunming mice; Intracytoplasmic sperm injection; Survival rate
近年来,不孕不育的患者呈现出逐年增加趋势,据报道,我国的不孕发生率约为12.5%[1]。部分患者通过治疗虽能怀孕,但仍有患者由于输卵管堵塞、严重少弱畸精症甚至无精子症等需要辅助生殖技术治疗,如体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)、卵母细胞胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)等。实验室胚胎培养是直接关系着辅助生殖技术成功与否的关键环节,因此,做好实验室质量控制,为配子发育与胚胎培养提供良好的环境显得至关重要[2]。有文献报道,昆明小鼠IVF-ET技术对实验室的环境监测、耗材质控方面提供了重要的价值,为人类IVF-ET技术的不断完善和临床妊娠率的不断提高作出了巨大贡献[3]。但是尚无关于小鼠ICSI在实验室质量管理和价值研究的报道。考虑由于人类卵子和小鼠卵子的差异,小鼠卵子通过人类ICSI操作系统难以顺利完成,单精子注射时卵子极易崩解[4-5]。因此,本研究在不改变实验室环境,ICSI操作系统的前提下,对细节部分进行改良,以期利用改良的小鼠ICSI技术能为人类ICSI技术的发展和实验室ICSI技术的质量控制提供价值,现报道如下:
1 材料与方法
1.1 实验动物
实验动物清洁级昆明小鼠均购自广东省实验动物中心,其中4~6周龄雌鼠50只,8~12周龄雄鼠20只。
1.2 实验试剂及设备
孕马血清促性腺激素(PMSG)、注射用人绒毛膜促性腺激素(HCG)均购自宁波市三生药业有限公司。取卵-胚胎处理液(G-MOPS)、洗精受精液(IVF)、卵裂胚培养液(G-1)、囊胚培养液(G-2)均购自瑞典vitrolife公司。培养皿、吸管购自美国Falcon公司。设备:丹麦IVF tech工作站、奥林巴斯(型号:LSZX10)及尼康(型号:SMZ1000)解剖显微镜、奥林巴斯导致显微镜(型号IX71)、Apendorf显微操作系统、ASTEC三气培养箱、CO2气体检测仪、温度测定仪等。
1.3 实验方法
1.3.1 促排卵及卵子准备 选择4~6周龄雌性昆明小鼠,于17:00时腹腔注射PMSG 10 U,48 h后腹腔注射HCG 10 U,14~16 h后采集卵子。卵子准备具体步骤:①颈部脱臼处死昆明小鼠,腹部用75%酒精清洁消毒,逐层打开腹腔,取出卵巢与子宫之间的输卵管组织,放入预恒温的G-MOPS液中;②在解剖显微镜下找到输卵管膨大的壶腹部(透亮),用1 mL注射器针头划破膨大部,流出卵丘复合物组织;③吸出卵丘复合物组织依次放入4孔板的IVF液体中,后保存于第4孔,放入CO2培养箱培养4 h;④准备4孔板,1孔中加入透明质酸酶0.5 mL(80 U/mL),2、3、4孔中加入0.6 mL IVF液体,均用石蜡油覆盖,预温2 h后,卵丘复合物放入1孔透明质酸酶中消化1 min,取出卵子周围的颗粒细胞,后依次在2、3、4孔中洗涤,去除透明质酸酶,完成卵子准备工作。
1.3.2 精子准备 ①选择8~12周龄雄性昆明小鼠,颈部脱臼处死,腹部酒精清洁消毒,打开腹腔,取出附睾尾部组织,放入预恒温的G-MOPS液中。②将附睾尾洗涤后,放入另一有G-MOPS的培养皿中,用1 mL注射器针头刺破附睾尾部组织,放入CO2培养箱孵育15 min。③准备好15 mL离心管,加入2 mL浓度为80%的精子梯度离心液,吸出游离出精子的G-MOPS液,缓慢加入到精子梯度离心液上面,可见清晰的分层,300~600 g离心15 min。④吸出精子沉淀,用IVF液洗涤2次,完成精子制备。
1.3.3 卵母细胞胞浆内单精子注射操作步骤 ①根据固定针的使用不同将ICSI操作分为两组:传统固定人类卵子的固定针组(C-ICSI组)和改良的固定针组(N-ICSI组)。C-ICSI组固定人卵的固定针通过商业化购买。N-ICSI组固定针通过自制完成:选择外径1.0 mm、内径0.75 mm的玻璃管,通过拉针仪和锻针仪拉制端口内径为45~50 μm,开口呈喇叭形的固定针。注射针均选择商业化的ICSI注射针。在显微操作系统上装好固定针和注射针。②ICSI操作皿的准备:取显微操作皿,中心偏上部位做30 μL左右的冲洗滴,以皿的中心为中点做一竖条形的PVP操作滴,再接着以PVP操作滴为对称轴分别在其两侧用G-MOPS做若干10 μL左右的卵子操作滴,覆盖4 mL矿物油后移至桌面培养箱或温箱中预热2 h。③PVP操作滴加入1滴精子悬液,卵子操作滴中加入卵子(3~5个/滴)。④注射针对精子进行断尾,吸取精子头,固定针固定卵子,使纺锤体位于6点钟位置,注射针3点钟处注射精子进入卵子内。⑤操作结束后,用IVF液洗涤卵子后,放入37℃ CO2培养箱培养。
1.4 观察指标
注射后7 h左右观察双原核情况,记录存活卵子数、正常受精卵子、异常受精卵子,24 h后观察卵裂情况,72 h观察桑葚胚,96 h观察囊胚发育、囊胚孵化情况。正常受精比例=正常受精卵子数/存活卵子数×100%;异常受精比例=异常受精卵子数/存活卵子数×100%。
1.5 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两种卵母细胞胞浆内单精子注射操作方法
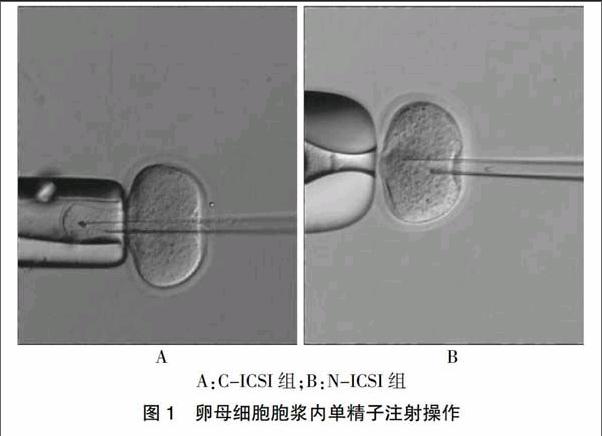
C-ICSI组采用固定人卵子的固定针进行ICSI操作。N-ICSI组采用自制完成的固定针进行操作:开口呈喇叭形。见图1。
A:C-ICSI组;B:N-ICSI组
图1 卵母细胞胞浆内单精子注射操作
2.2 卵子存活率与受精率比较
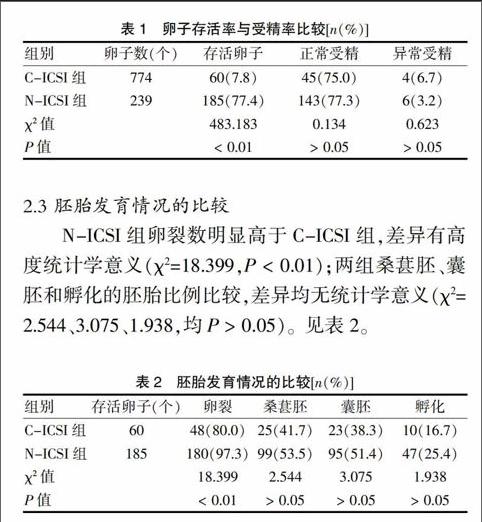
N-ICSI组卵子存活率明显高于C-ICSI组,差异有高度统计学意义(χ2=483.183,P < 0.01),而两组正常受精率及异常受精率比较,差异无统计学意义(P > 0.05)。见表1。
表1 卵子存活率与受精率比较[n(%)]
2.3 胚胎发育情况的比较
N-ICSI组卵裂数明显高于C-ICSI组,差异有高度统计学意义(χ2=18.399,P < 0.01);两组桑葚胚、囊胚和孵化的胚胎比例比较,差异均无统计学意义(χ2=2.544、3.075、1.938,均P > 0.05)。见表2。
表2 胚胎发育情况的比较[n(%)]
3 讨论
人类胚胎实验室是精子、卵子受精和胚胎发育的体外培养场所。实验室内与精子、卵子和胚胎接触的环境直接影响着它们的发育和培养质量,直接关系着辅助生殖技术的成功,如实验室的空气质量、湿度和温度;培养液的pH值、营养物质和渗透压;培养皿的毒性和杂质;培养箱的CO2和O2浓度等的异常都可导致精卵体外受精失败和胚胎发育障碍[6-7]。因此,加强胚胎实验室监测和管理,创造一个适宜稳定的实验室培养环境对提高辅助生殖技术,提高生殖中心整体水平具有重要的作用。有学者报道了小鼠IVF-ET技术可以用于检测实验室的质量,这为生殖医学中心IVF-ET技术的环境稳定提供了保障[8-9]。但是,尚无文献报道关于ICSI技术的实验室质量控制。
ICSI技术从一开始就应用于人的临床治疗,未进行动物实验研究,因此,对于ICSI应用于临床治疗的风险性尚无法得到有效评估[10]。ICSI操作时,是将人工制作的注射针穿刺卵细胞,可能对卵细胞的骨架结构、微丝微管结构造成损伤,并将这些损伤的缺陷传给下一代[11-12]。再则,注射针注入的精子不像自然状态下的受精过程,自然情况下精子通过阴道、宫颈、子宫、输卵管等多个管道才能到达受精部位,这中间存在多个筛选屏障,只有质量足够优良的精子才能越过这些屏障,因此,起到了优胜劣汰的作用。ICSI技术是通过注射针人为地挑选出表观尚正常的精子注入进卵子内,这可能将有遗传缺陷的精子注入卵细胞内[13]。因此,寻找研究ICSI技术及其质量控制的动物模型显得十分必要。
小鼠动物模型价格便宜,且小鼠携带着丰富的遗传信息,小鼠卵子容易获得,因此是比较理想的ICSI模型,但是小鼠的卵子比人的卵子小,对外界损伤的刺激特别是穿刺刺激较敏感,容易崩解,因此临床中对小鼠动物模型进行ICSI研究进展艰难[14-15]。邓利[16]采用传统ICSI方法进行小鼠实验,发现注射后卵子存活率仅为22%,成囊率仅为20%。本研究中C-ICSI组的卵子存活率更低,仅为7.8%,其余大部分均由于注射后胞浆内物质流出细胞外死亡,成囊率为38.3%。表明用人的ICSI操作系统进行小鼠实验,卵子损伤严重,注射部位的卵胞膜受损后,无法自然恢复,导致细胞破裂死亡。苗聪秀等[17]采用改良ICSI方法进行小鼠实验,即使用自制的喇叭型固定针进行ICSI操作,结果卵子存活率达到83.7%,卵裂率达到91.1%。采用改良固定针,不改变实验室的其他环境,与人类的ICSI技术非常相似,小鼠ICSI动物实验成功率明显提高。与传统的ICSI技术相比,改良的ICSI技术能使受损的卵细胞膜有充足的时间修复,因此成活率大大提高。这种可靠的ICSI改良技术,可以广泛用于生殖中心实验室关于ICSI技术的质量控制和科学研究,不断发展和提高人类ICSI技术。不仅如此,改良的ICSI技术还可以检测精子的受精能力。例如,临床中经常遇到一些不孕夫妇,取出的卵子数较多,且质量较好,但进行体外受精时无一卵子受精。这类患者可以采用改良的ICSI技术,将这类患者的精子注入进老鼠的卵细胞内,研究患者的精子激活鼠卵的能力,并对分裂的受精卵进行研究,分析人精子的核型异常情况[18]。
改良的小鼠ICSI技术,可以明显提高操作时卵子的存活率,这将为辅助生殖技术的发展和研究和人类实验室ICSI技术的质量控制提供保障,同时,可以利用该项研究成果,对人精子激活卵母细胞的能力进行研究,分析人精子的核型。因此,改良的小鼠ICSI技术对人类辅助生殖技术的不断发展有着重要的价值,值得进一步研究和应用。
[参考文献]
[1] 曹逸,雷俊,戴婵媛.不孕女性心理应激及测评工具研究进展[J].中华行为医学和脑科学杂志,2014,23(1):86-88.
[2] 沈肖方,张玉花,陈丽丽,等.利用废弃胚胎进行体外受精实验室质控的可行性探讨[J].生殖与避孕,2013,22(2):97-100.
[3] 侯文文,胡卫华,吴满意.新建IVF实验室使用前的生物学检测[J].安徽医学,2013,34(8):1062-1065.
[4] Ron EI R,Liu J,Nagy Z,et al. Intracytoplasmic sperm injection in the mouse [J]. Hum Reprod,1995,10(11):283l-2834.
[5] 苗聪秀,燕志光,杨红梅,等.精子脱尾温育降低小鼠卵胞浆内单精子显微注射的受精率[J].中国现代医学杂志,2013,23(14):1-4.
[6] Brazil C,Swan SH,ToHenr CR,et al. Quality control of laboratory methods for semen evaluation in a multicenter research study [J]. J Androl,2004,25(4):645-656.
[7] 李弘,袁彩霞,秦琴,等.小鼠胚胎实验对新建人类体外受精实验室质量控制的评价[J].中国医药,2013,8(Suppl):47-48.
[8] 李小平,郝朝亮,高庭,等.鼠胚实验在新建胚胎培养实验室质量控制中的作用[J].中南医学科学杂志,2013,41(1):21-23.
[9] Hughes PM,Morbeck DE,Hudson SB,et al. Peroxides in mineral oil used for in vitro fertilization: defining limits of standard quality control assays [J]. J Assist Reprod Genet,2010,27(2-3):87-92.
[10] 李雷,金帆.单精子卵细胞质内注射安全性研究进展[J].国际遗传学杂志,2010,33(1):51-64.
[11] Wen J,Jiang J,Ding C,et al. Birth defects in children conceived by in vitro fertilization and intracytoplasmic sperm injection:a meta-analysis [J]. Fertil Steril, 2012, 97(6):1331-1337.
[12] Derijck AA,van der Heijden GW,Ramos L,et al. Motile human normozoospermic and oligozoospermic semen samples show a difference in double-strand DNA break incidence [J]. Hum Reprod,2007,22(9):2368-2376.
[13] Kobayashi H,Sato A,Otsu E,et al. Aberrant DNA methylation of imprinted loci in sperm from oligospermic patients [J]. Hum Mol Genet,2007,16(21):2542-2551.
[14] 邓利,曾明,匡延平,等.小鼠卵子胞膜在显微穿刺中存活的膜特性因素研究[J].生殖与避孕,2011,12(31):791-796.
[15] Cohen J. A step closer to developing a clinical ICSI model using mouse oocytes [J]. Reprod Biomed Online,2010,21(5):587-588.
[16] 邓利.小鼠ICSI技术改良及体外畸形孵化与囊胚内细胞团分裂风险关系的研究[D].长沙:中南大学,2010, 1-39.
[17] 苗聪秀,燕志光,杨红梅.一种非Piezo依赖的高卵子存活率小鼠显微授精技术[J].上海交通大学学报,2012, 32(8):1020-1023.
[18] Araki Y,Yoshizawa M,Abe H,et al. Use of mouse oocytes to evaluate the ability of human sperm to activate oocytes after failure of activation by intracytoplasmic sperm injection [J]. Zygote,2004,12(2):111-116.
(收稿日期:2014-09-30 本文编辑:任 念)
