2012~2013年鲍曼不动杆菌临床分布及耐药性分析*
2015-01-25吴伟清张彦鹏李卓成
吴伟清,张彦鹏,李卓成
(深圳市第二人民医院检验科,广东深圳518023)
鲍曼不动杆菌(AB)是革兰阴性条件致病菌之一,在临床分离非发酵菌中所占比例仅次于铜绿假单孢菌。AB不仅可引起尿路、呼吸道感染,还可引起危及生命的脑膜炎、心内膜炎和败血症等[1]。近年来,广谱抗菌药物及免疫抑制剂的过度应用,使AB对多种抗菌药物产生耐药性,耐药水平迅速上升,已成为院内感染和二重感染的重要致病菌[2]。现将1 190株AB的流行特征及耐药性分析如下,旨在为临床合理用药提供依据。
1 材料与方法
1.1 一般资料 2012~2013年分离自住院患者不同类型标本的AB 1 190株,剔除分离自同一患者相同部位标本的重复菌株。
1.2 仪器与试剂 VITEK-2Compact全自动微生物分析仪、ID-GN鉴定卡、哥伦比亚血平板购自法国生物梅里埃公司。阿米卡星(AK)、米诺环素(MH)、头孢吡肟(FEP)、头孢曲松(CRO)、美罗培南(MEM)、环丙沙星(CIP)、庆大霉素(GM)、亚胺培南(IPM)、头孢他啶(TAZ)、氨苄西林/舒巴坦(AMS)、哌拉西林/他唑巴坦(TZP)、哌拉西林(PIP)、左氧氟沙星(LEV)、妥布霉素(TOB)、头孢哌酮/舒巴坦(SCF)、替卡西林/克拉维酸(TCC)药敏纸片购自英国OXID公司;Mueller-Hinton平板购自郑州贝瑞特公司。
1.3 方法 按《全国临床检验操作规程》的要求进行标本涂片、接种和培养[3]。所有菌株分离、纯化后,采用 VITEK-2 Compact分析仪进行菌种鉴定。药敏实验采用纸片扩散法(KB法),实验方法和耐药性判定标准参照美国临床和实验室标准协会文件[4]。SCF耐药性判读标准参照头孢哌酮。以大肠埃希菌标准菌株ATCC 25922、铜绿假单胞菌标准菌株ATCC 27853作为质控菌株。
1.4 统计学处理 药敏实验结果分析采用世界卫生组织细菌耐药监测中心推荐的WHONET5.6软件。
2 结 果
2.1 菌株标本分布 1 190株AB分离自痰、灌洗液、分泌物、全血、尿液等标本,其中以痰标本最多(75.21%),其次是灌洗液(7.65%)和分泌物(6.38%),见表1。
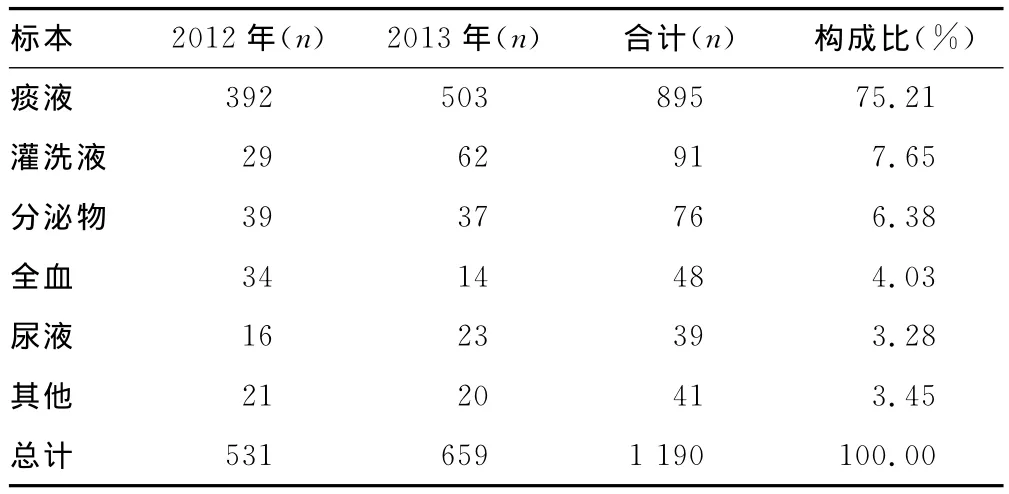
表1 1 190株AB标本分布
2.2 菌株科室分布 1 190株AB均来源于住院患者,主要分布科室为重症监护病房(41.93%)、神经外科(15.97%)、呼吸内科(9.83%)及康复医学科(9.08%),见表2。
2.3 药敏实验结果 1 190株AB对各类抗菌药物呈不同程度的耐药,且耐药率呈上升趋势,除了对SCF、AK、MH的耐药率低于50%外,对其他药物的耐药率为60%~80%。2013与2012年相比,除SCF耐药率下降外,其他抗菌药物的耐药率均升高,其中耐药率显著升高的药物依次为TOB(18.06%)、TZP(17.06%)、IPM (16.65%)、TRO (16.52%)、TAZ(15.46%)。抗菌药物药敏实验结果见表3。

表2 1 190株AB科室分布
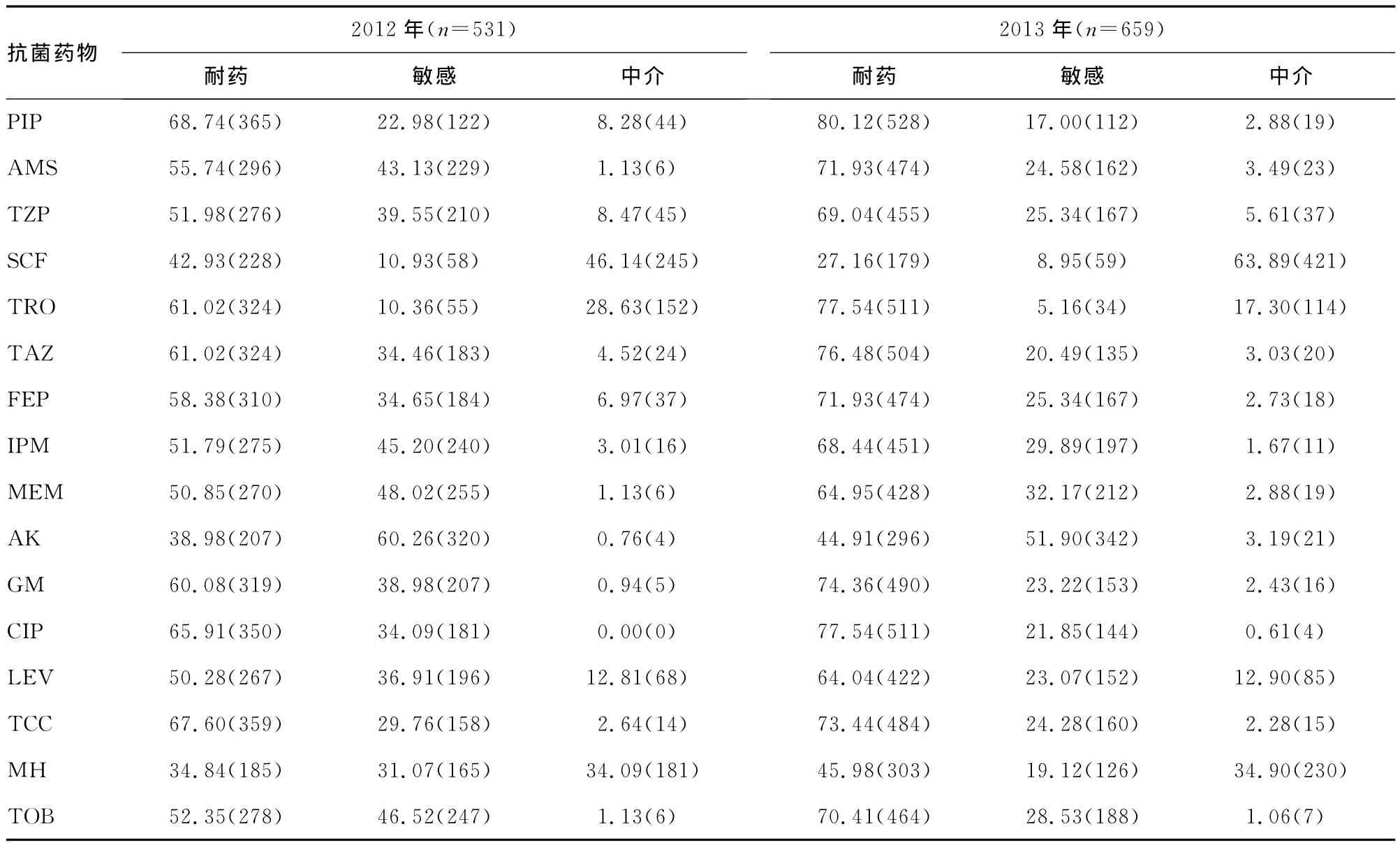
表3 1 190株AB药敏实验结果[%(n)]
3 讨 论
AB是需氧不发酵糖革兰阴性杆菌,属于条件致病菌,临床科室分离菌以重症监护病房、神经外科、呼吸内科、康复医学科多见,同时以下呼吸道标本痰和灌洗液多见,与类似研究报道结果一致[5]。上述科室的患者一般有严重的慢性疾病、并发症,病情危重,需长期卧床,且多有气管插管、气管切开、使用呼吸机等侵袭性操作,加之广谱抗菌药物的不合理使用,易引起AB的定植及过度繁殖,导致菌群失调,进而引起感染[6]。同时,AB是院内感染最常见致病菌,是医院获得性肺炎,尤其是呼吸机相关肺炎的重要致病菌之一。因此,临床相关科室应高度重视医务人员个人防护及消毒卫生、注意患者之间的隔离,防止菌群的相互传播,控制院内感染的发生。
随着广谱抗菌药物的广泛应用,药物选择性压力增大,AB耐药性不断增加,已给临床治疗带来了严峻的挑战。本研究显示,AB耐药现象严重,对多类抗菌药物的耐药率较高,对青霉素类、头孢菌素类、碳青霉烯类、喹诺酮类、氨基糖苷类的耐药率都高达60%,与类似研究报道结果基本一致[7]。对碳青霉烯类IPM的耐药率为68.44%,远高于全国平均水平(56.8%)[7],但低于重庆、安徽、浙江等地[5]。这可能与近年来IPM过度应用,导致AB耐药株增多及交叉感染发病率升高有关。
与2012年相比,2013年AB耐药率上升趋势明显,其中耐药率升高最显著的药物依次为 TOB(18.06%)、TZP(17.06%)、IPM(16.65%)、TRO(16.52%)、TAZ(15.46%),这与上述药物大量应用有关。因此,应严格把握此类药物的适应证,避免不合理用药的发生。同时,本研究显示AB对加酶抑制剂的TZP敏感率高于PIP,说明他唑巴坦等能有效抑制β-内酰胺酶。此外,AB对SCF的耐药率从42.93%降至27.16%,可能与严格执行抗菌药物分级管理制度,控制其使用范围有关,同时也与舒巴坦能与β-内酰胺酶不可逆结合、直接作用于青霉素结合蛋白有关[8]。因此,舒巴坦类的β-内酰胺酶抑制剂对AB具有良好的抗菌活性,可依据其药敏实验结果选择性用药。
有研究显示,AB耐药机制十分复杂[9-10]。对各类抗菌药物的耐药机制分别有:外排泵过度表达、产生β-内酰胺酶、外膜蛋白突变或缺陷导致对β-内酰胺类耐药;外排泵激活、产苯唑西林酶(OXA-23、24、51、58等)和金属酶导致对碳青霉烯类耐药;产生16SrRNA甲基化酶或氨基糖苷类修饰酶(AMEs)导致对氨基糖苷类耐药;DNA旋转酶gyrA亚基及拓扑异构酶ⅣparC亚基点突变导致对喹诺酮类耐药。
AB感染是临床治疗难题之一。对于非多重耐药或多重耐药AB感染株,应根据药敏实验结果选择敏感的抗菌药物,也可适当联合用药。目前较常使用β-内酰胺类与舒巴坦复方抑制剂类,如氨苄西林或头孢哌酮与舒巴坦的复方抑制剂。对于泛耐药AB感染,应采用两药或三药联合用药,例如上述药物与氨基糖苷类药物、多黏菌素B、替加环素联合应用,或再加米诺环素、喹诺酮类等[7]。总之,临床应合理使用抗菌药物,不断优化抗菌治疗方案,以防止和延缓耐药株的产生与流行。
[1] Munoz Price LS,Weinstein RA.Acinetobacter infection[J].N Engl J Med,2008,358(12):1271-1281.
[2] Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful pathogen[J].Clin Mierobiol Rev,2008,21(3):538-582.
[3] 叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006.
[4] Clinical and Laboratory standards Institute.M100-S22Performance standards for antimicrobial susceptibility testing:twenty-second informational supplement[S].Wayne,PA,USA:CLSI,2012.
[5] 张辉,张小江,徐英春,等.2011年中国CHINET不动杆菌属细菌耐药性监测[J].中国感染与化疗杂志,2013,13(9):342-348.
[6] 刘德新,卢俊英,田加坤,等.综合性ICU鲍曼不动杆菌肺部感染调查及耐药性分析[J].中国实验诊断学,2013,17(1):127-129.
[7] 汪复,朱德妹,胡付品,等.2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2013,13(5):321-330.
[8] 谈华,邵海枫,王锦娜,等.舒巴坦单剂及舒巴坦与第三代头孢菌素联合对鲍曼不动杆菌的体外抗菌作用比较[J].中国抗生素杂志,2006,31(8):488-491.
[9] 郑卫东,陈娟,郭亮,等.鲍曼不动杆菌耐药性分析及治疗应对策略[J].国际检验医学杂志,2014,35(12):1597-1599.
[10] Anitha P,Anbarasu A,Ramaiah S.Computational gene network study on antibiotic resistance genes of Acinetobacter baumannii[J].Comput Biol Med,2014,48(8):17-27.
