高效液相色谱—串联质谱法测定动物肝脏中20种全氟烷基类化合物
2015-01-20何建丽彭涛谢洁代汉慧陈冬东岳振峰范春林李存
何建丽+彭涛+谢洁+代汉慧+陈冬东+岳振峰+范春林+李存


摘 要 建立了QuEChERs-高效液相色谱-串联质谱(HPLC-MS/MS)同时测定动物肝脏中20种全氟烷基类化合物(Perfluorinated alkyl substances, PFAS)残留量的分析方法。样品用0.1% HCl-乙腈振荡提取,C18、N-丙基乙二胺(PSA)和石墨化碳黑(GCB)净化,在C18色谱柱,以5 mmol/L NH4Ac甲醇溶液和5 mmol/L NH4Ac溶液为流动相进行梯度洗脱。多反应监测(MRM)负离子模式,采用基质匹配同位素内标法和外标法结合进行定量分析。20种PFAS在0.1~10 μg/L浓度范围内呈线性关系,相关系数不小于0.995;检出限为0.05~0.2 μg/kg,定量限为0.4~0.5 μg/kg。动物肝脏中20种PFAS的3个浓度水平(0.5, 2和5 μg/kg)加标的平均回收率为70.3%~108.1%,相对标准偏差(RSD)在2.1%~11.9%(n=6)之间。
关键词 全氟烷基类化合物;QuEChERs;高效液相色谱-串联质谱;动物肝脏
1 引 言
全氟烷基类化合物(PFAS)是一类具有重要应用价值的含氟有机化合物,含有极高化学键能(约为110 kcal/mol)的〖JG(〗C〖ZJY〗F〖JG)〗共价键,其稳定性高,具有疏油、疏水等特性,被广泛应用于纺织、造纸、包装、农药、地毯、皮革、洗发香波和灭火泡沫等工业和民用领域[1]。PFAS能够经受很强的热、光照、化学、微生物作用和高等脊椎动物的代谢而不降解[2],可以随食物链的传递在生物机体内富集和放大至相当高的浓度[3,4],PFAS在生物体内的蓄积水平高于已知的有机氯农药和二恶英等持久性有机污染物的数百至数千倍[5]。 研究发现,PFAS具有诱发肝中毒、发育毒性、免疫毒性、内分泌干扰以及潜在致癌性等毒理效应[6,7]。2006年,欧盟议会通过决议,规定欧盟市场上全氟辛烷磺酸在配制品中的含量不得超过产品质量的0.005%,半成品中不得超过0.1%,纺织品或塗料中不得超过1 μg/m2, 标志着欧盟正式全面禁止全氟辛烷磺酸在商品中的使用[8]。PFAS主要分布于动物的血液、肝脏、肾脏、心脏和肌肉等组织中,并以血液和肝脏中浓度最高。因此,建立快速、灵敏、准确地测定动物肝脏中PFAS的方法尤为重要。
目前,检测PFAS的常用方法是高效液相色谱-串联质谱法(HPLC-MS/MS),样品前处理多采用液液萃取或离子对试剂提取,WAX固相萃取柱[9~12]净化。传统的前处理方法步骤繁琐、耗时长,方法重现性不好。相比之下,以基质分散固相萃取为基础的QuEChERs(Quick, Easy, Cheap, Effective, Rugged and Safe)方法因其具有灵敏、高效、快速等特点,近年来被广泛应用。
HPLC-MS/MS技术具有高的灵敏度、选择性和重现性,是目前分析PFAS常用的方法[13]。根据动物肝脏基质的特点,本研究采用QuEChERS方法对样品进行提取和净化,采用基质匹配同位素内标法和外标法结合进行定量分析,建立了基质校正HPLC-MS/MS同时测定动物肝脏中20种PFAS残留量的分析方法。本方法简单、实用性强、分析速度快,可广泛用于动物类样品中PFAS的分析。
2 实验部分
2.1 仪器与试剂
ACQUITY UPLCTM超高效液相色谱仪配TQD三重四级杆质谱仪(Waters公司);D160均质/分散机(Dragon Lab公司);TRIO TM-1N型旋涡混合器(AS ONE公司);SR-2DS型水平振荡器(TATEC公司);3-30K型高速冷冻离心机(Sigma公司);N-EVAP 112型氮吹仪(Organomation Associates公司);Milli-Q超纯水仪(Millipore公司);KQ-600B型超声波清洗器(昆山市超声仪器有限公司)。
全氟丁酸、全氟戊酸、全氟丁烷磺酸钾、全氟己酸、全氟庚酸、全氟己烷磺酸钠、全氟辛酸、全氟庚烷磺酸钠、全氟壬酸、全氟辛烷磺酸钠、全氟癸酸、全氟癸烷磺酸钠、全氟十一烷酸、全氟十二烷酸、全氟十三烷酸、全氟十四烷酸、全氟十六烷酸、全氟十八烷酸、全氟壬烷磺酸钠、全氟戊烷磺酸钠和同位素内标13C4-全氟丁酸、13C2-全氟己酸、18O2-己烷磺酸钠、13C4-全氟辛酸、13C4-辛烷磺酸钠、13C5-全氟壬酸、13C2-全氟癸酸、13C2-十一烷酸、13C2-十二烷酸混合内标(Wellington公司);甲醇、乙腈(色谱纯,Fisher公司);乙酸铵(色谱纯,Acros Organics公司);C18(CNWBOND HC-C18,40~63 μm,CNW公司),N-丙基乙二胺(PSA,40~60 μm,艾尔杰公司),石墨化碳黑(GCB,CNWBOND Carbon-GCB,120~400目,CNW公司),实验用水为Milli-Q超纯水,其它未作特殊说明的试剂均为分析纯。
为防止引入高背景值,实验过程避免使用聚四氟乙烯材质的色谱管路和器皿。
2.2 样品预处理
2.2.1 提取 准确称取2.00 g牛肝匀质样品置于50 mL离心管中,加入适量内标,再加入4 mL超纯水,漩涡混合1 min后,加入0.1%盐酸乙腈10 mL,均质1 min后振摇10 min,加入2 g NaCl,再次振摇10 min,13000 r/min离心10 min。取上层乙腈相于15 mL离心管中,40 ℃下氮吹约至4 mL,以乙腈定容至4 mL,待净化。endprint
2.2.2 净化 将上述溶液转移至装有80 mg C18、100 mg PSA和40 mg GCB填料的离心管中,振摇10 min后, 13000 r/min离心10 min,取上清液(约4 mL)于另一离心管中,40 ℃下氮气吹至干,以1 mL甲醇定容后, 过0.22 μm滤膜,HPLC-MS/MS分析。
2.2.3 HPLC-MS/MS分析条件 液相色谱条件:Atlantis T3色谱柱(150 mm×2.1 mm,3 μm);柱温:38 ℃;流速:0.2 mL/min;进样量:10 μL;流动相:A为5 mmol/L NH4Ac-甲醇溶液,B为5 mmol/L NH4Ac溶液;洗脱梯度:0~3 min,10%~30% A;3~13 min,30%~100% A;13~14 min,100%~10% A;14~20 min, 10% A。
质谱条件:电喷雾离子源(ESI);多反应监测(MRM);负离子模式;毛细管电压: 3.0 kV;源温度:120 ℃;去溶剂气流:氮气,650 L/h;去溶剂温度:350 ℃;锥孔气流:氮气,100 L/h;碰撞气压:氩气,2.4×10 Symbolm@@ 6 Pa。其它参数见表1。
2.3 标准曲线2.3.1 外标曲线 以阴性空白牛肝样品提取液(操作同2.2节,但提取步骤不加内标溶液)作为溶剂,将标准品稀释成0.1, 0.5, 1, 2, 5和10 μg/L系列基质匹配标准溶液,以待测物的质量浓度为横坐标,定量离子质量色谱峰面积为纵坐标, 绘制外标曲线。
2.3.2 内标曲线 步骤同2.4.1节,其中每份标准溶液内都含1 μg/L内标,以待测物的质量浓度为横坐标,定量离子质量色谱峰面积与内标峰面积的比值为纵坐标, 绘制内标曲线。
3 结果与讨论
3.1 色谱条件的优化
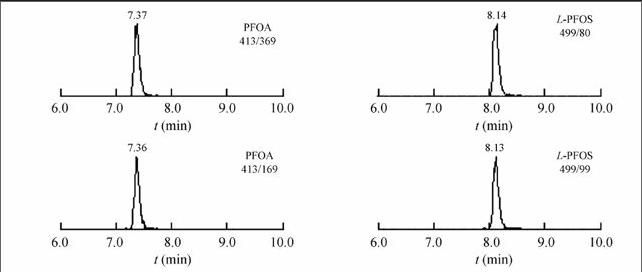
PFAS同时具有亲水性和疏水性,采用较低硅羟基活性填料的C18反相色谱柱可实现这类化合物的良好分离[14~16]。通过对Waters XTerra C18柱、Capcell Pak C18和Atlantis T3 C18色谱柱进行对比,发现Atlantis T3 C18的峰形与分离度效果最佳。流动相选取乙腈-水、甲醇-水等进行比较,结果表明, 以甲醇-水作为流动相, 化合物分离度更好。所测PFAS都是羧酸或者磺酸盐,在流动相中加入NH4Ac能使其保持一定的pH值及离子强度,减少拖尾,改善峰形[17],有研究表明, 较高浓度的NH4Ac对质谱检测有较强的抑制作用[18]。因此,经过优化后,本实验采用Atlantis T3 C18型色谱柱,以5 mmol/L NH4Ac甲醇溶液和5 mmol/L NH4Ac溶液进行梯度洗脱(梯度洗脱条件见2.3节),20种目标物在20 min内可实现良好分离,保留时间见表2。PFOA和L-PFOS的标准溶液的MRM色谱图见图1。
3.2 质谱条件的优化
由于目标物带有SO2 Symbolm@@ 3,难于质子化,不宜采用ESI+模式,故本实验选取ESI Symbolm@@ 模式进行扫描。用针泵以20 μL/min的流速分别注入100 μg/L PFAS标准溶液,在m/z 200~1000扫描范围内, 以负离子模式进行一级质谱扫描,发现PFAS化合物峰较强,大部分化合物以电离后失去羧基上氢原子为主。确定分子离子后,分别以其作为母离子,进行子离子扫描,选取丰度最强碎片离子作为定量离子,次强的碎片离子作为定性离子。部分化合物打碎后的碎片离子少,只能找到一个离子。最后,以选择反应监测(MRM)负离子模式优化锥孔电压、碰撞能量等参数,质谱条件见表1。
3.3 提取溶剂的选择
PFAS属于酸性化合物,在酸性环境下呈分子状态,有利于进入有机相。已报道的文献中采用0.1% HCl-甲醇溶液[19]、乙腈[20]、2%甲酸-甲醇溶液[21]等作为提取溶剂,提取尿液[13]、奶粉[19]和肝脏[21]等基质中PFAS。在参考文献的基础上,本实验分别用乙腈、甲醇、0.1% HCl-乙腈溶液、2%甲酸-甲醇溶液、0.1%HCl-甲醇溶液、2%甲酸-乙腈溶液作为提取溶剂,比较不同提取溶剂对目标物的提取效率。结果表明,用0.1% HCl-乙腈溶液提取的效率最好,在1 μg/kg 加标水平下, 目标物的平均回收率为85.3%~117.2%,且不同目标物之间无明显差异,结果见图2。最后,选择0.1% HCl-乙腈溶液为提取溶剂。
3.4 净化方式的选择
动物肝脏中存在色素、脂肪、甾醇等杂质,PSA可以吸附基质中的碳水化合物、有机酸和酚类,C18可以去除脂肪和酯类等,GCB可以去除色素、甾醇类等。吸附剂粉末的用量直接影响前处理净化效果和目标物的回收率,用量小则净化效果不明显,用量大,净化效果虽好,但回收率低,不能满足检测要求,为选择合适的吸附剂粉末的用量,比较了3种不同的吸附剂净化的样品回收率。
用C18净化样品后的平均回收率大于80%,但重现性不好,且净化后的溶液有色素残留;PSA和GCB净化色素效果较好,但净化后的溶液有油脂残留。为了解决以上难题,使用以上3种吸附剂的组合,在检测灵敏度、最佳净化效果和合理回收率之间寻求平衡点,使全部化合物获得满意的结果。实验对不同比例PSA、C18、GCB(1∶1∶1,2∶2∶1,2.5∶2∶1,3∶2∶1,w/w)的净化效果进行了考察(图3),结果表明,以2.5∶2∶1的质量比混合3种吸附剂PSA、C18、GCB获得最佳净化效果,20种PFAS平均回收率能达到73%~112%,背景值干净,加标样品的分离度和峰形均较好。因此,选择混合吸附剂(PSA, C18, GCB,2.5∶2∶1, w/w)为净化吸附剂。endprint
3.5 基质效应
以阴性空白牛肝样品提取液作为溶剂,配制1 μg/L 的混合标准溶液,测定其峰面积为A;以甲醇为溶剂配制1 μg/L的混合标准溶液测定其峰面积为B。基质效应ME(%)=B/A×100[22],结果见表3。其中ME>100%的为基质增强效应,ME<100%的为基质抑制效应。可以看出,样品提取液对部分目标化合物存在一定的基质影响。为保证定量分析准确性,本方法选择基质匹配的标准溶液进行测定。
3.6 定量方式及线性关系
在检测PFAS的过程中,通常情况下由于待测样品中PFAS的含量较低,因此在检测技术不够稳定以及仪器灵敏度有所限制的条件下,采用外标法定量测定会产生较大的误差,而内标法的使用会使这一问题迎刃而解,可最大限度地减少由仪器响应度所引起的误差[5]。同时,由于存在基质效应,因此实验中以空白牛肝样品提取液作为溶剂配制混合标准系列溶液。L-PFHpS、PFTrDA、L-PFPeS未寻找到性质相同的同位素内标,采用基质匹配外标法,其它17种PFAS采用基质匹配内标法进行定量分析,结果见表4。
在阴性样品中添加目标化合物,按照给定的方法测定,以3倍信噪比(S/N)对应的添加水平作为检出限(LOD),10倍信噪比(S/N)对应的添加作为定量限(LOQ),结果见表4。结果表明,本方法LOD在0.05~0.2 μg/kg之间,LOQ在0.4~0.5 μg/kg之间。
3.7 准确度和精密度
实验选择1倍、4倍和10倍LOQ作为添加量,考察方法的准确度和精密度。选取阴性牛肝为空白样品,分别添加相当于0.5, 2和5 μg/kg浓度的PFAS混合标准溶液,按本方法进行测定,每个浓度6个平行。同时做空白实验,均扣除本底值后计算添加回收率和相对标准偏差(RSD)。PFAS在牛肝中的添加回收率为70.3%~108.1%,RSD在2.1%~11.9%范围内,结果见表5。3.8 实际样品分析
应用本方法测定60份市售牛肝样品,结果发现,实际样品中检出PFDA、L-PFHxS、L-PFOS,含量在0.6~0.9 μg/kg,其余各组分均未检出,实际检出率低于7.3%。长链PFAS检出率较高,在肝脏组织中富集明显且普遍。图4为阳性牛肝样品中检出的3种PFAS的MRM色谱图。
4 结 论
本实验通过对仪器检测参数和样品前处理条件的优化,采用基质匹配同位素内标法和外标法结合定量,首次建立了基质校正HPLC-MS/MS同时测定动物肝脏中20种PFAS残留量的分析方法。方法简单、快速、灵敏度高、准确度好、溶剂消耗量少, 且有效克服了基质干扰问题,可广泛用于动物类样品中PFAS的测定。
References
1 Kissa E. Fluorinated Surfactants: Synthesis, Properties, and Applications. NewYork: Marcel Dekker, 1994: 50
2 Kissa E. Fluorinated Surfactants and Repellents, 2nd Edition. New York: Marcel Dekker Inc., 2001
3 Kannan K, Tao L, Sinclair E, Pastva S D, Jude D J, Giesy J P. Arch. Environ. Contam. Toxicol., 2005, 48: 559-566
4 Tomy G T, Budakowski W, Halldorson T, Helm P A, Stern G A, Friesen K, Pepper K, Tittlemier S A, Fisk A T. Environ. Sci. Technol., 2004, 38(24): 6475-6481
5 ZHOU Qing, ZHANG Man-Cheng, LU Yu-Fei, WANG Lian-Hong, LI Ai-Min. Environ. Sci. Technol., 2008, 31(7): 44-52
周 庆, 张满成, 卢宇飞, 王连红, 李爱民. 环境科学与技术, 2008, 31(7): 44-52
6 Luebker D J, Case M T, York R G, Moore J A, Hansen K J, Butenhoff J L. Toxicology, 2005, 215(1/2): 126-148
7 Luebker D J, York R G, Hansen K J, Moore J A, Butenhoff J L. Toxicology, 2005, 215(1/2): 149-169
8 JIANG Hong, SHENG Xuan, YANG Yan-Yan, ZHANG Lei, ZHENG Ping. Anhui Chemical Industry, 2007, 146(2): 5-10
蒋 闳, 盛 旋, 杨嫣嫣, 张 蕾, 郑 屏. 安徽化工, 2007, 146(2): 5-10
9 Clarkea D B, Baileyb V A, Routledgeb A, Lloyda A S, Hirda S, Mortimerc D N, Gemc M. Food Addit. Contam., 2010, 27(4): 530-545endprint
10 GUO Meng-Meng, WU Hai-Yan, LI Zhao-Xin, TAN Zhi-Jun, ZHAI Yu-Xiu. Chinese J. Anal. Chem., 2013, 41(5): 1322-1327
郭萌萌, 吴海燕, 李兆新, 谭志军, 翟毓秀. 分析化学, 2013, 41(5): 1322-1327
11 Chang Y C, Chen W L, Bai F Y, Chen P C, Wang G S, Chen C Y. Anal. Bioanal. Chem., 2012, 4(2): 1315-1327
12 WANG Jie-Ming, WANG Li, FENG Yu-Jing, PAN Yuan-Yuan, SHI Ya-Li, CAI Ya-Qi. Food Sci., 2010, 31(4): 127-131
王杰明, 王 丽, 冯玉静, 潘媛媛, 史亚利, 蔡亚歧. 食品科学, 2010, 31(4): 127-131
13 GUO Fei-Fei, WANG Yu-Xin, LI Jing-Guang, ZHANG Jia-Ling, ZHAO Yun-Feng, WU Yong-Ning. Chinese Journal of Chromatography, 2011, 29(2): 126-130
郭斐斐, 王雨昕, 李敬光, 张加玲, 赵云峰, 吴永宁. 色谱, 2011, 29(2): 126-130
14 ZHANG Ping, SHI Ya-Li, CAI Ya-Qi, MOU Shi-Fen. Chinese J. Anal. Chem., 2007, 35(7): 969-972
张 萍, 史亚利, 蔡亚歧, 牟世芬. 分析化学, 2007, 35(7): 969-972
15 PAN Yuan-Yuan, SHI Ya-Li, CAI Ya-Qi. Chinese J. Anal. Chem., 2008, 36(10): 1321-1326
潘媛媛, 史亚利, 蔡亚歧. 分析化学, 2008, 36 (10): 1321-1326
16 PAN Yuan-Yuan, SHI Ya-Li, CAI Ya-Qi. Chinese J. Anal. Chem., 2008, 36 (12): 1619-1623
潘媛媛, 史亚利, 蔡亚歧. 分析化学, 2008, 36 (12): 1619-1623
17 Nakata H, Nakata A, Okada F, Ito R, Inoue K, Saito K, Nakazawa H. Bunseki Kagaku, 2005, 54(9): 877-884
18 LAN Fang, FENG Sha, SHEN Jin-Can, WU Xiao-Ping, YUE Zhen-Feng. Chinese J. Anal. Chem., 2013, 41(12): 1893-1898
蓝 芳, 冯 沙, 沈金灿, 吴晓萍, 岳振峰. 分析化学, 2013, 41(12): 1893-1898
19 WANG Jie-Ming, PAN Yuan-Yuan, SHI Ya-Li, CAI Ya-Qi. J. Instrumental Anal., 2009, 28(6): 720-724
王杰明, 潘媛媛, 史亚利, 蔡亚岐. 分析测试学报, 2009, 28(6): 720-724
20 LIU Li-Zhi, GUO Xin-Dong, SUN Fang-Jun, XIAN Yan-Ping, HUANG Cong, PENG Rong-Fei, LUO Xiao-Yan. J.Instrumental Anal., 2013, 32(7): 862-866
刘莉治, 郭新东, 孙方军, 冼燕萍, 黄 聪, 彭荣飞, 罗晓燕. 分析测试学报, 2013, 32(7): 862-866
21 WANG Yu-Xin, LI Jing-Guang, ZHAO Yun-Feng,GUO Fei-Fei, WU Yong-Ning. Chinese J. Anal. Chem., 2011, 39(8): 1134-1140
王雨昕, 李敬光, 赵云峰, 郭斐斐, 吴永宁. 分析化学, 2011, 39(8): 1134-1140
22 Matuszewski B K, Constanzer M L, Chavez-Eng C M. Anal. Chem., 2003, 75: 3019-3030
Development of a QuEChERs Method for Determination of 20endprint
Perfluorinated Compounds in Animal Liver by HPLC-MS/MS
HE Jian-Li1,2, PENG Tao*2, XIE Jie3, DAI Han-Hui2, CHEN Dong-Dong2,
YUE Zhen-Feng4, FAN Chun-Lin2, LI Cun*1
1(Tianjin Agricultural University, Tianjin 300384, China)
2(Chinese Academy of Inspection & Quarantine, Beijing 100123, China)
3(College of Veterinary Medicine, China Agricultural University, Beijing 100083, China)
4(Shenzhen Entry-Exit Inspection and Quarantine Bureau, Shenzhen 518033, China)
Abstract A method for simultaneous determination of 20 Perfluorinated alkyl substances (PFAS) in animal liver using QuEChERs and HPLC-MS/MS technique was developed. The samples were extracted with 0.1% hydrochloric acetonitrile and cleaned up with C18, N-Propylethylendiamine (PSA) and graphitized carbon blacks (GCB). The analytes were separated by a reversed phase C18 column and gradiently eluted with a mixed solution of 5 mmol/L ammonium acetate methanol and 5 mmol/L ammonium acetate. The samples were quantified using isotope internal standard and external standard with the matrix matched standard calibration curve method. Good linearity was obtained for all the 20 PFAS at the concentration of 0.1-10 μg/L with the linear correlation coefficients more than 0.9995. The limits of detection (LOD) and the limits of quantification (LOQ) for PFAS were 0.05-0.2 μg/kg and 0.4-0.5 μg/kg, respectively. The recoveries at three different concentration levels (0.5, 2 and 5 μg/kg) were in the range of 70.3%-108.1%. The repeatability expressed as relative standard deviations (RSD) was ranged from 2.1% to 11.9% (n=6).
Keywords Perfluorinated alkyl substances; QuEChERs; High performance liquid chromatography-tandem mass spectrometry; Animal liver
(Received 29 July 2014; accepted 19 September 2014)endprint
