豆蔻酸和棕榈酸诱导茄子根际拮抗菌与黄萎菌数量消长的关系
2015-01-20尹玉玲汤泳萍周宝利
尹玉玲, 刘 圆, 汤泳萍, 周宝利
1 江西省农业科学院蔬菜花卉研究所, 南昌 330200 2 辽宁省盐碱地利用研究所, 盘锦 124010 3 沈阳农业大学园艺学院, 沈阳 110161
豆蔻酸和棕榈酸诱导茄子根际拮抗菌与黄萎菌数量消长的关系
尹玉玲1, 刘 圆2, 汤泳萍1, 周宝利3,*
1 江西省农业科学院蔬菜花卉研究所, 南昌 330200 2 辽宁省盐碱地利用研究所, 盘锦 124010 3 沈阳农业大学园艺学院, 沈阳 110161
以气质联用仪(GC-MS)鉴定的嫁接茄与自根茄根系分泌物主要差异成分豆蔻酸和棕榈酸,利用它们的模拟物质研究了其对茄子根际土壤黄萎菌拮抗真菌与细菌数量和根际土壤黄萎菌数量的影响,明确了两模拟成分对茄子根际拮抗真菌和拮抗细菌的诱导作用及对黄萎菌数量抑制效果。同时,进一步分析了茄子根际拮抗真菌与细菌数总和与根际土壤黄萎菌数量的相关性。结果表明豆蔻酸和棕榈酸处理,茄子根际拮抗真菌和细菌数量均有所增加,在中高浓度下拮抗真菌和细菌数量增加显著。两物质处理下拮抗真菌与细菌数量在开花期和结果期增加显著。两物质对茄子根际黄萎菌数量的影响,整体来说,随两模拟组分浓度的增加土壤黄萎菌数量有所减少,各时期表现有所差异,在开花期两物质处理显著减少了黄萎菌数量。相关性分析表明豆蔻酸和棕榈酸处理下茄子根际拮抗真菌与细菌总量与根际黄萎菌数量呈显著的负相关性。说明嫁接通过改变茄子根系分泌物成分与对茄子根际土壤黄萎菌拮抗菌的诱导有一定关系。
豆蔻酸; 棕榈酸; 根系分泌物; 黄萎菌; 拮抗菌
茄子黄萎病是由大丽轮枝菌(Verticilliumdahliae)引起的土传病害,该菌从根部侵染,通过维管束进入植株,植株感病后叶片发黄严重时干枯脱落,黄萎菌以微菌核的形式越冬,能够在土壤中长期存活,防治难度大,是茄子重要病害之一。随着蔬菜专业化生产和设施栽培的发展,茄子连作障碍加剧,黄萎病发生有越来越早的趋势,而且病害加重,严重影响茄子的正常产量。嫁接作为克服茄子连作障碍的一种有效的技术措施,已经在生产上广泛应用,防治黄萎病效果达到90%以上[1]。关于嫁接抗病机理的报道有很多,嫁接后,茄子的生长势明显增强,植株高大、长势旺盛,砧木对接穗产生一系列生理影响,茄子内源激素水平增加,光合作用增强,且研究发现抗病砧木根部能够抑制病菌的初侵染[2]。其抗病效果与抗氧化系统酶活性的变化也呈正相关[3]。
植物对土传病害的抗性与根际微生物有密切关系[4],利用植株上附生的或根际土壤中的拮抗细菌或其代谢产物调控根围有害微生物的平衡以达到防病的目的,是土传病害防治的重要途径之一[5-7]。嫁接增加了茄子根际细菌菌群数量,降低了真菌菌群数量,改善了土壤微生物环境[8]。并且嫁接诱导了茄子根际黄萎菌拮抗菌株产生[9]。而植株是通过根系分泌物直接或间接地影响土壤微生物包括病原微生物的。嫁接改变茄子根系分泌物中氨基酸和酚酸种类和含量且对黄萎菌的有一定的化感抑制作用[10]。本课题组前期研究证明嫁接可以诱导茄子根际土壤产生拮抗菌,并发现嫁接可改变了茄子根系分泌物的生化组成,增加豆蔻酸和棕榈酸等物质[11],嫁接茄根际土壤中化感物质的变化与根系分泌物生化组成变化基本一致[12]。然而,嫁接茄子根系分泌物生化组成的改变是否是土壤拮抗菌产生的原因,还未见报道。本文选取两种化感模拟物质豆蔻酸和棕榈酸,明确差异性根系分泌物组分对茄子根际土壤拮抗菌数量的影响,并研究化感物质对茄子根际土壤中黄萎菌数量的影响,分析化感物质诱导的拮抗菌数量与黄萎菌数量的相关性。旨在以根系分泌物化感作用为切入点,阐明嫁接诱导茄子根际拮抗菌产生的生物化学基础,深入探讨嫁接诱导茄子根系分泌物成分的改变趋化拮抗菌间接和直接抑制黄萎菌滋生这一嫁接抗病机理。
1 材料与方法
茄子品种为西安绿茄,用于温室盆栽试验;供试品种均由沈阳农业大学园艺学院提供。模拟在GC-MS中鉴定出的茄子根系分泌物替代成分豆蔻酸(十四酸商品名)和棕榈酸(十六酸商品名)均购自上海化学试剂公司。
1.1 试验设计
2011年2月12日播西安绿茄,当长至3—4片真叶时定植于直径为20 cm的花盆中,栽培基质为草炭∶土∶粪=1∶1∶1,土为蔬菜温室连作土壤,每盆1株。根据本课题组对化感物质浓度研究经验和前期室内测定两种化感物质对黄萎菌孢子萌发和菌丝生长影响的结果,设定5个浓度,即豆蔻酸为0、0.05、0.5、1、2 mmol/kg;棕榈酸为0、0.05、0.5、1、5 mmol/kg,按浓度与栽培基质混匀,每盆装1.5 kg基质。以不添加处理即0 mmol/kg为对照。每个处理15次重复;随机排列,培养15 d后开始分3个时期取样,每次随机选取3盆混合取样。分别为现蕾期、开花期和结果期。进行根际土壤黄萎菌和拮抗菌数量测定。
1.2 茄子根际土壤黄萎菌数量测定
取植株根际土,风干7d后,4 ℃冰箱内保存待测黄萎菌菌核数。采用水筛法分离土壤黄萎菌:称取5 g土样溶于装有200 mL水的三角瓶中,静置20 min后,充分摇动5 min,并在自来水下用200—38 μm筛网过筛土样液,并将留在38 μm 筛网上的土壤残留物全部转移到小三角瓶中,用蒸馏水定容为40 mL。接5 皿,每皿用液移枪分别移取2 mL展布于培养基表面(每皿相对接种量为0.25 g),置超净工作台上自然风干,在25 ℃下培养3 周,取出培养皿后,在自来水下用毛刷轻轻刷掉培养基表面的土粒,借助光源在双目解剖镜下,统计培养基上黄萎菌微菌核萌发形成的菌落数。
1.3 土壤中拮抗菌数量测定
将真菌和细菌分离培养基中加入孢子浓度为107的黄萎菌的发酵液,采用土壤稀释法分离真菌、细菌,每次各处理分离2种微生物拮抗菌,各浓度处理均分离3皿(3次重复)。25 ℃温箱内培养,3d后计数黄萎菌拮抗菌数量并汇总。
1.4 数据处理
采用Microsoft Excel和DPS统计软件Duncan法进行数据差异显著性分析。
2 结果与分析
2.1 豆蔻酸和棕榈酸对根际拮抗菌的诱导作用
2.1.1 豆蔻酸对根际拮抗菌的诱导作用
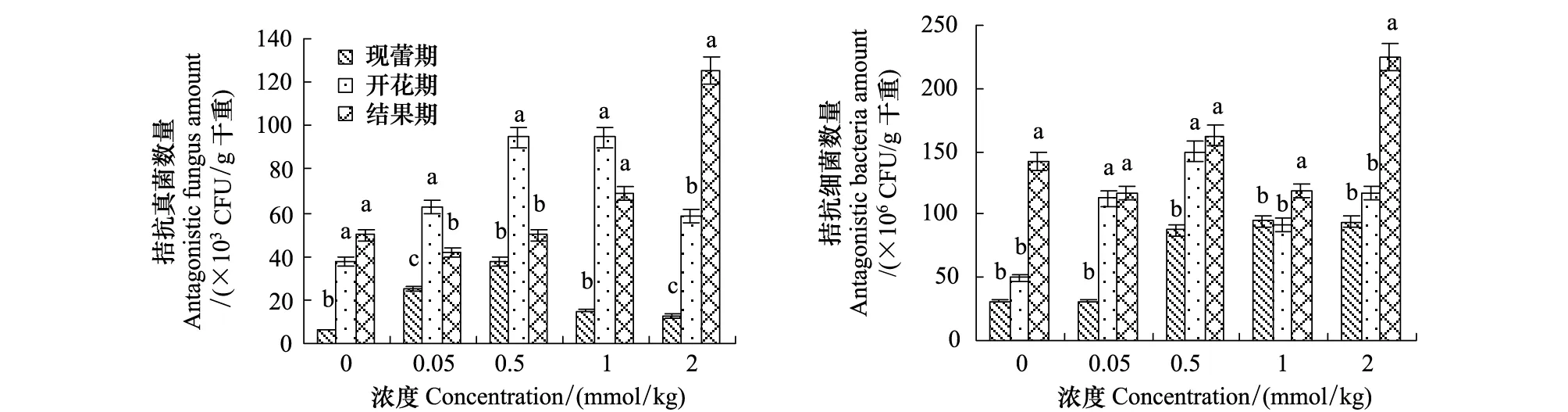
图1 豆蔻酸对茄子根际拮抗菌数量消长的影响Fig.1 Effect of myristic acid on the amount of antagonistic microbes in the rhizosphere of the eggplantsCFU: 菌落形成单位Colony-forming units; 字母完全不同表示差异显著(P<0.05)
豆蔻酸处理增加了茄子根际土壤黄萎菌拮抗真菌和细菌的数量,对拮抗真菌的增加幅度要高于拮抗细菌,各时期均以中高浓度最为显著(图1)。现蕾期,拮抗真菌数量随豆蔻酸浓度增加表现先增加后降低;开花期,豆蔻酸对拮抗真菌表现出了显著的诱导效果,0.5和1 mmol/kg 最为显著;结果期,高浓度处理较为显著地诱导了拮抗真菌数量。而对于拮抗细菌数量在现蕾期和开花期受豆蔻酸诱导增加的幅度较大。现蕾期,拮抗细菌数量0.05 mmol/kg处理与0 mmol/kg相差不多,其它浓度处理则显著增加;开花期,拮抗菌数量随豆蔻酸浓度表现出先增加后降低的趋势;结果期在高浓度2 mmol/kg处理下,拮抗细菌数量显著高于其他浓度处理。
2.1.2 棕榈酸对根际拮抗菌的诱导作用
棕榈酸处理均增加了茄子根际土壤黄萎菌拮抗真菌和细菌数量(图2)。随着时期的增加,各浓度处理均增加了茄子根际黄萎菌拮抗真菌数量;现蕾期在棕榈酸1 mmol/kg处理处拮抗真菌数量最多;开花期,拮抗真菌数量波动较大,总体上在高浓度处理,棕榈酸显著增加拮抗真菌数量;结果期,在浓度0.05 mmol/kg处理下,棕榈酸增加拮抗真菌数量最多,之后随浓度增加略有下降。而对于拮抗细菌数量,现蕾期,随棕榈酸浓度增加表现出逐渐增加的趋势;开花期,表现出随浓度增加先增加后降低的趋势,在棕榈酸0.5 mmol/kg处理,达最大值;结果期,各浓度,除了1 mmol/kg处理外,其它浓度处理均显著增加了拮抗细菌数量。
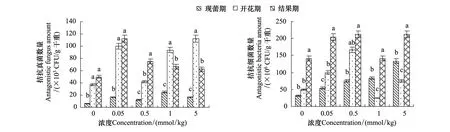
图2 棕榈酸对茄子根际拮抗菌数量消长的影响Fig.2 Effect of palmitic acid on the amount of antagonistic microbes in the rhizosphere of the eggplants
2.2 豆蔻酸和棕榈酸对茄子根际黄萎菌数量的影响
豆蔻酸和棕榈酸处理均降低了茄子根际黄萎菌数量,两者相比,豆蔻酸处理下,茄子根际土壤黄萎菌数量下降较多。豆蔻酸处理,开花期表现出较强的降解黄萎菌效果。3个时期均表现出高浓度处理降解效果明显的特点(图3)。棕榈酸处理减少了茄子根际黄萎菌的数量。随着生育时期,黄萎菌数量均表现为先增加后降低的趋势,现蕾期,各浓度处理均降低了黄萎菌数量,但处理间相差不多;开花期,棕榈酸处理显著降低了茄子根际黄萎菌数量,黄萎菌数量表现出先增加后降低的趋势。高浓度下黄萎菌数量下降最多。结果期,黄萎菌数量随棕榈酸浓度的增加呈现梯度降低的现象,高浓度效果显著(图4)。
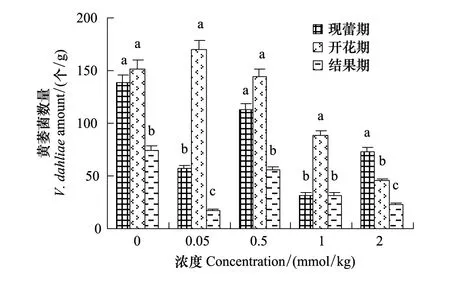
图3 豆蔻酸对茄子根际土壤黄萎菌数量的影响Fig.3 Effect of myristic acid on the amount of V. dahliae in the rhizosphere of the eggplants
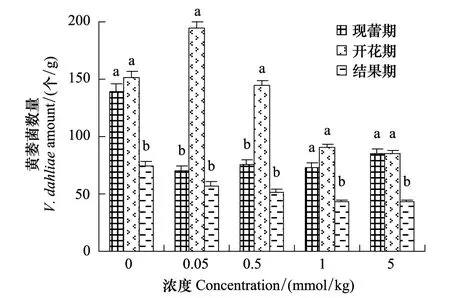
图4 棕榈酸对茄子根际土壤黄萎菌数量的影响Fig.4 Effect of palmitic acid on the amount of V. dahliae in the rhizosphere of the eggplants
2.3 根际拮抗真菌与细菌总量与黄萎菌数量的相关性
豆蔻酸和棕榈酸处理下,茄子根际拮抗菌总数与根际黄萎菌数量均呈负相关(表1),两模拟物质处理相比,豆蔻酸处理的茄子根际拮抗菌与黄萎菌数量负相关在现蕾期和结果期均高于棕榈酸处理。茄子发育的不同时期,其根际拮抗菌与黄萎菌数量的负相关性有所波动,豆蔻酸处理下,两者负相关关系数逐渐降低,现蕾期负相关系数达到显著水平,为-0.815。而棕榈酸处理下,则表现出了先增高后减低的趋势,且开花期,拮抗菌总量与黄萎菌数量相关系数呈极显著的负相关,达到-0.9643,决定系数达到0.93。
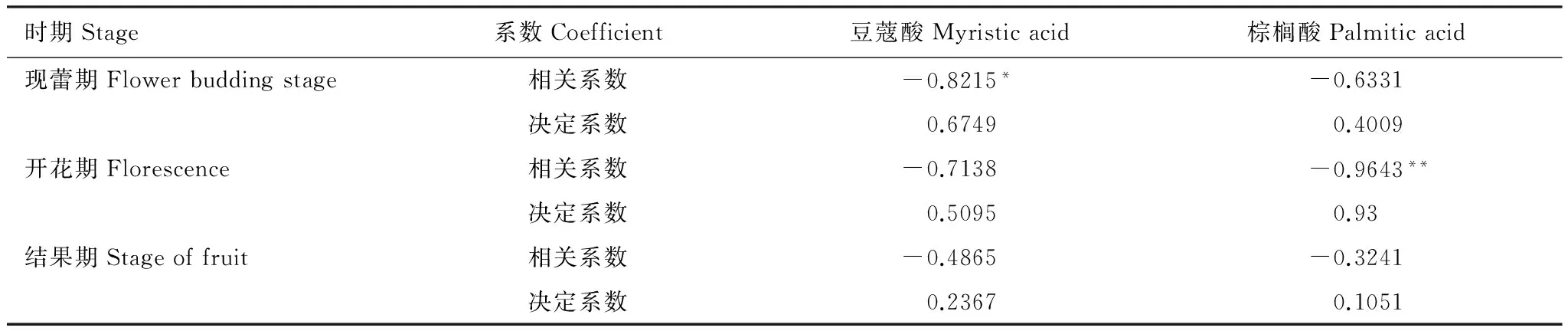
表1 豆蔻酸和棕榈酸处理下茄子根际拮抗真菌和细菌总量与黄萎菌数量的相关分析
3 讨论
根系作为连接植物与土壤的纽带,通过根系分泌物向根际环境释放各种有机和无机化合物,因此根系分泌物改变植物的根际微环境[13]。目前,已发现的根分泌物包括糖、有机酸、氨基酸等初生代谢产物以及酮、酚、胺、萜类、有机酸等次生代谢物和一些不知名的代谢物。这些物质可以影响土壤透气性、湿度、酸碱度、土壤颗粒大小等土壤理化性质、养分有效性及根际微生物的种类和数量[14-15]。同时,根系分泌物也能够诱导土壤有益微生物菌群而有助于植物的生长发育[16]。特殊的酚类化合物可以作为信号物质吸引有益微生物、固氮菌如根瘤菌和菌根真菌在根际的定殖[17]。根际假单胞荧光杆菌属能够克服燕麦全蚀病菌对寄主的侵染[18-19]。番茄根系分泌中的苹果酸、柠檬酸和琥珀酸等增加了有益芽孢杆菌在根系定殖的数量[20], 可以控制植株枯萎病发生。根系分泌物中的醌类物质可以使得土壤中菌根真菌定殖[21]。模拟组分试验表明嫁接茄根系分泌物模拟物质对茄子根际黄萎菌拮抗菌的诱导作用也很明显,但也因处理浓度不同有一定差异,总体看,豆蔻酸高浓度处理对拮抗菌影响较大,棕榈酸在低浓度处理时表现出对拮抗菌的诱导。这也说明嫁接诱导茄子根际黄萎菌拮抗菌的产生是通过改变茄子根系分泌物组成引起的。而土壤中拮抗微生物是防治土传病害重要组成部分。
大量研究发现,根系分泌物中的氨基酸、多糖、脂类等成分能够为土传病原菌生存提供必要的碳源和氮源,对病原菌的繁殖或孢子萌发有明显促进作用,有助于病害的发生及为害程度的加重[22-23 ]。另外,少数根系分泌物对土传病原菌繁殖或孢子萌发有明显的抑制作用[24],如养麦根系分泌物可显著抑Nd, 麦全蚀病,水葫芦根系分泌物可抑制金色葡萄球菌生长[25-26]。有研究表明根系分泌物中的脂肪酸可以被病原物内吞入胞质中,从而造成细胞质紊乱,细胞膜瓦解,蛋白质合成受阻等一系列效应[27]。嫁接茄根系分泌物对黄萎菌的抑制作用要显著高于自根茄根系分泌物,且分离的根系分泌物差异物质对黄萎菌孢子萌发和菌丝生长均具有较强抑制作用[12]。本试验发现两化感物质对茄子根际土壤黄萎菌数量也有一定的影响,豆蔻酸和棕榈酸对茄子土壤黄萎菌数量的影响表现出随处理浓度增加而增加的趋势。说明嫁接改变茄子根系分泌物成分而一定程度抑制了茄子根际土壤黄萎菌的增殖。而土壤拮抗菌增强了茄子的抗病性,说明嫁接改变根系分泌物成分豆蔻酸和棕榈酸诱导拮抗菌产生,限制了土壤黄萎菌数量的增殖,从而降低茄子的发病率。
有研究发现黄瓜病原菌与拮抗菌间呈密切正相关关系[28],其原因可能是由于植物根系在生长过程中,由于各种原因以多种方式向根际土壤释放有机物和无机物,这些物质将是根际微生物赖以生存的食物,病原菌与拮抗菌对食物的竞争具有同步性,从而产生正相关的生态效应。而又有研究证明,种植土壤中存在潜在的病原微生物,根系分泌物作为营养来源吸引大量有益或中立微生物到根际范围,作为强大的养分竞争者制止了病原菌在根际的存在[29]。本研究发现模拟物质处理的茄子根际拮抗菌数量与病原菌数量呈负相关,可能是这个原因,即根际有益微生物菌群竞争能力强,占据根部的定殖位点,使得黄萎病菌不能够在茄子根际生存。
[1] 周宝利, 姜荷, 赵鑫. 不同砧木嫁接茄子抗黄萎病特性及其与根系分泌物关系. 沈阳农业大学学报, 2001, 32(6):414-417.
[2] 王茹华, 周宝利, 张启发, 付亚文. 茄子/番茄嫁接植株的生理特性及其对黄萎病的抗性. 植物生理学通讯, 2003, 39(4):330-332.
[3] 周宝利, 高艳新, 林桂荣, 付亚文. 嫁接茄子抗病性与电导率, 脯氨酸含量及苯丙氨酸解氨酶活性的关系. 园艺学报, 1998, 25(3):300-302.
[4] Doornbos R F, van Loon L C, Peter A H, Bakker M. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere. Agronomy for Sustainable Development, 2012, 32(1):227-243.
[5] Yao Q, Qing F, Li X, Christine P. Utilization of sparingly soluble phosphate by red clover in association withGlomusmosseaeandBacillusmegaterium. Pedosphere, 2002, 12(2):131-138.
[6] Harman G E, Howel C H, Viterbo A, Chet I, Lorito M. Trichoderma species-opportunistic, avirulent plant symbionts. Nature Review of Microbiology, 2004, 2(1):43-56.
[7] Badri D V, Chaparro J M, Manter D K, Martinoia E, Vivanco J M. Influence of ATP-Binding cassette transporters in root exudation of phytoalexins, signals, and in disease resistance. Frontiers in Plant Science, 2012, 3:149.
[8] Yin Y L, Zhou B L, Li Y P. Effects of grafting on rhizosphere microorganisms of eggplants. Allelopathy Journal, 2009, 23(1):149-156.
[9] 尹玉玲, 周宝利, 李云鹏, 付亚文. 嫁接对茄子根际土壤微生物种群的化感效应. 园艺学报, 2008, 35(8):1131-1136.
[10] 王茹华, 周宝利, 张启发, 廉华, 付亚文. 茄子根系分泌物中香草醛和肉桂酸对黄萎菌的化感效应. 生态学报, 2006, 26(9):3152-3155.
[11] Zhou B L, Yin Y L, Zhang F L, Ye X L. Allelopathic effects of root extracts of grafted eggplants onVerticilliumdahliaeand their constituents′ identification. Allelopathy Journal, 2010, 25(2):393-402.
[12] 周宝利, 尹玉玲, 李云鹏, 徐妍, 陈绍莉, 叶雪凌. 嫁接茄根系分泌物与抗黄萎病的关系及其组分分析. 生态学报, 2010, 30(11):3073-3079.
[13] 韩雪, 吴风芝, 潘凯. 根系分泌物与土传病害关系之研究综述. 中国农学通报, 2006, 22(2):316-318.
[14] Shi S, Richardson A E, O′Callaghan M, DeAngelis K M, Jones E E, Stewart A, Firestone M K, Condron L M. Effects of selected root exudate components on soil bacterial communities. FEMS Microbiology Ecology, 2011, 77:600-610.
[15] 刘洪升, 宋秋华, 李风民. 根分泌物对根际矿物营养及根际微生物的效应. 西北植物学报, 2002, 22(3):693-702.
[16] Chaparro J M, Badri D V, Bakker M G, Sugiyama A, Manter D K, Vivanco J M. Root Exudation of phytochemicals in arabidopsis follows specific patterns that are developmentally programmed and correlate with soil microbial functions. PLoS One, 2013, 8(2):e55731.
[17] Bais H P, Weir T L, Perry L G, Gilroy S, Vivanco J M. The role of root exudates in the rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology, 2006, 57:233-266.
[18] Thomashow L S, Weller D M. Role of a phenazine antibiotic from Pseudomonas fluorescens in biological control ofGaeumannomycesgraminisvar. tritici. Journal of Bacteriology, 1988, 170(8):3499-3508.
[19] Capper A L, Higgins K P. Application of Pseudomonas fluorescens isolates to wheat as potential biological control agents against take-all. Plant Pathology, 2007, 42(4):560-567.
[20] Tan S Y, Yang C L, Mei X L, Shen S Y, Raza W, Shen Q R, Xu Y C. The effect of organic acids from tomato root exudates on Rhizosphere colonization of Bacillus amyloliquefaciens T-5. Applied Soil Ecology, 2013, 64:15-22.
[21] Akiyama K, Matsuzaki K, Hayashi H. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi. Nature, 2005, 435(7043):824-827.
[22] Ye S F, Yu J Q, Peng Y H, Zheng H J, Zou L Y. Incidence of Fusarium wilt inCucumissativusL. is promoted by cinnamic acid, an autotoxin in root exudates. Plant and Soil, 2004, 263(1):143-150.
[23] Scheffknecht S, Mammerler R, Steinkellner S, Vierheilig H. Root exudates of mycorrhizal tomato plants exhibit a different effect on microconidia germination ofFusariumoxysporumf. sp.Lycopersicithan root exudates from non-mycorrhizal tomato plants. Mycorrhiza, 2006, 16:365-370.
[24] Nóbrega F M, Santos I S, Da Cunha M, Carvalho A O, Gomes V M. Antimicrobial proteins from cowpea root exudates:inhibitory activity againstFusariumoxysporumand purification of a Chitinase-like protein. Plant and Soil, 2005, 272(1/2):223-232.
[25] 张庆平, 刘中兴. 荞麦根系分泌物对小麦全蚀病菌的抑制及根际微生物种群数量观察. 内蒙古农业科技, 1994, (1):8-9.
[26] 郑师章, 何敏. 水葫芦根部分泌物对若干细菌作用的研究. 生态学杂志, 1990, 9(5):56-57.
[27] Rayan P, Stenzel D, McDonnell P A. The effects of saturated fatty acids on Giardia duodenalis trophozoites in vitro. Parasitology Research, 2005, 97(3):191-200.
[28] 梁建根, 张炳欣, 喻景权, 石江, 陈振宇. 黄瓜根际重要病原与其拮抗菌消长规律的研究. 应用生态学报, 2005, 16(5):911-914.
[29] Mathesius U, Noorden van G E. Genomics of Root-Microbe Interactions // Oliveira de A C, Varshney R K. Root Genomics. Berlin:Heidelberg, 2011, 73-97.
Population fluctuations of antagonistic microbes andVerticilliumdahliaeinfluenced by myristic and palmitic acids in root exudates present in eggplant rhizospheres
YIN Yuling1, LIU Yuan2, TANG Yongping1, ZHOU Baoli3,*
1InstituteofVegetableandFlower,JiangxiAcademyofAgriculturalSciences,Nanchang330200,China2LiaoningSalineorAlkalineLandUtilizationandResearchInstitute,Panjin124010,China3CollegeofHorticulture,ShenyangAgriculturalUniversity,Shenyang110161,China
Microorganisms with antagonist effects against the fungusVerticilliumdahliaeexist in the rhizospheres of grafted eggplants. Gas chromatography mass spectrometry (GC-MS) identifies both myristic acid and palmitic acid in the root exudates of grafted eggplants, which are absent in self-rooted controls; however, it is unknown whether these compounds affect microbes that are antagonistic towardsV.dahliae. This study examined the allelopathic effects of myristic and palmitic acids on beneficial microbes and pathogens. We investigated the numbers of antagonistic fungi and bacteria and the numbers of microsclerotia ofV.dahliaein rhizospheres of eggplants treated with myristic or palmitic acid. In addition, we examined the relationship between the antagonistic microbes and theV.dahliaein rhizospheres. Both myristic acid and palmitic acid were found to significantly increase colony-forming units (CFUs) of antagonistic fungi and bacteria, in a dose-dependent manner. However, these effects varied with stage. At lower concentrations of myristic acid, antagonistic microbes varied significantly at florescence. The effect of palmitic acid treatment was greatest at the fruiting stage. Moreover, increased concentrations of either compound correlated with a reduction ofV.dahliaein the rhizosphere; again, the effects varied with stage. For example, the anti-fungal effect of myristic acid was most marked at florescence. In contrast, a low concentration of palmitic acid led to an increase inV.dahliaeat florescence, but this effect was reversed at high concentrations. Moreover, a negative correlation was found between numbers of antagonistic microbes andV.dahliaein the rhizosphere. In the myristic acid treatment, the correlation coefficient was -0.8215 at the flower budding stage. Both the correlation coefficient and the determinative coefficient decreased concomitantly with eggplant growth stage. In the palmitic acid treatment, both coefficients displayed a parabolic trend:antagonistic microbe numbers increased concomitantly with a decrease inV.dahliae. The largest negative correlation occurred at florescence. This phenomenon may be due to stronger competitive effects of beneficial microorganisms. They first occupy colonization loci on the root to pathogenic bacteria nonviable in the rhizosphere. Therefore, it is likely that grafting alters the makeup of eggplant root exudates, which influence rhizosphere microbes and, in turn, affect the development ofV.dahliae.
myristic acid; palmitic acid; root exudate;Verticilliumdahliae; antagonistic microbe
国家自然科学基金项目(31171950); 国家自然科学基金项目(31460514); 江西省青年科学基金项目(20142BAB214015); 江西省农业科学院创新基金博士启动项目(2013CBS003)
2014-03-28; < class="emphasis_bold">网络出版日期:
日期:2014-12-18
10.5846/stxb201403280586
*通讯作者Corresponding author.E-mail: zblaaa@163.com
尹玉玲, 刘圆, 汤泳萍, 周宝利.豆蔻酸和棕榈酸诱导茄子根际拮抗菌与黄萎菌数量消长的关系.生态学报,2015,35(20):6728-6733.
Yin Y L, Liu Y, Tang Y P, Zhou B L.Population fluctuations of antagonistic microbes andVerticilliumdahliaeinfluenced by myristic and palmitic acids in root exudates present in eggplant rhizospheres.Acta Ecologica Sinica,2015,35(20):6728-6733.
