外源激素ABA影响新疆荒漠盐生植物异子蓬异型种子萌发机制
2015-01-20李晓荣兰欣欣兰海燕
曹 婧, 李晓荣, 王 翠, 王 璐, 兰欣欣, 兰海燕
新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室, 乌鲁木齐 830046
外源激素ABA影响新疆荒漠盐生植物异子蓬异型种子萌发机制
曹 婧, 李晓荣, 王 翠, 王 璐, 兰欣欣, 兰海燕*
新疆大学生命科学与技术学院,新疆生物资源基因工程重点实验室, 乌鲁木齐 830046
以新疆荒漠盐生植物异子蓬(Suaedaaralocaspica)异型种子为材料,通过外源ABA直播(长时间)与浸种(短时间)处理分别研究不同浓度(0、0.5、1.0、5.0、10.0 μmol/L)ABA对异型种子萌发、幼苗生长的影响,并通过定量PCR技术分析与萌发相关的ABC转运蛋白基因、丝裂原活化蛋白激酶激酶基因和DNA修复和转录因子基因在5.0 μmol/L ABA处理下的表达规律,探讨外源ABA影响异子蓬异型种子萌发差异的机制。结果显示:(1)外源ABA直播处理下,褐色种子萌发及幼苗生长均受到明显抑制,黑色种子的萌发和幼苗生长在低浓度被促进,较高浓度被显著抑制;短时间浸种处理,能够同时促进异型种子的萌发及幼苗生长,且随ABA浓度增加促进效应增强。(2)直播萌发后,褐色种子中3个基因的表达量与对照相比均不变或降低表达(除了DNA修复和转录因子基因在8 h显著升高),黑色种子与对照相比均上调表达(除了ABC转运蛋白基因在8h显著下调);短时间浸种萌发后,褐色种子中3个基因的表达量均比对照显著升高,黑色种子中升高不明显。基因表达规律与种子萌发结果趋势一致,暗示ABA浸种可能触发了异子蓬种子萌发内在机制并对随后的萌发过程产生促进作用。而黑色种子对ABA处理表现出较好的萌发响应,可能是其幼苗能抵御荒漠地区逆境环境的重要原因。
ABA; 异子蓬; 异型种子; 种子萌发; 定量PCR; 分子机制
种子休眠和萌发是高等植物个体发育中的重要事件,直接关系到种群的生存、分布和繁衍,具有重要的生态意义[1]。种子萌发是极其复杂的生理过程,受到环境因素、内部因素及萌发相关基因的调控。迄今对大量影响种子休眠和萌发突变体的研究发现,在种子休眠的获得或解除过程中起关键作用的内源信号分子是脱落酸(Abscisic acid, ABA)和赤霉素(Gibberellin 3, GA3)[2],其中,脱落酸对植物生长发育的许多重要过程都起调节作用,包括种子贮藏蛋白和脂质的合成、种子的耐脱水性和休眠、胚胎生长向萌发生长转变的抑制和营养生长到生殖生长转变的抑制等[3-4],特别是对保持种子休眠和抑制种子萌发和萌发后幼苗生长等具有重要作用[5-6]。研究表明,ABA的营养缺陷型能够增强种子萌发能力,甚至有时会产生胎萌[7],而大量积累ABA的转基因株系增强了休眠,且ABA能抑制这些转基因株系后代种子的早熟发芽,诱导种子的初级休眠[8-9]。深入研究显示,ABA主要通过抑制细胞壁降解酶的合成使种子的胚乳不能软化,导致胚根尖无法突破种皮而抑制萌发[10]。多项研究表明,添加外源ABA能够抑制多种植物种子的萌发[11-15],但也有报道显示低浓度的外源ABA能够促进某些植物如黄连种子的萌发[16],也可促进植物根或胚轴的生长等[17-18]。但有关外源ABA 促进植物种子特别是荒漠盐生植物种子萌发的相关机制鲜见报道。
异子蓬(Suaedaaralocaspica)是藜科异子蓬属具典型种子异型性的一年生草本盐生植物,在我国仅分布于准噶尔盆地南缘,生长于重度盐碱化荒漠戈壁和丘间低地,其生长、发育、繁殖等各个阶段都受到逆境的胁迫,具有很强的耐干旱、盐碱和贫瘠能力[19-20]。种子异型性在盐生植物中较常见,是盐生植物应对胁迫生境的重要策略之一[21]。异子蓬异型种子的种皮结构存在显著差异,褐色种子只有一层薄膜状种皮,而黑色种子有内外两层种皮结构且外种皮细胞排列致密,质地坚硬[22]。黑色种子的外种皮限制了胚胎吸水速度,对胚根伸长产生一定的机械阻力,从而导致与褐色种子之间具有不同的萌发与休眠特性,对环境刺激也产生不同的响应[23]。在本研究小组前期对异子蓬种子萌发的胁迫实验中发现,低浓度ABA处理能够明显促进异子蓬异型种子的萌发,且有时间效应(数据未显示)。同时利用cDNA-AFLP技术研究了异子蓬异型种子萌发过程中基因表达的差异,从中筛选到一些在种子萌发过程显著上调的基因,如ABC转运蛋白基因、丝裂原活化蛋白激酶激酶基因和DNA修复和转录因子基因等,并在此基础上选择了以上基因对ABA影响异子蓬异型种子萌发的深层机制进行分析。目前,对异子蓬的研究主要集中于叶片解剖结构[23-25]、光合类型[26]及异型种子萌发特性[27]等方面,对胁迫(包括ABA处理)下异型种子萌发差异的深层机制的探索研究鲜见报道。基于前期的初步实验,为进一步了解ABA促进异子蓬异型种子萌发的分子机制,本研究以ABA直播(长时间)和浸种(短时间)处理方式和不同浓度对异型种子的萌发过程和特性、幼苗生长以及萌发相关基因的表达等方面进行了分析,期望从分子水平对ABA促进异子蓬种子萌发的机制有深入理解,并探索ABA在盐生植物异型种子休眠与萌发中的调控方式,为今后利用干旱区植物资源修复并改良盐碱地生态环境提供理论依据。
1 材料和方法
1.1 实验材料
2011年10月于新疆五家渠103团治沙站北沙窝(44°29′N, 87°31′E)重度盐碱地上自然成熟的异子蓬植株上采集两种类型种子。此生境属于中温带荒漠区,春季有融雪、较湿润;全年降雨稀少(仅310 mm),蒸发量大(约1300 mm),大气湿度和土壤含水量均很低。种子采集后,置通风避光处晾干,筛选干净,室温保存备用。
1.2 方法
1.2.1 种子萌发实验
萌发实验均按4重复、每重复30粒种子设置。① 直播处理:将完整饱满大小一致的异子蓬异型种子,随机播在铺有二层滤纸的培养皿(直径为9 cm)中,分别添加5 mL不同浓度(0.5、1.0、5.0、10.0 μmol/L)ABA溶液和蒸馏水,于25 ℃、16 h光 /8 h 暗的培养箱中萌发,期间不断补充水分及对应浓度的ABA溶液。② 浸种处理:分别用上述浓度ABA溶液浸泡种子3 h,以蒸馏水洗净种子后,接入用蒸馏水浸润饱和的滤纸上进行萌发实验。种子萌发以胚根露出为准,每24 h记录一次,直到发芽率恒定后统计终萌发率,同时选择30株幼苗分别测量子叶、下胚轴及胚根长度。
1.2.2 萌发相关基因的表达分析
(1) 直播处理 挑选40粒完整饱满的异子蓬异型种子置于铺有两层滤纸的培养皿中,分别加5 mL 5.0 μmol/L ABA(预实验中促进萌发的浓度)和灭菌蒸馏水于25 ℃恒温光照培养箱中培养。萌发8 h和3 d时分别选择状态一致的种子(幼苗)提取总RNA(参照Bioteke RNAprep Pure Plant Kit试剂盒说明书)。
(2) 浸种处理 分别添加5.0 μmol/L ABA和灭菌蒸馏水浸泡异子蓬异型种子3 h后,用蒸馏水洗净种皮表面残留溶液后于水中萌发,选择萌发8 h和萌发3 d时状态一致的种子(幼苗)提取总RNA。
利用GeneAmp 7500实时PCR系统及SYBR Green (Invitrogen)进行定量PCR分析。反应条件:95℃ 2 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,40个循环。相关引物见表1。以异子蓬β-actin基因为内参,分析ABC转运蛋白基因(ABC transporter family protein,简称SaABC)、丝裂原活化蛋白激酶激酶基因(Mitogen-activated protein kinase kinase,简称SaMAPKK)以及DNA修复和转录因子基因(DNA repair and transcription factor,简称SaDRTF)在上述不同胁迫处理及不同萌发时间的表达变化,具体操作步骤参照Invitrogen公司荧光定量试剂盒说明书。
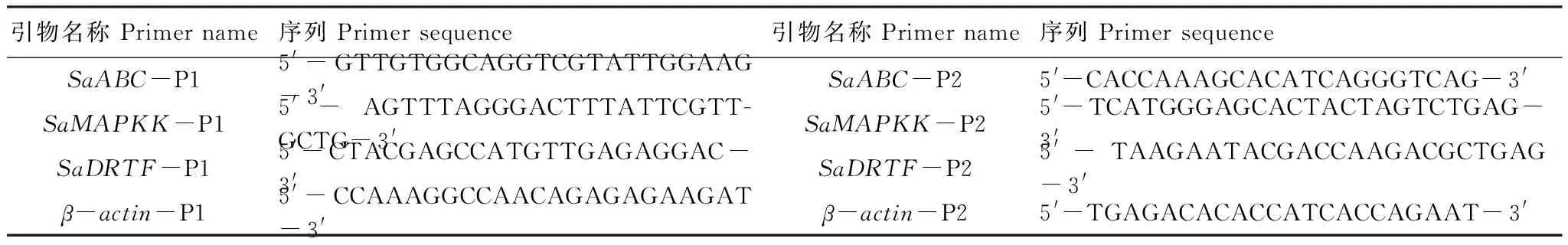
表1 定量PCR引物
1.3 统计分析方法
种子萌发率和萌发速率数据经反正弦转换,以保证方差齐性。本研究中萌发数据采用4次重复,荧光定量数据采用3次生物学重复和两次技术重复(共6个重复)计算平均值,所有图表中的误差线代表平均数的标准误差。数据分析和图的绘制均用GraphPad Prism 4软件。利用One-way ANOVA和Two-way ANOVA对种子萌发率、幼苗生长指标及基因表达规律等进行差异显著性检验。用Tukey多重比较法确定各样本间的差异显著水平。
2 结果与分析
2.1 外源激素ABA对异子蓬异型种子萌发及幼苗生长的影响
异子蓬褐色与黑色种子在ABA不同处理下的萌发进程存在较大差异,日累计萌发率及终萌发率结果(图1,图2)。随ABA浓度的增加,直播的褐色种子萌发率逐渐降低且均低于对照,而所有浸种处理的褐色种子萌发率均高于对照;黑色种子萌发则在ABA较低浓度(0.5、1.0 μmol/L)的直播及较高浓度的浸种(1.0、5.0、10.0 μmol/L)均受到促进。
双因素方差分析结果显示(表2),ABA直播与浸种两种处理下,种子类型、ABA浓度以及二者间的交互作用均对异子蓬种子萌发具有显著影响。
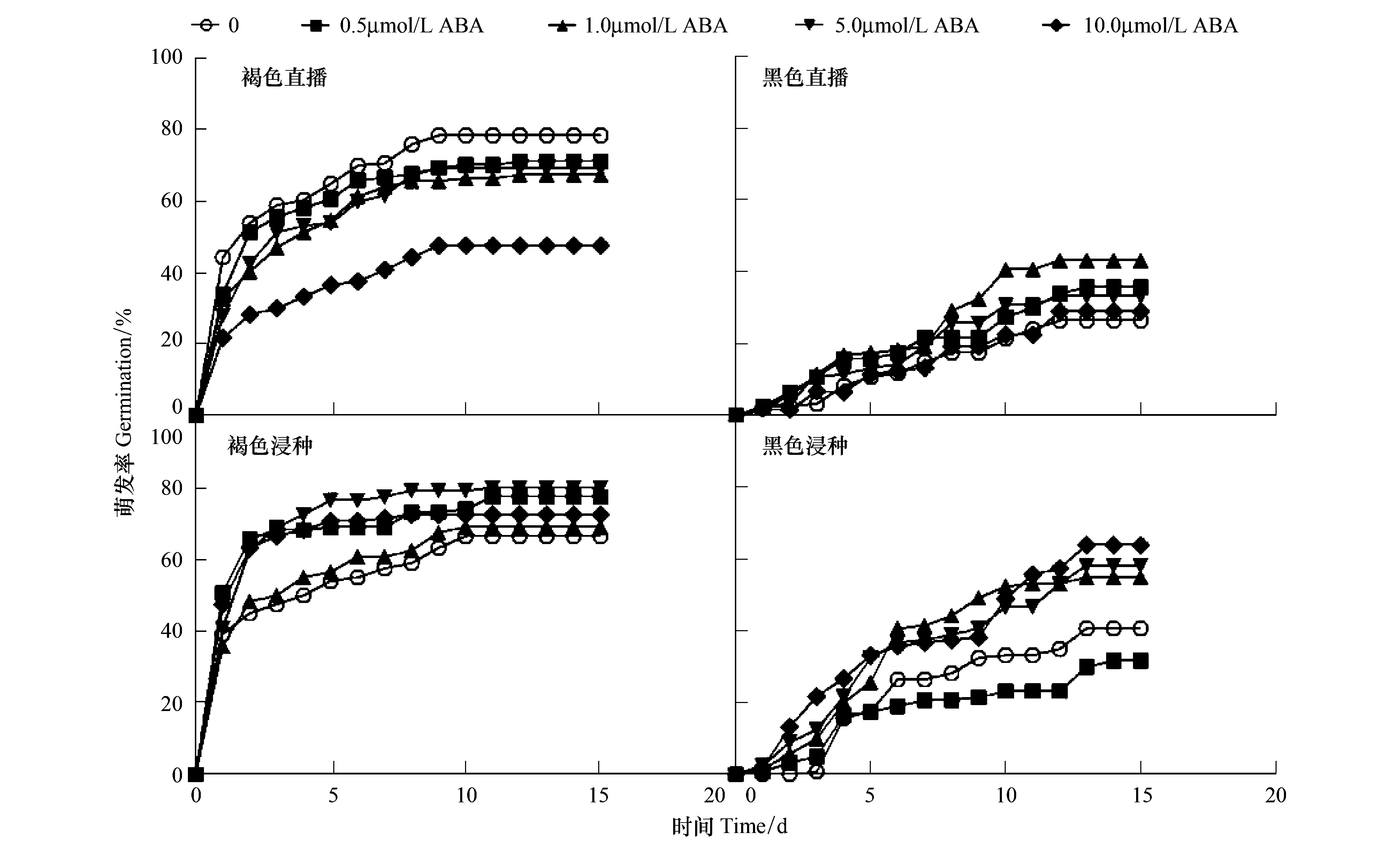
图1 不同脱落酸(ABA)浓度对异子蓬异型种子萌发进程的影响Fig.1 Effect of various concentration of abscisic acid on germination process of S. aralocaspica heteromorphic seed
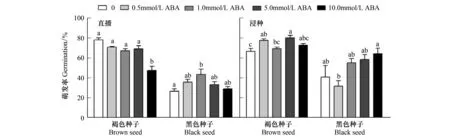
图2 不同ABA浓度对异子蓬异型种子终萌发率的影响Fig.2 Effect of various concentration of ABA on final germination percentage of S. aralocaspica heteromorphic seed
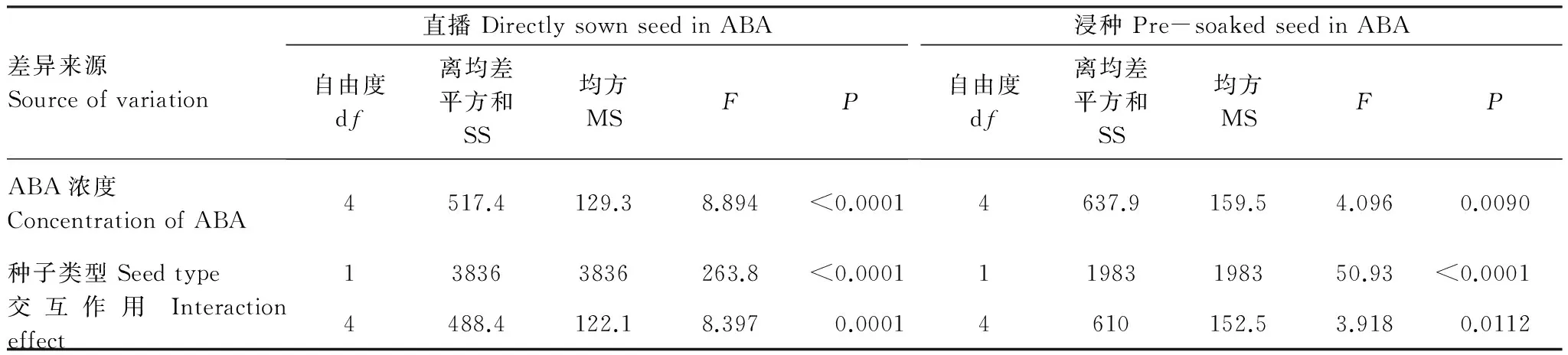
表2 不同浓度脱落酸(ABA)和种子类型对异子蓬种子萌发影响的双因素方差分析
不同浓度ABA处理的异子蓬异型种子幼苗生长情况存在较大差异(图3,两周幼苗),从幼苗长势观察,随ABA浓度升高,直播的褐色和黑色种子幼苗生长受到较明显抑制,且程度依次加剧;而浸种处理对幼苗无明显抑制现象,且低浓度(0.5μmol/L与1.0μmol/L)ABA对幼苗生长产生一定促进作用。
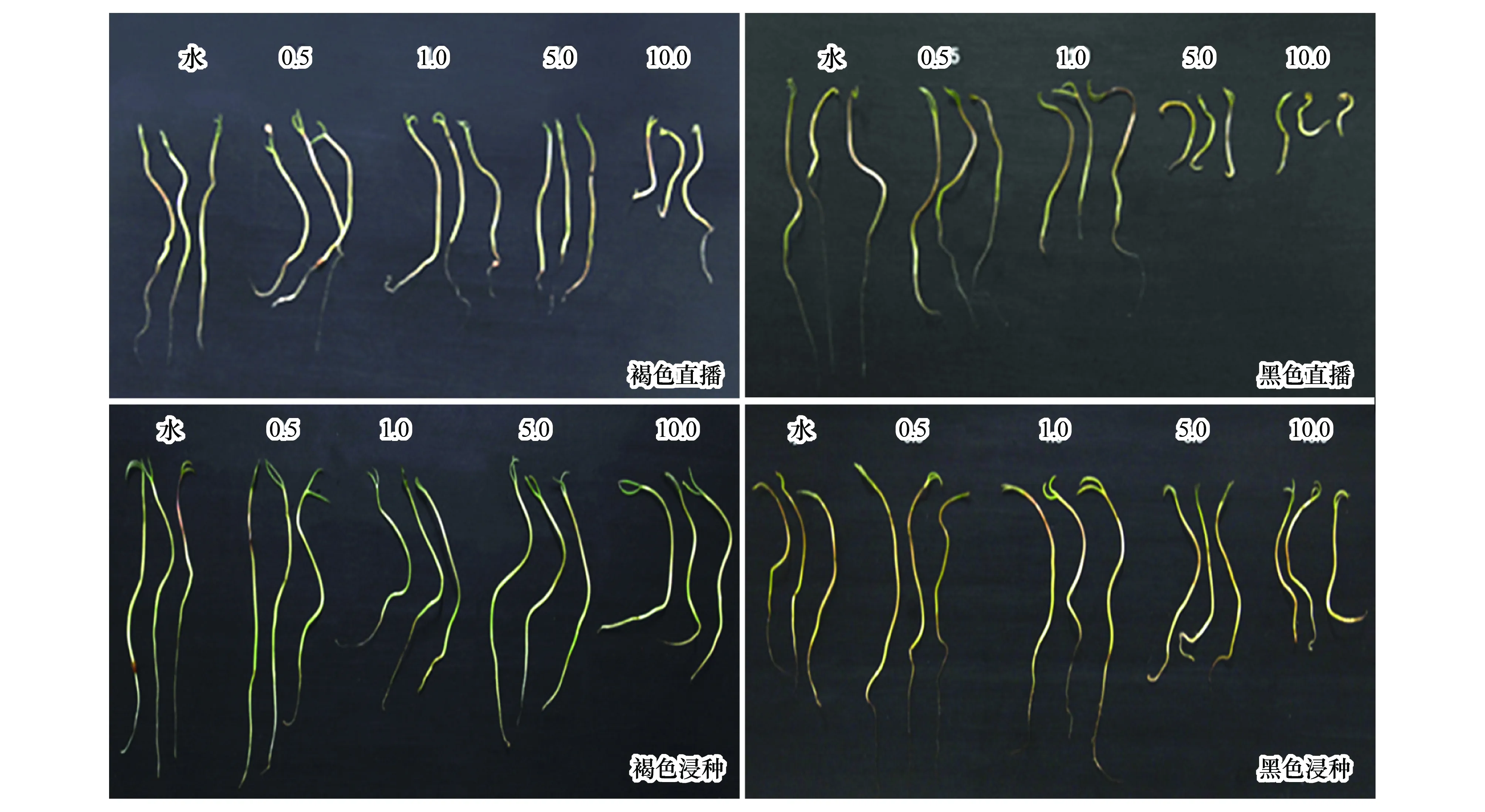
图3 不同ABA浓度对异子蓬异型种子幼苗生长的影响Fig.3 Effect of various concentration of ABA on seedling growth of S. aralocaspica heteromorphic seed
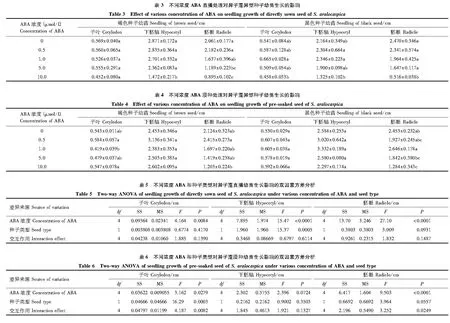
对幼苗子叶、下胚轴和胚根长度的测量结果显示:直播处理下(表3),褐色种子幼苗的子叶、下胚轴及胚根生长均受ABA的不显著抑制,10.0 μmol/L则显著影响其下胚轴和胚根的伸长(P<0.0001);低浓度ABA(0.5—1.0 μmol/L)不显著地促进黑色种子幼苗子叶和下胚轴生长,但所有处理浓度均抑制其胚根伸长,特别是高浓度下抑制作用更明显。浸种处理对两种幼苗的子叶和下胚轴生长均表现促进作用(表4),但对胚根伸长产生抑制效应。整体趋势显示,ABA浸种处理的幼苗子叶和下胚轴长势优于直播处理。
ABA与种子类型对异子蓬幼苗生长影响的双因素方差分析结果显示,直播处理下(表5),不同ABA浓度对异子蓬幼苗子叶、下胚轴、胚根的伸长均有显著影响,种子类型仅对幼苗下胚轴伸长有显著影响,二者之间的交互作用对幼苗各项指标的影响均不显著;浸种处理下(表6),不同ABA浓度对异子蓬幼苗子叶、胚根伸长具有显著影响,种子类型仅对幼苗子叶伸长有显著影响,而二者交互作用对子叶、胚根伸长具有显著影响。
2.2 外源激素ABA处理下异子蓬种子萌发相关基因的表达分析
为进一步了解添加外源ABA促进异子蓬异型种子萌发和幼苗生长的内在机制,基于前期对异子蓬异型种子萌发过程中mRNA (cDNA)的差异表达分析结果(数据未显示),选择了其中可能与种子萌发相关的3个基因,包括:ABC转运蛋白基因(SaABC)、丝裂原活化蛋白激酶激酶基因(SaMAPKK)、DNA修复和转录因子基因(SaDRTF),对5.0 μmol/L ABA直播或浸种后萌发0 h(对照)、8 h(萌发期)和3 d(幼苗早期)的表达情况进行了定量PCR分析。
2.2.1 ABC转运蛋白基因(SaABC)
如图4所示,在5.0 μmol/L ABA直播处理下异子蓬异型种子萌发过程中ABC转运蛋白基因的表达与对照相比显著降低(褐色种子在处理3 d时,黑色种子在处理8 h时)。浸种处理时褐色和黑色种子中该基因在8 h和3 d时均比水中萌发的表达升高,褐色种子中表现为极显著上调(P<0.001)。

图4 定量PCR检测ABA处理下ABC转运蛋白基因(SaABC)的表达规律Fig.4 Quantitative PCR analysis of the expression pattern of SaABC gene in S. aralocaspica under H2O and ABA treatment
2.2.2 丝裂原活化蛋白激酶激酶基因(SaMAPKK)
异子蓬褐色种子在水中萌发时丝裂原活化蛋白激酶激酶基因的表达呈现8 h显著升高(P<0.05),3 d下降趋势(图5)。5.0 μmol/L ABA直播或浸种处理后褐色种子中该基因的表达变化趋势与对照一致,但浸种处理该基因在8 h和3 d时相对于水中的萌发表达极显著上升(P<0.001)。黑色种子中,该基因在水中不同时间点的表达变化不显著,而ABA直播或浸种两种处理下该基因的表达随时间有增高趋势,但无显著差异。
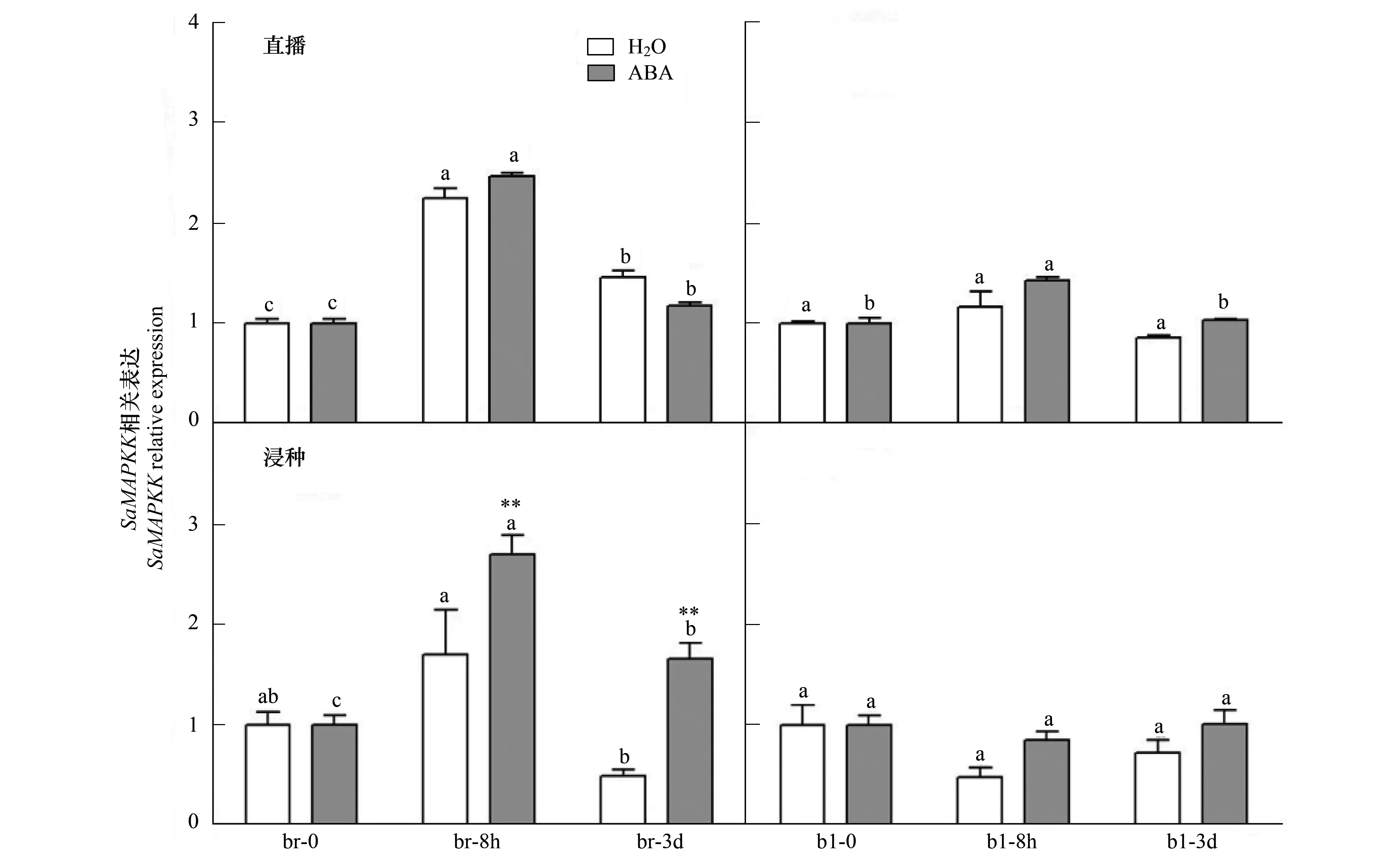
图5 定量PCR检测ABA处理下丝裂原活化蛋白激酶激酶基因(SaMAPKK)的表达规律Fig.5 Quantitative PCR analysis of the expression pattern of SaMAPKK gene in S. aralocaspica under H2O and ABA treatment
2.2.3 DNA修复和转录因子基因(SaDRTF)
5.0 μmol/L ABA直播或浸种处理褐色和黑色种子萌发过程中DNA修复和转录因子基因在8 h时的表达均比水中显著升高(图6),3 d时直播黑色种子和浸种褐色种子该基因的表达比水中显著上升,直播褐色种子和浸种黑色种子表达与对照无显著差异。
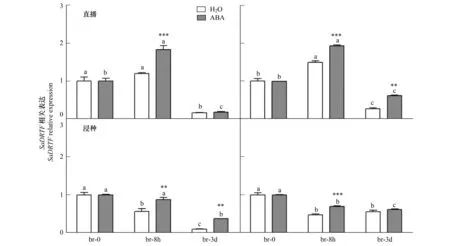
图6 定量PCR检测ABA处理下DNA修复和转录因子基因(SaDRTF)的表达规律Fig.6 Quantitative PCR analysis of the expression pattern of SaDRTF gene in S. aralocaspica under H2O and ABA treatment
3 讨论
ABA 是20世纪60年代发现的一种倍半萜类化合物,作为最重要的激素之一参与调控植物的生长发育(如胚胎发育、种子休眠与萌发、幼苗生长、根系发育、果实成熟和衰老等),并对干旱、高盐、低温、病菌等胁迫产生应答[3-4, 28-30]。通常认为ABA是促进种子成熟、诱导和维持种子休眠并抑制种子萌发的植物激素[31-35]。但对某些植物而言,低剂量的ABA却能促进种子萌发和幼苗生长[16,36-41]。然而目前对ABA促进种子萌发的深层机制鲜见报道。本研究通过ABA对异子蓬异型种子萌发过程的影响及相关基因的表达分析,初步探讨了ABA促进种子萌发的机制。对异子蓬褐、黑种子进行ABA直播和短时间浸种萌发实验发现,低浓度ABA可能通过引发(或触发)萌发过程相关生理机制及分子事件从而促进种子萌发和幼苗生长。
研究表明,外源ABA能促进黄连种子萌发[16];低浓度(≤1 μmol/L) ABA可以刺激拟南芥、豌豆(Pisumsativum)及黄豆幼苗根部的生长[17, 36];此外,ABA还能促进拟南芥根毛的发生[37];Xing等发现 0.5 μmol/L ABA能刺激拟南芥幼苗根伸长,但高浓度(5—50 μmol/L) ABA处理后,根长及生物量积累均受到抑制[38],由此说明ABA对幼苗生长的影响存在剂量效应。ABA浸种能显著促进幼苗生长,如ABA浸种处理水稻后的秧苗素质、壮苗指标及产量均明显优于对照组[39-40];经过较高浓度ABA浸种的甜瓜种子能够明显促进幼苗后期生长[41]。本研究通过对新疆荒漠盐生植物异子蓬异型种子在低浓度ABA直播或浸种处理下的萌发过程观察发现,褐色与黑色种子在ABA不同处理下的萌发进程存在明显差异。不同浓度外源ABA直播处理下异子蓬褐色种子萌发及幼苗生长均受到明显抑制,并呈剂量效应;直播黑色种子的萌发和幼苗生长在低浓度(0.5—1.0 μmol/L)ABA被促进,较高浓度则被显著抑制;而ABA短时间浸种处理能够同时促进褐色和黑色种子的萌发及幼苗的生长,且随ABA的浓度增加促进效应增强。产生这种现象的可能原因是异型种子种皮结构的差异以及低浓度ABA短时间处理起到的刺激信号作用。通常成熟种子的种皮主要用以保护胚胎免受外界环境不利条件的影响[42]。而异子蓬褐色种子只有一层薄膜状种皮[22],透水性强,无休眠现象,胚根极易突破种皮,遇水就能萌发(直播0—8 h内萌发率接近60%)。当种子长时间在ABA溶液中直接萌发时,由于胚几乎没有任何保护层,即使ABA浓度很低,仍然对种子萌发产生了抑制作用;而黑色种子具有一层致密且坚硬的外种皮[22],透水性差、阻碍外界空气进入及内外物质交换[43],处于非深度休眠状态,虽然直播处理后种皮软化,吸水增强,但黑色种子致密的外种皮仍能对长时间的ABA直接处理产生一定隔离保护作用,使较高浓度ABA对黑色种子萌发没有影响(尽管幼苗生长受到抑制),而此时低浓度ABA作为长时间的刺激(或适当胁迫)因素,在一定程度上激活了种子内在的生理活性,缓解了黑色种子的休眠状态,从而提高种子的萌发率。在短时间浸种(用ABA浸泡种子3 h后于水中萌发)处理下,较高浓度的ABA在一定程度上得以稀释从而产生了低剂量效应,更重要的是,前期较高浓度ABA的短时间浸种对褐色及黑色种子的萌发起到了一定的引发刺激作用,并能缓解黑色种子的休眠,这种脉冲刺激和低剂量效应同时作用,显著地促进了两种种子的萌发及随后的幼苗生长。这也同时能够说明ABA低浓度直播而高浓度浸种促进黑色种子萌发的现象。研究显示,异子蓬黑色种子萌发需经过极端逆境的引发效应,从而打破休眠[44]。本研究采用了不同浓度ABA直播和浸种两种方式,分别代表着不同剂量长时间和短时间的处理,结果显示,ABA对异子蓬种子特别是黑色种子萌发及幼苗生长的促进作用不仅有剂量效应(低浓度和高浓度),还有时间依赖效应(长时间直播和短时间浸种)。ABA对异子蓬种子的这种短时间促进而长时间抑制的作用方式暗示,外源ABA短暂处理可能对种子萌发起到了“引发”(或“触发”)的作用,类似于引发剂在种子萌发中的促进作用[45-46];ABA亦或作为一种胁迫因素促进了种子萌发过程中防御系统的启动,从而使与萌发相关的生理过程和分子事件变得活跃。ABA促进种子休眠以及抑制种子萌发的机制已众所周知[5-6],但在一定条件下,当ABA做为第二信使起作用时[47],它能够通过刺激相应信号系统,激发相关基因的表达及适应机制的启动来调节植物的适应反应[48-49]。如Xiong等从水稻中分离得OsMAPK5基因,可被外源ABA激活,正调控与干旱、高盐和低温响应相关基因的表达[50];添加外源ABA能使高粱中甜菜碱醛脱氢酶BADH的表达水平上升,添加ABA合成抑制剂则会使该基因下调表达,ABA通过促进BADH和甜菜碱的合成来调节水分和离子平衡,从而增加耐盐性[51];外源ABA能使抗寒基因cor基因家族(cor78、cor47、cor15a、cor66等)上调表达,参与调控拟南芥冷诱导基因cor15和rd19a的启动等,最终提高植物耐寒性[52]。浸种处理可以提前完成种子萌发过程的代谢活动,提高种子的萌发率,促进极端环境下幼苗的最初生长并提高植物抗逆性[53]。研究表明,ABA处理可显著提高涝渍条件下水稻种子的出苗率、种子相对活力指数[54];ABA预浸种能缓解盐胁迫对向日葵种子的伤害[55];低浓度ABA处理能缓解镉对种子萌发的毒害作用等[56]。
ABA对异子蓬种子萌发引发作用的推测与对萌发相关基因表达的分析结果相吻合。为了探索ABA对异子蓬种子萌发和幼苗生长促进作用的内在机制,利用前期在异子蓬异型种子萌发过程中获得的mRNA(cDNA-AFLP)差异条带,从中选取了ABC转运蛋白基因(SaABC)、丝裂原活化蛋白激酶激酶基因(SaMAPKK)、DNA修复和转录因子基因(SaDRTF)等在异型种子中显著上调表达的基因开展研究。我们在实验中发现,较高浓度ABA长时间处理黑色种子时,尽管没有影响其萌发率(还有少许升高),但其幼苗生长受到了显著影响,这似乎暗示较高浓度ABA长时间处理对幼苗的生长影响更严重,为了区分萌发期和幼苗期对ABA响应可能存在的内部差异,选择了萌发8 h代表萌发期(前期研究确定此时间点足以看出异型种子相关基因上调表达趋势),3 d代表幼苗期对相关基因的表达进行了分析。结果显示,这3个基因在5.0 μmol/L ABA短时间浸种的异子蓬萌发种子及幼苗中的表达呈上升趋势(褐色种子达显著水平),而在直播处理中则较大程度上表现不变或降低表达。以上趋势初步显示,在短暂浸种处理时,ABA可能作为信号分子激发相关基因的表达从而促进萌发过程[47-49]。经ABA直播3 d的褐色种子幼苗中各基因的表达比对照降低或不变,而黑色种子幼苗中有两个基因的表达与对照无差异。这与萌发实验中的观察结果基本一致,即一定浓度ABA长期处理对异子蓬幼苗生长的影响比萌发更强烈。研究表明,拟南芥中AtPMP2蛋白属于ABC转运蛋白家族的ABCD亚族,其功能是运载长链脂肪酸到过氧化物酶体,是脂肪酸β氧化所必需的蛋白,种子中该基因的突变将导致萌发缺陷[57]。Footitt等在拟南芥中也发现一个ABC转运蛋白可以控制拟南芥的种子萌发和休眠,并且转运脂肪酸乙酰辅酶A进入过氧化物酶体[58]。在此之前Russell等也曾报道ABC转运蛋白基因可以显著促进种子萌发,该基因的突变体表现为深度休眠[59]。丝裂原活化蛋白激酶(MAPK)途径是细胞内一个极其复杂的信号网络通路,植物遭受低温、干旱、机械损伤、植物激素、活性氧物质及病原体侵染等胁迫时会激活MAPK,它是植物生长发育和应对逆境的重要组分[60-62]。丝裂原活化蛋白激酶激酶基因作为MAPK信号通路中第2个关键蛋白,受多种信号分子的调控,许多实验证实MAPK级联途径参与调控ABA信号转导过程[63]。在非生物胁迫下植物细胞DNA 可能受到严重损伤,并由此对植物产生毒性[64]。为此,DNA修复相关因子在其中起到重要作用。有报道显示,拟南芥种子在吸胀过程中 DNA 连接酶迅速表达,且在没有 DNA 复制和细胞分裂的情况下,有大量新DNA的合成,说明是对损伤的 DNA进行修复[65]。本研究中外源ABA浸种处理下异子蓬异型种子萌发过程中ABC转运蛋白基因、丝裂原活化蛋白激酶激酶基因和DNA修复和转录因子基因尽管在8 h和3 d时的表达量比对照的萌发均显著上升,但3个基因的总体表达趋势是下降的(图4,图5,图6),这可能由于前3h种子完全浸没在水中,从而对相关基因的表达产生了影响,因为褐色种子用蒸馏水浸种处理的萌发率比直播的明显降低(图1,图2)。
生存于盐碱地中的植物通常都面临一系列的逆境胁迫,而盐生植物种子应对逆境胁迫主要有两种策略:一是直接在高盐、干旱等条件下顺利萌发;其次在逆境中不萌发但保持生活力,待环境条件适合时迅速萌发[66]。而异子蓬作为典型的荒漠盐生植物,同时具有这两种特性,即褐色种子种皮薄萌发快、耐受逆境能力较强,黑色种子种皮厚且硬、能抵御外界不良因素刺激、可在逆境中保持休眠推迟萌发[22, 67]。ABA是种子成熟过程中积累的主要激素,也可以作为一种胁迫刺激信号,对异子蓬异型种子产生不同的影响从而表现萌发的差异,这不仅拓宽了种子的萌发时间,还分散了单次萌发的风险,提高了幼苗的存活率,有效地保证了种群的成功建立和顺利繁殖[66],由此对盐生植物异子蓬在种子阶段主动适应逆境具有重要的生态学意义。ABA对植物生长发育的调控是一个十分重要且复杂的过程,它与多个调控途径存在互作关系,全面深入理解 ABA在植物中的生理功能,将为植物生长的精细调控提供重要的理论基础。而了解其在植物体内的作用方式并应用于培育抗逆作物,将为现代农业生产提供有价值的理论借鉴。
[1] Philippi T. Bet-edging germination of desert annuals beyond the first year. American Naturalist, 1993, 142(3):474-487.
[2] Brady S M, Mccourt P. Hormone cross-talk in seed dormancy. Journal of Plant Growth Regulation, 2003, 22(1):25-31.
[3] Leung J, Giraudat J. Abscisic acid signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49(1):199-222.
[4] Rohde A, Kurup S, Holdsworth M.ABI3 emerges from the seed. Trends in Plant Science, 2000, 5(10):418-419.
[5] Koornneef M, Bentsink L, Hilhorst H. Seed dormancy and germination. Current Opinion in Plant Biology, 2002, 5(1):33-36.
[6] Kucera B, Cohn M A, Leubner-Metzger G. Plant hormone interactions during seed dormancy release and germination. Seed Science Research, 2005, 15(4):281-307.
[7] McCarty D R. Genetic control and integration of maturation and germination pathways in seed development. Annual Review of Plant Physiology and Plant Molecular Biology, 1995, 46(1):71-93.
[8] Okamoto M, Kuwahara A, Seo M, Kushiro T, Asami T, Hirai N, Kamiya Y, Koshiba T, Nambara E. CYP707A1and CYP707A2, which encode ABA 80′-hydroxylases, are indispensable for proper control of seed dormancy and germination inArabidopsis. Plant Physiology, 2006, 141(1):97-107.
[9] Okamoto M, Tatematsu K, Matsui A, Morosawa T, Ishida J, Tanaka M, Endo T A, Mochizuki Y, Kamiya Y, Shinozaki K, Nambara E, Swki M. Genome-wide analysis of endogenous abscisic acid-mediated transcription in dry and imbibed seeds of Arabidopsis using tiling arrays. The Plant Journal, 2010, 62(1):39-51.
[10] Müller K, Tintelnot S, Leubner-Metzger G. Endosperm-limited Brassicaceae seed germination:abscisic acid inhibits embryo-induced endosperm weakening ofLepidiumsativum(cress) and endosperm rupture of cress andArabidopsisthaliana. Plant and Cell Physiology, 2006, 47(7):864-877.
[11] Schmitz N, Abrams S R, Kermode A R. Changes in ABA turnover and sensitivity that accompany dormancy termination of yellow-cedar (Chamaecyparisnootkatensis) seeds. Journal of Experimental Botany, 2002, 53(366):89-101.
[12] 李章海, 王能如, 冯勇刚, 徐增汉, 周慧玲, 王东胜. 天然型脱落酸和微量元素对烤烟种子萌发的影响. 烟草科技, 2006, (2):53-55.
[13] 汤日圣, 王节萍, 童红玉. 脱落酸对水稻种子萌发和秧苗生长的调控作用. 江苏农业学报, 2003, 19(2):75-80.
[14] 王熹, 陶龙兴, 黄效林, 谈惠娟, 董文忠, 季茂荣. 外源ABA抑制水稻种子发芽的生理机制. 作物学报, 2004, 30(12):1250-1253.
[15] 雍太文, 杨文钰, 王小春. 利用外源ABA控制杂交水稻穗萌的研究. 农学通报, 2003, 19(1):21-23, 29-29.
[16] 陈瑛, 李先恩, 张军. ABA促进黄连种子萌发1例. 中国中药杂志, 1993, 18(3):145-146.
[17] Lopez-Molina L, Mongrand S, Chua N H. A postgermination developmental arrest checkpoint is mediated by abscisic acid and requires the ABI5 transcription factor inArabidopsis. Proceedings of the National Academy of Sciences of United States of America, 2001, 98(8):4782-4787.
[18] 吴三桥, 丁锐, 李新生. 赤霉素和脱落酸对黑稻黄化幼苗中胚轴伸长生长的作用研究. 氨基酸和生物资源, 2002, 24(3):44-45.
[19] 李安仁. 中国植物志(第二十五卷, 第二分册). 北京:科学出版社, 1979:157-186.
[20] 毛祖美. 新疆植物志(第二卷, 第一分册). 乌鲁木齐:新疆科技卫生出版社, 1994:84-106.
[21] Clavijo E R D. The reproductive strategies of the heterocarpic annualCalendulaarvensis(Asteraceae). Acta Oecologica, 2005, 28(2):119-126.
[22] 宋以刚, 李利, 张希明, 潘响亮, 曾歆花. 异子蓬二型性种子的种皮结构及离子含量差异. 植物研究, 2012, 32(2):290-295.
[23] Wang L, Huang Z Y, Baskin C C, Baskin J M, Dong M. Germination of dimorphic seeds of the desert annual halophyteSuaedaaralocaspica(Chenopodiaceae), a C4plant without Kranz anatomy. Annals of Botany, 2008, 102(5):757-769.
[24] Voznesenskaya E V, Franceschi V R, Kiirats O, Freitag H, Edwards G E. Kranz anatomy is not essential for terrestrial C4plant photosynthesis. Nature, 2001, 414(6863):543-546.
[25] Sage R F. The evolution of C4photosynthesis. New Phytologist, 2004, 161(2):341-370.
[26] Lara M V, Chuong S D X, Akhani H, Andreo C S, Edwards G E. Species having C4single-cell-type photosynthesis in the Chenopodiaceae Family evolved a photosynthetic phosphoenolpyruvate carboxylase like that of Kranz-type C4species. Plant Physiology, 2006, 142(2):673-684.
[27] 王雷, 董鸣, 黄振英. 种子异型性及其生态意义的研究进展. 植物生态学报, 2010, 34(5):578-590.
[28] Nambara E, Marion-Poll A. ABA action and interactions in seeds. Trends in Plant Science, 2003, 8(5):213-217.
[29] Shinozaki K, Yamaguchi-Shinozaki K. Molecular responses to dehydration and low temperature:Differences and cross-talk between signaling pathways. Current Opinion in Plant Biology, 2000, 3(3):217-223.
[30] 曹婧, 兰海燕. 植物激素脱落酸受体及其信号转导途径研究进展. 生物技术通报, 2014, (6):22-29.
[31] Hilhorst H W M. A critical update on seed dormancy. I. Primary dormancy. Seed Science Research, 1995, 5(2):61-73.
[32] Kermode A R. Role of abscisic acid in seed dormancy. Journal of Plant Growth Regulation, 2005, 24(4):319-344.
[33] Feurtado J A, Kermode A R. A merging of paths:Abscisic acid and hormonal cross-talk in the control of seed dormancy maintenance and alleviation. Annual Plant Reviews, 2007, 27:176-223.
[34] Finch-Savage W E, Leubner-Metzger G. Seed dormancy and the control of germination. New Phytologist, 2006, 171(3):501-523.
[35] Holdsworth M J, Finch-Savage W E, Grappin P, Job D. Post-genomics dissection of seed dormancy and germination. Trends in Plant Science, 2008, 13(1):7-13.
[36] Pitet P E. Some cellular and molecular properties of abscisic acid:its particular involvement in growing plant roots. Cellular and Molecular Life Sciences, 1998, 54(8):851-865.
[37] Bai L, Zhou Y, Zhang X R, Song C P, Cao M Q. Hydrogen peroxide modulates abscisic acid signaling in root growth and development inArabidopsis. Chinese Science Bulletin, 2007, 52(8):1142-1145.
[38] Xing Y, Jia W, Zhang J.Atmkk1 andAtmpk6 are involved in abscisic acid and sugar signaling inArabidopsisseed germination. Plant Molecular Biology, 2009, 70(6):725-736.
[39] 陈文瑞, 张武军. 脱落酸浸种对水稻秧苗素质的影响. 四川农业大学学报, 2000, 18(2):131-133.
[40] 邵玺文, 孙长占, 阮长春, 韩立军, 赵兰坡, 胡耀辉. ABA浸种对水稻生长及产量的影响. 吉林农业大学学报, 2003, 25(3):243-245, 249-249.
[41] 苗永美, 戈应祥, 居文军, 杨海林, 王万洋, 简兴, 周玉丽. 不同浸种处理对甜瓜种子发芽及幼苗生长的影响. 种子, 2013, 32(11):20-27.
[42] Mohamed-Yasseen Y, Barringer S A, Splittstoesser W E, Costanza S. The role of seed coats in seed viability. Botanical Review, 1994, 60(4):426-439.
[43] Yao S X, Lan H Y, Zhang F C. Variation of seed heteromorphism inChenopodiumalbumand the effect of salinity stress on the descendants. Annals of Botany, 2010, 105(6):1015-1025.
[44] 何美香, 杜晓峰, 陈玲, 吕秀云, 兰海燕. 盐分、变温和激素处理对盐生植物异子蓬异型性种子萌发及成苗的影响. 生态学杂志, 2013, 32(1):45-51.
[45] 管博, 曹迪, 于君宝. 引发处理对甜高粱种子萌发阶段生理生态影响. 生态学杂志, 2014, 33(4):982-988.
[46] 何军, 浦俊, 王渭玲, 高青鸽. 引发对黄芪种子萌发及幼苗抗旱性的影响. 干旱地区农业研究, 2013, 31(5):233-237.
[47] Finkelstein R R, Gampala S S L, Rock C D. Abscisic acid signaling in seeds and seedlings. The Plant Cell, 2002, 14(S1):15-45.
[48] Fujita Y, Fujita M, Satoh R, Maruyama K, Parvez M M, Seki M, Hiratsu K, Takagi M O, Shinozaki K, Shinozaki K Y. AREB1is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance inArabidopsis. The Plant Cell, 2005, 17(12):3470-3488.
[49] Xiong L, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress. The Plant Cell, 2002, 14:165-l83.
[50] Xiong L, Yang Y. Disease resistance and abiotic stress tolerance in rice are inversely modulated by an abscisic acid-inducible mitogen-activated protein kinase. The Plant Cell, 2003, 15(3):745-759.
[51] Saneoka H, Ishiguro S, Moghaieb R E A. Effect of salinity and abscisic acid on accumulation of glycinebetaine and betaine aldehyde dehydrogenase mRNA in sorghum leaves (Sorghumbicolor). Journal of Plant Physiology, 2001, 158(7):853-859.
[52] Yamaguchi-Shinozaki K, Shinozaki K. A novel cis-acting element in anArabidopsisgene is involved in responsiveness to drought, low-temperature, or high-salt stress. The Plant Cell, 1994, 6(2):251-264.
[53] 张小冰, 邢勇, 郭乐, 张彩凤. 腐植酸钾浸种对干旱胁迫下玉米幼苗保护酶活性及MDA含量的影响. 中国农学通报, 2011, 27(7):69-72.
[54] 陈思妍, 邹华文. 脱落酸浸种提高萌发期水稻种子对涝渍胁迫的抗性研究. 安徽农业科学, 2013, 41(2):593-594.
[55] 颜宏, 赵伟, 张志静, 胡晓悦. 盐胁迫下ABA预浸种对向日葵幼苗的缓解效应. 中国农学通报, 2013, 29(34):139-143.
[56] 张晓菲. ABA对Cd胁迫下小麦种子萌发特性的影响. 现代商贸工业, 2010, (4):305-306.
[57] Wanders R J, Visser W F, van Roermund C W, Kemp S, Waterham H R. The peroxisomal ABC transporter family. Pflugers Archiv--European Journal of Physiology, 2007, 453(5):719-734.
[58] Footitt S, Slocombe S P, Larner V, Kurup S, Wu Y S, Larson T, Graham L, Baker A, Holdsworth M. Control of germination and lipid mobilization by COMATOSE, theArabidopsishomologue of human ALDP. The EMBO Journal, 2002, 21(12):2912-2922.
[59] Russell L, Larner V, Kurup S, Bougourd S, Holdsworth M. TheArabidopsisCOMATOSE locus regulates germination potential. Development, 2000, 127(17):3759-3767.
[60] Tena G, Asai T, Chiu W L, Sheen J. Plant mitogen-activated protein kinase signaling cascades. Current Opinion in Plant Biology, 2001, 4(5):392-400.
[61] Pitzschke A, Schikora A, Hirt H. MAPK cascade signaling networks in plant defence. Current Opinion in Plant Biology, 2009, 12(4):421-426.
[63] 张茂迎, 宗晓娟, 李德全. 植物MAPK级联途径参与调控ABA信号转导. 生命科学, 2010, 22(8):736-742.
[64] 钟鸣, 陈琢, 刘宛, 李培军, 台培东. 逆境胁迫下植物DNA损伤和DNA错配修复研究进展. 生态学杂志, 2013, 31(9):2404-2411.
[65] Bray C M., West C E. DNA repair mechanisms in plants:crucial sensors and effectors for the maintenance of genome integrity. New Phytologist, 2005, 168(3):511-528.
[66] Weber D J. Salinity and Water Stress. Netherlands:Springer, 2009:179-185.
[67] 刘艳芳, 魏岩, 严成. 异子蓬二型种子的萌发与休眠特性及其生态适应. 生态学报, 2009, 29(12):6609-6614.
Effects of exogenous abscisic acid on heteromorphic seed germination ofSuaedaaralocaspica, a typical halophyte of Xinjiang desert region
CAO Jing, LI Xiaorong, WANG Cui, WANG Lu, LAN Xinxin, LAN Haiyan*
XinjiangKeyLaboratoryofBiologicalResourcesandGeneticEngineering,CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China
In order to examine the effects of exogenous abscisic acid (ABA) on germination and seedling growth of heteromorphicSuaedaaralocaspicaseeds, we either directly sowed (long-term treatment) or presoaked (short-term treatment) the two seed morphs under different concentrations (0, 0.5, 1.0, 5.0, 10.0 μmol/L) of ABA. To further understand the molecular mechanism of exogenous ABA effects on different germination characteristics of heteromorphic seeds ofS.aralocaspica, we examined the expression of three genes with known functions in seed germination:ABC transporter family protein, mitogen-activated protein kinase kinase, and DNA repair and transcription factor. Gene expression was analyzed using quantitative PCR on directly sown and presoaked seeds treated with 5.0 μmol/L ABA. The results revealed two findings:(1) For directly sown seeds, different concentrations of exogenous ABA inhibited germination and seedling growth of brown seeds significantly, while these processes in black seeds were accelerated by lower concentrations of ABA, rather than by higher concentrations. In contrast, pre-soaking promoted germination and seedling growth of both types of seed, and this effect increased at higher concentrations of ABA. (2) Quantitative PCR revealed that, for directly sown brown seeds, only the expression level of the gene for DNA repair and transcription factor increased significantly at 8 h compared to that of control seeds. In black seeds, the genes for DNA repair and transcription factor and for mitogen-activated protein kinase kinase were significantly up regulated compared to those in the control. For pre-soaked seeds, treatment with ABA markedly increased the expression levels of all three genes in brown seeds rather than in black seeds. Expression patterns of the three genes were consistent with the results of seed germination. These results suggest that presoaking with ABA may trigger the internal germination mechanism ofS.aralocaspicaseeds and accelerate the subsequent germination process. The stronger response of black seeds to ABA treatment may be an important adaptation to the harsh and unpredictable environment of Xinjiang desert region.
ABA;Suaedaaralocaspica; heteromorphic seeds; seed germination; quantitative PCR; molecular mechanism
国家自然科学基金(31260037, 31060027); 新疆自治区优秀青年科技人才培养项目(2013721013); 新疆生物资源基因工程重点实验室开放基金(XJDX0201-2011-03)
2014-05-13; < class="emphasis_bold">网络出版日期:
日期:2014-12-18
10.5846/stxb201405130978
*通讯作者Corresponding author.E-mail: lanhaiyan@xju.edu.cn
曹婧, 李晓荣, 王翠, 王璐, 兰欣欣, 兰海燕.外源激素ABA影响新疆荒漠盐生植物异子蓬异型种子萌发机制.生态学报,2015,35(20):6666-6677.
Cao J, Li X R, Wang C, Wang L, Lan X X, Lan H Y.Effects of exogenous abscisic acid on heteromorphic seed germination ofSuaedaaralocaspica, a typical halophyte of Xinjiang desert region.Acta Ecologica Sinica,2015,35(20):6666-6677.
