稻田土壤关键元素的生物地球化学耦合过程及其微生物调控机制
2015-01-20吴金水葛体达胡亚军
吴金水,葛体达,胡亚军
中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125
稻田土壤关键元素的生物地球化学耦合过程及其微生物调控机制
吴金水*,葛体达,胡亚军
中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125
水稻土是在长期植稻下人为培育的特殊耕作土壤,是我国土壤学的特色,其研究也反映我国土壤学的国际地位。水稻土是研究土壤生物地球化学过程的理想模型。稻田土壤关键元素(碳氮磷硫铁等)的生物地球化学循环过程、耦合机理及其驱动机制研究是土壤生物学研究的核心之一。因此,以国际土壤年为契机,结合中国科学院院士工作局资助的“土壤生物学发展战略研究”项目的部分成果,以稻田关键元素(碳氮磷硫铁等)生物地球化学循环过程及其耦合的微生物驱动机制为核心,重点讨论了稻田土壤基本生物化学特征、稻田土壤碳-氮、碳-氮-磷、碳-氮-铁等多元素耦合过程及其与微生物之间的反馈机制,并由此提出了稻田土壤关键元素生物地球化学循环微生物驱动机制研究的未来重点发展方向为:1)土壤关键元素生物地球化学过程的异质性及其微生物过程的互作机制研究;2)微生物参与机制对土壤关键元素循环过程的响应、反馈机制与调控机制研究;3)土壤关键生物地球化学过程的计量学研究。
稻田土壤;碳氮磷硫铁;微生物生态学;耦合过程;调控机制
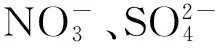
土壤学科的发展始一直赖于研究方法的突破和改进。目前,以高通量测序技术和光谱成像技术为代表的新型技术的发展极大的推动了土壤元素循环的微生物机理研究。土壤宏基因组学、宏转录基因组学和DNA-SIP 等新技术为揭开土壤中不可培养微生物的代谢能力及其在土壤生态系统中的功能提供了可能。目前,以欧美各国分别竞相开展相关的大型研究计划,例如,美国土壤宏基因组计划与地球微生物计划、英国土壤生物多样性计划和德国土壤生物地球化学界面研究计划等。我国也通过一系列科研项目的实施,包括典型土壤关键生物地球化学过程的国家自然科学基金委重大项目以及中国科学院战略性先导科技专项“土壤-微生物系统功能及其调控”等,我国科学家围绕土壤生态系统的生物地球化学关键过程,在有机质分解、土壤元素循环、水稻土碳、氮、铁循环过程特点、耦合机制及其关键功能微生物的群落结构等方面的土壤元素生物地球化学循环的微生物驱动机制等方面取得了重要进展[3,6-9]。同时,由中国科学院院士工作局资助的 “土壤与土壤生物学发展战略研究”以及 “土壤生物学发展战略研究”项目的实施,更是从国家需求和学科发展的角度系统分析了我国土壤生物学的发展历程和国内外土壤生物学现状及发展趋势,提出了我国土壤生物地球化学领域的重要挑战,凝练了今后5—10年土壤生物地球化学领域的优先发展目标和关键科学问题。
因此,本文以国际土壤年(International year of soil)为契机,旨在提高人们对土壤在粮食安全和基本生态系统功能方面重要作用的认识和了解,同时结合上述“土壤生物学发展战略研究”项目的部分成果,从稻田碳氮磷硫铁等关键元素耦合的生物地球化学循环过程的微生物驱动机制入手,重点讨论稻田土壤基本生物化学特征、稻田土壤关键元素(碳氮磷硫铁等)生物地球化学循环过程及其与微生物之间的反馈机制和研究方法,并展望了稻田土壤关键元素生物地球化学循环微生物驱动机制研究的重点发展方向,期望推动我国该研究领域的基础理论建设和新技术发展。
1 稻田土壤基本生物化学特征
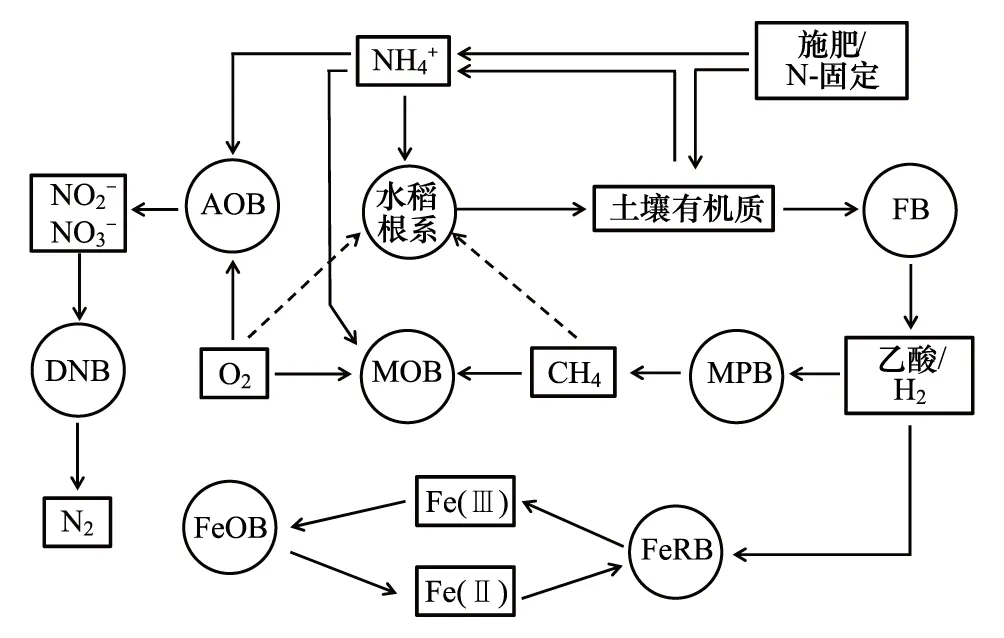
图1 稻田碳氮铁循环的好氧和厌氧微生物过程之间的相互耦合作用示意图[14]Fig.1 Schematic presentation of the interactions between the oxygen-releasing root and aerobic and anaerobic microbial processes involved in C-and N-cycling as well as in methane emission from flooded soils[14]实线箭头表示相关的微生物过程,而虚线箭头扩散过程;生物体被示为圆形为微生物过程,矩形框为反应的底物;FB:发酵菌fermenting bacteria; MPA:产甲烷古菌methane-producing archaea; FeRB:铁还原菌iron reducing bacteria; MOB:甲烷氧化菌methane oxidizing bacteria; FeOB:铁细菌铁氧化细菌iron oxidising bacteria; AOB;氨氧化细菌ammonium oxidising bacteria; DNB:反硝化细菌denitrifying bacteria
稻田是我国典型的农田生态系统,现有稻田面积330多万hm2,约占全国耕地总面积的27%;水稻产量世界第一,占全国粮食总产量约50%,是具有重大经济意义的土壤资源,对我国粮食安全具有举足轻重的作用。
水稻土一直是我国土壤科学研究的特色,早在20世纪60年代,我国水稻土研究先驱马溶之指出:“耕作土壤的形成条件除自然因素外,还有人为因素,而当人为因素占主导时,土壤发育方向发生变化,因而土壤的熟化作用成了耕作土壤的特殊过程”。土壤学家对水稻土的发生学特点与物理、化学和生物学基本性质等开展了大量研究,在理论和应用上都取得了国际公认的巨大成就[10-11]。确立了水稻土是在长期水耕和植稻作用下形成的一种特殊的人为土类,具有明显区别于其它土壤类型的土壤发生学特性,包括氧化-还原交替过程和水稻根系泌氧引起的土壤铁、锰的形态转化与淋溶过程、土壤母质剖面的改变与稻田耕作层的形成与演化。同时还系统阐明了水稻土理化性质、生物学特点与肥力基础,包括水稻土特有的氧化-还原反应变化基本规律及其对土壤物理和化学过程的作用、土壤有机质与主要养分基本状况与作物供应能力、土壤微生物区系(如好气和嫌气微生物、固氮菌)等。Wu等[12]揭示了稻田土壤有机碳积累的特殊生物化学特性,发现稻田土壤的微生物量及微生物周转速率尽管大于旱作土壤,但外源添加有机底物条件下的矿化率却明显较低,且并未产生明显的激发效应,而旱地土壤的激发效应极为显著。提出了稻田土壤有机碳矿化存在阻滞效应的观点;发现稻田土壤有机碳矿化及其对温度的响应可能并不受土壤粘粒含量的影响,而是受底物有效性的控制[13]。从而较系统阐明了稻田土壤长期持续固碳的生物地球化学机制。
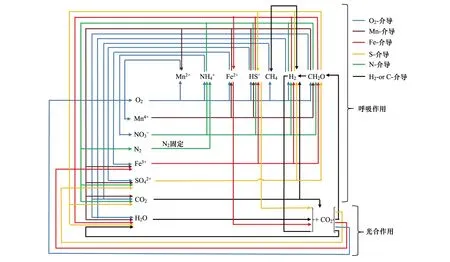
图2 微生物生物介导的氢,碳,氮,氧,硫和铁循环的耦合网络[15]Fig.2 A schematic diagram depicting a global, interconnected network of the biologically mediated cycles for hydrogen, carbon, nitrogen, oxygen, sulfur, and iron[15]
2 稻田土壤碳氮磷硫铁耦合的微生物机制
稻田作为一种典型的人为土壤,其元素循环过程受到自然与人为因素的双重影响。稻田的元素循环过程与与其他生态系统具有差别。例如,稻田特有的水耕熟化作用促进有机碳的保持与增长,土壤中氧化铁通过改善团聚体结构促进有机碳的复合包裹,施肥措施能显著改变氮的转化过程。土壤淹水后,氧气的消耗改变土壤氧化还原梯度,微生物的群落迅速演变并参与土壤的关键元素氧化还原的电子传递。因此,在不同的氧化还原梯度下研究土壤-植物-微生物相互作用是理解陆地生态系统关键生物地球化学循环过程的关键所在(图1)[14]。水稻土壤氧化-还原梯度下的生物学研究更是受到国际学术界的关注。美国微生物学会将水稻土生态系统作为21世纪微生物生态学研究的模型系统之一。德国科学基金提供专项支持水稻土生物地球化学研究,关注稻田碳氮铁耦合循环过程。稻田土壤中各种来源和形态的有机物质最终都必须经过微生物的分解矿化过程才能重新进入土壤生物地球化学循环(图2)。因此,解析稻田土壤生物地球化学的微生物驱动机制,是深刻理解微生物功能与过程的重要突破口。稻田生态系统关键元素(碳氮磷硫铁等)的生物地球化学过程与微生物生态过程耦合研究已成为土壤生物学研究的热点和前沿性科学问题之一。
2.1 碳氮耦合的微生物机制
稻田土壤碳氮生物地球化学循环涉及多种反应以及多种功能微生物的参与。稻田土壤氧化还原交替作用强烈影响碳-氮循环过程,好氧条件下土壤有机碳在微生物的作用下降解为CO2,排放到大气中[16],或者被微生物同化固定并转化为土壤有机质[4,17-18];厌氧条件下土壤有机碳通过一系列的微生物发酵降解过程产生小分子有机酸,最终产生甲烷排放至大气[16,19]。稻田土壤碳氮循环过程互相依赖,紧密联系。例如,Ge等[9]运用碳同位素连续标记技术,探讨了水稻光合同化碳的土壤传输和转化及其对氮肥施用的响应,较高的施氮水平明显促进水稻新鲜根际碳的沉积,并显著影响土壤微生物量碳的更新率。
碳氮耦合的微生物过程研究一直以来都是土壤微生物生态学研究的热点之一。稻田甲烷氧化与和氨氧化是稻田碳氮耦合微生物机制的典型例子。据估算,稻田产生的甲烷排放到大气之前,大约30%—90%已经在稻田好氧区域被甲烷氧化细菌所氧化[20-21]。Yuan等[22-23]揭示了水稻土厌氧产甲烷古菌群落对土壤干湿交替、氧气和硝酸盐胁迫的响应机制,发现氧和硝酸盐对产甲烷古菌的调控作用主要发生在功能基因的转录水平。同时,甲烷氧化细菌和硝化细菌关键基因的结构和功能相似,具有一定遗传进化关系。甲烷氧化菌含有与氨单加氧酶功能相似的甲烷单加氧酶,室内纯菌培养试验已证明其执行硝化作用的过程中,有N2O 气体产生,而在田间是否具有相同的功能还未得到证实[24]。而且,甲烷氧化细菌和氨氧化细菌可以互相利用底物生长。因此,在稻田生态系统中,以甲烷氧化和氨氧化为模式耦合生态过程,有助于从简单到复杂,逐步深入研究土壤碳、氮循环的耦合微生物机理。
土壤中碳氮的周转受其计量比的控制[25],在氮素充足的条件下,土壤中较高的植物残体投入量及其较低的碳氮比导致微生物更倾向于选择“新鲜”碳源底物,进而减少了原有有机碳的矿化[26];反之,在氮素受限条件下,高碳氮比的植物残体可能会增加微生物对无机氮素的需求,刺激土壤原有有机质的分解[27],由于反馈作用的存在,微生物氮固持又会造成植物生长养分受限,从而改变了外源氮和土壤原有氮素在生态系统的循环特征[28]。近年来利用稳定同位素探针技术,发现稻田土壤施用铵态氮后,对Type-I 甲烷氧化细菌没有影响,却抑制了Type-Ⅱ 甲烷氧化细菌繁殖[29],然而稻田土壤中Type-I 甲烷氧化细菌通常为优势种群,一般认为在甲烷氧化过程中发生重要作用[30-31],因此,该结果似乎并不能完全解释氮肥施用对甲烷排放的影响机制,其微生物分子机理还有待进一步研究。同时,甲烷氧化细菌和氨氧化细菌的特征磷脂脂肪酸非常相似,因此,磷脂脂肪酸作为分子标尺的分辨率较低,可能无法真实反映铵态氮肥影响土壤甲烷氧化过程的微生物驱动机理,技术手段仍是研究甲烷氧化和氨氧化相互影响规律的瓶颈。
2.2 碳氮磷耦合的微生物机制
土壤磷素微生物转化与碳氮生物地球化学循环相互耦合。Sinsabaugh等[32]研究发现土壤和沉积物碳氮磷比例控制不同生态系统中养分和能量的流向,异养微生物同化碳氮磷的酶活性呈现固定的计量关系。土壤微生物在促进磷素吸收的同时会加快土壤有机质的周转[33]。同时,Sinsabaugh等在生态酶计量关系上揭示土壤和沉积物生态系统中CNP利用存在普遍的比率关系,从而控制不同生态系统中养分和能量的流向[34]。同样,土壤微生物自身也维持相对稳定的CNP比值。据估计,全球土壤微生物的CNP比值的平均值为60∶7∶1[35]。微生物的CNP比值受到环境因子的影响,如环境因子能够通过影响微生物群落结构进而影响到微生物的CNP比值[36]。另外,在不同生态系统的环境限制因子条件下,微生物也能通过储存糖源或聚磷酸盐等改变微生物的CNP比值[37-38]。在湖泊体系中,磷沉降的加剧改变了水体中的NP比值,导致其生态系统由磷限制因子转变为氮限制因子[39]。在稻田土壤中,同样存在土壤碳氮磷耦合的微生物机制。比如,基于硝酸根的厌氧铁氧化菌调节水稻磷和氮的吸收过程[40]。而Li等[41]应用生态化学计量学的原理和方法,从区域景观单元上,量化了稻田土壤微生物量(碳氮磷)与元素碳氮磷的生态化学计量关系,提出亚热带景观尺度稻田土壤微生物C∶P受土壤C∶P控制的观点。
微生物可以调控无机态磷和微生物生物量磷的周转,促进难溶性无机磷的活化及其作物的吸收[42]。土壤有机磷循环与转化的关键过程,如植酸磷的矿化、磷酸脂的形成,也均由微生物驱动。同时,微生物对磷素的活化需要碳源供给,其活化过程受碳源质量与输入量调控[43],碳磷同位素双标记研究表明,葡萄糖和丙氨酸小分子物质能够刺激磷素的微生物活化,但小分子甲硫氨酸却对磷素的微生物活化影响较小,推测原因可能是甲硫氨酸的碳硫键稳定,难以被微生物作为碳源利用[44]。尽管土壤微生物过程对磷素转化与供应的影响较大,但除了在菌根共生研究外[45],近年来进展相对缓慢。迄今,国内外尚缺乏土壤磷素微生物转化过程与碳氮过程耦合的系统研究,特别是缺少对特定磷活化功能微生物和功能基因与碳氮过程的关联研究,这严重制约了稻田碳氮磷耦合的微生物机制的深入认识。
2.3 氮铁耦合的微生物机制
微生物对土壤铁的氧化还原不仅决定着铁的生物有效性,还通过改变土壤氧化还原势调控其它元素的氧化还原过程。在水成土和底泥中,有机物分解、矿质元素的溶解与侵蚀、地质矿物的形成、重金属离子的移动或固定[46]、养分高效利用[47]和温室气体排放[48]等都有微生物铁氧化过程的发生。参与铁氧化过程的微生物主要涉及古菌和细菌。环境中主要存在4种营养型铁氧化菌:好氧嗜酸性和好氧嗜中性铁氧化菌,厌氧光能和依赖于硝酸盐的铁氧化菌。铁的微生物还原是发生在厌氧沉积物及淹水土壤中重要的微生物学过程。
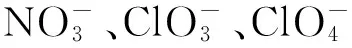
2.4 碳氮铁耦合的微生物机制
稻田土壤可能存在强烈的土壤碳氮铁生物地球化学循环的微生物耦合过程。在氧化还原电位较低的厌氧非根际土壤中,依赖于硝酸盐的厌氧型铁氧化菌能利用外界Fe(Ⅱ)作为电子供体,同时氧化硝酸根所释放出来的能量满足生长发育的需要。硝酸根作为厌氧铁氧化过程必需的电子受体,同时受到氨氧化(好氧微域)或厌氧铵氧化(厌氧微域)的调控。铁还原微生物包括古菌、细菌和真菌[52]。迄今为止发现的铁还原菌大多数属于Geobacteraceae属,稻田土壤中铁还原菌的主要种群也被发现属于Geobacteraceae,并可能主导稻田土壤有机质厌氧降解的产甲烷过程[53]。铁还原菌也广泛存在于水稻土中,导致厌氧铁氧化产物三价铁与稻田土壤有机碳代谢过程紧密相关。淹水条件下稻田土壤有机质分解不彻底,导致乙酸、丙酸、乳酸和丁酸等易降解有机酸的累积,为铁还原菌提供了电子供体。此外,乙酸同时可作为电子供体将三价铁还原为二价铁,二价铁在厌氧条件下将硝态氮还原为亚硝态氮,亚硝态氮与可溶性土壤有机质可形成络合物,即碳氮铁耦合微生物机理的铁轮假设[54]。此外,许多研究发现,铁还原条件会使产甲烷过程受到严重抑制,并认为铁还原菌和产甲烷菌竞争共同的底物(例如乙酸和氢气)是产生抑制的主要原因[55],而且铁还原还会加速N2O 释放[56]。因此,明确鉴别土壤中碳-氮、碳-铁、氮-铁和碳-氮-铁生物地球化学过程的关键微生物驱动者,是深刻理解稻田土壤中碳-氮-铁耦合机理的前提。
2.5 多元素(碳氮磷硫铁等)耦合过程的微生物互作机制
土壤中有机质与氮、磷、硫、铁等关键元素存在着相互耦合关系,这种耦合关系加剧了其过程的复杂性和不确定性。比如,化能自养的氨氧化微生物及厌氧氨氧化细菌本身即是一个重要的碳库,其活性与动态直接影响着碳的源汇平衡。Kellermann等[57]发现,在甲烷存在时,厌氧甲烷氧化古菌优先利用无机碳进行自养生长。因此,这些微生物也参与了二氧化碳固定[57]。最近,还陆续报道了可将厌氧甲烷氧化与亚硝酸盐还原耦合的细菌[58]和将厌氧甲烷氧化与硝酸盐还原耦合的古菌[59]。同时稳定同位素和元基因组分析表明,厌氧氨氧化菌通过乙酰CoA途径固定二氧化碳,由此推测,这些微生物对碳循环也具有重要影响[60]。而且,厌氧氨氧化菌与化能自养氧化硫细菌Thioploca形成的共生体可以将海底的氨和硝酸盐转化为氮气,估计由此产生的氮气可占海底总氮气的(57±21)%[61]。水稻土中参与硫的氧化还原的微生物除了主导硫的生物地球化学循环,同时参与其他元素循环。研究证实,硫酸盐还原菌被证明能够参与甲烷的厌氧氧化过程和含氮有机物的产氨过程[2]。显然,生态系统诸元素循环紧密耦合,调控和驱动生物地球化学过程。微生物驱动的多元素过程耦合机制是目前微生物生态学和生物地球化学过程研究的前沿,在水稻土中相互的耦合关系,探讨微生物分子生态学机制具有重要的理论和实际意义[15]。
3 总结与展望
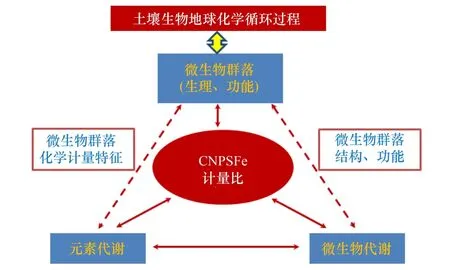
图3 土壤生物地球化学关键过程计量特征概念框架图 Fig.3 Conceptual framework of stoichiometry for the key soil biogeochemical processes
综上所述,生物活动在一定程度上控制了土壤关键元素(碳氮磷硫铁等)的循环过程,是土壤中各种生源要素形成与转化的关键动力,也是联系土壤圈、大气圈、岩石圈、水圈和生物圈相互作用的纽带,被认为是元素生物地球化学循环的一个重要引擎,生源要素诸元素循环紧密耦合,调控和驱动生物地球化学过程。因此,解析土壤生物地球化学的微生物驱动机制,是深刻理解微生物功能与过程的重要突破口。
然而,过去土壤关键元素生物地球化学循环的研究主要集中在整个土体的均一化、均质化的层次。关键元素的生物地球化过程可能会影响土壤微结构的形成,后者进而改变土壤微环境,推动土壤微生物群落结构发生演替[62]。而传统的均一化、均质化研究忽略了关键元素与微生物的微观高度异质性,在土壤微结构界面上,关键元素(比如碳)与微生物接触距离的远近形成微生物作用的暗区与热点区域,而这些热点区域被目前均一化、均质化的研究所忽略了[63]。另一方面,土壤微生物个体尺度在μm级别,微生物群落作用的范围同样在亚毫米、微米尺度,微生物在土壤微环境中的趋化性,吸附,生长,成膜过程都伴随着对周围环境的强烈的依赖、选择和改造,微观尺度上的土壤关键元素生物地球化学过程需要重点关注,而长期以来由于土壤的不透明性,土壤生物学以黑(灰)箱理论为基础,往往只关注宏观结果而忽略了微观动态过程。因此,将土壤关键元素生物地球化学过程的异质性与其对微生物过程的影响联系起来是当今土壤微生物生态学的研究前沿之一。
尽管土壤中大多数微生物都参与土壤关键元素的生物地球化学过程,但微生物如何参与,哪些微生物优先参与仍不清楚;在复杂的微生物环境中,各种微生物之间是竞争机制还是条件控制机制是有待揭示的科学问题[64-65]。对微生物参与机制和过程的认识将促进土壤关键元素循环过程调控的研究[66]。因此,目前需要从微生物参与机制的角度对土壤关键元素的生物地球化学过程及其调控机理开展深入研究。
以往研究集中在单个元素或单个过程的生物地球化学过程及其微生物驱动机制。但是,一切微生物驱动的生物地球化学过程受制于生物体的化学计量特征(图3)。通过计量学定量描述它们在土壤中的存在状态和所担负的生态功能,是揭示土壤元素生物地球化学循环过程内在机制的有力工具,也是实现对土壤生态过程的预测和调控的重要理论基础。计量学是推进当前土壤生物地球化学的微生物驱动机制研究的新工具(图3)。因此,需要明确土壤生物地球化学过程的计量特征与土壤元素及环境的偶联关系,深入理解土壤微生物关键过程之间的相互作用及平衡制约关系是未来研究的重点。
[1] Amundson R, Berhe A A, Hopmans J W, Olson C, Sztein A E, Sparks D L. Soil and human security in the 21st century. Science, 2015, 348(6235): 1261071.
[2] 贺纪正, 陆雅海, 傅伯杰. 土壤生物学前沿. 北京: 科学出版社, 2014.
[3] Ge T D, Wu X H, Chen X J, Yuan H Z, Zou Z Y, Li B Z, Zhou P, Liu S L, Tong C L, Brookes P, Wu J S. Microbial phototrophic fixation of atmospheric CO2in China subtropical upland and paddy soils. Geochimica et Cosmochimica Acta, 2013, 113: 70-78.
[4] Long X E, Yao H Y, Wang J, Huang Y, Singh B, Zhu Y G. Community structure and soil pH determine chemoautotrophic carbon dioxide fixation in drained paddy soils. Environmental Science & Technology, 2015, 49(12): 7152-7160.
[5] Rütting T, Boeckx P, Müller C, Klemedtsson L. Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle. Biogeosciences, 2011, 8(7): 1779-1791.
[6] Ding L J, An X L, Li S, Zhang G L, Zhu Y G. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence. Environmental Science & Technology, 2014, 48(18): 10641-10647.
[7] Ding L J, Su J Q, Xu H J, Jia Z J, Zhu Y G. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-13C-acetate probing coupled with pyrosequencing. The ISME Journal, 2014, 9(3): 721-734.
[8] Ge T D, Yuan H Z, Zhu H H, Wu X H, Nie S A, Liu C, Tong C L, Wu J S, Brookes P. Biological carbon assimilation and dynamics in a flooded rice-Soil system. Soil Biology and Biochemistry, 2012, 48: 39-46.
[9] Ge T D, Liu C, Yuan H Z, Zhao Z W, Wu X H, Zhu Z K, Brookes P, Wu J S. Tracking the photosynthesized carbon input into soil organic carbon pools in a rice soil fertilized with nitrogen. Plant and Soil, 2015, 392(1/2): 17-25.
[10] 李庆逵. 中国水稻土. 北京: 科学出版社, 1992.
[11] 于天仁. 水稻土的物理化学. 北京: 科学出版社, 1983.
[12] Wu J S, Zhou P, Li L, Su Y R, Yuan H Z, Syers J K. Restricted mineralization of fresh organic materials incorporated into a subtropical paddy soil. Journal of the Science of Food and Agriculture, 2012, 92(5): 1031-1037.
[13] Zhou P, Li Y, Ren X E, Xiao H A, Tong C L, Ge T D, Brookes P C, Shen J L, Wu J S. Organic carbon mineralization responses to temperature increases in subtropical paddy soils. Journal of Soils and Sediments, 2014, 14(1): 1-9.
[14] Kögel-Knabner I, Amelung W, Cao Z H, Fiedler S, Frenzel P, Jahn R, Kalbitz K, Kölbl A, Schloter M. Biogeochemistry of paddy soils. Geoderma, 2010, 157(1/2): 1-14.
[15] Falkowski P G, Fenchel T, Delong E F. The microbial engines that drive Earth′s biogeochemical cycles. Science, 2008, 320(5879): 1034-1039.
[16] Kimura M, Murase J, Lu Y H. Carbon cycling in rice field ecosystems in the context of input, decomposition and translocation of organic materials and the fates of their end products (CO2and CH4). Soil Biology and Biochemistry, 2004, 36(9): 1399-1416.
[17] Yuan H Z, Ge T D, Chen C Y, O′Donnell A G, Wu J S. Significant role for microbial autotrophy in the sequestration of soil carbon. Applied and Environmental Microbiology, 2012, 78(7): 2328-2336.
[18] Wu X H, Ge T D, Yuan H Z, Li B Z, Zhu H H, Zhou P, Sui F G, O′Donnell A G, Wu J S. Changes in bacterial CO2fixation with depth in agricultural soils. Applied Microbiology and Biotechnology, 2014, 98(5): 2309-2319.
[19] Lu Y, Arah J R M, Wassmann R, Neue H U. Simulation of methane production in anaerobic rice soils by a simple two-pool model//Wassmann R, Lantin R S, Neue H -U, eds. Methane Emissions from Major Rice Ecosystems in Asia. Netherlands: Springer, 2000: 277-284.
[20] Zhang G B, Yu H Y, Fan X F, Liu G, Ma J, Xu H. Effect of rice straw application on stable carbon isotopes, methanogenic pathway, and fraction of CH4oxidized in a continuously flooded rice field in winter season. Soil Biology and Biochemistry, 2015, 84: 75-82.
[21] Chanton J P, Powelson D K, Abichou T, Fields D, Green R. Effect of temperature and oxidation rate on carbon-isotope fractionation during methane oxidation by landfill cover materials. Environmental Science & Technology, 2008, 42(21): 7818-7823.
[22] Yuan Q, Lu Y H. Response of methanogenic archaeal community to nitrate addition in rice field soil. Environmental Microbiology Reports, 2009, 1(5): 362-369.
[23] Yuan Y L, Conrad R, Lu Y H. Responses of methanogenic archaeal community to oxygen exposure in rice field soil. Environmental Microbiology Reports, 2009, 1(5): 347-354.
[24] Sutka R L, Ostrom N E, Ostrom P H, Gandhi H, Breznak J A. Nitrogen isotopomer site preference of N2O produced byNitrosomonaseuropaeaandMethylococcuscapsulatusBath. Rapid Communications in Mass Spectrometry, 2003, 17(7): 738-745.
[25] Chen R R, Senbayram M, Blagodatsky S, Myachina O, Dittert K, Lin X G, Blagodatskaya E, Kuzyakov Y. Soil C and N availability determine the priming effect: microbial N mining and stoichiometric decomposition theories. Global Change Biology, 2014, 20(7): 2356-2367.
[26] Hagedorn F, Spinnler D, Siegwolf R. Increased N deposition retards mineralization of old soil organic matter. Soil Biology and Biochemistry, 2003, 35(12): 1683-1692.
[27] Bloor J M G, Niboyet A, Leadley P W, Barthes L. CO2and inorganic N supply modify competition for N between co-occurring grass plants, tree seedlings and soil microorganisms. Soil Biology and Biochemistry, 2009, 41(3): 544-552.
[28] Garten C T Jr, Iversen C M, Norby R J. Litterfall15N abundance indicates declining soil nitrogen availability in a free-air CO2enrichment experiment. Ecology, 2011, 92(1): 133-139.
[29] Mohanty S R, Bodelier P L E, Floris V, Conrad R. Differential effects of nitrogenous fertilizers on methane-consuming microbes in rice field and forest soils. Applied and Environmental Microbiology, 2006, 72 (2): 1346-1354.
[30] Bao Z H, Watanabe A, Sasaki K, Okubo T, Tokida T, Liu D Y, Ikeda S, Imaizumi-Anraku H, Asakawa S, Sato T, Mitsui H, Minamisawa K. A rice gene for microbial symbiosis,OryzasativaCCaMK, reduces CH4flux in a paddy field with low nitrogen input. Applied and Environmental Microbiology, 2014, 80(6): 1995-2003.
[31] Hu A, Lu Y H. The differential effects of ammonium and nitrate on methanotrophs in rice field soil. Soil Biology and Biochemistry, 2015, 85: 31-38.
[32] Sinsabaugh R L, Hill B H, Shah J J F. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment. Nature, 2009, 462(7274): 795-798.
[33] Hodge A, Campbell C D, Fitter A H. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material. Nature, 2001, 413(6853): 297-299.
[34] Sinsabaugh R L, Shah J J F. Ecoenzymatic stoichiometry and ecological theory. Annual Review of Ecology, Evolution, and Systematics, 2012, 43: 313-343.
[35] Cleveland C C, Liptzin D. C:N:P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass?. Biogeochemistry, 2007, 85(3): 235-252.
[36] Hall E K, Maixner F, Franklin O, Daims H, Richter A, Battin T. Linking microbial and ecosystem ecology using ecological stoichiometry: a synthesis of conceptual and empirical approaches. Ecosystems, 2011, 14(2): 261-273.
[37] Wilson W A, Roach P J, Montero M, Baroja-Fernández E, Muoz F J, Eydallin G, Viale A M, Pozueta-Romero J. Regulation of glycogen metabolism in yeast and bacteria. FEMS Microbiology Reviews, 2010, 34(6): 952-985.
[38] Chbergerová L, Nahálka J. Polyphosphate-an ancient energy source and active metabolic regulator. Microbial Cell Factories, 2011, 10: 63-63.
[39] Camarero L, Catalan J. Atmospheric phosphorus deposition may cause lakes to revert from phosphorus limitation back to nitrogen limitation. Nature Communications, 2012, 3: 1118.
[40] Chen X P, Zhu Y G, Xia Y, Shen J P, He J Z. Ammonia-oxidizing archaea: important players in paddy rhizosphere soil?. Environmental Microbiology, 2008, 10(8): 1978-1987.
[41] Li Y, Wu J S, Liu S L, Shen J L, Huang D Y, Su Y R, Wei W X, Syers J K. Is the C∶N∶P stoichiometry in soil and soil microbial biomass related to the landscape and land use in southern subtropical China?. Global Biogeochemical Cycles, 2012, 26(4).
[42] Bünemann E K, Oberson A, Liebisch F, Keller F, Annaheim K E, Huguenin-Elie O, Frossard E. Rapid microbial phosphorus immobilization dominates gross phosphorus fluxes in a grassland soil with low inorganic phosphorus availability. Soil Biology and Biochemistry, 2012, 51: 84-95.
[43] Spohn M, Kuzyakov Y. Phosphorus mineralization can be driven by microbial need for carbon. Soil Biology and Biochemistry, 2013, 61: 69-75.
[44] Spohn M, Ermak A, Kuzyakov Y. Microbial gross organic phosphorus mineralization can be stimulated by root exudates-A33P isotopic dilution study. Soil Biology and Biochemistry, 2013, 65: 254-263.
[45] Smith S E, Jakobsen I, Grønlund M, Smith F A. Roles of arbuscular mycorrhizas in plant phosphorus nutrition: interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition. Plant Physiology, 2011, 156(3): 1050-1057.
[46] Wang X J, Chen X P, Yang J, Wang Z S, Sun G X. Effect of microbial mediated iron plaque reduction on arsenic mobility in paddy soil. Journal of Environmental Sciences, 2009, 21(11): 1562-1568.
[47] Moore J K, Doney S C, Glover D M, Fung I Y. Iron cycling and nutrient-limitation patterns in surface waters of the World Ocean. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2001, 49(1/3): 463-507.
[48] Kampschreur M J, Kleerebezem R, De Vet W W J M, Van Loosdrecht M C M. Reduced iron induced nitric oxide and nitrous oxide emission. Water Research, 2011, 45(18): 5945-5952.
[49] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. Nature Reviews Microbiology, 2006, 4(10): 752-764.
[50] Ratering S, Schnell S. Nitrate-dependent iron (Ⅱ) oxidation in paddy soil. Environmental Microbiology, 2001, 3(2): 100-109.
[51] Weber K A, Urrutia M M, Churchill P F, Kukkadapu R K, Roden E E. Anaerobic redox cycling of iron by freshwater sediment microorganisms. Environmental Microbiology, 2006, 8(1): 100-113.
[52] Lovley D. Dissimilatory Fe (Ⅲ)-and Mn (IV)-reducing prokaryotes//Dworkin M, Falkow S, Rosenberg E, Schleifer K -H, Stackebrandt E, eds. The Prokaryotes. New York: Springer, 2006: 635-658.
[53] Hori T, Noll M, Igarashi Y, Friedrich M W, Conrad R. Identification of acetate-assimilating microorganisms under methanogenic conditions in anoxic rice field soil by comparative stable isotope probing of RNA. Applied and Environmental Microbiology, 2007, 73(1): 101-109.
[54] Davidson E A, Chorover J, Dail D B. A mechanism of abiotic immobilization of nitrate in forest ecosystems: the ferrous wheel hypothesis. Global Change Biology, 2003, 9(2): 228-236.
[55] Reiche M, Torburg G, Küsel K. Competition of Fe (Ⅲ) reduction and methanogenesis in an acidic fen. FEMS Microbiology Ecology, 2008, 65(1): 88-101.
[56] Huang B, Yu K W, Gambrell R P. Effects of ferric iron reduction and regeneration on nitrous oxide and methane emissions in a rice soil. Chemosphere, 2009, 74(4): 481-486.
[57] Kellermann M Y, Wegener G, Elvert M, Yoshinaga M Y, Lin Y S, Holler T, Mollar X P, Knittel K, Hinrichs K U. Autotrophy as a predominant mode of carbon fixation in anaerobic methane-oxidizing microbial communities. Proceedings of the National Academy of Sciences of the United states of America, 2012, 109(47): 19321-19326.
[58] Ettwig K F, Butler M K, Le Paslier D, Pelletier E, Mangenot S, Kuypers M M M, Schreiber F, Dutilh B E, Zedelius J, De Beer D, Gloerich J, Wessels H J C T, Van Alen T, Luesken F, Wu M L, Van De Pas-Schoonen K T, Op Den Camp H J M, Janssen-Megens E M, Francoijs K -J, Stunnenberg H, Weissenbach J, Jetten M S M, Strous M. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria. Nature, 2010, 464(7288): 543-548.
[59] Haroon M F, Hu S H, Shi Y, Imelfort M, Keller J, Hugenholtz P, Yuan Z G, Tyson G W. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage. Nature, 2013, 500(7464): 567-570.
[60] Schouten S, Strous M, Kuypers M M M, Rijpstra W I C, Baas M, Schubert C J, Jetten M S M, Damsté J S S. Stable carbon isotopic fractionations associated with inorganic carbon fixation by anaerobic ammonium-oxidizing bacteria. Applied and Environmental Microbiology, 2004, 70(6): 3785-3788.
[61] Prokopenko M G, Hirst M B, De Brabandere L, Lawrence D J P, Berelson W M, Granger J, Chang B X, Dawson S, Crane E J III, Chong L, Thamdrup B, Townsend-Small A, Sigman D M. Nitrogen losses in anoxic marine sediments driven byThioploca-anammox bacterial consortia. Nature, 2013, 500(7461): 194-198.
[62] Schmidt M W I, Torn M S, Abiven S, Dittmar T, Guggenberger G, Janssens I A, Kleber M, Kögel-Knabner I, Lehmann J, Manning D A C, Nannipieri P, Rasse D P, Weiner S, Trumbore S E. Persistence of soil organic matter as an ecosystem property. Nature, 2011, 478(7367): 49-56.
[63] Vogel C, Mueller C W, Höschen C, Buegger F, Heister K, Schulz S, Schloter M, Kögel-Knabner I. Submicron structures provide preferential spots for carbon and nitrogen sequestration in soils. Nature Communication, 2014, 5: 2947, doi: 10.1038/ncomms3947.
[64] Trivedi P, Anderson I C, Singh B K. Microbial modulators of soil carbon storage: integrating genomic and metabolic knowledge for global prediction. Trends in microbiology, 2013, 21(12): 641-651.
[65] Kuzyakov Y, Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept & review. Soil Biology and Biochemistry, 2015, 83: 184-199.
[66] Schimel J P, Schaeffer S M. Microbial control over carbon cycling in soil. Frontiers in Microbiology, 2012, 3: 348, doi: 10.3389/fmicb.2012.00348.
A review on the coupling of bio-geochemical process for key elements and microbial regulation mechanisms in paddy rice ecosystems
WU Jinshui*, GE Tida, HU Yajun
KeyLaboratoryofAgro-ecologicalProcessesinSubtropicalRegion,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China
Paddy rice soil, derived from long-term rice planting, is a type of artificial soil. Studies of paddy rice soil in China reflect the international status of Chinese soil science based on the long history and importance of rice cultivation. Paddy soil is a classical model for studying soil biogeochemical processes. Investigation of biogeochemical cycles, and the coupling and driving mechanisms of key elements (carbon, nitrogen, phosphorus, sulfur, iron, etc.) in paddy soil is important in soil biology studies. Therefore, in this study, on account of the International Year of Soils, we review some achievements of the "Soil biology development strategy research" project funded by Academician Bureau of Chinese Academy of Sciences, and discuss the biogeochemical cycles of key elements (carbon, nitrogen, phosphorus, sulfur, iron, etc.) in paddy ecosystems and the microbial regulation mechanisms of their coupling. We emphasize the basic biochemical features of paddy soil, the coupling processes of C—N, C—N—P, C—N—Fe, and other processes in paddy soil, as well as its microbial feedback regulation mechanism. We also propose perspectives for the development of future studies on the microbial driving mechanisms of the biogeochemical cycles of key elements in paddy soil.
paddy soil; C-N-P-S-Fe; microbial ecology; coupling process; regulation mechanisms
国家自然科学基金项目(41430860, 41271279);中国科学院亚热带农业生态过程重点实验室开放基金项目(ISA2015101)
2015-06-08;
2015-07-30
10.5846/stxb201506081157
*通讯作者Corresponding author.E-mail: jswu@isa.ac.cn
吴金水,葛体达,胡亚军.稻田土壤关键元素的生物地球化学耦合过程及其微生物调控机制.生态学报,2015,35(20):6626-6634.
Wu J S, Ge T D, Hu Y J.A review on the coupling of bio-geochemical process for key elements and microbial regulation mechanisms in paddy rice ecosystems.Acta Ecologica Sinica,2015,35(20):6626-6634.
