颅内孤立性纤维瘤的CT和MR表现
2015-01-20程增辉栾丽娟王佩芬
程增辉 戴 飞 栾丽娟 王佩芬 武 刚
2 复旦大学附属中山医院病理科
3 复旦大学附属中山医院放射科
孤立性纤维瘤(solitary fibrous tumor,SFT)是一种少见的间叶源性良性肿瘤,早在1931年由Klemperer和Rabin描述为脏层胸膜来源的一种原发性梭形细胞肿瘤[1]。此后,随着认识不断提高,胸腔外其他组织器官SFT相继被发现描述,但原发于中枢神经系统的SFT非常罕见,自1996年首次报道至今,文献统计约220多例,大部分为颅内孤立性纤维瘤(intracranial solitary fibrous tumor,ISFT)[2]。ISFT大部分源于脑膜,与常见的纤维型脑膜瘤及血管外皮瘤(hemangiopericytoma,HPC)表现相似,故影像学鉴别非常困难。目前国内外ISFT病例多为散发报道[3],且主要侧重临床及病理改变,而对影像学表现描述较少,故本研究回顾性分析经手术病理证实的ISFT术前CT与MR临床及影像特点,以提高对本病的认识,对术前诊断提供一定帮助。
方 法
1.一般资料
回顾性分析4例2011年8月到2014年1月在复旦大学附属中山医院及青浦分院手术切除后经病理、免疫组织化学证实的ISFT病例资料,4例术前均行MR平扫及增强扫描,3例同时行CT平扫检查,所有病灶均行手术完整切除,由两名病理科医师在组织病理及免疫组织化学基础上对ISFT进行诊断。
2.检查方法
CT扫描采用美国GE lightspeed 16排螺旋CT扫描仪,主要参数:120kV,200mA,层厚5mm,层间距5mm;MR采用美国GE signa HDe 1.5T超导扫描仪及8通道头颅线圈,轴位采用自旋回波(SE)序列:T1WI(TR 450~510ms,TE 11~15ms)、T2WI(TR 4000~5000ms,TE 90~105ms)、液体衰减反转恢复(FLAIR)序列(TR 8500~8800ms,TE 150~200ms),层厚6~8mm,间距2mm,兴趣区(FOV)20~25cm,矩阵256×256。经肘静脉注射Gd-DTPA(0.1mmol/kg)行头颅MR轴位、冠状位及矢状位T1WI增强扫描。DWI(diffusion weighted imaging)采用单次激发梯度平面回波序列(TR 5500~6000ms,TE 5~10ms,b=0、1000s/mm2)。
3.影像分析
由两名具有神经影像诊断特长的医师在GE workstation工作站上对图像进行分析,达成一致意见后记录数据,包括:病灶位置、大小、形态、质地、密度或信号强度、边缘、强化方式及邻近结构改变,其中大小测量取最大径,质地以囊性及实性成分来定,强化方式分为均匀强化及不均匀强化,邻近结构改变包括有无脑膜尾征及局部颅骨骨质改变等。
结 果
1.临床表现及随访结果(表1)
本组4例均为女性,年龄38~72岁,平均51岁。临床表现为头痛头晕(3/4),且呈渐进性加重,其中1例(编号2)伴左侧同向偏盲;另外1例(编号1)表现为左侧听力下降、眩晕、左侧面部麻木、声嘶、吞咽困难及走路不稳。4例患者术前影像学全部误诊,3例误诊为脑膜瘤,1例误诊为听神经瘤。所有病灶均行手术完整切除,其中1例患者术后第2天死于突发室颤,余3例术后分别随访4个月、12个月及33个月均未见复发。
2.影像学表现(表1)
所有病灶均为境界清晰的颅内脑外占位灶,皆与硬脑膜关系密切,天幕以上者共2个病灶,1个位于右额叶凸面(编号4),1个位于右颞叶蝶骨嵴旁(编号3),幕下者1个,位于左小脑脑桥角(编号1),跨天幕生长者1个位于右侧(编号2)。病灶最大径3~8.5cm(平均5.6cm);3个病灶大部实性,内见小囊状坏死灶,1个呈均匀实性。
CT平扫3例呈不均匀稍高及高密度,未见明显钙化灶,邻近颅骨呈侵蚀性改变2个(图1~A),另外1个颅骨未见侵蚀性改变及反应性增厚。
MR表现信号均匀者1个,信号不均匀3个,T1WI等信号1个,稍高信号3个;T2WI等信号3个,另外1个病灶由高、低信号两部分组成,病灶内部囊变坏死2个,出血2个,伴流空血管影3个。增强后均匀强化1个,不均匀强化3个,出现脑膜尾征2个(图1)。DWI等信号2个,稍高信号1个,高低混杂信号1个。
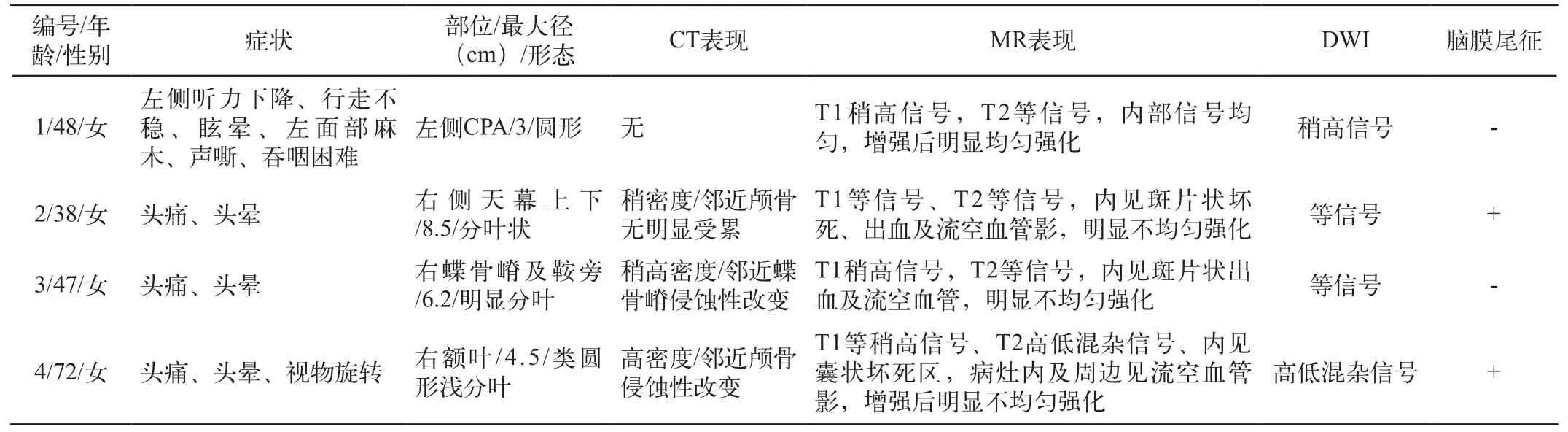
表1 临床症状与影像学表现

表2 免疫组织化学染色结果
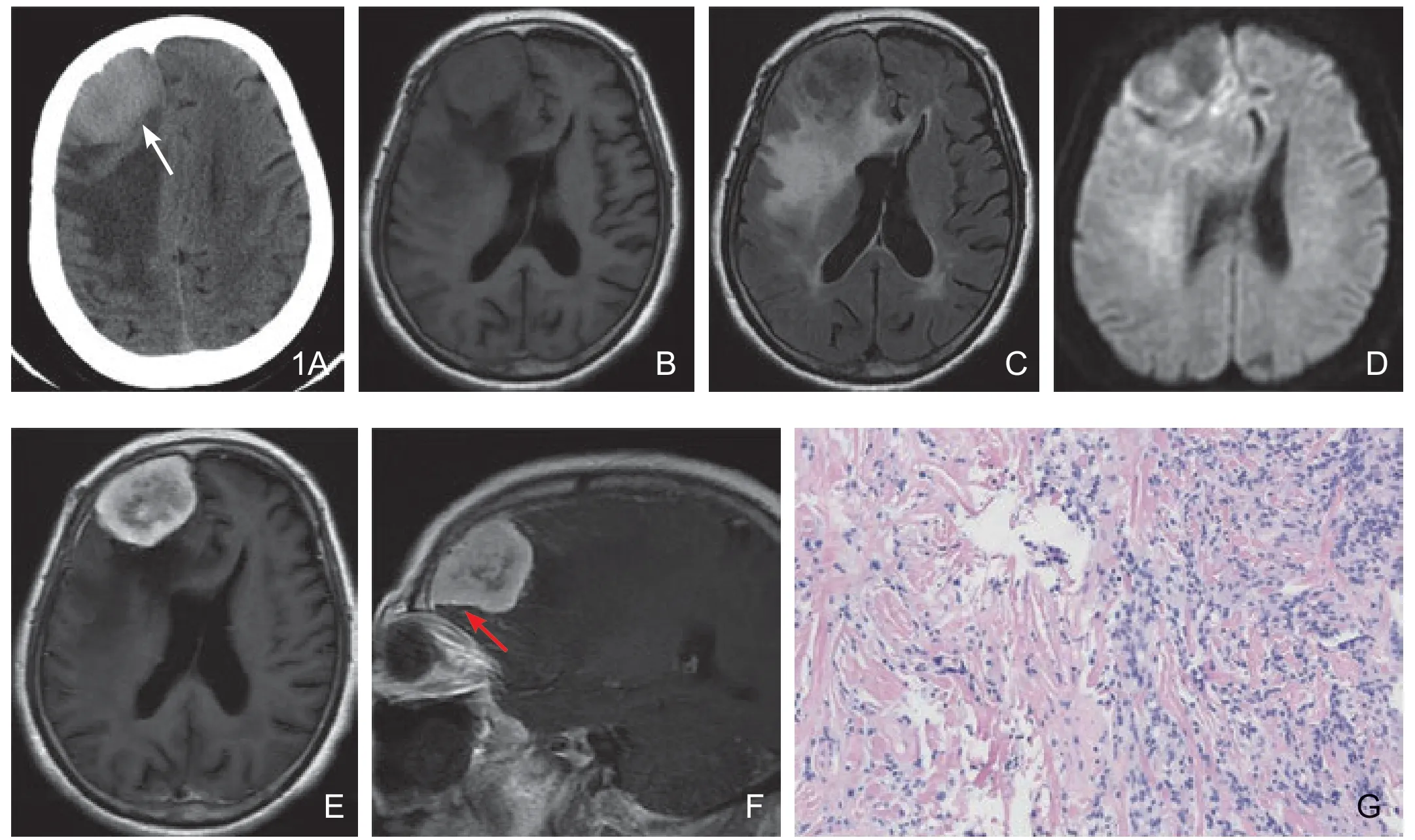
图1 颅内孤立性纤维瘤。CT平扫(A)示病灶位于右额部,呈稍高密度,内见略低密度区,邻近颅骨内板侵蚀性改变(白色箭头);MR平扫T1WI(B)呈等稍低信号,T2FLAIR(C)呈高低不均信号,周围见大片水肿区。DWI(D)示病灶呈高低混杂信号。MR增强后轴位、矢状位(E、F):病灶明显不均匀强化,并见“脑膜尾征”(红色箭头),T2WI低信号区可见强化,呈所谓的“阴阳征”。病理:乏细胞区(G左)见宽大胶原纤维内梭形肿瘤细胞排列稀疏杂乱;富细胞区(G右)见密集杂乱的梭形肿瘤细胞内夹杂部分胶原纤维(HE×100)。
3.免疫组织化学表现
免疫组织化学检查4例CD34及vim均阳性,BCL-2阳性1例,EMA及SMA阴性2例,S-100均为阴性(表2)。其中1例核分裂象约40个/50HPF,诊断为恶性ISFT,1例5~8个/10HPF,诊断为低度恶性ISFT,另外2例未见明显核分裂象,诊断为良性ISFT。
讨 论
1.ISFT的病理学特点
ISFT是一种罕见的间叶源性梭形细胞肿瘤[4],其组织形态学与其他梭形细胞肿瘤相似,大体病理可见肿瘤轮廓规整,常与硬脑膜紧密相连;显微镜下,由富含肿瘤细胞区及乏肿瘤细胞区两部分构成,前者梭形细胞呈束状或不规则状排列,后者可见宽大胶原纤维及分枝状、玻璃样变薄壁血管(图1G)。但仅从病理组织学上,尤其是伊红-苏木素染色很难将ISFT与其他梭形细胞肿瘤相鉴别,近年来,随着免疫组织化学的发展,ISFT得以鉴别:SFT通常高表达CD34、Vimentin、BCL-2,而不表达EMA及S-100[5-6]。
2.ISFT的临床特点
截止到2011年7月,Michele 等[2]总结文献220例中枢神经系统的SFT发现:89.58%的患者年龄在30岁以上,无明显性别差异,临床表现与病灶发生部位及大小有关,常见症状有头痛、头晕、恶心、呕吐、视野缺损、步态不稳、记忆力下降、意识丧失等;发病部位以幕上最为多见(约48%),幕下次之(约32%,其中20%发生在CPA),3例跨天幕生长;病灶最大径超过5cm者约52.63%,大多数类圆形,或分叶状,边界清楚,有完整或部分包膜。本组研究中,发病年龄在38~72岁,平均51岁,皆为女性患者,可能与病例数少有关;病灶位于幕上者2例,幕下者1例,跨天幕生长1例,病灶最大径3~8.5cm,平均5.6cm,大部表现为类圆形或分叶状,皆与文献报道一致。
3.ISFT的影像学表现
CT平扫多表现为等或稍高密度,增强后明显强化,内部钙化罕见,邻近颅骨可有侵蚀性改变[6]。本组有3例行CT平扫检查,分别呈等、稍高及高密度,这可能与组织构成有关,高密度可能与富含梭形细胞,且排列紧密有关,而等稍高密度则可能夹杂部分胶原纤维成分。3例均未见钙化,2例邻近颅骨呈侵蚀性改变,1例未见明显颅骨骨质改变。
MR 多数T1WI等信号,T2WI低信号,且T2WI信号不均匀[7],本组病例T2WI大部分(3/4)呈高低混杂信号,这可能与肿瘤内部组织结构、出血及坏死有关,肿瘤内及周围可见迂曲流空血管影,提示ISFT富血供,这与其他脑膜上皮来源的肿瘤(如脑膜瘤)不同;另外1例T2WI均匀等信号,可能与肿瘤较小、未出现明显出血坏死及组织结构中富肿瘤与乏肿瘤细胞区比例相似有关。增强后大部分肿瘤(3/4)呈明显不均匀强化,值得一提的是有1例T2WI由低信号区及高信号区两部分组成,增强后低信号区可见强化,这在既往的文献中被描述为“黑白征”或“阴阳征”(图1C~E),对ISFT诊断有一定的特征性[7-8]。分析其组织病理学发现:T2WI高信号区主要由聚集梭形细胞组成,低信号区主要由胶原基质及纤维成分组成;1例增强后明显均匀强化,可能与肿瘤较小未出现明显出血坏死有关。本研究2例增强后可见“脑膜尾征”,有学者认为无该征象者常常提示ISFT可能[7],但笔者认为“脑膜尾征”出现仅能说明肿瘤与硬脑膜关系密切,不能对硬脑膜来源的肿瘤进行鉴别诊断。
功能MRI目前文献报道极少,Clarencon等[7]发现肿瘤部分结构水分子扩散明显受限,这在脑外其他肿瘤中很少出现,可作为ISFT的一种特征表现。本组有2例部分肿瘤组织在T2WI高信号,DWI高信号,ADC值较低,可能因为该区域肿瘤细胞密集,细胞间隙小,因而水分子扩散受限,这一点可作为ISFT术前影像诊断的一个重要提示线索。
4.ISFT的鉴别诊断
ISFT的影像学特征表现——“阴阳征”对定性诊断很有帮助,如无此征,鉴别将非常困难,只能依赖病理及免疫组化。主要鉴别诊断有纤维型脑膜瘤和HPC。
纤维型脑膜瘤一般密度或信号均匀,邻近颅骨反应性增厚,“脑膜尾征”明显,增强后明显均匀强化,水分子扩散受限不明显,免疫组织化学表达EMA和(或)S-100蛋白,而不表达或轻微表达CD34;HPC也可出现骨质侵蚀与流空血管影,但其更具侵袭性,且可引起硬膜静脉窦闭塞[9]。有学者认为HPC应归为富梭形细胞的SFT[4],也有学者认为两者不同,HPC更具侵袭性,更易复发及转移[10]。HPC 通常轻微、灶性表达Vimentin及CD34[11]。
总之,ISFT很少见,当脑外占位呈分叶状,邻近颅骨侵蚀性改变,T2WI信号不均匀,增强后明显不均匀强化,尤其是出现典型的“阴阳征”,肿瘤部分结构扩散明显受限时应想到ISFT的可能性,但其确诊仍依赖病理组织学及免疫组织化学。
[1]Klemperer P,Rabin CB.Primary neoplasms of the pleura:a report of five cases.Arch Pathol,1931,11:385-412.
[2]Michele B,Carlos G,Giuseppe G,et al.Solitary Fibrous Tumor of the Central Nervous System:A 15-year Literature Survey of 220 Cases(August 1996-July 2011).Adv Anat Pathol,2011,18:356-392.
[3]余水莲,满育平,马隆佰,等.颅内孤立性纤维瘤的影像表现.中华放射学杂志,2012,46:489-493.
[4]Gengler C,Guillou L.Solitary fibrous tumour and haemangiopericytoma:evolution of a concept.Histopathology,2006,48:63-74.
[5]Teranishi K,Yamamoto T,Nakao Y,et al.Recurrent solitary fibrous tumor of the falx cerebri with intraventricular extension:case report.Neurol Med Chir,2007,47:269-272.
[6]Weon YC,Kim EY,Kim HJ,et al.Intracranial solitary fibrous tumors:imaging findings in 6 consecutive patients.Am J Neuroradiol,2007,28:1466-1469.
[7]Clarencon F,Bonneville F,Rousseau A,et al.Intracranial solitary fibrous tumor:imaging findings.Eur J Radiol,2011,80:387-394.
[8]Sa G,Bonneville F,Poirier J,et al.Giant solitary fibrous tumour of the meninges:MR-pathological correlation.J Neuroradiol,2006,33:343-346.
[9]Osborn AG,Blaser SI,Salzman KL.Diagnostic imaging:brain.Utah,USA:Salt Lake City;2007
[10]Mekni A,Kourda J,Chelly I,et al.Hemangiopericytoma in the central nervous system:a study of eight cases.Neurochirurgie,2008,54:15-20
[11]Yilmaz C,Kabatas S,Ozen OI,et al.Solitary fibrous tumor.J Clin Neurosci,2009,16:1578-1581.
