氧化损伤与遗传毒性的检测研究概况
2015-01-20吕惠萍菏泽学院化学化工系山东菏泽274000
吕惠萍,朱 琪 (菏泽学院化学化工系,山东菏泽 274000)
氧化损伤与遗传毒性的检测研究概况
吕惠萍,朱 琪 (菏泽学院化学化工系,山东菏泽 274000)
概述了氧化损伤与遗传毒性的分子毒理学评价手段。简单介绍和讨论了活性氧自由基(ROS)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽解毒酶(GST)、丙二醛含量(MDA)、DNA损伤等生物学指标在毒理学领域的研究现状,重点探讨了彗星实验技术(SCGE)在检测遗传毒性方面的应用情况。
活性氧化基;抗氧化酶系;解毒酶;丙二醛;SCGE
在毒理学领域,传统的毒性测定方法对于判定污染物对生物的毒性效应必不可少,但已不能满足评价和预测外来污染物对环境生物的早期毒害情况的需求。已有的数据大多集中在污染物对指示生物的急性毒性、慢性毒性以及对生物的繁殖行为、生长情况的影响。但是,由于环境中污染物的浓度增加而引起的生物死亡、生长受阻,繁殖能力下降导致的生态系统破坏,已属于污染的晚期影响。并且,在污染早期,许多污染物含量都较低,达不到致死或影响生物生长的水平。因此,采用更加敏感的研究手段有利于预防早期污染。
在污染物进入环境后,对生物的作用开始在个体的分子水平上,然后在细胞、器官、个体、种群、群落、生态系统等各个水平上显现出来[1]。所以,要分析污染物在各个水平和预测少量污染物对个体的潜在影响,尽早避免或减轻环境污染具有重要意义[2]。一些污染物在生物体内的代谢反应中会导致体内活性氧自由基增多,产生氧化应激。生物体自身的生化反应如酶类参加的反应会降低污染物的产生,反之,过量的自由基会对生物大分子如酶类、脂质、蛋白质、DNA造成损伤。污染物对生物体的氧化损伤和遗传毒性已成为毒理学领域中的一个研究热点,也是能够早期预测污染物的生态毒性效应的一个重要方面。该研究简要论述了氧化损伤与遗传毒性的分子毒理学评价手段的最新进展、发展趋势、研究热点以及应用情况。
1 活性氧自由基(ROS)概述
1.1 ROS的产生ROS是生物体内生理性氧的代谢产物,在线粒体呼吸链部位由单电子传递给氧而产生,是引起蛋白质氧化损伤的重要因素。ROS具有很强的化学活性,主要包括超氧阴离子(O2-)、羟自由基(·OH)、过氧化氢(H2O2)和脂质过氧化物的中间产物——烷氧自由基、烷过氧自由基等[3]。许多疾病、生命的衰老(特别是衰老性疾病)都涉及活性氧自由基反应。近年来,活性氧的检测及抗氧化药物的筛选在多个领域受到高度的重视。
ROS在生物体内的产生过程主要有酶反应和非酶反应,其中ROS产生的主要途径是与线粒体呼吸链有关的酶的反应,而且这些ROS可以被机体所利用,显示出十分重要的生理功能。Chance等[4]证明,产生ROS的重要场所是线粒体。在正常的生理情况下,线粒体需要消耗约2%的氧产生的ROS,由呼吸链底物端释放出电子还原氧分子单电子,产生ROS的前体——超氧阴离子和过氧化氢。另外,一些外源性污染和刺激也能够导致机体内ROS的增加。有研究表明,温度、含氧量、盐度、过渡金属离子、农药等因素都能够诱导水生生物体内的ROS[5]。朱茂祥等[6]用一系列剂量的γ射线照射细胞,细胞内ROS显著的增加。Song等[7]发现,六氯苯或过氯苯可以引起鲤鱼肝脏和大脑的氧化应激状态。虽然六氯苯作为一种持久性有机污染物已被斯德哥尔摩公约在全球范围内禁止使用,但由于很多是工业过程的副产品,仍然持续地向环境中释放。六氯苯引起机体ROS的增加,有两个原因:一是作为脂溶性化合物,它可以与细胞色素结合而不易代谢,如此便拆开单加氧酶反应的电子转移链,结果有利于活性氧自由基的产生;二是六氯苯的主要代谢物五氯苯酚是潜在的ROS产生源。
1.2 ROS的清除在正常的生理条件下,机体产生和清除ROS处于一个相对平衡的状态。但是,在特殊生理条件或在外界的刺激下,体内ROS会不同程度地增加。生物体自身的代谢过程可以清除ROS,维持平衡状态。
生物体内ROS清除剂包括以下两类物质:一类是在抗氧化条件下,机体本身具有的酶系统和抗氧化剂;另一类是在病理条件下,加入外源抗氧化酶和抗氧化剂。抗氧化酶有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSP-Px)、谷胱甘肽硫转移酶(GST)等。抗氧化剂主要有以下3种:一类是水溶性抗氧化剂,包括N-乙酰半胱氨酸、白蛋白、VC等;另一类是脂溶性抗氧化剂,包括金属络合物、VA、VE、激素类、胆红素等;另外,硒、铜、锌等微量元素也可以间接地清除ROS。研究表明,ROS最强清除剂是番茄红素[8]。VE作为天然的脂溶性抗氧化剂,对保护生物膜、脂溶性蛋白免受氧化损伤也有重要的作用[9]。
1.3 ROS的生物学意义生物体产生的ROS可以被机体所利用,并发挥十分重要的生理作用。首先,ROS可以参与核苷酸的还原、胶原蛋白合成、凝血酶原的合成等。而且,ROS可以参与杀菌和体内解毒。其次,ROS是机体细胞、组织、器官的产生和生长的重要信号分子。Sauer等[10]研究表明,ROS能促进胚胎心脏的生长和分化,同时ROS清除剂可抑制心肌的正常生长发育。Huang等[11]研究发现,如果将ROS的清除剂如乙酞水杨酸、N-乙酞半肤氨酸等用在铬(VI)诱导的细胞凋亡中,那么会使凋亡的细胞减少。
过量的ROS会导致细胞损伤或细胞凋亡。ROS的活泼性和氧化反应能力都很强,能通过氧化作用攻击细胞的生物大分子物质(核酸、蛋白质、糖类、脂质)。过量的ROS可与脂质分子发生过氧化反应,使得破坏细胞膜的通透性遭到破坏,而且可以使蛋白和蛋白酶变性或失活;或者通过碱基修饰损伤DNA,进而影响基因的表达。有研究表明,ROS与脂质分子的过氧化作用形成大量的脂氢过氧化物,对人体正常肺细胞中的蛋白质和DNA等生物大分子造成损伤。
1.4 ROS的检测自由基具有性质活泼和反应性强的特点,既易还原又易氧化,其本身并不稳定。其检测手段有以下几种:电子自旋共振法(ESR)、高效液相色谱法、气相色谱法、化学发光法、荧光分析法、分光光度法以及电化学方法。但是,这些检测手段能够直接测定的方法相当有限,所以在环境、医学等领域迫切需要开发直接测定活性氧或其他自由基的检测方法。
2 氧化损伤的生物学指标概述
由于污染物会引起生物体内活性氧自由基的大量产生,直接或间接地导致酶变性失活或诱导其活性增强。过量的ROS也能与脂质发生过氧化反应产生MDA,进一步损伤生物大分子,破坏遗传物质。已有的研究常用抗氧化酶活性、解毒酶活性、脂质过氧化产物——丙二醛(MDA)、ROS、DNA损伤等指标评价污染物引起的氧化损伤程度[12-13]。
2.1 抗氧化酶系需氧生物为了阻止氧化损伤,机体形成有效的保护机制,做出相应的改变来适应外界环境。抗氧化酶能够减缓氧化的速度,使生物体内活细胞产生催化剂,其中抗氧化酶系统在这种保护机制中起重要作用。抗氧化酶系统主要包括超SOD、CAT、过氧化物酶(POD)。
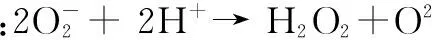
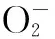
POD也被认为是生物保护酶之一,在许多植物和动物中普遍存在。POD通过一个二质子、二电子还原过程催化过氧化氢对底物AH的氧化:H2O2+ 2AH → 2H2O+ A2。其作用是催化过氧化氢与对各种有机物和无机物氢供体之间的氧化反应,具有消除过氧化氢和酚类、胺类毒性的双重作用[17]。SOD的存在可以保护CAT、POD酶免受超氧阴离子的损害,同时CAT和POD可以清除SOD催化生成的过氧化氢。三者互相保护,并且共同抵御外界引起的氧化胁迫压力,组成了一个完整的防氧化链条。
2.2 解毒酶——谷胱甘肽-S-转移酶(GST)GST是广泛存在于生物体内的一类多功能同工酶,是谷胱甘肽结合反应的关键酶,催化谷胱甘肽结合反应的起始步骤,主要存在于胞液中。它能够起到解毒和消除自由基的双重功能,避免生物大分子受到损伤。GST的功能之一是催化亲电子类物质与GSH的巯基的结合,包括过氧化物、A,B-不饱和醛酮、烷基或芳香基化合物等物质。GST的普遍底物是2,4-二硝基氯苯(CDNB),CDNB与GSH结合生成S-2,4-二硝基苯谷胱甘肽。GST作为Ⅱ相解毒酶,在机体处于氧化胁迫条件下参与清除过量的ROS。这是抵御氧化损伤的一种机制[18]。另外,GST也可以与一些疏水性强的物质结合如血红素、胆酸、染料、激素等,使之亲水性增强,通过代谢排出体外[19]。在GST发挥其解毒作用的同时,自身的活性会受到外源物质的影响。有研究表明,微粒体GST第49位半胱氨酸的巯基可以与过氧化氢、烷化剂等特异性结合,使得GST的活性增强[20]。
2.3 丙二醛(MDA)MDA分子式为OHC-CH2-CHO,分子量为72.06,是脂质过氧化反应的终产物。自由基和脂质物质发生过氧化反应,其产物为具有细胞毒性的MDA。它可引起蛋白质、核酸等生命大分子的交联聚合反应。发生脂质过氧化反应多是由于机体产生的ROS与生物膜中的多不饱和脂肪酸发生作用。这可以降低膜脂的流动性,减少膜的不饱和脂肪酸,并且生成过氧化产物。脂质过氧化作用具有极大的危害性。它可通过链式反应放大ROS的作用,把活性氧转变为非自由基的质类分解产物。这些分解产物有的无害,有的则能导致功能及细胞代谢障碍,甚至细胞死亡。
因此,ROS引起的生物膜的脂质过氧化作用的危害表现在两个方面。一是生物膜的流动性降低,正常的运输吸收功能受阻;二是脂质过氧化产物(如丙二醛)可与蛋白质、核酸等生命大分子发生多肽链的链内交联和链间交联,改变其正常的结构和功能导致代谢异常,具有细胞毒性。测定机体组织中MDA含量,可以从侧面反映出脂质过氧化程度,也是作为探索细胞损伤原因的一个重要方面[21]。
3 单细胞凝胶电泳(SCGE)概述
单细胞凝胶电泳具有周期短、敏感度高等优点,被广泛应用于肿瘤发病机理、环境检测、辐射生物学、遗传毒理、诊疗、衰老和细胞凋亡机理的研究等方面。
3.1 DNA损伤及其检测方法DNA 是由反向平行的两条多聚核苷酸链构成的稳定的双螺旋结构,其内部的碱基序列按碱基配对原则相互结合。碱基的种类、数量以及排列次序决定DNA分子所携带的遗传信息。DNA稳定的双螺旋结构可维系细胞和生物体的生命,保障生物体的生命特征得以传承。但是,生物体内部及外部的很多因素均可能造成DNA分子结构的异常即DNA损伤[22]。通常所说的DNA损伤是指一级结构发生变化,其中包括碱基烷基化、碱基异构化、碱基丢失、碱基脱氮、链的断裂、DNA交联等。DNA损伤可以被生物体自身的一套完善的修复系统极大限度地修复,而未被修复的极少量DNA损伤是导致机体产生疾病、衰老及物种变异的原因[23]。
引发DNA损伤的因素分为物理因素和化学因素。物理因素包括高温、紫外线和电离辐射等,如紫外线可能会导致RNA的转录停止和DNA复制停止等。电离辐射可直接导致成DNA链的断裂损伤,也可以间接损伤DNA。在引起DNA损伤的因素中,化学因素占很大一部分,其中包括农药、重金属离子、碱基分子结构的改变产生的各种自由基都可以直接导致DNA损伤。
用于检测DNA断链和交联的技术有碱洗脱技术和单细胞凝胶电泳技术。用于检测DNA加和物的技术有吸收光谱移动法和色谱、质谱联用法、荧光光谱测定法、32P后标记法、免疫法等。其他综合性检测方法有变性高效液相色谱分析、变性梯度凝胶电泳、姐妹染色单体交换分析、切割酶片段长度多态性分析、DNA芯片技术等。
单细胞凝胶电泳技术(SCGE),也称彗星实验(Comet assay),指单细胞水平上检测真核细胞DNA的损伤与修复的荧光检测方法,具有原位、快速、简单、灵敏度等特征,被广泛应用于环境生物监测、生物学、毒理学、医学等领域,也常作为生物标志物分析环境污染的生物学效应。其原理是先在强碱溶液的作用下将琼脂中的细胞裂解。裂解作用主要是使膜结构的稳定力遭到破坏,膜内的RNA、蛋白质和其他成分溶解,从而进入电解液中,但是DNA分子不能进入溶液中,仍在原位。高pH的解旋液促进DNA的变性和解旋,使得双链容易变成单链、RNA全部水解。目前,常用的裂解液pH在13以上[24],在此条件下DNA单链断裂、碱性不稳定点、DNA交联、DNA与蛋白质交联以及不完全切除修复位点等损伤均能被检测到。解旋后断裂DNA片段的缺口部分阴电荷暴露了出来,受到外界电场力的作用,迫使从细胞核中迁移,并且向阳极移动,从而形成彗星图像尾部;完好的DNA则仍在细胞核中,形成彗星图像中心。所以,含DNA链的缺口越多,彗星图像尾部的DNA越多,实验图像中彗星尾部的荧光强度越高,尾长越长。彗尾的长度和DNA含量可以反映DNA损伤的大小。目前,主要用彗星尾长、尾部DNA含量、Olive尾距3个参数来评价损伤程度。
3.2 SCGE及其在检测遗传毒性方面的应用研究表明,在遗传毒性产生前可能有DNA 损伤域值。彗星实验有助于探索毒物对DNA的直接损伤、DNA或染色体突变的可能性[25]。1999年3月25~26日国际遗传毒性检测程序工作会议(IWGTP)上碱性彗星实验被认为最适合用来检测各种物质的遗传毒性。研究证实,SCGE 是研究低剂量遗传毒理效应的有效工具,相比于其他DNA损伤检测技术(如姐妹染色单体实验),在相对较低的毒物浓度下就可能发生显著的DNA的断链[26]。彗星实验证明,草甘磷和阿特拉津等除草剂可使牛蛙的红血球细胞产生DNA损伤[27]。Mitchelmore等[28]发现,硝基芘和苯并[a]芘在虹鳟鱼的肝细胞中能够导致DNA损伤,有彗星现象,但是不能在红细胞中发生。彗星实验还证明,杀虫剂马拉硫磷的主要代谢物马拉氧磷和它的异构体对人血细胞的DNA损伤作用存在剂量-效应关系[29]。
4 结语
通过对氧化损伤与遗传毒性的生物学指标的全面评价和综合分析,发现检测这些指标是毒理学领域的研究重点,因此新技术、新方法不断涌现,并且在毒理学研究中得到成功应用,尤其是单细胞凝胶电泳检测法的应用。因此,在环境、医学等众多领域,需要开发选择性专一和灵敏度高的检测氧化损伤与遗传毒性的生物学指标方法
[1] 赵于丁,徐敦明,范青海,等.生物标志物在农药水生态毒理学中应用的进展[J].江苏农业学报,2009,25(1):203-209.
[2] 董璐玺,谢秀杰,周启星,等.新型环境污染物抗生素的分子生态毒理研究进展[J].生态学杂志,2010,29(10):2042-2048.
[3] CHAUHAN D,PANDEY P,OGATA A,et al.Cytochrome c-dependent and-independent induction of apoptosis in multiple myeloma cells[J].Journal of Biological Chemistry,1997,272(48):29995-29997.
[4] CHANCE B,SIES H,BOVERIS A.Hydroperoxide metabolism in mammalian orgns[J].Physiological Reviews,1979,59(3):527-605.
[5] LUSHCHAK V I.Environmentally induced oxidative stress in aquatic animals[J].Aquatic Toxicology,2011,101:13-30.
[6] 朱茂祥,杨险华,龚治芬.辐射诱发细胞内ROS增高与DNA氧化损伤研究[J].辐射研究与辐射工艺学报,2001,19(4):270-273.
[7] SONG S B,XU Y,ZHOU B S.Effects of hexachlorobenzene on antioxidant status of liver and brain of common carp(Cyprinuscarpio)[J].Chemosphere,2006,65(4):699-706.
[8] 郑荣梁.生物自由基[M].北京:高等教育出版社,1992.
[9] PACKER L.Protective role of vitamin E in biological systems[J].The American Journal of Clinical Nutrition,1991,53(4):1050-1055.
[10] SAUER H,RAHIMI G,HESUHELER J,et al.Role of reactive oxygen species and phusphatidyinositol 3-kinase in carfiomyocyte differentiation of embryonic setm cells[J].FEBS Letters,2000,476(3):218-221.
[11] HUANG C,DING M,LI J,et al.Vanadium-induced nuclear factor of activated T cells activation through hydrogen peroxide[J].Journal of Biological Chemistry,2001,276(25):22397-22403.
[12] LIN D S,XIE X J,ZHOU Q X,et al.Biochemical and genotoxic effect of triclosan on earthworms(Eiseniafetida)using contact and soil tests[J].Environmental Toxicology,2012,27(7):385-392.
[13] ZHU L S,DONG X L,XIE H,et al.DNA damage and effects on glutathione-stransferase activity induced by atrazine exposure in zebrafish(Daniorerio)[J].Environmental Toxicology,2011,26(5):480-488.
[14] FRIDOVICH I.Superoxide radical and superoxide dismutases[J].Annual Review of Biochemistry,1995,64(1):97-112.
[15] 毛玉霞,郑洪,郭祥群,等.过氧化氢酶荧光分析法及其在海洋水生生物酶活力测定中的应用[J].高等学校化学学报,2002,10(23):1864-1867.
[16] 李毅平,龚和.昆虫体内抗氧化系统研究进展[J].生命科学,1998,10(5):240-243,221.
[17] CHANCE B,MACHLY A C.Assay of catalase and peroxidases.Methods in Enzymology[M].New York:Academic Press, 1995:764-775.
[18] WU Y Q,WANG C G,WANG Y,et al.Antioxidant responses to benzo[a]pyrene,tributyltin and their mixture in the spleen ofSebasticusmarmoratu[J].Journal of Environment Science,2007,19:1129-1135.
[19] BOOTH J,BOYLAND E,SIMS P.An enzyme from rat liver catalysing conjugations with glutathione[J].Biochemical Journal,1961,79(3):516.
[20] SVENSSON R,RINALDI R,SWEDMARK S,et al.Reactivity of cysteine-49 and its influence on the activation of microsomal glutathione transferase 1:evidence for subunit interaction[J].Biochemistry,2000,39(49):15144-15149.
[21] CHEN C,ZHOU Q,LIU S,et al.Acute toxicity,biochemical and gene expression responses of the earthwormEiseniafetidaexposed to polycyclic musks[J].Chemosphere,2011,83(8):1147-1154.
[22] BERWICK M,VINEIS P.Markers of DNA repair and susceptibility to cancer in humans:an epidemiologic review[J].Journal of the National Cancer Institute,2000,92(11):874-897.
[23] TAKATA M,SASAKI M S,SONODA E,et al.Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells[J].The EMBO Journal,1998,17(18):5497-5508.
[24] SINGH N P,MCCOY M T,TICE R R,et al.A single technique for qunatification of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988,175(1):184-191.
[25] MANIVE I,GODARD T,DOERGE D R,et al.DNA damage and DNA adduct formation in rat tissues following oral administration of acry-lamide Isabelle[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2005,580:119-129.
[26] 衡正昌,张遵真.二氯胺基酚对 V79 细胞 DNA 损伤效应的研究[J].卫生毒理学杂志,1997,11(2):87-89.
[27] CLEMENTS C,RALPH S,PETRAS M.Genotoxicity of select herbicides in Rana catesbeiana tadpoles using the alkaline single cell gel DNA electrophoresis(Comet)assay[J].Environmental and Molecular Mutagenesis,1997,29(3):277-288.
[28] MITCHELMORE C L,CHIPMAN J K.DNA strand breakage in aquatic organisms and the potential value of the comet assay in environmental monitoring[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,1998,399(2):135-147.
[29] BLASIAK J,JALOSZYNSKI P,TRZECIAK A,et al.Invitrostudies on the genotoxicity of the organophosphorus insecticide malathion and its two analogues[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,1999,445(2):275-283.
General Situation of Research on Oxidative Damage and Genetic Toxicity Detection
LV Hui-ping, ZHU Qi
(Department of Chemistry and Chemical Engineering, Heze University, Heze, Shandong 274000)
The molecular toxicology evaluation methods on oxidative damage and genetic toxicity were reviewed. The research status of biological indicators(ROS, SOD, CAT, POD, GST, MDA, DNA damage) in the field of toxicology were introduced and discussed, focusing on the application of Single Cell Gel Electrophoresis (SCGE) in the detection of genetic toxicity.
ROS; POD; GST; MDA; SCGE
吕惠萍(1985- ),女,甘肃靖远人,助教,硕士,从事化学方面的研究。
2015-03-30
R 394.6
A
0517-6611(2015)14-007-03
