紫外辐射对菹草成株生理特性的影响
2015-01-19王锦旗郑有飞
王锦旗, 郑有飞, 薛 艳
1 南京信息工程大学应用气象学院, 南京 210044 2 江苏省环境演变与生态建设重点实验室, 南京 210023 3 南京信息工程大学大气物理学院, 南京 210044 4 南京信息工程大学环境科学与工程学院, 南京 210044
紫外辐射对菹草成株生理特性的影响
王锦旗1,2,*, 郑有飞3, 薛 艳4
1 南京信息工程大学应用气象学院, 南京 210044 2 江苏省环境演变与生态建设重点实验室, 南京 210023 3 南京信息工程大学大气物理学院, 南京 210044 4 南京信息工程大学环境科学与工程学院, 南京 210044
研究不同剂量UV-B辐射下菹草生理特征变化,在光合有效辐射、UV-A辐射一致的条件下,对菹草进行不同剂量UV-B辐射,测定菹草叶片光合色素含量及生理生化指标。结果表明:≤10.8 kJ/m2剂量辐射可促进叶绿素及类胡萝卜素含量增加,衰亡阶段起抑制作用,>10.8 kJ/m2一直起到抑制作用,且随剂量的增加,抑制作用增强;UV-B辐射初期可促进过氧化氢酶(CAT)、过氧化物(POD)酶活性及丙二醛(MDA)含量升高,且随辐射剂量增加而逐渐升高,但随辐射时间延长,CAT、POD酶活性、MDA含量均有所降低,超氧化物歧化酶活性随辐射时间延长逐渐升高,且随辐射剂量增加而增加;短期辐射可促进叶片可溶性蛋白质和可溶性糖的合成,其含量随辐射剂量增加而升高,长期辐射起抑制作用,且随辐射剂量增加,抑制作用增强。因此,春末夏初野外强UV-B辐射可能是促进菹草大批衰亡的重要原因。
UV-B辐射; 光合色素; 抗氧化酶系统; 膜脂过氧化产物; 光合产物
菹草(Potamogetoncrispus)是眼子菜科多年生沉水草本植物,世界广布[1],是一种典型的秋季萌发、越冬生长的沉水植物,主要分布在淡水湖泊、池塘、稻田、河流等水域[2]。菹草作为冬春季沉水植物的优势种,对水体中的氮、磷等营养盐有吸收作用,在净化水质、改善水环境质量、提高水体透明度、抑制藻类生长等方面均有显著作用[3],在维持水生生态系统的平衡与健康有重要意义[4]。野外菹草生长特性表现为春季生长迅速、夏初死亡,其衰亡的原因一直是很多学者研究的重点。研究认为强光照是造成菹草春末夏初大量衰亡的原因,在生长早期,光照一般不会对水下菹草生长产生抑制;而到后期,强日照日数增多,菹草经春季快速生长已到达水表,水表强烈光照将对菹草生长、生存产生剧烈抑制作用,进而促进菹草衰亡[5]。那么强光照中到底是什么波段真正起作用的呢?对比江苏省水环境中试平台温室内外光照差异不难发现,温室内外光照差异不大,但紫外辐射明显减弱,尤其以UV-B减少明显(仅为室外2%—5%),而PAR(光合有效辐射)、UV-A差异较小。UV-B辐射不仅能抑制陆生植物的生长,而且对水生生物有较大的危害,研究发现,对生物有危害的UV-B辐射在一些海域可深入水下几米,甚至几十米[6-7]。在长江中下游湖泊中对生物有害的紫外辐射基本上能到达湖底[8-9]。在一些UV-B对水生生物伤害研究中,UV-B可引起叶片氮含量、可溶性蛋白及1,5-二磷酸核酮糖酶含量的下降[10]。
因此,研究UV-B对菹草生理特性的影响,对研究春末夏初阳光中UV-B增强对菹草衰亡的影响,探索菹草衰亡机制,对控制湖泊水华爆发具有一定意义。
1 材料与方法
1.1 实验地点选择
实验地点选择在江苏省环境工程重点实验室水环境生态修复中试平台(32.11°N, 118.91°E)玻璃温室内。经几多次随机测量,玻璃温室内PAR为室外的80%—85%,UV-B透过率仅为2%—5%(室外最低10 μW/cm2,室内最低2.8 μW/cm2;室外最高103.0 μW/cm2,室内最高4.8 μW/cm2),UV-A透过率60%—70%(室外最低139.5 μW/cm2,室内最低95.7 μW/cm2;室外最高1049.0 μW/cm2,室内最高634.7 μW/cm2)。
1.2 实验设计
将采集的菹草成株种植于上口直径18 cm、下口直径12.5 cm、高15 cm的花盆中,每个花盆种植约15—20株(分枝)。为减少底泥带来的营养盐差异,在花盆底部铺设少量泥土加碎石细沙以固着菹草植株根部。将上述花盆置于上口直径64 cm,高72 cm,下底直径52 cm的白色塑料水桶中,桶容量为200 L。
将培育好的菹草植株种植于水桶中,分别设3组平行,桶上方用120 cm不锈钢支架悬挂UV-B灯管。UV-B灯管采用南京华强特种光源厂生产的纯UV-B灯管(40 W,主峰313 nm)。
1.3 UV-B剂量设定
以南京信息工程大学农业气象站2004年及2008年4—8月实际测量的全天UV-B剂量的平均值为参照(采用监测的仪器及传感器与本实验一致),通过SpectroSense2 (英国SKYE公司)连接SKU 430UV-B传感器(280—315 nm)测定UV-B剂量,设定4个UV-B剂量梯度,最高剂量不超出南京地区4—7月实际UV-B剂量日均值。其中,对照组水桶上方用125 μm聚酯薄膜以过滤温室中少量的UV-B辐射,使其接受到的UV-B辐射为0,仅接受UV-A及PAR,记作R0,其余组通过调节悬挂灯管粗细及微调悬挂高度,使水面处剂量分别为50、100、150、200 μW/cm2,分别记作R50、R100、R150、R200,每日UV-B灯管照射时间为6h(9:00—15:00),其累积UV-B辐射量分别为10.8、21.6、32.4、43.2 kJ/m2。对照组通过调节滤膜厚度及倾斜角度,使其与各处理组接受可见光基本一致。由于实验水体为自来水加人工配置营养液,故UV-B透过性较高,各处理组UV-B辐射均可透射至水底。为防止辐射对植株造成急性伤害,以50 μW/cm2为基准辐射剂量,采取每两日增加50 μW/cm2方式缓慢递增,最终调整到设定剂量为止。
1.4 光合色素及生理指标测定
光合色素采用丙酮法,用80%丙酮溶液提取叶片光合色素,用分光光度计分别测定645、663和440 nm处的吸光度;过氧化氢酶(CAT)活性利用紫外吸收法测定,将提取的叶片酶液加入CAT反应体系,测定240 nm波长吸光度降低速度;过氧化物酶(POD)活性采用愈创木酚法测定,将提取的叶片酶液加入POD反应体系,记录470 nm处吸光度增加速度;超氧物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定,取适量叶片提取液,加入反应液,于光照培养箱下(4000 lx)反应,测定560 nm处吸光值;丙二醛(MDA)含量采用硫代巴比妥酸比色法:用5%三氯乙酸提取叶片,离心取上清液,加硫代巴比妥酸在沸水浴中反应30 min,冷却后再离心,取上清液测定532、600 nm和450 nm处吸光度值;可溶性蛋白质(Pr)采用紫外吸收法,取适当的样品提取液,用磷酸缓冲液适当稀释后,读取280 nm和260 nm波长吸光度;可溶性糖(SC)采用苯酚法测定:取适量植株样品,加蒸馏水于沸水中提取30 min,提取液分别加入9%苯酚、浓硫酸溶液,显色并测定吸光度[11]。测定的分光光度计为岛津UV3600紫外可见近红外分光光度计。
1.5 测定频率
分别于实验开始、第16天、第24天、第31天的9:00—10:00分别在各平行组采集1、2株植株,取植株顶端完全伸展叶片进行色素及生理指标测定。
1.6 数据分析
试验数据用Excel 软件进行统计分析及图表制作。
2 结果与分析
2.1 UV-B对菹草光合色素的影响
叶绿素含量变化见图1,第16天,各组叶绿素a(Chla)、叶绿素b(Chlb)及总叶绿素(Chlt)含量较开始差异显著(P<0.05),R0及R50组较实验开始Chla、Chlb及Chlt含量有所增加,其中R50组3个指标较实验开始分别升高67.3%、89.1%、73.1%,而R50—R200组随剂量增高而降低;第23天,各组较实验开始差异显著(P<0.05),R0组Chla、Chlb及Chlt含量继续增加,而R50组略有降低,R100—R200组Chla、Chlb及Chlt含量较第16天有所提高,但仍随辐射剂量增加而递减;第31天,R150及R200因辐射死亡,R0—R100组较实验开始时差异不显著(P>0.05),较第23天均有增加,但仍随辐射剂量增加而递减。
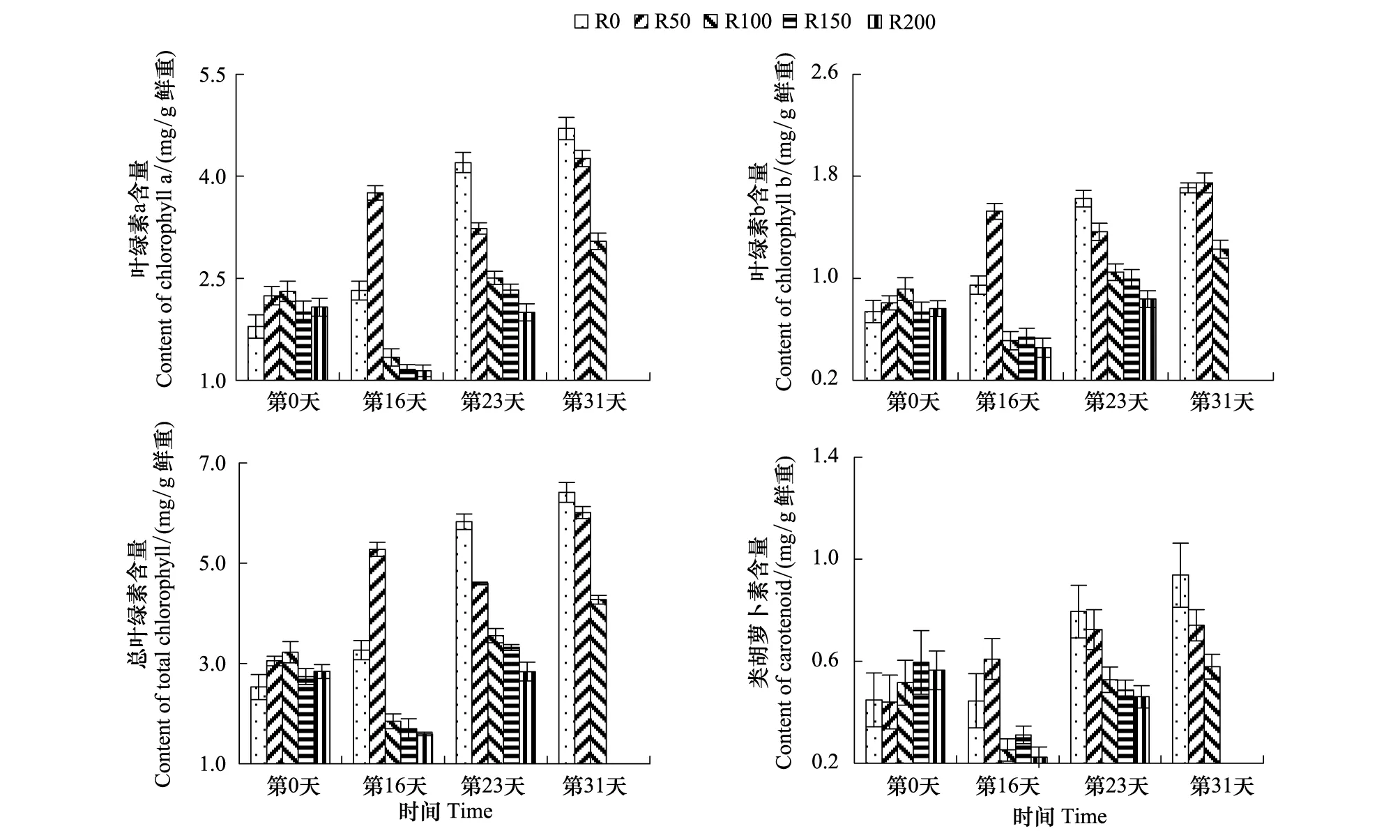
图1 UV-B对菹草成株光合色素含量的影响Fig.1 Photosynthetic pigments content of Potamogeton crispus affected by UV-B radiation* R0、R50、R100、R150、R200代表处理组水面处接受到UV-B剂量分别为0、50、100、150、200 μW/cm2
类胡萝卜素(Car)含量变化见图1,Car变化趋势与叶绿素含量变化基本一致,第16天,各组较开始差异不显著(P>0.05),R50较实验开始有所提高,R0组基本未变,R100—R200大幅下降;第23天,各组较开始差异仍不显著(P>0.05),R0—R200含量随辐射剂量增加而递减,其中R100—R200组差异不大,第31天,R0—R100组较第23天略有增加,但较实验开始差异仍不显著(P>0.05),但仍随辐射剂量增加而递减。
2.2 UV-B对菹草抗氧化系统酶的影响
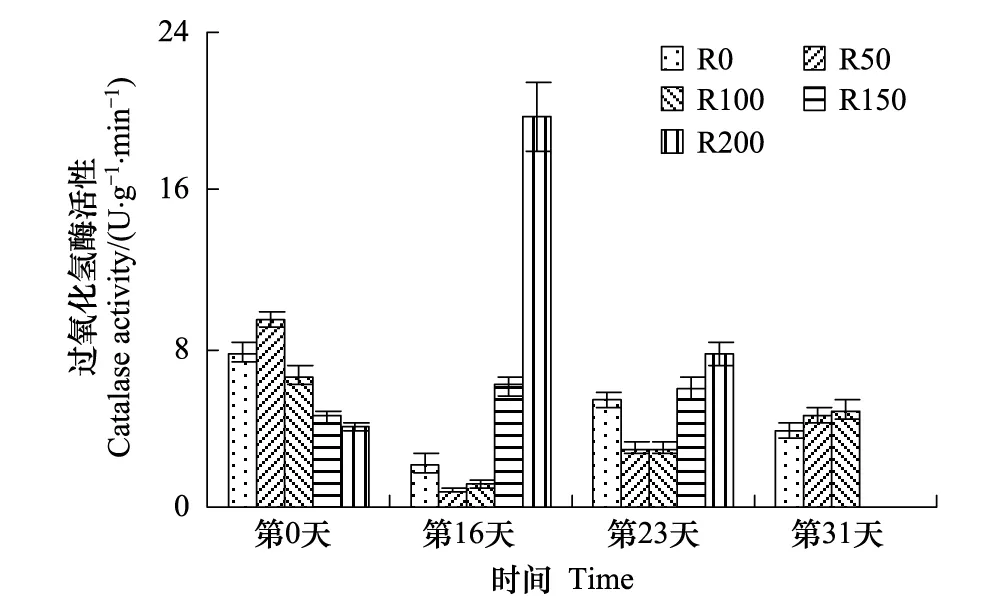
图2 UV-B对菹草成株过氧化氢酶活性的影响 Fig.2 Catalase activity of Potamogeton crispus affected by UV-B radiation
CAT活性变化见图2,实验开始时R0与R50组活性较高,R100—R200依次降低,经过16d辐射后,R50—R200组随辐射剂量增加而递增,且较开始差异显著(P<0.05),R200较R50组高2172.3%,其中R0—R100 组低于实验开始,R150及R200组高于实验开始,分别较开始增加34.3%、383.3%;第23天,R0—R100组较第16天有所升高,但较开始差异不显著(P>0.05),R150及R200组有所降低;第31天,仅余3组CAT活性随辐射剂量增加而增加。
POD活性变化见图3,开始时各组间无显著规律性,经16天辐射后,R0组较开始有所降低,4个辐射组随辐射剂量增大而递增,且较开始差异显著(P<0.05),其中R200较R0组高351.3%,较实验开始高190.5%;第23天,各组较开始差异不显著(P>0.05),其中R0—R150组逐渐升高,而R200组较第16天急剧下降,较第16天降低64.4%;第31天,R0—R100组呈逐渐降低趋势,且较开始差异不显著(P>0.05),R0组升至实验期间最高,R50及R100组则降至实验期间最低。
SOD活性变化见图4,开始各组活性基本相当,经16天辐射后,各组较开始差异极显著(P<0.01),R50—R150组呈逐渐增高趋势,均高于R0,R0、R50及R200组较开始略有降低;第23天,各组SOD活性均显著提高(P<0.01),其中R150组仍保持最高值,R200组较第16天增加281.7%,略低于R150组,R0—R150组仍然呈持续递增的趋势;第31天,R0—R100组较第23天均显著增加(P<0.05),但呈逐渐降低趋势,其中R0组达实验期间最高,较实验开始增加298.5%。
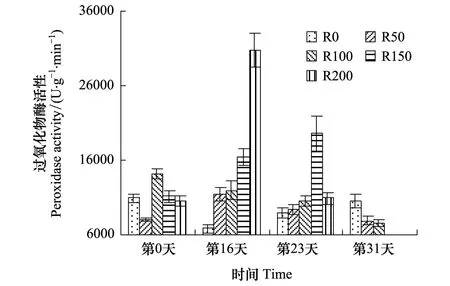
图3 UV-B对菹草成株过氧化物酶活性的影响 Fig.3 Peroxidase activity of Potamogeton crispus affected by UV-B radiation
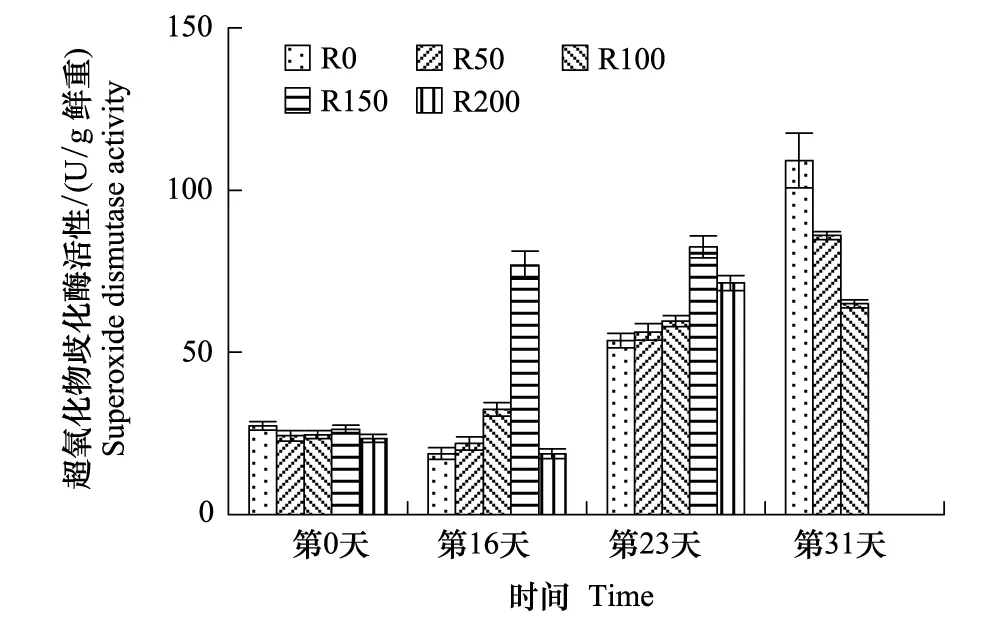
图4 UV-B对菹草成株超氧化物歧化酶活性的影响 Fig.4 Superoxide dismutase activity of Potamogeton crispus affected by UV-B radiation
2.3 UV-B对菹草膜脂过氧化的影响
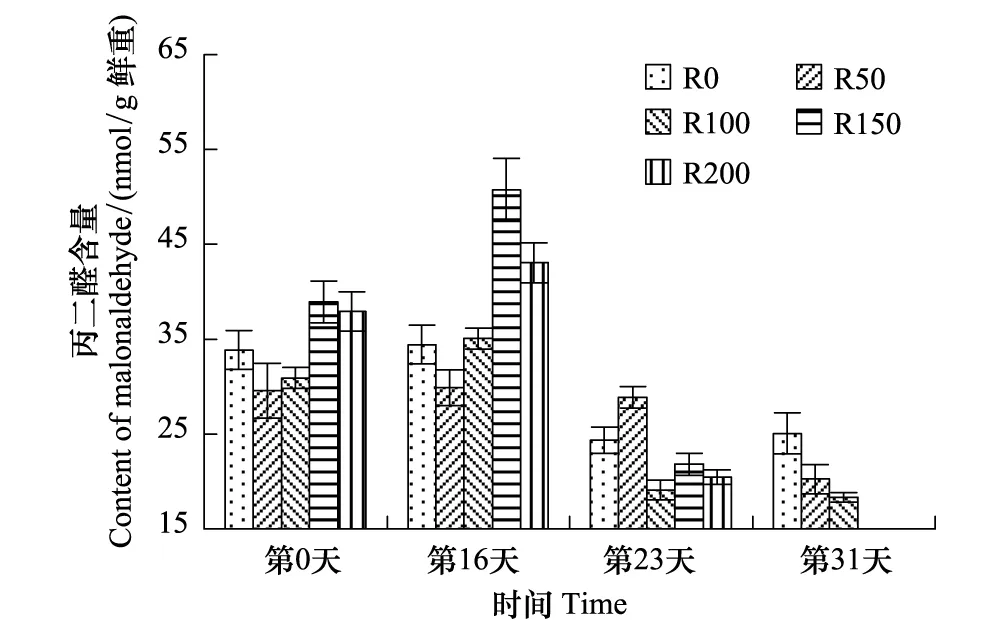
图5 UV-B对菹草成株丙二醛含量的影响 Fig.5 Malonaldehyde content of Potamogeton crispus affected by UV-B radiation
MDA含量变化见图5,开始时R50与R100组含量较低,R150与R200组较高,R0组介于中间;第16天,R0与R50组基本未变,R100—R200组略有升高,但较开始差异不显著(P>0.05);第23天,因植株逐步衰亡,各组含量均有降低,但较开始差异不显著(P>0.05),其中R100—R200组降低较多,分别较第16天降低显著(P<0.05),分别低45.6%、57.0%、52.4%,其含量低于R0与R50组,R0组较第16天低29.2%,R50组略有降低;第31天,随植株逐渐衰亡,R0—R100组呈逐渐递减的趋势,较开始及第23天差异均不显著(P>0.05)。
2.4 UV-B对菹草叶片光合产物含量的影响
Pr含量变化见图6,实验开始时,各组间Pr含量差异较大,且无规律性;经辐射处理后,R0组含量较实验开始略低,而R50—R150组随辐射剂量增加而递增,与实验开始比较,各组差异不显著(P>0.05),其中R100、R150组有所增加,而R50组略有降低,R200组降低28.0%;第23天,各组较开始差异仍不显著(P>0.05),R0含量继续降低,R50—R150组含量基本一致,而R200组持续降低,其含量仅为实验开始的55.1%;第31天,R0—R100组随辐射剂量增加而递减,与第23天相比,R0组略有增加,R50组略有降低,R100组降低33.0%。
SC含量变化见图7,SC含量变化趋势与Pr变化基本一致,实验开始时各组SC含量差异较小,第16天,R0组较实验开始有所增加,4个辐射处理中,R50与R100组较开始略有降低,R150组增加43.1%,而R200组则较开始降低26.7%,R50—R150组随辐射剂量增加而递增;第23天各组含量均有所降低,但较开始差异不显著(P>0.05),R0与R50组高于其他3个处理组;第31天,R150与R200组因辐射较强死亡,R0与R50组基本相当,高于R100组,R100组较实验开始降低56.2%,为实验期间最低,但较开始差异不显著(P>0.05)。
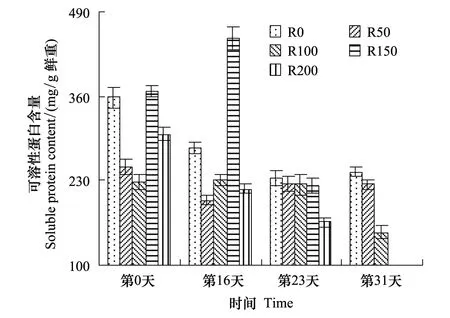
图6 UV-B对菹草成株可溶性蛋白含量的影响 Fig.6 Soluble protein content of Potamogeton crispus affected by UV-B radiation
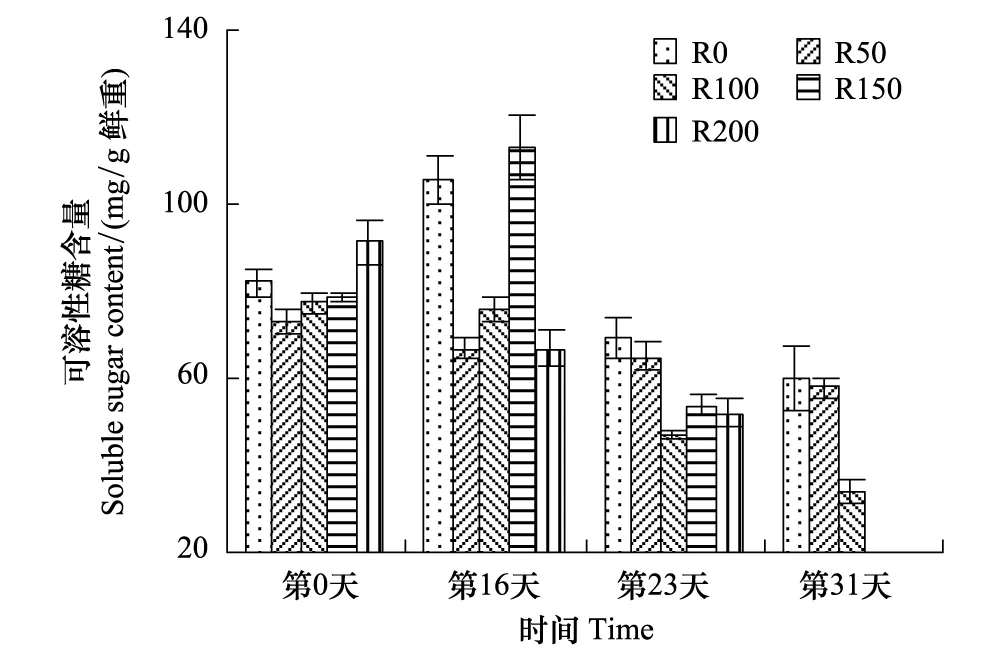
图7 UV-B对菹草成株可溶性糖含量的影响 Fig.7 Soluble sugar content of Potamogeton crispus affected by UV-B radiation
3 讨论
3.1 UV-B辐射对菹草叶片光合色素的影响
叶绿素是光合作用的主要色素,是光能捕捉(吸收)、传递和转换重要结构,叶绿素含量与光合作用紧密相关,其含量高低可反应叶绿体的光能利用率[12]。在植物体内叶绿素含量的多少,在很大程度上决定着光合作用的强弱,并与植物生长和生理状况紧密相关[12]。许多研究证实增强UV-B辐射能降低植株叶绿素含量(包括叶绿素,总叶绿素和类胡萝卜素)[13-14]。但不同植物叶绿素对UV-B辐射的敏感性存在较大差异,而叶绿素含量降低是叶绿素合成受阻,或降解增加,或是二者共同作用的结果[15]。
菹草作为一种沉水植物,在水下主要依靠水体的屏蔽作用抵御阳光中紫外辐射,一旦接近水面,紫外辐射对其伤害立即体现,有研究表明,低剂量UV-B辐射能使LHCII(捕光色素蛋白复合体Ⅱ)中色素分子对能量的吸收明显增强,传递到PS II核心的能量也明显增多,即UV-B辐射作为一种弱胁迫,刺激了光合结构的功能发挥[16],故对菹草成株而言,50 μW/cm2处理在短期辐射下促进光合色素的提高。但高剂量UV-B对植株叶片色素细胞有强烈的漂白效应[17],可能因某些色素蛋白吸收UV-B能量,导致光化学反应使光合色素含量降低[18];或色素被辐射高能量激活,产生活性氧损坏细胞[19];细胞在UV-B作用下产生一些活性氧(ROS)对光合色素进行光化学降解[17]。但类胡萝卜素能与活性氧反应后能够再生,所以类胡萝卜素是在保护UV-B辐射的起重要作用[17],相对而言类胡萝卜素通常比叶绿素的影响要小[20]。基于上述原因,R100至R200组植株接近水面的叶片在高剂量UV-B辐射下,叶片受到伤害,其叶绿素含量显著下降,尤其高于100 μW/cm2处理组出现明显的急性伤害作用,顶端叶片出现明显漂白现象,光合色素含量随辐射剂量增加而逐渐递减。第23天,高于100 μW/cm2组植株顶端受辐射衰亡,植株高度随辐射剂量增加依次降低,故测定的均为新生长出叶片,各项光合色素含量较第16天有所增加,而R50组,植株叶片与其余组一起逐渐进入衰亡期,故光合色素含量较前有所降低,但因辐射伤害较小,光合色素含量仅次于对照组,而其余组抵御辐射能力均降低,随辐射剂量增加光合色素含量下降;第31天,仅余3组植株高度随辐射剂量增加降低,叶片逐渐远离辐射源,实际收到辐射程度减弱,故光合色素含量仍在增加。
3.2 UV-B辐射对菹草叶片抗氧化酶系统的影响
植株体内活性氧产生与清除的代谢系统发生变化,严重时会失调,导致活性氧在体内的过量积累,从而对植物造成伤害[21-22]。但植物在遭遇UV-B暴露后,其抗氧化酶系统响应存在一定的差异性[23]。CAT和POD是清除H2O2的重要保护酶,能将H2O2分解为O2和H2O,从而使机体免受H2O2的毒害作用,其活性与植物的抗逆性密切相关。POD是植物体内普遍存在的、活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等都有密切关系,在植物生长发育过程中,它的活性不断发生变化;SOD普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶,能将超氧阴离子自由基歧化为过氧化氢和氧气[24]。菹草在逆境条件下,如重金属胁迫[25]、水体污染[26]、营养盐急性伤害[27],植株体内CAT、POD、SOD活性会出现不同程度升高,但超过一定阈值后,这些酶活性呈下降趋势,UV-B辐射作为一种逆境同样会对菹草叶片抗氧化酶系统产生影响,在UV-B辐射初期,随辐射剂量增加,活性氧增多,为清除活性氧,叶片抗氧化酶系统开始增强,因SOD功能是将产生超氧阴离子自由基歧化为过氧化氢和氧气,故SOD含量也随辐射剂量增加而增加,但其歧化产物加剧叶片中H2O2的含量;CAT与POD均为清除H2O2的重要保护酶,则叶片中CAT、POD增加幅度要超过SOD增幅。在UV-B辐射初期,植株CAT、POD含量达最高,而随辐射进行有所降低,SOD活性随辐射进行能持续升高,各种抗氧化酶随辐射剂量增加而增加,由此说明菹草抗氧化酶系统在UV-B持续辐射条件下受到一定的损伤,植株在剂量较高情况下酶活性出现不可逆转的伤害,最终可导致植株死亡。第16天,由于辐射时间较短,植株出现应急抗逆反应,其CAT、POD均达到监测时期中最高,且随辐射剂量伤害越大,植株抗逆境反应越明显,CAT、POD含量越高,且随辐射剂量迅速升高,SOD随辐射时间延长含量逐渐增高,且随辐射剂量增加而增加,但R200组因辐射剂量过大,超过其承受阈值,伤害最明显,故SOD出现明显降低趋势。随辐射时间延长,植株各项机能下降,产生的活性氧增多,故第23天,CAT、POD较前明显下降,第31天,R150、R200组植株由于辐射剂量过大植株死亡,而其余3组POD、SOD活性均呈逐渐降低趋势,说明由于UV-B伤害植株产生的活性氧增多,植株清除能力下降,而CAT活性虽呈逐渐升高趋势,但与R0组也相差不大。另一重要原因可能为随辐射进行植株顶部叶片逐渐漂白死亡,植株矮化,接受到UV-B辐射减弱,测定的抗氧化酶活性多为植株新顶部的叶片,其活性低于辐射初期活性。
3.3 UV-B辐射对菹草叶片膜脂过氧化产物的影响
脂质分子是相当稳定的,在空气中不易发生氧化作用,可是一旦有活泼自由基存在,就可导致脂质过氧化的发生,在光、某种射线或自由基的作用下,可使脂质分子LH脱去1个氢原了形成脂质自由基L·,此脂质自由基再与氧反应形成脂质过氧自由基LOO·,此过氧自由基再进攻其它脂质分子,夺取其氢原子,再生成新的自由基和脂质氢过氧化物LOOH,此反应叫反复进行,从而导致脂质分子的不断消耗和脂质过氧化物的大量生成[28]。MDA是膜脂过氧化产物之一,其浓度表示脂质过氧化强度和膜系统伤害程度,植物在逆境或衰老条件下,会发生膜脂的过氧化作用,通常利用它作为膜质过氧化指标,表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱[11]。在陆生植物的研究中,UV-B辐射增强可导致膜脂过氧化产物——MDA含量明显升高,同时膜脂脂肪酸组成配比改变,不饱和度指数有所下降,最终仍导致植物体受到伤害[29]。在UV-B辐射下,菹草植株会产生大量过氧化物,促使叶片MDA含量升高,在辐射初期,由于强辐射使叶片在短期内释放大量过氧化物,使叶片MDA含量达最高,故在实验第16天达最高,在长期辐射过程中,脂质不断消耗,产生的过氧化物量可能有所降低,膜通透性增加,故从顶部叶片外观也观测到植株顶部叶片逐渐受到辐射白化死亡,造成株高变矮,植株中部叶片代替白化死亡叶片成为新顶部叶片,受辐射剂量减小,则MDA含量降低,而新成为顶部的叶片也持续遭受辐射,脂质分子也在遭受持续氧化,其过氧化物也释放量会有所降低,随辐射进行,成为MDA含量持续降低的重要原因,第23天,R50—R200组持续降低,第31天,R0—R150呈递减趋势,均能明显反应出脂质分子持续氧化后其产物逐渐减少的趋势。
3.4 UV-B辐射对菹草叶片光合产物含量的影响
根据上述分析,在较高剂量UV-B辐射下植株叶绿素含量降低,叶绿素含量降低,必将影响色素蛋白复合体的功能,从而降低叶绿体对光能的吸收,使叶片光合速率下降,影响光合产物含量[30]。由于植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,它的含量是了解植物体总代谢的一个重要指标[31]。关于UV-B辐射对植株可溶性蛋白含量的影响,大量的研究认为,UV-B辐射会抑制蛋白质的合成,使植物的蛋白质含量减少,其中包括对水稻、大豆、冬小麦的研究[32],但也有研究表明UV-B辐射促进蛋白质的合成,引起植物蛋白质含量增加[33],在一些海洋生物实验中也发现,UV-B 辐射使大型海藻孔石莼可溶性蛋白在初始阶段有所增加, 而后却出现极显著下降[34]。由于蛋白质最大吸收波长正好处在UV-B辐射波长范围内,因此蛋白质会受到UV-B辐射的影响[35]。植株蛋白质含量增加可能是芳香族氨基酸合成加强的结果,芳香族氨基酸是合成黄酮的前体,而类黄酮物质有利于保护植物免遭UV-B辐射的伤害[36]。植株叶片可溶性蛋白含量降低还可能与UV-B降低蛋白水解酶的活性,促进蛋白质含量升高[37]。UV-B辐射下蛋白质含量的增减,决定于辐射强度和不同植物对UV-B辐射的敏感程度,可溶性蛋白质中约有50%为RUBP羧化酶,因此,可溶性蛋白质下降会导致植物光合作用能力下降、叶片可溶性蛋白含量降低,还可能与UV-B辐射增强所导致的植物RUBP羧化酶活性下降有关[36]。因可溶性蛋白测定主要参与各种代谢的酶类,在前面分析中,参与代谢CAT、POD、SOD等各种的酶蛋白含量均随辐射增加而升高,且均于辐射第16天达最高,故测定的可溶性蛋白含量随辐射剂量的增加而增加,而UV-B又能抑制植株可溶性蛋白合成,故第16天R200组有所体现,其Pr含量急剧降低,且长期辐射后,伤害增加,UV-B抑制植株可溶性蛋白合成得到体现,Pr含量开始随辐射剂量增加而降低,当植株进入繁殖期后,剂量高于200 μW/cm2则又抑制蛋白质合成,造成植株死亡。
SC不仅是植物的主要光合产物,而且是碳水化合物代谢和暂时贮藏的主要形式[38]。UV-B辐射可促使植株叶片SC含量的降低,在小麦[39]、菠菜[40]等研究中均有体现,而对水稻的研究结果是先增加后降低[41],因菹草成株在野外经历过短暂弱辐射,故实验开始阶段表现明显,但随辐射持续,叶片SC含量逐渐呈下降趋势,且随辐射剂量增加而逐渐递减,这可能因UV-B辐射降低了植株叶片中光合作用的关键酶—1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)的含量和酶活性,使CO2羧化效率降低,增加叶片气孔阻力增大,CO2的传导率降低,引起胞间CO2浓度下降,影响CO2的同化效率[42]。
4 结论
(1)在PAR、UV-A一致的条件下,≤10.8 kJ/m2剂量UV-B辐射可促进菹草叶片叶绿素及类胡萝卜素含量的增加,衰亡阶段起抑制作用;>10.8 kJ/m2起抑制作用,并随辐射剂量增加抑制作用增强。
(2)UV-B辐射在辐射初期可促进抗氧化酶系统中CAT、POD酶活性以及MDA含量的升高,且随辐射剂量增加而逐渐升高,但随辐射时间延长,CAT、POD酶活性受到抑制, MDA含量降低;而SOD活性随辐射时间延长逐渐升高,且随辐射剂量增加而增加。
(3)短期辐射可促进菹草叶片可溶性蛋白质和可溶性糖含量升高,且随辐射剂量增加而升高,长期辐射起抑制作用,且随辐射剂量增加而同化物含量递减。
致谢:感谢南京师范大学地理科学学院王国祥教授提供实验场地。
[1] Ali M B, Vajpayee P, Tripathi R D, Rai U N, Kumar A, Singh N, Behl H M, Singh S P. Mercury bioaccumulation induces oxidative stress and toxicity to submerged macrophytePotamogetoncrispusL. Bulletin of Environmental Contamination and Toxicology, 2000, 65(5): 573-582.
[2] Chi J. Phthalate acid esters inPotamogetoncrispusL. from Haihe River, China. Chemosphere, 2009, 77(1): 48-52.
[3] Zhang M, Cao T, Ni L Y, Xie P, Li Z Q. Carbon, nitrogen and antioxidant enzyme responses ofPotamogetoncrispusto both low light and high nutrient stresses. Environmental and Experimental Botany, 2010, 68(1): 44-50.
[4] 金送笛, 李永函, 倪彩虹, 王斌. 菹草(Potamogetoncrispus)对水中氮、磷的吸收及若干影响因素. 生态学报, 1994, 14(2): 168-173.
[5] 苏胜齐, 沈盎绿, 唐洪玉, 姚维志. 温度光照和pH对菹草光合作用的影响. 西南农业大学学报, 2001, 23(6): 532-537.
[6] Ryan K G. UV radiation and photosynthetic production in Antarctic sea ice microalgae. Journal of Photochemistry and Photobiology, 1992, 13(3/4): 235-240.
[7] Smith R C, Prezelin B B, Baker K S, Bidigare R R, Boucher N P, Coley T, Karentz D, Maclntyre S, Matlick H A, Menzies D. Ozone depletion: ultraviolet radiation and phytoplankton biology in Antarctic water. Science, 1992, 225(5047): 952-959.
[8] 张运林, 秦伯强, 马荣华, 朱广伟, 陈伟民. 太湖典型草、藻型湖区紫外辐射的衰减及影响因素分析. 生态学报, 2005, 25(9): 2354-2361.
[9] 张运林, 秦伯强, 陈伟民. 增强的UV-B对湖泊生态系统的影响研究. 地球科学进展, 2005, 20(1): 106-112.
[10] Hidema J, Kang H S, Kumagai T. Differences in the sensitivity to UVB radiation of two cultivars of rice (OryzasativaL.). Plant and Cell Physiology, 1996, 37(6): 742-747.
[11] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
[12] 刘雪琴, 仝瑞建, 施佳妮. 外源Ca2+对盐胁迫下玉米萌发与幼苗生长的影响. 中国农学通报, 2010, 26(17): 197-200.
[13] Azizpour K, Shakiba M R, Sima K K, Alyari H, Mogaddam M, Esfandiari E, Pessarakli M. Physiological response of spring durum wheat genotypes to salinity. Journal of Plant Nutrition, 2010, 33(6): 859-873.
[14] Liang C J, Zhang G S, Zhou Q. Effect of cerium on photosynthetic pigments and photochemical reaction activity in soybean seedling under ultraviolet-B radiation stress. Biological Trace Element Research, 2011, 142(3): 796-806.
[15] 郑有飞, 徐卫民, 吴荣军, 张金恩, 刘瑞娜, 姚娟, 胡会芳. 地表臭氧浓度增加和UV-B辐射增强及其复合处理对大豆光合特性的影响. 生态学报, 2012, 32(8): 2515-2524.
[16] 刘晓, 贺俊芳, 岳明. 荧光动力学方法研究光系统II原初传能过程对低剂量UV-B辐射的响应. 生物物理学报, 2011, 27(10): 839-848.
[17] Wang G H, Hao Z J, Anken R H, Lu J Y, Liu Y D. Effects of UV-B radiation on photosynthesis activity ofWolffiaarrhizaas probed by chlorophyll fluorescence transients. Advances in Space Research, 2010, 45(7): 839-845.
[18] Quesada A, Mouget J L, Vincent W F. Growth of antarctic cyanobacteria under ultraviolet radiation: UVA counteracts UVB inhibition. Journal of Phycology, 1995, 31(2): 242-248.
[19] Castenholz R W, Garcia-Pichel F. Cyanobacterial responses to UV radiation // Whitton B A. Ecology of Cyanobacteria II. Netherlands: Springer, 2012: 481-499.
[20] Bornman J F. New trends in photobiology: Target sites of UV-B radiation in photosynthesis of higher plants. Journal of Photochemistry and Photobiology B: Biology, 1989, 4(2): 145-158.
[21] 陈建勋, 王晓峰. 植物生理学实验指导 (第二版). 广州: 华南理工大学出版社, 2006.
[22] 朱涵毅, 陈益军, 劳佳丽, 沈梁, 李菲菲, 米兰, 王慧中, 薛大伟. 外源NO对镉胁迫下水稻幼苗抗氧化系统和微量元素积累的影响. 生态学报, 2013, 33(2): 603-609.
[23] 姚晓芹, 刘庆. 陆生植物体内酶系统对UV-B辐射增强的响应. 应用生态学报, 2006, 17(5): 939-942.
[24] 孙存普, 张建中, 段绍瑾. 自由基生物学导论. 合肥: 中国科学技术大学出版社, 1999.
[25] 陈辉, 施国新, 徐勤松, 王红霞, 杨海燕, 潘秋红. Cr6+对菹草叶绿素荧光参数、抗氧化系统和超微结构的胁迫影响. 植物研究, 2009, 29(5): 559-564.
[26] 朱伟, 张兰芳, 操家顺, 万蕾, 梅新敏. 水污染对菹草及伊乐藻生长的影响. 水资源保护, 2006, 22(3): 36-39.
[27] 马剑敏, 靳同霞, 李今, 吴娟, 吴振斌. 伊乐藻、苦草和菹草对磷急性胁迫的响应. 水生生物学报, 2008, 32(3): 408-412.
[28] 陈拓, 任红旭, 王勋陵. UV-B辐射对小麦叶抗氧化系统的影响. 环境科学学报, 1999, 19(4): 453-455.
[29] 李韶山, 王艳, 刘颂豪. UV-B对水稻幼苗膜脂过氧化作用的影响. 激光生物学报, 2000, 9(1): 23-26.
[30] 蔺冬梅, 徐世健, 张新芳, 安黎哲, 杨晓明, 刘慧艳. 过量铁胁迫对豌豆幼苗光合特性和叶绿体膜的影响. 草业科学, 2011, 28(11): 1950-1956.
[31] 姬晓明, 齐凤慧, 尹静, 詹亚光. 钾肥对白桦生理特性及三萜含量的影响. 中国农学通报, 2012, 28(4): 13-17.
[32] 何永美, 湛方栋, 高召华, 祖艳群, 李元. 水稻对UV-B 辐射响应的敏感性差异. 生态环境学报, 2012, 21(3): 489-495.
[33] 朱鹏锦, 尚艳霞, 师生波, 韩发. 植物对UV-B辐射胁迫响应的研究进展. 热带生物学报, 2011, 2(1): 89-96.
[34] 蔡恒江, 唐学玺, 张培玉, 杨震. UV-B辐射对孔石莼生长及其生理生化特征的影响. 科学技术与工程, 2005, 5(5): 283-287.
[35] 冯国宁, 安黎哲, 冯虎元, 王勋陵. 增强UV-B辐射对菜豆蛋白质代谢的影响. 植物学报: 英文版, 1999, 41(8): 833-836.
[36] 张静, 王进, 田丽萍. 紫外线(UV-B)辐射增强对植物生长的研究进展. 中国农学通报, 2009, 25(22): 104-108.
[37] 李惠梅, 师生波. 增强UV-B辐射对麻花艽叶片的抗氧化酶的影响. 西北植物学报, 2005, 25(3): 519-524.
[38] 陆飞伍, 罗兴录, 李红雨, 莫凡, 何远兰. 不同木薯品种叶片碳氮代谢与块根淀粉积累特性研究. 中国农学通报, 2009, 25(10): 120-124.
[39] 牛传坡, 蒋静艳, 黄耀. UV-B辐射强度变化对冬小麦碳氮代谢的影响. 农业环境科学学报, 2007, 26(4): 1327-1322.
[40] 赵晓莉, 郑有飞, 王传海, 胡正华, 高桂枝, 何都良. UV-B增加对菠菜生长发育和品质的影响. 生态环境, 2004, 13(1): 14-16.
[41] 殷红, 郭巍, 毛晓艳, 张涛. 增强的UV-B辐射对水稻光合作用的影响. 作物杂志, 2009(4): 41-45.
[42] 李元, 张翠萍, 祖艳群. 紫外辐射增强对植物糖代谢的影响. 生态学杂志, 2006, 25(10): 1265-1268.
Influence of ultraviolet radiation on physiological characteristics ofPotamogetoncrispus
WANG Jinqi1,2,*, ZHENG Youfei3, XUE Yan4
1SchoolofAppliedMeteorology,NanjingUniversityofInformationScience&Technology,Nanjing210044,China2JiangsuKeyLaboratoryofEnvironmentalChange&EcologicalConstruction,Nanjing210023,China3SchoolofAtmosphericPhysics,NanjingUniversityofInformationScience&Technology,Nanjing210044,China
4SchoolofEnvironmentalScienceandEngineering,NanjingUniversityofInformationScience&Technology,Nanjing210044,China
Potamogetoncrispusplays an important role in purifying water and maintaining a healthy aquatic ecosystem in some shallow lakes; however, mass mortality occurs toP.crispuspopulations in the late spring and early summer, which possibly results in secondary pollution. Therefore, the causes ofP.crispusmass mortality have been a hot research topic in the field of aquatic ecological restoration. Some researchers have reported that intense light is the key factor in the decline ofP.crispus. The UV-B band in strong light is generally recognized to damage plants and animals, and can even penetrate into the water column and cause harm to aquatic organisms. Therefore experiments were conducted to determine the effect of the UV-B radiation in strong light onP.crispusdecline. In this study, mature plants ofP.crispuswere daily exposed to different doses of UV-B radiation (50, 100, 150, and 200 μW/cm2) for 6 hours (09:00—15:00). The cumulative effective doses of UV-B radiation were, respectively, 10.8 kJ/m2, 21.6 kJ/m2, 32.4 kJ/m2and 43.2 kJ/m2. The control group was only exposed to UV-A radiation and photosynthetically active radiation (PAR). PAR and UV-A radiation were set to the same levels in all treatment groups. The physiological characteristics of the experimental plants were monitored regularly under UV-B radiation, and physiological and biochemical indices and photosynthetic pigment contents were determined. The results show that the chlorophyll a (Chla), chlorophyll b (Chlb), total chlorophyll (Chlt), and carotenoid (CAR) contents can be improved by UV-B radiation at doses below 10.8 kJ/m2, and can be inhibited in the decline stage. The Chla, Chlb, Chlt, and CAR contents were all decreased by UV-B radiation when the UV-B radiation dose was greater than 10.8 kJ/m2, and the inhibition effects increased with increasing radiation dose. Catalase (CAT) and peroxidase (POD) activities were increased under short-term radiation and gradually increased with increasing radiation dose; however, these activities were inhabited with continuing exposure to radiation. The activity of superoxide dismutase (SOD) increased gradually with prolonged irradiation time, and the activity of SOD increased with increasing radiation dose. The malondialdehyde (MDA) content was increased at the beginning of the UV-B radiation and gradually increased with increasing radiation dose; however, the MDA content decreased with continuing radiation. The soluble protein (Pr) and soluble sugar (SC) contents were improved at the beginning of the UV-B radiation, and gradually increased with increasing radiation dose, but these contents decreased after long-term UV-B radiation, and the contents decreased gradually with increasing radiation dose. The results indicate that UV-B radiation may be an important factor leading to the mass mortality ofP.crispusin late spring and early summer. Accordingly, we deduce that the sharp increases in ultraviolet radiation on the land surface in the late spring and early summer leads to mass mortality of wildP.crispuspopulations. However, further research is necessary to study whether UV-B radiation acts synergistically with other environmental factors to affect physiological activity in the decline ofP.crispus.
UV-B radiation; photosynthetic pigment; antioxidant enzyme system; malondialdehyde; photosynthate
国家自然科学基金(41105113, 51109109); 江苏省环境演变与生态建设重点实验室开放基金资助项目
2014-01-16;
日期:2014-11-19
10.5846/stxb201401160121
*通讯作者Corresponding author.E-mail: w_j_q@sina.com
王锦旗, 郑有飞, 薛艳.紫外辐射对菹草成株生理特性的影响.生态学报,2015,35(18):5975-5983.
Wang J Q, Zheng Y F, Xue Y.Influence of ultraviolet radiation on physiological characteristics ofPotamogetoncrispus.Acta Ecologica Sinica,2015,35(18):5975-5983.
