增温和氮素添加降低荒漠草原多年生植物氮素回收效率
2015-01-19李元恒韩国栋王正文赵萌莉王萨仁娜
李元恒,韩国栋,*,王 珍,王正文,赵萌莉,王萨仁娜,3
1 内蒙古农业大学生态环境学院,呼和浩特 010019 2 中国科学院沈阳应用生态研究所森林与土壤生态国家重点实验室,沈阳 110164 3 内蒙古师范大学遥感与地理信息系统重点实验室,呼和浩特 010022
增温和氮素添加降低荒漠草原多年生植物氮素回收效率
李元恒1,韩国栋1,*,王 珍1,王正文2,赵萌莉1,王萨仁娜1,3
1 内蒙古农业大学生态环境学院,呼和浩特 010019 2 中国科学院沈阳应用生态研究所森林与土壤生态国家重点实验室,沈阳 110164 3 内蒙古师范大学遥感与地理信息系统重点实验室,呼和浩特 010022
植物营养器官在枯萎过程中将部分氮素转移到储藏组织之中,是植物适应生境的重要策略。以位于内蒙古荒漠草原的增温和添加氮素的交互试验为平台,对建群种短花针茅(Stipabreviflora)以及优势种无芒隐子草(Cleistogenessongorica)、银灰旋花(Convolvulusammannii)、冷蒿(Artemisiafrigida)和木地肤(Kochiaprostrata)等5种多年生植物绿叶期和枯叶期氮浓度,以及氮素回收效率进行了研究。结果表明:增温处理下,植物绿叶期和枯叶期的平均氮素浓度提高了5.5%和11.3%,氮素回收效率显著降低了7.0%。氮素添加使绿叶期植物氮浓度显著提高了5.2%,使植物氮素回收效率降低2.9%。增温和氮素添加对植物枯叶期、绿叶期氮浓度和氮素回收效率有显著的交互作用。氮浓度和氮素回收效率对增温和氮素添加的响应在5个物种间都有显著差异,即这种响应具有物种特异性。研究表明独立的增温和氮素添加以及两者的交互作用都降低该荒漠草原生态系统中植物氮素回收效率,这些结果将为气候变化条件下荒漠生态系统氮素回收效率变化趋势的预测提供数据支持和实验证据。
氮回收度;氮素回收效率;气候变暖;氮素添加;荒漠草原
在20世纪,受包括化石燃料燃烧和土地利用变化在内的人类活动影响,地球表面的平均温度升高了0.6℃。而且这种趋势仍会延续下去,预计到本世纪末地球表面的平均温度还将上升1.8—4.0℃[1]。由于相同的原因,地球表面的氮素沉降量在过去140年间(1860—2000年)也至少增加了1倍[2]。据估计,全球每年输入到各类陆地生态系统中的活性氮高达43.47Tg N(1Tg = 1012g)[3],并且未来几十年内氮的输入将会持续增加[4]。温度和氮素是影响植物生长的两个重要的非生物因子,尤其在高纬度地区,温度和氮沉降的增加改变了群落中植物的种间关系,影响植物群落的组成和结构[5-6],而且通过延长生长季和改变植物物候而影响植物生长[7],植物群落和结构的改变最终影响生态系统功能,并能潜在反馈到气候变暖进程中[8]。除此之外,温度升高改变春季融雪时间,刺激土壤氮素矿化作用并间接改善土壤氮素可利用性[9]。氮素沉降或添加可直接增加生态系统可利用氮的含量,使陆地植物体氮含量增加28.5%,从而促进植物的光合、生长和繁殖,改变物种组成和功能,增加整个生态系统净初级生产力[10]。这些生物学过程的改变都将直接或间接影响生态系统中植物绿叶期和枯叶期的氮素含量和氮素回收效率[11-12]。
多年生植物在衰老过程中将部分养分回收是植物适应生境的一种重要策略,尤其是生长在营养受限制的环境中,植物通过养分回收转移,可以重新利用这些养分,提高养分保持能力,降低对当前环境中养分供应的依赖性,从而提高对环境的适应性[13]。在全球气候变化和氮沉降增加的背景下,研究草原植物叶片中养分浓度和养分回收效率,对预测未来草地生态系统的碳和氮循环有重要生态学意义[14]。例如,增温可以提高C3禾草蓝茎冰草(Pascopyrumsmithii)的叶氮浓度,而降低C4禾草格兰马草(Boutelouafracilis)的叶氮浓度[15]。北美高草草原连续4a的控制性增温研究表明,增温降低不同物种绿叶期和枯叶期氮素浓度,同时也降低各物种的氮素回收效率[14],而瑞士亚北极的增温对多年生植物氮素浓度没有影响[16]。即使是在同一生态系统中,不同物种或功能群植物的叶氮浓度对温度升高的响应规律也不一致,而过去对气候变化下生态系统碳氮循环的研究,主要集中于温度对土壤可利用氮和氮矿化的影响,而忽略了植物氮回收和利用效率策略的变化[8]。氮素添加即直接增加不同生态系统可利用的氮素,被广泛地被应用于退化草地土壤的恢复[17]和大气氮沉降的模拟[6]。该领域的生态学家们普遍认为,氮素添加提高植物绿叶期氮含量[10],而降低其氮素回收效率[18]。一般认为,贫瘠的生境中,植物具有较高的养分回收效率,但是许多研究表明养分回收效率与土壤的养分提供能力之间的关系存在不一致性[19-21]。例如,氮素添加有时可以提高枯落组织中的养分浓度,也就是说明氮素添加降低了养分回收度及养分利用率[22]。所以,关于养分回收度与土壤养分浓度之间关系及其对全球变化的响应还存在争议。因此,开展温度升高与氮素添加对植物养分浓度和回收效率及其关系影响的研究,对于更好的理解气候变暖和氮沉降背景下草地生态系统氮素循环过程的变化具有重要意义。
内蒙古荒漠草原是一个十分重要的生态系统类型,也是我国北方草原的重要组成部分。目前,对于荒漠草原植物的氮磷等养分特征的研究,主要集中在不同生态系统类型之间的比较以及养分特征对放牧和氮素添加的响应等方面[23-25],然而对于气候变暖和大气氮沉降及其交互作用影响下荒漠草原植物养分回收响应的研究较为缺乏。为此,我们以内蒙古短花针茅草原为研究对象,利用长期(2006—)红外线增温和氮素添加交互实验平台,探讨多年生植物绿叶期和枯黄期氮素浓度及氮回收效率对增温、氮素添加及其交互作用的响应规律,为气候变化条件下荒漠生态系统氮素回收效率变化趋势的预测提供数据支持和实验证据。
1 试验区概况和方法
1.1 研究地点概况
本研究的野外实验平台位于内蒙古自治区四子王旗(111°53′41.7″ N,41°46′43.6″ E,1456 m a.s.l)。属典型中温带大陆性气候,由于受阴山山脉阻隔,春季干旱多风,夏季炎热。3—5 月常有大风,月均风速达4—5 m/s。四子王旗近50年(1961—2010年)的气象数据表明,年平均气温3.57℃,最热月平均气温19.9℃(7月),最冷月平均气温-14.9℃(1月),极端最低气温-31.8℃, ≥10℃的年积温为2200—2500℃,无霜期90—120 d。年平均降水量为303 mm,其中6—8月降水量占全年的62%。平均日照时数为3117.7h。土壤为淡栗钙土,土壤有机碳含量为13%,全氮含量为0.13%。该实验区的植被主要是以短花针茅(Stipabrevifora)为建群种的荒漠草原,其它优势物种主要有冷蒿 (Artemisiafrigida)、无芒隐子草(Cleistogenessongorica)、木地肤(Kochiaprostrata)、银灰旋花(Convolvulusammannii)等,同时伴随着非地带性的森林、灌丛和沙地群落。植被稀疏低矮,平均高度8 cm,平均盖度为12%—25%。
1.2 实验设计
本研究以内蒙古四子王旗短花针茅天然荒漠草原为研究对象,于2006年5月架设增温控制装置并设置样方。试验采用2 × 2因素完全随机区组的裂区设计,共设6个区组,每个区组中包括两种温度主处理样方(对照和增温),共12个样方。样地内增温与氮素添加处理小区均为随机分布,每个主样方(对照或增温)设计面积大小为12 m2,即3 m × 4 m。同时每个主样方被裂区分为两个面积相同的氮素添加次样方处理,其中一个次样方(面积3 m × 2 m)为氮素添加处理,另一个次样方为无氮素添加处理。这样,实验共有4种处理,分别为对照(Control, C)、增温(Warming, W)、氮素添加(Nitrogen addition, N)和增温+氮素添加(Warming + Nitrogen addition, WN),每个处理6次重复,共24个实验次样方,合计面积为144 m2。6个增温区内各安装一个红外线辐射器(Infrared Radiator, Kalglo Electronics Inc., Bethlehem, PN, USA)进行加热,辐射器距地面2.25m,安放于3 m × 4 m小区的中间部位,灯的最大功率是2000瓦,使用时调至8档。2006年5月3日开始加热,全年365d不间断。每个对照区的中间部位,距地面2.25m也安装了与辐射器大小相同的“假灯”以模拟增温小区中由于红外线辐射器遮挡阳光的效应。同时,在每年6月下旬到7月上旬的雨季进行氮肥添加处理,氮素添加选用中性肥硝酸铵(NH4NO3,氮含量35%),施肥量为10 g N m-2a-1(以纯氮计算)。各年度具体施肥时间分别为6月23日(2006)、7月1日(2007),6月26日(2008)和6月30日(2009)。
气象数据来源于距离试验样地300m处安装的小型气象站(GroWeather® software version 1.2, Davis instruments corporation, USA)。土壤10cm温度是用安装于每个样地的ECH2O-TE/TM传感器(Decagon Devices, Inc. USA)同时监测获得。实验地2009年月均降雨和温度的季节动态都表现为非对称性的单峰曲线(图1),年均温4.8℃,最高温21.3℃(7月),年降水量为248.8 mm。不同处理对土壤10cm温度的影响也有较大的季节波动性,增温和增温+氮素添加引起的土壤温度波动幅度为0.2—1.0℃和0.3—1.7℃,都高于单纯氮素添加处理引起的土壤温度波动幅度(-0.3—0.5℃)。增温和增温+氮素添加处理土壤10cm年平均温度都显著高于对照和氮素添加处理(P<0.05)。与对照样地土壤年均温7.4℃相比较,增温将土壤温度显著提高了0.7℃,而增温+氮素添加则显著提高了0.8℃(P<0.05)(图1)。
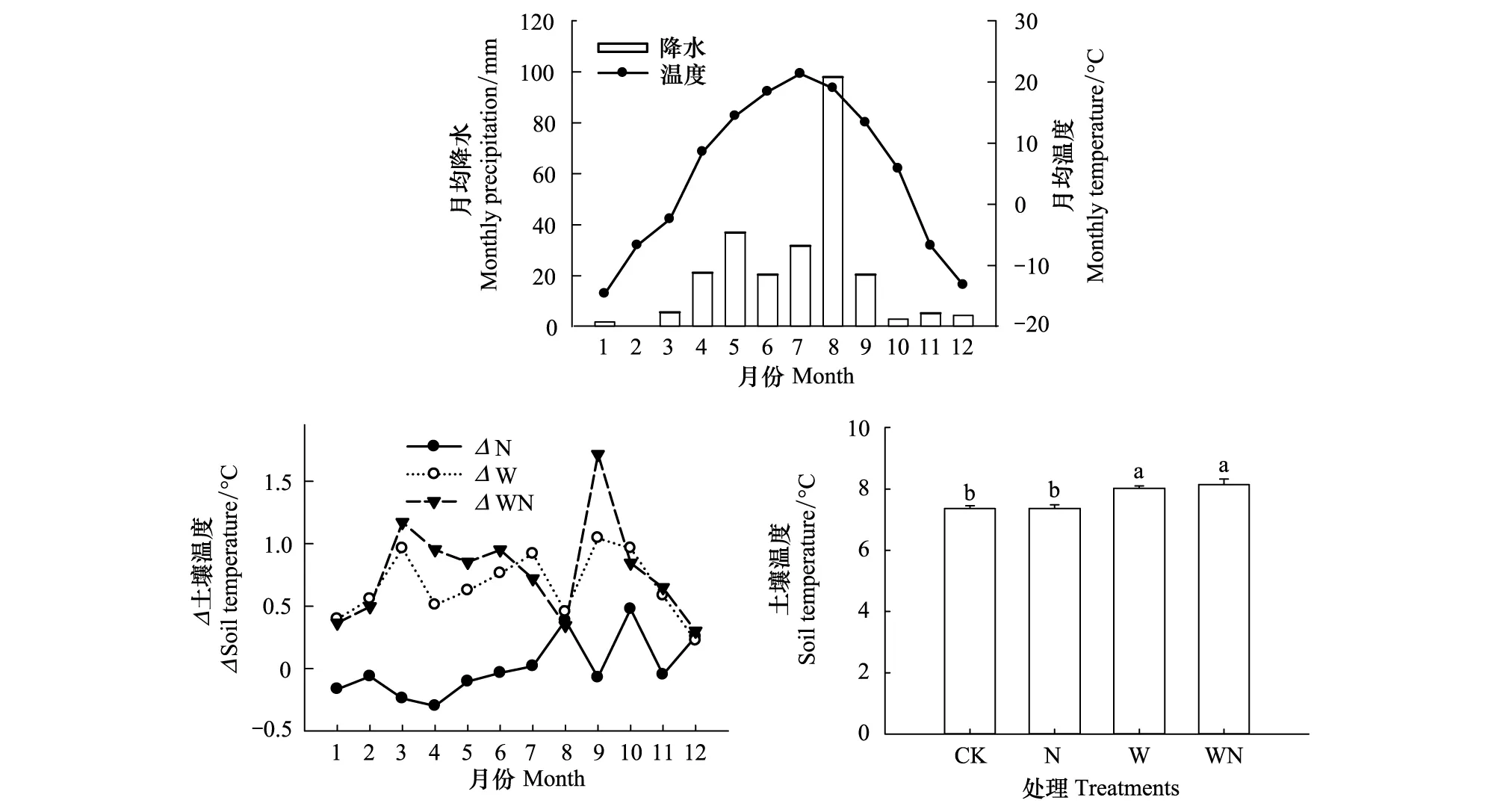
图1 2009年月均温度和降水的季节变化;增温、氮素添加和增温+氮素添加引起土壤10cm温度的季节变化和不同处理土壤年均温度Fig.1 Seasonal change of monthly precipitation and monthly mean temperature in 2009, Seasonal change of mean soil temperature at 10cm depth treatment-induced by warming (W), nitrogen addition (N) and warming plus nitrogen addition (WN), Annual mean temperature on different treatments
1.3 植物样品采集和化学分析
选取该实验地具有代表性的5种多年生物种(属3个生活型)为研究对象,其中丛生禾草类选择短花针茅(Stipabreviflora)和无芒隐子草(Cleistogenessongorica),杂类草选择银灰旋花(Convolvulusammannii),半灌木选择冷蒿(Artemisiafrigida)和木地肤(Kochiaprostrata)。于2009年8月初植物生长高峰期,在每个处理样方内,每个物种选择10株形态上大致相似、无病虫害的健康成熟个体进行挂牌标记,并分别于2009年8月12日植物绿叶期和10月6日植物枯黄期,随机选择5株,收集其全部叶片,装入纸袋,放入保鲜箱,迅速带回实验室,所收集的叶片全部是完整、无病虫害且未被食草动物采食过的叶片。所有样品都在105℃下杀青10分钟,然后在65℃下烘干至恒重,磨碎,过40目筛后进行化学测定。采用元素分析仪(Elementar vario Macro,Elementar Analysensysteme, GmbH, Germany)测定烘干植物样品中的全氮浓度。
1.4 氮素回收效率计算
基于所取物种都来源于稳定的生态系统和成熟植株,而且本试验样地位于半干旱区,样地内的年降水稀少,可以忽略通过雨水淋洗损失的氮素,各物种在每个处理中绿叶期和枯叶期的平均氮库被用于氮素回收效率(NRE)的计算[16, 26]。
式中,Ng、Ns分别为绿叶期、枯叶期中的氮库,即单位面积内物种氮素浓度与生物量的乘积。枯叶中的氮素浓度直接作为氮素回收度(NRP)的度量[26],枯叶氮素浓度越低,表明其氮素回收度越高。
1.5 数据分析
利用裂区设计的三因素方差(Three-way analysis of variance)混合模型(Proc Mixed)对植物绿叶期和枯叶期氮浓度和氮素回收效率进行分析,其中物种、增温、氮素添加及它们的交互作用作为固定效应,裂区、重复及它们的交互作用作为随机效应。不同处理间的显著性差异用Tukey′s多重比较检验(P<0.05)。对于不同处理下各物种绿叶期和枯叶期氮浓度和氮素回收效率利用裂区设计的单因素方差(One-way analysis of variance)混合模型进行分析。所有上述统计分析均采用SAS V9.0(SAS Institute Inc. 2002, Cary, NC, USA)完成。
2 结果与分析
2.1 增温和氮素添加对物种绿叶期的氮素浓度
增温、氮素添加、物种3个主效应对绿叶期氮素浓度有显著性的影响(P<0.05),且增温和氮素添加的交互作用也有显著性作用,其它交互作用不显著(表1)。增温和氮素添加分别使植物绿叶期氮浓度提高5.5% 和5.1%。5个物种绿叶期叶氮含量浓度范围为20.3—28.1 mg/g,叶氮浓度大小顺序为木地肤>银灰旋花>无芒隐子草>冷蒿>短花针茅。对每一物种在不同处理间差异进行的单因素方差分析表明,增温、氮素添加及其交互作用都显著提高银灰旋花、无芒隐子草和冷蒿3个物种绿叶期的氮浓度,但木地肤和短花针茅两个物种绿叶期氮浓度在4个处理间均无差异(图2)。

表1 增温、氮素添加与物种对植物种群绿叶期(Ng)和枯叶期氮浓度(Ns)和氮素回收效率(NRE)影响的三因素方差分析
2.2 增温和氮素添加对物种枯叶期的氮素浓度
总体而言,增温显著提高植物枯叶期的氮浓度,而氮素添加对枯叶期植物氮浓度没有显著影响。各物种间枯叶期氮素浓度有显著性的差异,5个物种枯叶期氮素浓度范围为16.6—22.7 mg/g,其大小顺序为银灰旋花>冷蒿>无芒隐子草>短花针茅>木地肤(表1)。增温和氮素添加交互作用对枯叶期氮素浓度有显著影响,其它交互作用都不显著。对每一物种的单因素方差分析表明,增温、氮素添加及其交互作用都显著提高各物种枯叶期的氮浓度,除木地肤在4个处理间均无显著差异外,其它4个物种在不同的处理间差异显著,主要表现为增温显著提高银灰旋花、短花针茅、冷蒿和无芒隐子草枯叶期氮浓度,提高幅度分别为3.7、2.9、2.8和3.5 mg/g,增温+氮素添加处理显著提高银灰旋花和冷蒿枯叶期的氮素浓度,提高幅度分别为3.4和2.2 mg/g(图2)。

图2 不同处理下各物种种群绿叶期和枯叶期的氮素浓度Fig.2 Nitrogen concentrations in green and senescent leaves of plant population at different treatments不同字母标记表示单因素方差分析下差异显著(P < 0.05)
2.3 增温和氮素添加对物种氮素回收效率
增温、氮素添加、物种3个主效应对氮素回收效率有显著性的影响(P<0.05),增温和氮素添加交互作用对氮素回收效率也有显著性影响,其它交互作用均不显著(表1)。增温和氮素添加分别降低了植物氮素回收效率的7.0%和2.9%。5个物种氮素回收效率范围为33.9%—50.1%,大小顺序为木地肤>无芒隐子草>冷蒿>银灰旋花>短花针茅。在物种水平,增温显著降低银灰旋花、短花针茅和冷蒿的氮素回收效率,与对照相比分别降低了13.2%、9.1%和20.8%;氮素添加显著降低短花针茅和冷蒿的氮素回收效率,与对照相比分别降低了4.2%和15.4%;增温+氮素添加处理显著降低短花针茅、冷蒿、木地肤和无芒隐子草的氮素回收效率,与对照相比分别降低了6.9%、19.2%、5.6%和11.6%(图3)。

图3 不同处理下各物种氮素回收效率Fig.3 Mean Nitrogen resorption efficiency of plant species at different treatments不同字母标记表示单因素方差分析下差异显著(P < 0.05)
3 讨论
本研究表明,自然条件下,荒漠草原5个多年生物种绿叶期和枯叶期氮素浓度范围分别为20.3—28.1 mg/g和16.6—22.7 mg/g。绿叶期氮素浓度高于全球452个位点的1280种植物的平均氮素浓度20.1 mg/g[27]和我国陆地生态系统753个物种的平均氮素浓度20.2 mg/g[28],而与李玉霖等[23]对中国北方典型荒漠及荒漠化地区214 种植物叶片氮浓度(24.5 mg/g)一致。通过与全球、全国以及荒漠区域尺度的研究相比较,本文结果符合荒漠植物叶片具有相对较高氮含量的假说[20]。枯叶期氮素浓度与内蒙古半干旱典型草原28种植物枯叶中的氮浓度(8.0—20.6 mg/g)结果相似[29],而明显高于全球365个取样点的638个物种平均枯叶氮素浓度10 mg/g[30]。枯叶组织中氮素浓度可直接表征植物回收能力(氮素回收度),其值越低表明植物保持养分的能力越强[26]。Killingbeck[26]提出,如果枯叶中氮素浓度低于7 mg/g,由植物对氮素的回收较完全,反之则回收不完全。根据这一标准,本研究中的5种多年生植物对枯叶期氮素的回收不完全。
本研究中,增温显著提高荒漠植物绿叶期和枯叶期平均氮素浓度,降低氮素回收效率。但到目前为止,增温对植物氮素浓度和回收效率的研究还没有一致的结论,且不同生态系统、物种和生活型都表现出不同的规律。如对北美高草草原连续4a的控制性增温实验表明,增温同时降低5种优势物种绿叶期、枯叶期氮浓度和各物种氮素回收效率[14];对瑞士亚北极泥碳地连续5a的气候变化研究表明,春季或夏季增温对各多年生物种的氮素浓度和氮素回收效率有微弱的影响[16]。这些研究充分证明,增温对不同生态系统或不同生活型植物的影响不一致。究其原因,有些研究认为这种不一致是由于增温处理对不同生态系统的持续时间长度和增温幅度不同导致的,如对亚北极矮灌丛石楠植被连续9a的增温对物种绿叶期叶片的化学性质有显著影响,即提高了黑果越桔(Vacciniummyrtillus)的叶氮浓度,而降低了笃斯越桔(Vacciniumuliginosum)和越桔(Vacciniumvitisidaea)的叶氮浓度[31]。而阿拉斯加州冻原草丛连续2a和3.5a的增温对物种的氮素浓度没有影响[32-33]。在相对寒冷的高纬度区域,温度增加改变春季融雪时间,刺激土壤氮素矿化作用并间接改善土壤氮素可利用性[9],而增温对植物生长的作用都大于对土壤氮矿化,引起成熟绿叶体内氮稀释[16, 27],而对枯叶氮浓度的影响较小[16],两个物候期叶片对增温不同的响应使植物氮回收效率随着温度增加而降低。此外,气温升高也会通过影响其它环境因子(如土壤水分、霜冻等)而影响植物对氮素的回收,如温度升高使得植物的生长季显著延长,而生长季延长易于使植物群落容易遭受霜冻的影响[34],突然的霜冻迫使植物加速衰老或死亡,加剧了植物氮素的不完全回收,从而降低植物氮素回收效率。
本研究证明氮素添加使所有物种氮素回收效率降低,这与其它基于氮素添加的实验结果相同[22, 35],主要原因是由于氮素添加使物种绿叶氮浓度增加,而对枯叶氮浓度没有影响。对全球456个陆地植种对氮素添加响应的整合分析(Meta-analysis)表明,氮素添加使陆地植物体氮含量增加28.5%,同时各物种对于氮素添加的响应依赖于不同的植物生活型和功能类型[10],说明外源养分供应对生态系统养分循环具有物种调节作用。一般认为生活在养分贫瘠生境中的植物比生长在土壤肥沃生境的植物有更高的养分回收效率,高的养分回收效率降低了植物对土壤养分库的依赖性[26]。该结论尽管与本文氮素添加处理相同,但到目前为止对于该观点仍存在争议。植物对养分的回收效率与土壤养分可利用性没有一致的关系[20],因为研究者仅仅比较物种最初是来源于贫瘠还是肥沃生境的,而没有区分物种和环境因子对氮素回收效率的影响[18]。植物中没有被回收转移的养分,将以凋落物的形式进入植被-土壤系统的养分循环,凋落物需要分解和矿化,才能被植物再次利用,养分回收度的多少影响到凋落物的质量,并进一步对分解速率和养分可利用性产生影响[17]。综上所述,植物氮素回收效率受外部多种环境因素的影响,仅仅从单一的因素去解释氮素回收效率的差异是不合理的,尤其是气候变化驱动多个环境因子对植物生态系统产生影响,增加了氮素回收效率研究的复杂性。因此,对不同生态系统、不同类群植物在多个环境因子变化情景下的氮素回收效率进行系统、深入和整合研究,并结合人为控制实验和自然生态系统的长期观测,才有可能完整揭示植物氮素回收效率的变化规律,并对未来全球变化背景下植物的氮素回收和利用对策做出合理的判断和预测。
[1] IPCC. Climate Change 2007: the Physical Science Basis: Working Group I Contribution to the Fourth Assessment Report of the IPCC. Cambridge University Press, 2007.
[2] Galloway J N, Aber J D, Erisman J W, Seitzinger S P, Howarth R W, Cowling E B, Cosby B J. The nitrogen cascade. Bioscience, 2003, 53(4): 341-356.
[3] Holland E A, Dentener F J, Braswell B H, Sulzman J M. Contemporary and pre-industrial global reactive nitrogen budgets. Biogeochemistry, 1999, 46(1/3): 7-43.
[4] Vitousek P M, Cassman K, Cleveland C, Crews T, Field C B, Grimm N B, Howarth R W, Marino R, Martinelli L, Rastetter E B, Sprent J. Towards an ecological understanding of biological nitrogen fixation. Biogeochemistry, 2002, 57-58(1): 1-45.
[5] Harte J, Shaw R. Shifting dominance within a montane vegetation community: results of a climate-warming experiment. Science, 1995, 267(5199): 876-880
[6] Yang H J, Wu Y M, Liu W X, Zhang Z, Zhang N L, Wan S Q. Community structure and composition in response to climate change in a temperate steppe. Global Change Biology, 2011, 17(1): 452-465.
[7] Xia J Y, Wan S Q. Independent effects of warming and nitrogen addition on plant phenology in the Inner Mongolian steppe. Annals of Botany, 2013, 111(6): 1207-1217.
[8] Niu S L, Sherry R A, Zhou X H, Wan S Q, Luo Y Q. Nitrogen regulation of the climate-carbon feedback: evidence from a long-term global change experiment. Ecology, 2010, 91(11): 3261-3273.
[9] Wan S Q, Hui D F, Wallace L, Luo Y Q. Direct and indirect effects of experimental warming on ecosystem carbon processes in a tallgrass prairie. Global Biogeochemical Cycles, 2005, 19(2): doi: 10.1029/2004GB002315.
[10] Xia J Y, Wan S Q. Global response patterns of terrestrial plant species to nitrogen addition. New Phytologist, 2008, 179(2): 428-439.
[11] Yuan Z Y, Li L H, Han X G, Chen S P, Wang Z W, Chen Q S, Bai W M. Nitrogen response efficiency increased monotonically with decreasing soil resource availability: a case study from a semiarid grassland in northern China. Oecologia, 2006, 148(4): 564-572.
[12] Lü X T, Cui Q, Wang Q B, Han X G. Nutrient resorption response to fire and nitrogen addition in a semi-arid grassland. Ecological Engineering, 2011, 37(3): 534-538.
[13] Aerts R, Chapin III FS. The mineral nutrition of wild plants revisited: a re-evaluation of processes and patterns. Advances in Ecological Research, 1999, 30: 1-67.
[14] An Y, Wan S Q, Zhou X H, Subedar A A, Wallace L L, Luo Y Q. Plant nitrogen concentration, use efficiency, and contents in a tallgrass prairie ecosystem under experimental warming. Global Change Biology, 2005, 11(10): 1733-1744.
[15] Read J J, Morgan J A. Growth and partitioning in Pascopyrum smithii (C3) and Bouteloua gracilis (C4) as influenced by carbon dioxide and temperature. Annals of Botany, 1996, 77(5): 487-496.
[16] Aerts R, Cornelissen J H C, van Logtestijn R S P, Callaghan T V. Climate change has only a minor impact on nutrient resorption parameters in a high-latitude peatland. Oecologia, 2007, 151(1): 132-139.
[17] Liu P, Huang J H, Han X G, Sun O J, Zhou Z Y. Differential responses of litter decomposition to increased soil nutrients and water between two contrasting grassland plant species of Inner Mongolia, China. Applied Soil Ecology, 2006, 34(2/3): 266-275
[18] Kobe R K, Lepczyk C A, Iyer M. Resorption efficiency decreases with increasing green leaf nutrients in a global data set. Ecology, 2005, 86(10): 2780-2792.
[19] Del Arco J M, Escudero A, Garrido M V. Effects of site characteristics on nitrogen retranslocation from senescing leaves. Ecology, 1991, 72(2): 701-708.
[20] Aerts R. Nutrient resorption from senescing leaves of perennials: are there general patterns? Journal of Ecology, 1996, 84(4): 597-608.
[21] Yuan Z Y, Li L H, Han X G, Huang J H, Jiang G M, Wan S Q. Soil characteristics and nitrogen resorption in Stipa krylovii native to northern China. Plant and Soil, 2005, 273(1/2): 257-268.
[22] Lü X T, Han X G. Nutrient resorption responses to water and nitrogen amendment in semi-arid grassland of Inner Mongolia, China. Plant and Soil, 2010, 327(1/2): 481-491.
[23] 李玉霖, 毛伟, 赵学勇, 张铜会. 北方典型荒漠及荒漠化地区植物叶片氮磷化学计量特征研究. 环境科学, 2010, 31(8): 1716-1725.
[24] 阿穆拉, 赵萌莉, 韩国栋, 贾乐, 董亭. 放牧强度对荒漠草原地区土壤有机碳及全氮含量的影响. 中国草地学报, 2011, 33(3): 115-118.
[25] 黄菊莹, 赖荣生, 余海龙, 陈卫民. N添加对宁夏荒漠草原植物和土壤C: N: P生态化学计量特征的影响. 生态学杂志, 2013, 32(11): 2850-2856.
[26] Killingbeck K T. Nutrients in senesced leaves: Keys to the search for potential resorption and resorption proficiency. Ecology, 1996, 77(6): 1716-1727.
[27] Reich P B, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001-11006.
[28] Han W, Fang J, Guo D, Zhang Y. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377-385.
[29] Yuan Z Y, Li L H, Han X G, Huang J H, Jiang G M, Wan S Q, Zhang W H, Chen Q S. Nitrogen resorption from senescing leaves in 28 plant species in a semi-arid region of Northern China. Journal of Arid Environments, 2005, 63(1): 191-202.
[30] Yuan Z Y, Chen H Y H. Global trends in senesced-leaf nitrogen and phosphorus. Global Ecology and Biogeography, 2009, 18(5): 532-542.
[31] Richardson S J, Press M C, Parsons A N, Hartley S E. How do nutrients and warming impact on plant communities and their insect herbivores? A 9-year study from a sub-Arctic heath. Journal of Ecology, 2002, 90(3): 544-556.
[32] Hobbie S E, Chapin III FS. The response of tundra plant biomass, aboveground production, nitrogen, and CO2flux to experimental warming. Ecology, 1998, 79(5): 1526-1544.
[33] Welker J M, Fahnestock J T, Sullivan P F, Chimner R A. Leaf mineral nutrition of Arctic plants in response to warming and deeper snow in northern Alaska. Oikos, 2005, 109(1): 167-177.
[34] Norby R J, Long T M, Hartz-Rubin J S, O′Neill E G. Nitrogen resorption in senescing tree leaves in a warmer, CO2-enriched atmosephere. Plant and Soil, 2000, 224(1): 15-29.
[35] van Heerwaarden L M, Toet S, Aerts R. Nitrogen and phosphorus resorption efficiency and proficiency in six sub-arctic bog species after 4 years of nitrogen fertilization. Journal of Ecology, 2003, 91(6): 1060-1070.
Nitrogen resorption efficiency of perennial plant decreases with warming and nitrogen addition in desert steppe
LI Yuanheng1, HAN Guodong1,*, WANG Zhen1, WANG Zhengwen2, ZHAO Mengli1, WANG Sharenna1, 3
1CollegeofEcologyandEnvironmentScience,InnerMongoliaAgriculturalUniversity,Hohhot010019,China2StateKeyLaboratoryofForestandSoilEcology,InstituteofAppliedEcology,ChineseAcademyofSciences,Shenyang110164,China3InnerMongoliaKeyLaboratoryofRemotesensingandGeographyInformationSystem,InnerMongoliaNormalUniversity,Hohhot010022,China
When vegetative organs of plants wither, the nutrient resorption from senescing tissues to storage tissues was the most important adaptative strategy in different growing environments. The nitrogen concentration in green, senescent stages and nitrogen resorption efficiency (NRE) in 5 perennial dominant species were evaluated in a manipulative experiment conducted inStipabrevifloradesert steppe, Inner Mongolia, with treatments of warming, nitrogen addition and its interaction. The results showed that warming significantly increased nitrogen concentration in green and senescent plants by 5.5% and 11.3%, respectively, and decreased NRE by 7.0%. Nitrogen addition significantly increased nitrogen contents in green plants by 5.2% and decreased NRE by 2.9%. There was significant interaction between warming and nitrogen addition to increase nitrogen concentrations of green and senescent plants and to reduce NRE. The nitrogen concentration and NRE of the five species showed higher species-specific responses in different treatments, these species-specific responses reflected flexible adaptation of the plants to environment change. This research indicated that independently warming and nitrogen and its interaction decreased plant NRE in desert steppe ecosystem. These results will provide data support and experimental evidence in predicting the trend of NRE of desert ecosystem under climate change.
nitrogen resorption proficiency; nitrogen resorption efficiency; global warming; nitrogen addition; desert steppe
国家自然科学基金(31360113,31100330,30860060);内蒙古自治区自然科学基金(2011MS0607)资助
2014-01-12;
日期:2014-11-19
10.5846/stxb201401120088
*通讯作者Corresponding author.E-mail: nmghanguodong@163.com
李元恒,韩国栋,王珍,王正文,赵萌莉,王萨仁娜.增温和氮素添加降低荒漠草原多年生植物氮素回收效率.生态学报,2015,35(18):5948-5956.
Li Y H, Han G D, Wang Z, Wang Z W, Zhao M L, Wang S R N.Nitrogen resorption efficiency of perennial plant decreases with warming and nitrogen addition in desert steppe.Acta Ecologica Sinica,2015,35(18):5948-5956.
