环氧合酶-2在宫颈癌组织中的表达及对预后的影响
2015-01-19辛华栋张莉华吴士茜成艳梅
辛华栋 张莉华 田 芬 焦 茹 吴士茜 成艳梅
1.河北省邯郸市第一医院神经内科,河北邯郸 056001;2.河北省邯郸市中心医院妇二科,河北邯郸 056001;3.河北省邯郸市中心医院妇一科,河北邯郸 056001;4.河北省邯郸市中心医院体检中心,河北邯郸 056001;5.河北省邯郸市中心医院病理科,河北邯郸 056001
随宫颈癌筛查技术的临床推广及应用,早期宫颈癌的治疗满意。 流行病学调查显示:年轻宫颈癌的发病率近年呈增高趋势。晚期及复发转移宫颈癌仍面临治疗困难、生存质量差的棘手问题,约60%的复发转移病例在2 年内死亡。而不良预后因素在临床治疗及病情监测方面发挥着重要的指导作用。在分子水平对恶性肿瘤的侵袭转移及预后的研究成为近年肿瘤学研究的热点领域。 COX-2 是花生四烯酸合成前列腺素的关键限速酶,在体内呈诱导型表达。 多项研究显示,在鼻咽癌[1]、食道癌[2]、胃癌[3]、结直肠癌[4]、乳腺癌[5]、膀胱移行细胞癌[6]、非小细胞肺癌[7]等上皮恶性肿瘤中COX-2 蛋白或COX-2 mRNA 高表达,并与不良预后及生存率有关。 本研究旨在探讨COX-2 与宫颈癌侵袭转移的关系及对预后的影响。
1 资料与方法
1.1 一般资料
选择2008 年6 月~2009 年10 月在邯郸市第一医院及中心医院住院治疗的原发宫颈癌患者的蜡块共95 例,临床病理资料完整,排除合并其他恶性肿瘤及心脑血管疾病的患者,年龄27~80 岁,中位年龄42 岁。所有病理切片请两位资深病理科医师复核,按照国际妇产科联盟(FIGO 2009)宫颈癌临床分期标准[3]进行分期:Ⅰ期22 例,Ⅱ期43 例,Ⅲ期21 例,Ⅳ期9 例。 高、中、低分化(G1、G2、G3)分别为16 例、49 例及30 例。 鳞癌77 例,非鳞癌18 例(腺癌11 例,腺棘细胞癌5 例,小细胞未分化癌1 例,透明细胞癌1 例)。
1.2 实验方法
采用链霉素抗生物素蛋白-过氧化物酶联结免疫组化(S-P)法进行实验检测。 基本原理是采用生物素标记的第二抗体与链霉菌抗生物素蛋白连接的过氧化物酶及基质素混合液来测定细胞和组织中的抗原。羊抗人COX-2 多克隆抗体、鼠抗人HPV16-E6 单克隆抗体。即用型羊S-P kate 检测试剂、即用型鼠S-P kate检测试剂;DAB 显色试剂盒、S-P 试剂盒均为北京中山生物技术有限公司产品。 本实验染色程序严格按S-P 染色试剂盒说明书操作。
1.3 免疫组化结果判断
COX-2 阳性判定标准:细胞核内出现棕色或棕褐色颗粒为阳性表达。 根据文献,按阳性细胞百分比及阳性细胞染色强弱评分(immunohistochemical scores,IHS)[8]:IHS=a×b。a 为阳性细胞百分比,每张切片随机选择5 个高倍视野计数阳性细胞100 个,放大倍数10×40:a=0,无阳性细胞;a=1,阳性细胞为1%~10%;a=2,阳性细胞>10%~50%;a=3,阳性细胞>50%~80%;a=4,阳性细胞>80%。b 代表阳性细胞染色强弱:b=0,阴性;b=1,弱阳性;b=2,中度阳性;b=3,强阳性。HIS 为0 分者计为阴性,≥1 分者计为阳性。将以已知COX-2 阳性的肺癌切片作为阳性对照。
1.4 随访
通过电话、门诊复查、书信等方式对患者进行随访,从确诊之日起,至2014 年10 月随访结束。生存期以月为计算单位,随访时间为8.6~76 个月。 随访期内,95 例宫颈癌患者中死亡26 例,失访3 例,其中9 例死于局部复发,8 例死于远处转移,7 例死于局部复发合并远处转移,1 例死于心肌梗死,1 例死于脑出血。 失访者自失访之日按截尾数据处理。
1.5 统计学方法
采用SPSS 21.0 软件进行统计分析。 计数资料用率表示,组间比较采用χ2检验或Fisher 确切概率法。Pearson 法及Spearman 等级相关检验进行双变量相关性分析,以Kaplan-Meier 法计算生存率并绘制生存曲线,组间生存率的比较采用Log-rank 检验,Cox 比例风险模型进行宫颈癌预后的多因素分析。 以P <0.05 为差异有统计学意义。
2 结果
2.1 COX-2 在宫颈癌中的表达情况
COX-2 的总阳性表达率为65.26%(62/95),见图1~2(封三)。 其在年龄、组织学分级、临床分期、肿瘤直径及病理类型各组中比较差异无统计学意义(P >0.05),而在淋巴结转移、宫旁或脉管浸润及肌层浸润深度各组中比较差异有统计学意义(P <0.05)。 相关分析显示:COX-2 与肿瘤直径、淋巴结转移及宫旁或脉管浸润呈正相关(r = 0.207、0.220、0.215,均P <0.05)。 见表1。
图1 COX-2 在宫颈癌中的阴性表达(HE 染色,200×)
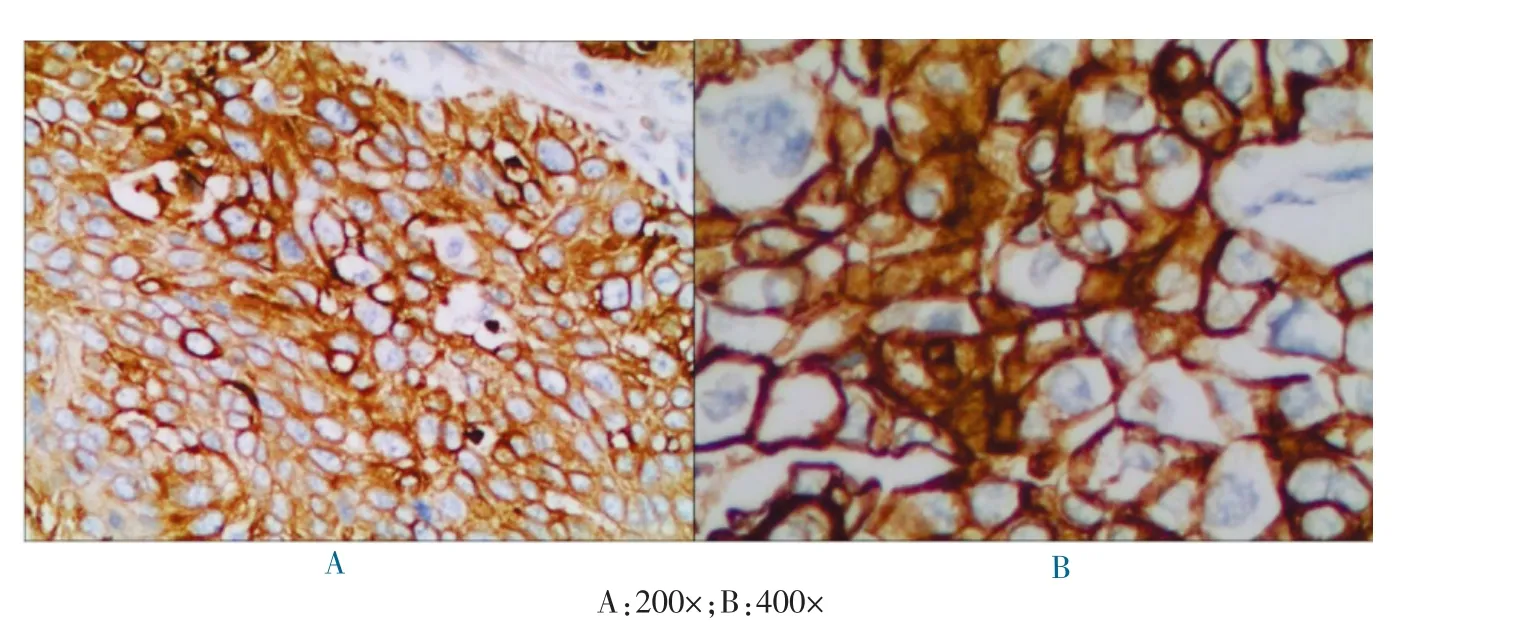
图2 COX-2 在宫颈癌中的阳性表达(S-P 染色)
2.2 患者5 年生存率分析
95 例宫颈癌患者的5 年生存率为72.63%(69/95),生存时间最短8.6 个月,最长73 个月,中位生存时间54 个月。95 例宫颈癌患者的总生存曲线见图3。
2.3 COX-2 对宫颈癌预后的单因素分析
COX-2 阳性患者的5 年生存率为61%,其中死亡23 例;COX-2 阴性患者的5 年生存率为91%,其中死亡3 例。 Log-rank 检验显示:COX-2 阳性组的5 年生存率显著低于阴性组(χ2=7.853,P <0.01),见表2。 生存曲线见图4。
2.4 宫颈癌预后影响因素的多因素分析
将所有可能因素进行多因素分析结果显示:COX-2、临床分期、淋巴结转移、肿瘤直径及肌层浸润深度对宫颈癌的预后均有影响差异统计学意义(P <0.05),是独立预后因素(P≤0.05 为进入水准,P >0.1为剔除水准)。 而年龄、组织学分级、病理类型、宫旁或脉管浸润对宫颈癌的预后无统计学意义(P >0.1)。见表3。
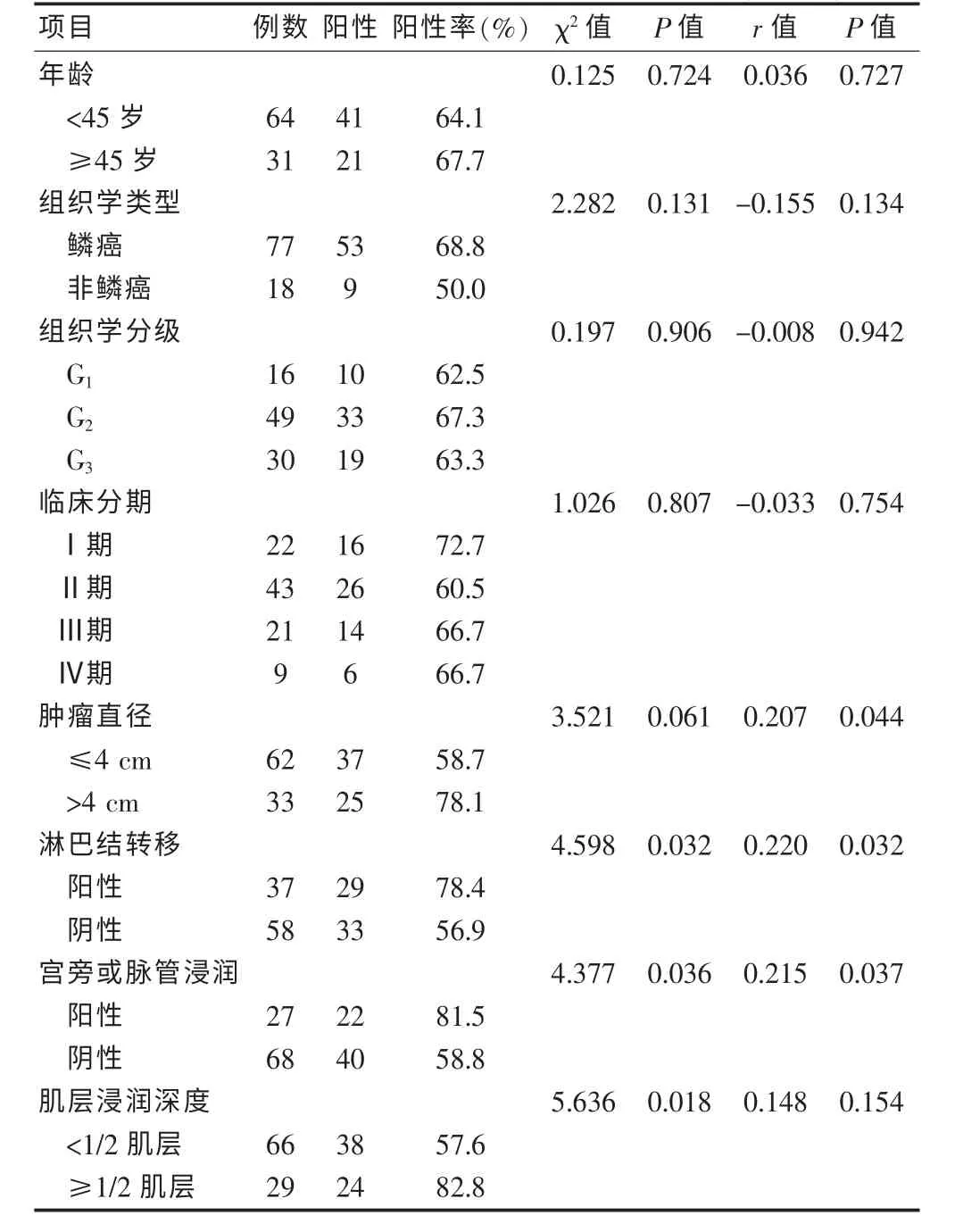
表1 COX-2 与宫颈癌临床病理特征之间的关系(n = 95)
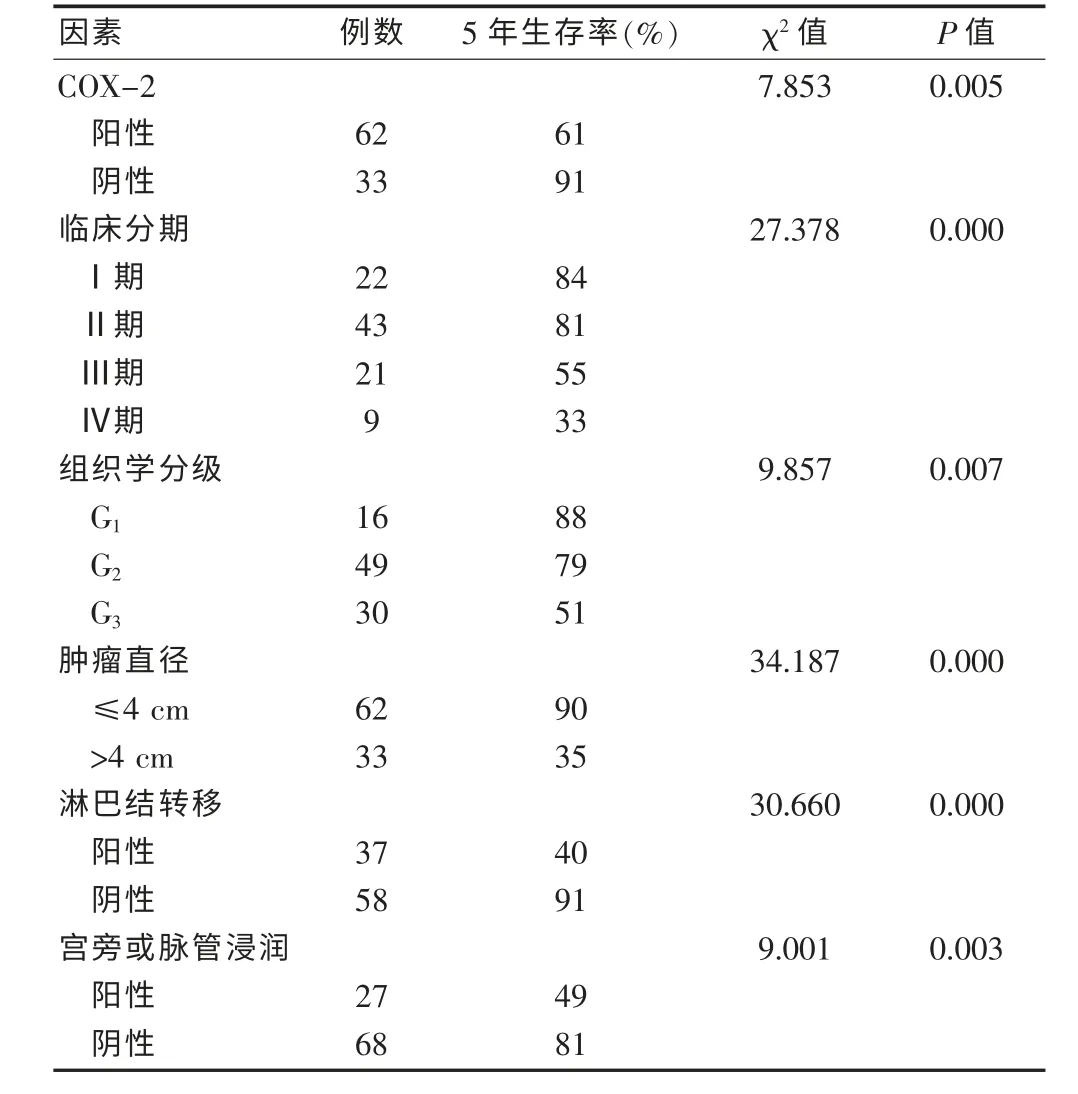
表2 宫颈癌预后的单因素分析结果(n = 95)
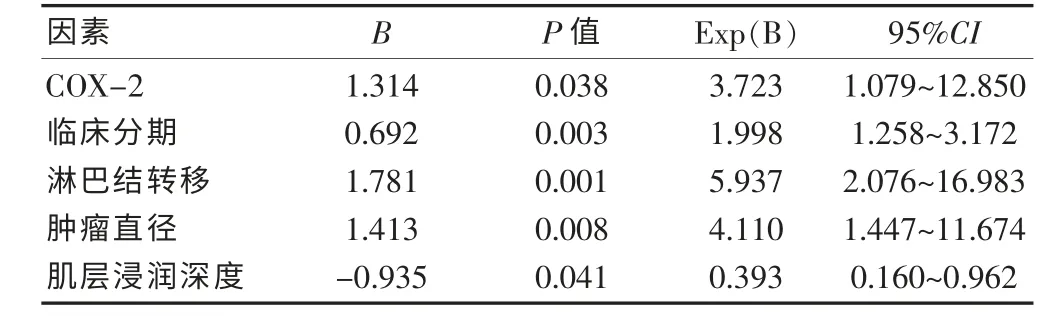
表3 宫颈癌预后影响因素的多因素分析
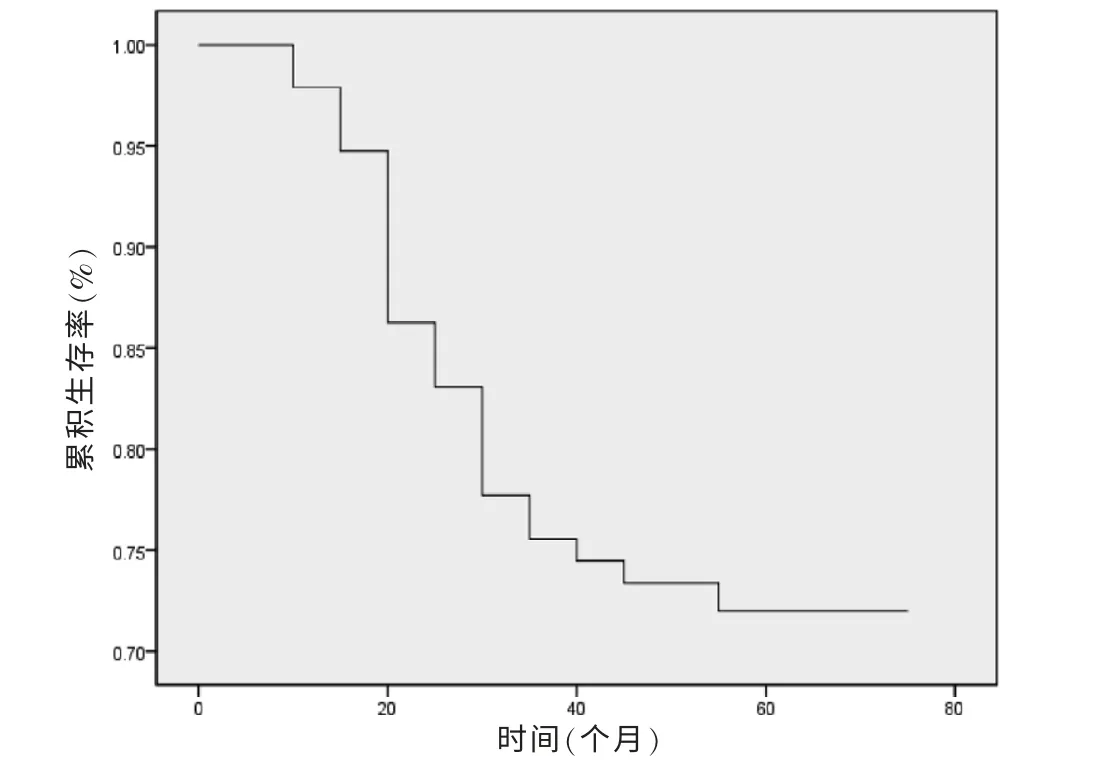
图3 95 例宫颈癌患者的总5 年生存率
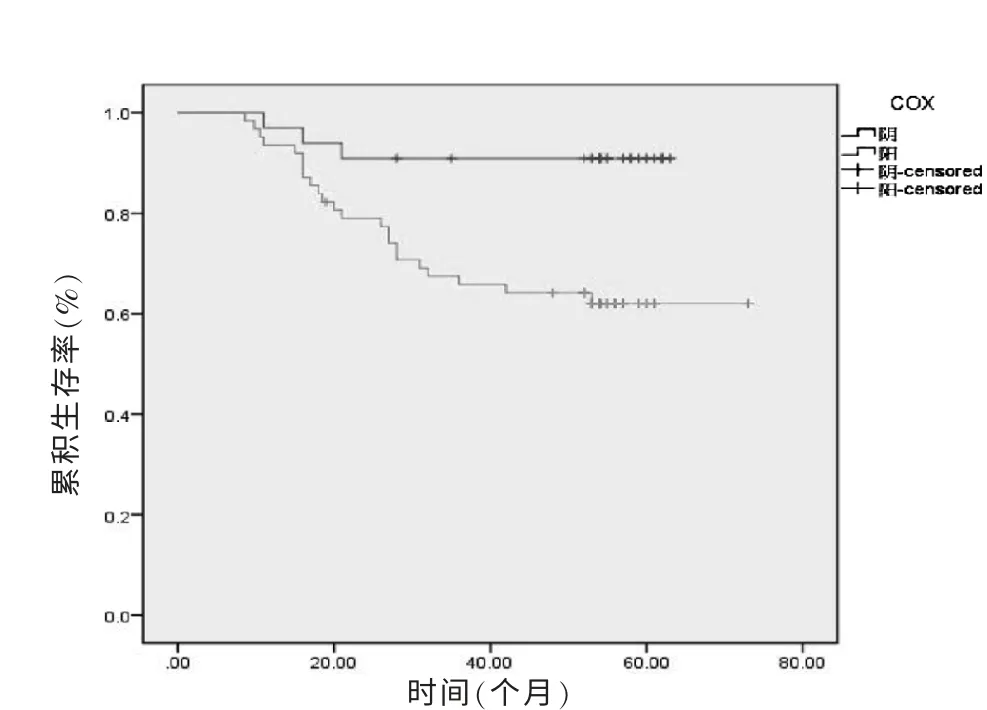
图4 COX-2 表达情况的生存曲线
3 讨论
COX-2 是完整的膜结合蛋白,在大多数正常组织中不表达或微量表达,但在炎症细胞因子、生长因子、促癌剂、一氧化氮、缺氧、癌基因活化等刺激下,可于短期内上调20~40 倍,也被称为即刻反应基因,与多种肿瘤的发生发展、侵袭转移及不良预后有关。李媛媛等[9]对乳腺癌的研究中发现:免疫电镜下COX-2 蛋白的胶体金颗粒定位于细胞的内质网及核膜上,这可解释免疫组化染色为胞浆棕黄色着色。 内质网及核膜同属于细胞内膜系统,COX-2 的定位提示:蛋白质的合成及转运,即通过多种信号转导通路及复杂的分子机制在肿瘤形成过程中可能发挥了重要作用,目前多项体内外实验已做了初步探讨[10-11]。
本研究中COX-2 阳性率在有淋巴结转移、宫旁或脉管浸润及深肌层浸润组中的表达显著低于无淋巴结转移、宫旁或脉管浸润及浅肌层浸润组中,与前期研究一致[12]。相关分析显示,COX-2 与淋巴结转移、宫旁或脉管浸润及肿瘤直径呈正相关。 提示:在宫颈癌浸润转移过程中,COX-2 与淋巴结转移、宫旁或脉管浸润、肌层浸润深度及肿瘤直径密切相关。 局部直接浸润和淋巴转移是宫颈癌的主要转移途径,晚期出现血行转移。 新生血管形成是肿瘤转移的必要前提,实体瘤内微血管的数量及密度与肿瘤转移的潜能呈正相关关系。 淋巴管多位于肿瘤间质内。 新生血管及淋巴管杂乱密集,基底膜连续性差,功能不完善,利于肿瘤细胞进入脉管系统,从而发生浸润转移。
一项直肠癌的研究显示[13],COX-2 与VEGF-C 表达呈线性关系,COX-2、VEGF-C 与微血管密度(MVD)及微淋巴管密度(MLVD)呈线性关系。 提示COX-2过表达可上调血管内皮生长因子C(VEGF-C)水平,进而诱导肿瘤组织中微血管及微淋巴管的生成,从而促进肿瘤的生长及转移。 成旭惠等[14]在胃癌的研究中发现:COX-2 与VEGF(血管内皮生长因子)及MVD(微血管密度)呈正相关,VEGF 与COX-2 相互作用,诱导肿瘤新生血管生成,并与淋巴结转移有关。 推测在宫颈癌中亦存在类似机制,促进肿瘤淋巴转移、深部浸润及远处转移。在宫颈癌侵袭的分子机制中,COX-2/前列腺素E2(PGE2)与MMP(基质金属蛋白酶)相互上调,溶解细胞外基质、破坏细胞间连接。 其中MMP-9能降解包括基底膜Ⅳ型胶原在内的多种细胞外成分,使癌细胞向深层间质浸润,亦可突破淋巴管及血管的基底膜形成脉管浸润,增加肿瘤细胞侵袭性。 研究发现[15],COX-2 通过NF-κB/Snail 信号通路下调E-钙黏蛋白(E-cadherin)表达,致使细胞间粘附作用减弱。以上机制均可导致肿瘤上皮细胞间质化(EMT),细胞结构改变,极性丧失,与周围细胞和基质的接触减少,获得间质细胞表型, 肿瘤细胞的迁移和运动能力增强,从而出现局部浸润及远处转移。 COX-2 过表达可通过多种分子机制及多种信号转导通路,增强宫颈癌细胞的侵袭性,使肿瘤细胞突破淋巴管及血管的脉管屏障,同时向间质深部浸润,促进癌灶的局部直接浸润及远处转移,与宫颈癌的不良预后有关。
本研究结果显示,COX-2 在组织学分级和临床分期各组中阳性率均无差异,提示COX-2 表达与分化程度及分期无关,相关分析结果亦证实以上结论。 但COX-2 与分化及分期进行统计学分析时,等级相关系数为负数,提示随着分化程度降低及临床期别的升高,COX-2 的表达有下降趋势,但差异无统计学意义。即在宫颈癌Ⅰ、Ⅱ期及高分化病例中COX-2 已存在较高水平的表达,推测COX-2 表达上调是宫颈癌发生的早期事件。 这与张焕等[16]对非小细胞肺癌的研究结果相似。 前期研究显示,在宫颈癌前病变时COX-2 的表达上调已有统计学意义,与HPV16-E6、E7 蛋白协同作用促使增生活跃的宫颈上皮细胞恶性转化,突破基底膜,形成浸润癌。 邓星辉[17]等对胃癌的研究亦认为在不典型增生阶段COX-2 高表达已存在,支持本研究结论。
本研究显示,宫颈癌的总体5 年生存率为72.63%,随临床期别的增加,5 年生存率依次递减,分别为84%、81%、55%及33%。 COX-2 表达阳性者5 年生存率为61%, 阴性者为91%, 经Log-rank 检验有显著性差异。多因素分析COX-2 亦有统计学意义。提示COX-2 为宫颈癌预后的影响因素,与宫颈癌的不良预后密切相关。 袁冬兰等[18]的研究结果与之相似。 国内外研究 报 导[4,7,19]:在卵巢癌、结直肠 癌 及非小 细 胞 肺 癌 中COX-2 均为不良预后的独立预测因素, 并且在免疫组化水平和血清检测中结果相似。本研究单因素分析显示:除COX-2 外,淋巴结转移、宫旁或脉管浸润、肿瘤直径、临床分期及组织学分级均与宫颈癌预后密切相关。 结合临床,进行多因素分析显示,COX-2、淋巴结转移、肌层浸润深度、肿瘤直径、临床分期为宫颈癌的独立预后因素。单因素分析中宫旁或脉管浸润及分化程度的累积5 年生存率有显著性差异,宫颈癌不良预后密切相关,但多因素分析中未进入COX 回归模型的方程中。 而肌层浸润深度的5 年生存率的Logrank 检验无统计学意义,但在P≤0.05 为进入水准的多因素分析中成为独立预后因素。 分析原因,影响宫颈癌预后的因素多样而复杂, 且通过多种分子机制、信号转导通路增加癌细胞侵袭转移潜能,各个因素在此过程中发挥权重不尽相同,还有待进一步深入研究其具体机制。 其二本研究入选病例有限,可能影响分析结果,期待大样本的预后分析研究。
国内多认为临床分期高、组织分化差及淋巴结阳性的病例预后差。 而国外文献报道间质深浸润、脉管浸润以及盆腔淋巴结转移是影响宫颈癌预后的3 大病理高危因素。 由此可见,淋巴结转移是影响预后的重要因素。本研究数据显示淋巴结阳性病例的死亡风险是阴性者的5.937 倍,COX-2 阳性的死亡风险是阴性者的3.723 倍,生存曲线可直观反映COX-2 对宫颈癌不良预后的影响。 国外研究亦显示,COX-2 高表达患者的5 年生存率显著低于低表达者[20]。 国内研究显示:COX-2 与淋巴结转移、临床分期及组织学分级有关[19,21],并与肿瘤浸润深度呈正相关[22]。COX-2 表达阳性者,其微淋巴管密度和微血管密度显著高于阴性者[23],一方面为肿瘤病灶的生长提供营养,一方面通过促进基质金属蛋白酶及CD44 活化,下调E-cadherin蛋白,增加肿瘤细胞的侵袭力。宫颈肿瘤直径越大,分化越差,期别越晚,COX-2 阳性表达率高,在分子机制水平发挥作用,致使通过宫旁新生毛细血管及淋巴管浸润转移的概论越高,出现深肌层浸润、脉管瘤栓及淋巴结转移的概论越高,从而影响患者的预后。
综上所述,COX-2 与宫颈癌的淋巴结转移、宫旁或脉管浸润、肌层浸润深度及肿瘤直径密切相关,在侵袭、演进及远处转移等恶性生物学行为中发挥了重要的作用,且是宫颈癌不良预后的独立预测因素,可作为预后监测的指标之一。 临床需重视淋巴结转移、宫旁浸润、脉管瘤栓、深肌层浸润、肿瘤病灶大、分期晚、分化差等高危因素的病例,结合COX-2 的检测,对评估预后及指导治疗具有重要的临床价值。近年研究发现COX-2 抑制剂能使多种肿瘤细胞如宫颈癌Hela细胞系体外增殖受限。 有研究显示[24],COX-2 抑制剂塞来昔布,已进行Ⅲ期临床试验,以减少结肠癌的发生。 COX-2 抑制剂作为宫颈癌放化疗的增敏剂,有学者已进行了初步探讨。 笔者推测COX-2 作为宫颈癌的靶点治疗将发挥积极的作用,期待COX-2 抑制剂临床实验的推广,本研究为此提供了理论基础及实验依据。
[1] Kim TJ,Lee YS,Kang JH,et al. Prognostic significance of expression of VEGF and COX-2 in nasopharyngeal carcinoma and its association with expression of ERBB2 and EGFR [J]. Surg Oncol,2011,103(1):46-52.
[2] 白美玲,张林西,李海军,等.Ang-2、COX-2 及CD105 联合检测评价食管鳞癌患者预后的意义[J].中国老年学杂志,2012,32(11):2238-2240.
[3] Hu Z,Liu X,Tang Z,et al. Possible regulatory role of Snail in NF-κB-mediated changes in E-cadherin in gastric cancer [J]. Oncol Rep,2013,29(3):993-1000.
[4] 谢竹田,张彧飞,姜文洁,等.环氧合酶-2 表达与结直肠癌预后关系的Meta 分析[J].齐鲁医学杂志,2014,29(3):192-195.
[5] Steenport M,Khan KM,Du B,et al. Matrix metalloproteinase(MMP)-1 and MMP-3 induce macrophage MMP-9:evidence for the role of TNF-alpha and cyclooxygenase-2 [J]. J Immunol,2009,183(12):8119-8127.
[6] 高放,何静华,张凤梅,等.nm23、COX-2 与MMP-9 与膀胱癌中的表达及其与肿瘤浸润和转移的关系[J].中外医疗,2012,1(13):26-28.
[7] Jiang H,Wang J,Zhao W. COX-2 in non-small cell lung cancer:a meta-analysis [J]. Chin Chin Acta,2013,41(9):26-32.
[8] 欧阳艳琼,吴绪峰,陈惠祯,等.宫颈癌组织中环氧合酶-2 和诱生型一氧化氮合酶的表达及其意义[J].现代妇产科进展,2003,12(5):363-365.
[9] 李媛媛,刘雨清,吴洪娟.COX-2 在乳腺癌组织中的超微结构定位及其意义[J].中国医药导报,2010,7(10):35-38.
[10] 赵婷婷,凌斌,冯定庆,等.NS-398 抑制SKOV3 细胞恶性生物学特性的机制[J].安徽医科大学学报,2014,49(9):1210-1213.
[11] Hiroko O,Masanobu O. The role of PGE2-associated inflammatory responses in gastric cancer development [J].Springer-Verlag Berlin Heidelberg,2013,35(2):139-150.
[12] 张莉华,田芬,辛华栋,等.COX-2 在宫颈癌变中的表达及其意义[J].河北医科大学学报,2010,31(5):578-580.
[13] 王爱亮,刘志强,陆信仰,等.直肠癌中环氧化酶2、血管内皮生长因子C 的表达及与血管生成、淋巴管生成相关性的研究[J].中华临床医师杂志:电子版,2012,6(5):1300-1302.
[14] 成旭惠,欧希龙,宋永谦,等.COX-2 及VEGF 在胃癌中的表达及临床意义[J].江苏医药,2012,40(17):2034-2036.
[15] Liu XJ,Chen ZF,Li HL,et al. Interaction between Cyclooxygenase-2,Snail,and E-cadherin in gastric cancer cells [J].World J Gastroenterol,2013,19(37):6265-6271.
[16] 张焕,仝磊,姬文莉,等.非小细胞肺癌组织中COX-2的表达及其与临床病理的关系[J].新疆医学,2014,44(17):17-21.
[17] 邓星辉,黎红,周伟.COX-2 和MMP-9 在胃癌组织中的表达及意义[J].中国现代医生,2011,49(12):234-245.
[18] 袁冬兰,钱华,王华,等.宫颈鳞状细胞癌组织中NDRG-1、COX-2、VEGF 的表达及其临床意义[J].江苏大学学报,2014,24(3):250-254.
[19] 刘晓丽,马礼鸿,王全义,等.COX-2、ERCC-1 在卵巢癌组织中的表达及意义[J].中国病原生物学杂志,2013,8(8):739-741.
[20] Saba NF,Choi M,Muller S,et al. Role of Cyclooxygenase-2 in tumor progression and survival of head and neck squamous cell carcinoma[J].Cancer Prev Res,2009,2(9):823-829.
[21] 王蕴众.Survivin 和Cox-2 在乳腺浸润性导管癌组织中的表达及临床意义[J].现代肿瘤医学,2013,21(11):2448-2450.
[22] 陆晓峰,陈刚.胃癌组织中PCNA、COX-2、p53 及RGFR的表达及其与预后的关系[J].山东医药,2012,52(41):39-41.
[23] 张焕,杨丽丽,房新志.非小细胞肺癌组织中COX-2 表达及其与微血管和微淋巴管密度的关系[J].新疆医科大学学报,2011,34(6):591-597.
[24] Benelli R,Vene R,Minghelli S,et al. Celecoxib induces proliferation and Amphiregulin production in colon subepithelial myofibroblasts,activatingerk1-2 signaling in synergy with EGFR[J].Cancer Lett,2013,328(1):73-82.
