强直性脊柱炎患者英夫利昔单抗治疗后MMP-3、MMP-9的变化及临床意义
2015-01-19刘伟丽张瑾李声东丁健应振华
刘伟丽 张瑾 李声东 丁健 应振华
●临床研究
强直性脊柱炎患者英夫利昔单抗治疗后MMP-3、MMP-9的变化及临床意义
刘伟丽 张瑾 李声东 丁健 应振华
目的 探讨强直性背脊柱炎(AS)患者英夫利昔单抗治疗后血清基质金属蛋白酶(MMP)3、9的变化,以及其与患者临床疾病活动性的相关性。方法 对44例AS患者分别于第0、2、6、12周给予静脉微泵滴注英夫利昔单抗针200mg或300mg,其中合并外周关节炎者25例;采用ELISA法检测英夫利昔单抗治疗前、治疗第12周血清MMP-3、MMP-9水平,同时采用血沉(ESR)、C反应蛋白(CRP)、强直性脊柱炎疾病活动指标(ASDAS)、Bath AS功能指数(BASFI)、Bath AS活动度衡量指数(BASMI)对患者进行临床疾病活动性评估。结果 44例AS患者治疗12周后,血清MMP-3、MMP-9水平以及ASDAS、BASFI、BASMI、ESR、CRP均有下降,差异均有统计学意义(均P<0.01),34例患者(77.3%)达临床重要改善,其中5例患者(11.4%)达临床显著改善。治疗前,血清MMP-3水平与ESR、CRP及ASDAS、BASFI有相关性(P<0.01),血清MMP-9水平与CRP及ASDAS、BASFI、BASMI有相关性(P<0.05)。治疗前后,血清MMP-3下降水平与ASDAS、BASFI、ESR、CRP的改善有相关性(P<0.05),而与BASMI的改善无关(P>0.05),血清MMP-9下降水平与BASMI、CRP的改善相关(P<0.05)。合并外周关节炎组的血清MMP-3、ESR、CRP水平均显著高于不合并外周关节炎组(P<0.05),而血清MMP-9水平低于不合并外周关节炎组(P<0.05)。结论 血清MMP-3、MMP-9水平与AS患者的疾病活动指标高度相关,可以作为英夫利昔单抗治疗时的病情监测指标,其中MMP-3在合并外周关节炎时升高显著,MMP-9水平变化在不合并外周关节炎时升高。
强直性脊柱炎 疾病活动性 基质金属蛋白酶3 基质金属蛋白酶9
强直性脊柱炎(AS)是以中轴关节慢性炎症为主、原因不明的全身免疫性疾病,临床表现常伴有外周关节炎、附着点炎,影响患者日常生活和工作。该病为慢性疾病,但容易急性反复发作。近年来,TNF-α拮抗剂的临床应用使AS治疗有效率显著提高。但因这类药物价格昂贵,目前多用于急性活动期的治疗。临床上一些常用的急性期炎症指标,如血沉(ESR)、C反应蛋白(CRP),与AS的活动性有一定相关性,但并不能完全反映病情[1],在临床中的应用有一定局限性。因此,寻找能够反映这类疾病炎症、预测治疗疗效的生物学标志物,指导临床医师确定及时、有效的治疗方案具有重要意义。近年来研究发现,细胞因子、基质金属蛋白酶(MMPs)和AS疾病活动性相关[2-3]。MMPs是体内主要的蛋白水解酶家族之一,不仅参与AS炎症,还是调节骨质破坏病理过程的重要因素;其中MMP-3和MMP-9是起主要作用的MMPs,它们在AS疾病急性活动期呈高表达,同时作为关节破坏的间接标志物,是关节受到更多侵蚀的预测指标。笔者通过检测血清MMP-3和MMP-9在AS急性活动期患者中的表达水平,以及它们在应用英夫利昔单抗治疗后的变化,探讨其与疾病活动度的相关性。
1 对象和方法
1.1 对象 收集2012年8月至2014年2月在宁波市李惠利医院(30例)及浙江省人民医院住院(14例)并确诊AS的44例患者资料,其中男39例,女5例,年龄18~56(28±8)岁;病程1~20(4.6±3.2)年;合并外周关节炎者25例。所有患者均符合1984年修订AS纽约标准[4],并处于疾病活动期(ASDAS≥1.3分),且排除感染、肿瘤性疾病的患者。所有患者均未合并使用糖皮质激素和双磷酸盐类药物,合并消炎镇痛药物要求稳定剂量4周以上。本研究经伦理委员会批准。
1.2 方法 所有患者分别于第0、2、6、12周给予静脉微泵滴注英夫利昔单抗针(商品名:类克,Cilag AG公司生产,100mg/瓶),剂量参照3~5mg/kg给予患者应用英夫利昔单抗针200mg或300mg。
1.3 血清MMP-3、MMP-9水平测定 在第0、12周注射英夫利昔单抗时采集血清,保存于-80℃备用。实验时分别以1∶10、1∶1稀释,采用ELISA法,应用美国R&D公司提供的人血清MMP-3、MMP-9抗体-ELISA试剂盒(产品编号:750598.4、750319.9),按试剂盒说明书进行操作。
1.4 疗效评价 疗效评价参数包括:(1)临床表现和体征的评估:强直性脊柱炎疾病活动指标(ASDAS)[5]、Bath AS功能指数(BASFI)[6]、Bath AS活动度衡量指数(BASMI)[7],中度活动为1.3≤ASDAS<2.1,重度活动为2.1≤ASDAS<3.5,严重活动为ASDAS≥3.5;(2)实验室指标:ESR、CRP代表炎性指标,血常规、肝肾功能常规监测不良反应。分别在第0、12周对上述疗效指标进行评估和监测。ASDAS改善>1.1为临床重要改善,ASDAS改善>2.0为临床显著改善[5]。
1.5 统计学处理 采用SPSS17.0统计软件。计量资料以表示,组间比较采用t检验,血清MMP-3、MMP-9水平与临床活动性指标相关性分析采用Spearman相关。
2 结果
2.1 AS患者治疗前后血清MMP-3、MMP-9水平及临床活动性指标的变化 44例患者应用英夫利昔单抗治疗12周后,血清MMP-3、MMP-9水平与治疗前比较差异均有统计学意义(均P<0.01);治疗后ASDAS、BASFI、BASMI、ESR、CRP较治疗前均有下降,差异均有统计学意义(P<0.01),详见表1。
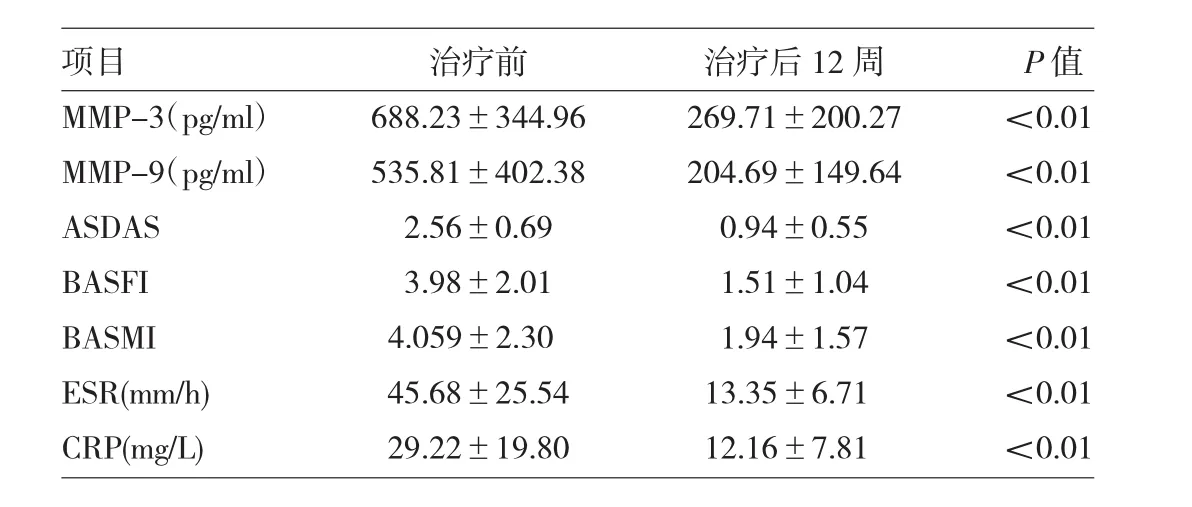
表1 AS患者治疗前后血清MMP-3、MMP-9水平及临床活动性指标的变化
2.2 AS患者临床疾病活动性指标评估 44例患者治疗前平均ASDAS为2.56±0.69,其中中度活动8例,重度活动20例,严重活动3例。所有患者均接受英夫利昔单抗针治疗12周时,平均ASDAS为0.94±0.55,其中27例患者达临床缓解期(ASDAS<1.3),中度活动15例,重度活动2例,严重活动0例;34例患者ASDAS改善>1.1,其中5例患者ASDAS改善>2.0。
2.3 血清MMP-3、MMP-9水平与临床活动性指标的相关性分析 血清MMP-3水平与ESR、CRP及ASDAS、BASFI均有相关性(r=0.7248、0.6393、0.4713、0.5806,均P<0.01),而与BASMI无相关性(r=0.2253,P>0.05);血清中MMP-9水平与CRP及ASDAS、BASFI、BASMI均有相关性(r=0.5475、0.5990、0.2536、0.6831,均P<0.05),而与ESR无相关性(r=0.1625,P>0.05)。
2.4 血清MMP-3、MMP-9下降水平与临床疗效指标改变的相关性分析 血清MMP-3下降水平与ASDAS、BASFI、ESR、CRP的改善有相关性(r=0.3717、0.3061、0.7211、0.5204,均P<0.05),而与BASMI的改善无关(r=0.1693,P>0.05),血清MMP-9下降水平与BASMI、CRP的下降相关(r=-0.3705、0.5290,均P<0.05),但与ASDAS、BASFI、ESR的改善无相关性(r=0.1598、0.1543、0.1312,均P>0.05)。
2.5 合并外周关节炎组与不合并外周关节炎组的MMP-3、MMP-9水平比较 合并外周关节炎组MMP-3水平显著高于不合并外周关节炎组,而MMP-9水平低于不合并外周关节炎组,差异有统计学意义(P<0.05或0.01)。合并外周关节炎组ESR、CRP显著高于不合并外周关节炎组(P<0.05或0.01),详见表2。

表2 合并外周关节炎组与不合并外周关节炎组的MMP-3与MMP-9水平比较
3 讨论
MMPs家族参与了降解细胞外基质,其成员很多,发挥了不同的生理作用和病理作用,其中MMP-3主要降解蛋白多糖、纤维粘连蛋白、较小的胶原,MMP-9主要作用是降解胶原蛋白造成骨破坏,并促进血管新生,尤其是肿瘤患者中会显著升高[8]。目前MMPs在AS方面的研究还不多,Vandooren等[9]采用免疫组化方法检测了41例AS患者的膝关节滑膜组织,在衬里层、衬里下层均可见MMP-1、MMP-2、MMP-3、MMP-9的表达,其中MMP-3、MMP-9的表达与总体炎症细胞浸润程度相关,但分布不同,MMP-3主要存在衬里下层,MMP-9在血管周围表达更多,关节液MMP-3水平是血液中的1 000倍,由此可见,MMP-3、MMP-9在AS活动期被活化,但可能发挥着不同的作用。基于已经证实MMP-3、MMP-9在AS活动期被活化,本研究监测其表达,并进一步探讨与疾病活动度、外周关节炎的相关性。目前国外有一些关于MMPs在应用TNF拮抗剂治疗AS过程的变化和意义的研究,但选择的MMPs种类多,结论尚未达到一致性,国内未见MMP-3和MMP-9在应用生物制剂治疗过程的监测意义的报道,因此本研究有一定的先进性。
本研究中血清MMP-3水平在疾病活动期显著升高,应用英夫利昔单抗针治疗12周后随着病情好转而下降,并且血清MMP-3基础水平及变化水平与炎症指标ESR、CRP以及疾病活动指标ASDAS、BASFI均有相关性,提示血清MMP-3水平可以作为病情监测的指标。Vandooren等[9]在证实AS活动期滑膜中MMP-1、MMP-2、MMP-3、MMP-9的表达增多后,同样给予英夫利昔单抗治疗12周,可见衬里层MMP-3明显下调,MMP-9也有一定程度的减少,同时血清中的MMPs均有明显下降。最近有研究证明,MMP-3可作为AS疾病活动的监测指标,高疾病活动的AS患者MMP-3水平高于低疾病活动期患者,与ASDAS相关性优于ESR、CRP[10]。本研究结果提示在疾病活动期,MMP-3水平与疾病活动性指标ASDAS、BASFI一致,表明MMP-3在活动期被活化。同时在应用英夫利昔单抗治疗后,MMP-3水平的变化与ASDAS、BASFI水平变化一致,即与疾病活动性仍相关。也有其他研究表明,MMP-3的表达在应用TNF抑制剂治疗后下降[9-10,12]。通过一项随访2年的研究,基础高水平的MMP-3是AS出现快速放射学进展的重要依据,是独立的预测指标[11]。而Arends[12]认为MMP-3的下降水平与在3~12个月时评估ASAS20、ASAS40的应答反应仍缺乏一致性。因此,MMP-3可能作为使用生物制剂的监测指标,尽管是否可以作为评价生物制剂应答的标志物还是未知数。
目前多数研究提到MMP-3的监测对合并外周关节炎患者更有利,而不能反映患者的整体病情[2,10-12],本研究中也把合并外周关节炎患者作了简单分析,发现合并外周关节炎组MMP-3水平显著升高,但两组间ESR、CRP差异有统计学意义,两组患者疾病活动性不一致,因而未能进一步对两组治疗后结果作进一步的对比。推测这可能是由于外周关节炎患者MMP-3水平显著升高有关,入组患者中外周关节炎患者减少可能会对结果造成影响,因而需要有更大的样本。由于MMP-3主要在软骨细胞、成纤维细胞、肉芽组织中的巨噬细胞高表达,这些病变在脊柱病变中同样存在[12],所以MMP-3水平代表整体还是外周关节炎还需用更多的研究来明确。
本研究中治疗前血清MMP-9水平与ASDAS、BASMI、CRP高度相关,并在应用英夫利昔单抗针治疗后其下降水平也与ASDAS、BASMI、CRP的变化相关,提示MMP-9水平变化与AS疾病活动性也存在相关性。与MMP-3不同的是,在基础水平和变化水平,MMP-9均与BASMI有相关性,与文中不成熟的数据-中轴型AS患者中MMP-9水平也要高于合并外周关节炎组,结果有一致性。由于BASMI主要评估患者脊柱功能,它与MMP-9的相关性提示了中轴型AS患者可以通过检测MMP-9水平来评估、监测病情,尤其是在中轴型AS患者常常ESR、CRP并不高[13]。关于MMP-9与疾病活动性的相关研究不多,Mattey等[14]入选了157例AS患者,监测了30种细胞因子、5种MMPs和4种MMPs组织抑制酶(TIMPs),并与临床活动性指标:BASDAI、BASFI等进行相关性分析,MMPs的高水平表达与CRP的升高、BASDAI、BASFI均有相关性,MMP-8、9与BASDAI最相关,而不是MMP-3。一方面,由于MMP-8、9均主要由中性粒细胞、巨噬细胞活化产生,中性粒细胞活化可能是AS的启动因素,随着活性氧的产生以及MMPs的活化,导致AS组织细胞的进一步损伤,这是否暗示了在AS患者中固有免疫应答比调节免疫过程更重要。另一方面,MMP-9在降解胶原蛋白造成骨破坏的同时,有促进血管新生的作用,而血管新生参与了AS患者新骨形成的病理过程[15]。因此,MMP-9的表达与疾病活动相关,可作为生物制剂治疗的监测指标之一,并可能在中轴型AS患者中监测意义更大。
近10年来,TNF-α拮抗剂的产生让更多AS患者疾病得到控制。英夫利昔单抗静脉注射,具有起效快的优势,本组患者在应用英夫利昔单抗治疗12周后,77.3%患者达临床重要改善,显示了其良好的有效性,但仍有部分患者临床疗效仍可能不佳。临床上我们在使用昂贵的生物制剂的同时,需要有更好的生物学指标来监测病情。本研究中,血清MMP-3、9水平与AS患者的疾病活动指标高度相关,可以作为英夫利昔单抗治疗时的病情监测指标。由于入组患者不足,血清MMP-3、9两者不同是否与中轴、外周型AS有关,是否可称为病情活动性是两个有效的生物标志物,这需要更大患者样本去监测。
[1] Ruof J,Stucki G.Validity aspects of erythrocyte sedimentation rate and C-reactive protein in ankylosing spondylitis:a literature review[J].J Rheumatol,1999,26(4):966-970.
[2] Appel H,Janssen L,Listing J,et al.Serum levels of biomarkers of bone and cartilage destruction and new bone formation in different cohorts of patients with axialspondyloarthritis with and without tumor necrosis factor-alpha blocker treatment[J].Arthritis Res Ther,2008,10(5):125-128.
[3] Bay-Jensen A C,Leeming D J,Kleyer A,et al.Ankylosing spondylitis is characterized by an increased turnover of several different metalloproteinase-derived collagen species:a crosssectionalstudy[J].RheumatolInt,2012,32(11):3565-3572.
[4] Van der Linden S,Valkenburg H A,Cats A.Evaluation ofdiagnostic criteria for ankylosing spondylitis:a proposalfor modification of the New York criteria[J].Arthritis Rheum,1984,27(4):361-368.
[5] Machado P,van der Heijde D.How to measure disease activity in axialspondyloarthritis[J]?Current Opinion in Rheumatology,2011, 23(4):339-345.
[6] Stone M A,Payne U,Pacheco-Tena C,et al.Spondyloarthritis:Is it time to replace BASDAI with ASDAS[J]?Nat Rev Rheumatol, 2013,9(7):388-390.
[7] Calin A,Garrett S L,Whitelock H,et al.A new approach to functional ability in ankylosing spondylitis:the Bath Ankylosing Spondylitis FunctionalIndex[J].J Rheumatol,1994,21(12):2281-2285.
[8] Li X,Qu L,Zhong Y,et al.Association between promoters polymorphisms of matrix metalloproteinases and risk of digestive cancers:a meta-analysis[J].J Cancer Res Clin Oncol,2013,139(9): 1433-1447.
[9] Vandooren B,Kruithof E,Yu D T,et al.Involvement of matrix metalloproteinases and their inhibitors in peripheral synovitis and down-regulation by tumor necrosis factor alpha blockade in spondylarthropathy[J].Arthritis Rheum,2004,50(9):2942-2953.
[10]Chen C H,Lin KC,Yu D T,et al.Serum matrix metalloproteinases and tissue inhibitors ofmetalloproteinases in ankylosing spondylitis:MMP-3 is a reproducibly sensitive and specific biomarker of disease activity[J].Rheumatology(Oxford),2006, 45(4):414-420.
[11]Maksymowych W P,Landewe R,Conner-Spady B,et al.Serum matrix metalloproteinase 3 is an independent predictor of structuraldamage progression in patients with ankylosing spondylitis [J].Arthritis Rheum,2007,56(6):1846-1853.
[12] Arends S,van der Veer E,Groen H,et al.Serum MMP-3 levelas a biomarker for monitoring and predicting response to etanercept treatment in ankylosing spondylitis[J].J Rheumatol,2011, 38(8):1644-1650.
[13] De Vries M K,van Eijk I,van der Horst-Bruinsma I E,et al.Erythrocyte sedi-mentation rate,C-reactive protein level,and serum amyloid a protein for patient selection and monitoring of anti-tumor necrosis factor treatment in ankylosing spondylitis[J]. Arthritis Rheum,2009,61(11):1484-1490.
[14]Mattey D L,Packham J C,Nixon N B,et al.Association ofcytokine and matrix metalloproteinase profiles with disease activity and function in ankylosing spondylitis[J].Arthritis Res Ther,2012,28: 127-130.
[15] Seo J S,Lee S S,Kim S I,et al.Influence ofVEGF gene polymorphisms on the severity ofankylosing spondylitis[J].Rheumatology(Oxford),2005,44:1299-1302.
Alteration of serum matrix metalloproteinase 3 and 9 levels in patients with ankylosing spondylitis during infliximab therapy
LIU Weili, ZHANG Jin,LI Shengdong,et al.
Department of Rheumatology,Ningbo Medical Treatment center Lihuili Hospital,Ningbo 315040,China
【 Abstract】 Objective To investigate serum levels of matrix metalloproteinase (MMP)3 and 9 in patients with ankylosing spondylitis(AS)treated with infliximab. Methods Serum MMP-3 and 9 levels of 44 AS patients,including 25 cases complicated with peripheral arthritis,were measured by ELISA before and 12 weeks after infliximab treatment.Serum ESR and CRP were measured,Ankylosing Spondylitis Disease Activity Score(ASDAS),Bath Ankylosing Spondylitis Functional Index(BASFI)and Bath Ankylosing Spondylitis Metrology Index(BASMI)were evaluated.The T-test and Spearman correlation analysis were used for statistic analysis. Results Serum MMP-3 and 9,ESR,CRP levels were decreased,and ASDAS, BASFI,BASMI scores were declined 12 weeks after infliximab treatment(P<0.01).Thirty four patients(77.3%)had clinically important improvement and 5 patients(11.4%)had major improvement after 12 weeks of infliximab treatment.Before treatment the MMP-3 level was correlated with ESR,CRP,and ASDAS,BASFI scores(P<0.01),MMP-9 was correlated with CRP,ASDAS,BASFI and BASMI(P<0.05).After 12 weeks of treatment the decline of MMP-3 was correlated with the changing of ASDAS,BASFI scores and ESR,CRP levels,but not with BASMI score.The decline of MMP-9 was correlated with the changing of BASMI and CRP.Patients with peripheral arthritis had higher MMP-3,ESR and CRP,while patients without peripheral arthritis had higher MMP-9. Conclusion High levels of MMP-3 and MMP-9 are associated with increased disease activity in AS patients and they declined during infliximab therapy.MMP-3 is associated with patients with peripheral arthritis, while MMP-9 is associated with patients without peripheral arthritis.
Ankylosing Spondylitis Disease activity index MMP-3 MMP-9
2014-10-24)
(本文编辑:严玮雯)
宁波市社会发展科研项目(2012C50013)
315040 宁波市医疗中心李惠利医院风湿免疫科(刘伟丽、张瑾、李声东、丁健);浙江省人民医院风湿免疫科(应振华)通信作者:刘伟丽,E-mail:wellylau@163.com
