桂花花冠裂片结构及其花期表皮细胞变化
2015-01-18张泽宏郭世群
张泽宏,郭世群
(闽南师范大学生物科学与技术学院,福建漳州363000)
桂花花冠裂片结构及其花期表皮细胞变化
张泽宏,郭世群
(闽南师范大学生物科学与技术学院,福建漳州363000)
运用叶片离析法和石蜡切片法制片,通过光学显微镜观察,研究了桂花(Osmanthusfragrans)花冠裂片的基本形态解剖结构以及释香过程中细胞的变化,并将桂花花冠和成熟叶片的部分数量特征进行了测量比较,探讨了桂花释放香气的细胞结构基础.结果表明:(1)桂花花冠裂片主要由上表皮、基本薄壁组织、分枝较小的维管系统和下表皮几部分组成,表皮细胞微向外突起,且其细胞表面布满规则的突起条棱.(2)桂花花冠与成熟叶片的解剖结构存在差异.(3)在桂花开放过程中,花冠裂片表皮细胞发生变化,且基本薄壁组织增厚,细胞不断膨大,但未发现异细胞.花冠裂片的这些结构及变化与桂花散发香气有一定的相关性.
桂花;花冠裂片;石蜡切片法;解剖结构
桂花为常绿阔叶灌木或小乔木经济树种,是木犀科木犀属模式种植物[1],花簇生,3~5朵生于叶腋,花冠分裂至基部,香气浓郁.全世界约有桂花品种40余种,我国桂花种质资源极其丰富,有27种[2],目前主要分布在南岭以北至秦岭以南的广大北亚热带和中亚热带地区[3].桂花的花是其最重要的观赏和利用器官,国内在桂花的花器官发育以及花香方面开展了不少研究[4],但多以桂花净油或浸膏为研究对象[5-7],较少有从花冠裂片的显微结构方面去研究其在开花过程中的结构变化与香气释放的相关性.本试验通过桂花成熟叶片及花冠裂片的显微观察,初步研究桂花花冠裂片的基本解剖结构以及香气释放过程中细胞的变化,为进一步探讨桂花释香机理,合理开发利用我国桂花资源提供理论依据,同时,对规范桂花的适宜采摘时期也有一定的指导作用.
1 材料与方法
1.1 试验材料
供试材料所用桂花花冠裂片和成熟叶片均采自闽南师范大学校园内,根据花冠裂片自然开张状况和香味程度分为5个时期采取整朵花:Ⅰ期,苞片完全包裹着花冠,无香味;Ⅱ期,苞片包裹着花冠,但花冠略展开,微香;Ⅲ期,苞片脱落,花半开放,浓香;Ⅳ期,花冠饱满,完全展开,浓香;Ⅴ期,花冠裂片发黄,有余香.在树上选择上述形态特征的花朵,采摘后立即带回实验室固定.叶片选取桂花的成熟叶片.
1.2 试验方法
1.2.1 叶表皮制片
取叶浸水0.5h,叶中部切成1cm×1cm的小块,放入2%的NaOH溶液中,室温下过夜,蒸馏水冲洗,剥离表皮,10%的H2O2溶液漂白5~10min,蒸馏水冲冼,1%番红酒精溶液染色5min,1%甘油封片.
1.2.2 石蜡制片
叶取最宽不超过1.5cm,叶脉居中的局部叶片,洗净,用锋利刀片截为纵长3~4mm的片段.花为整朵,不做处理.然后经过固定及保存→整染→脱水→透明→浸蜡→包埋→切片→展片及粘片→脱蜡→复水→染色→脱水及透明→封藏等程序,完成制片全过程并保存备用.
1.2.3 显微观察及测量
将叶的横切面,叶的上、下表皮细胞,不同开花阶段的花冠裂片的横切面在光学显微镜下观察.
成熟叶片的测量:叶片厚度,上、下蜡质层厚度,上、下表皮厚度,栅栏组织厚度,海绵组织厚度,栅栏组织细胞长度和宽度,海绵组织细胞长度和宽度.
花冠裂片的测量:不同开花阶段的花冠裂片厚度,上、下表皮厚度,基本薄壁组织厚度,基本薄壁组织细胞的长度和宽度.
2 结果与分析
2.1 花冠裂片基本结构及其特点
对桂花花冠裂片的切片观察可知,其横切面由外到内主要由上下表皮、基本薄壁组织和维管系统几部分组成(如图1),各部分均可见细胞核.

图1 花冠裂片横切结构(10×40)
花冠裂片的上表皮细胞微向外凸起,与空气接触的表面积较大,细胞较饱满,大多呈长圆形、椭圆形和方形等不规则状,下表皮细胞较小,形状较规则,上下表皮细胞均有密集的条纹刷状毛(如图2).基本薄壁组织细胞排列紧密,大小不一,但无异细胞存在.
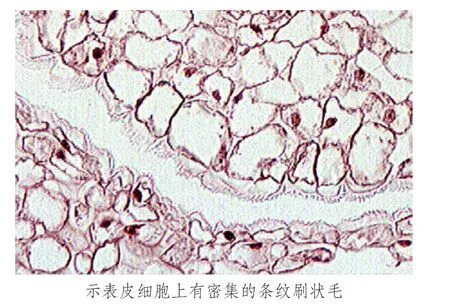
图2 花冠裂片表皮细胞(10×40)
2.2 花冠裂片与叶片显微结构差异比较
桂花的花冠裂片实质上是一种变态叶,但与叶片的功能不同,在解剖结构上也存在较大差异.对桂花的花冠裂片和成熟叶片的显微结构观察发现,其结构差异主要有以下三个方面:
(1)花冠裂片表皮细胞无蜡质层(如图1),成熟叶片表皮细胞具蜡质层,该蜡质层在光镜下形成一条清晰的亮带(如图3).

图3 叶表皮细胞的蜡质层(10×40)
(2)成熟叶片表皮细胞排列紧密,形状不规则,有腺毛分布,多个长圆形的腺毛细胞呈辐射状排列,腺毛周围的细胞呈二到多层同心环状排列在腺毛周围,腺毛细胞与周围的表皮细胞一起构成花环式结构(图4).叶片表皮细胞垂周壁光滑,没有密集的条纹刷状毛,而成熟的花冠裂片表皮层无腺毛和花环式结构,上下表皮细胞上均有密集的条纹刷状毛.
(3)花冠裂片基本薄壁组织细胞排列紧密,不含叶绿体,无石细胞,无栅栏组织和海绵组织分化.而成熟叶片叶肉中含叶绿体和石细胞,有栅栏组织和海绵组织的分化(如图5).栅栏组织由2~4层柱状细胞构成,排列整齐紧密,含叶绿体较多.在海绵组织中,紧靠下表皮的一层细胞排列较紧密,其它细胞排列疏松,含叶绿体较少.
桂花花冠裂片与成熟叶片解剖结构的数量特征差异有:(1)花冠裂片的表皮比叶片的更厚.叶片顶面观上下表皮细胞形状和大小极不一致,下表皮细胞边界不清,形状不规则,而花冠裂片的上下表皮细胞顶面观大小与形状均较为一致.(2)花冠裂片基本薄壁组织细胞与成熟叶片海绵组织细胞的形状相似,长宽比均为1.25左右,但基本薄壁组织细胞要大很多.详见表1、表2.

图4 表皮腺毛横切面(10×40)

图5 叶片横切结构(10×40)

表1 桂花成熟叶片解剖结构数量特征(单位/μm)

表2 桂花花冠裂片解剖结构的数量特征(单位/μm)
2.3 释香过程中花冠裂片细胞形态结构的变化
对桂花自然开放的5个时期花冠裂片横切面的光学显微镜观察结果表明(见图6-10):(1)从Ⅰ期开始,表皮细胞便可见条纹刷状毛,随着花的开放程度增加而稍微变粗.在开花过程中,花冠裂片上、下表皮细胞先变饱满,呈凸状,随后又由凸变凹,Ⅴ时期与其余时期相比,上、下表皮细胞出现内陷、变形,细胞缩水.(2)在桂花开放过程中,基本薄壁组织增厚,细胞不断膨大,但无异细胞产生,到Ⅴ时期基本薄壁细胞全部胀破(见表3).花冠裂片的这些结构变化与桂花香气释放之间的分子机理,尚待进一步深入研究.

图6 I期花冠裂片横切面(10×40)
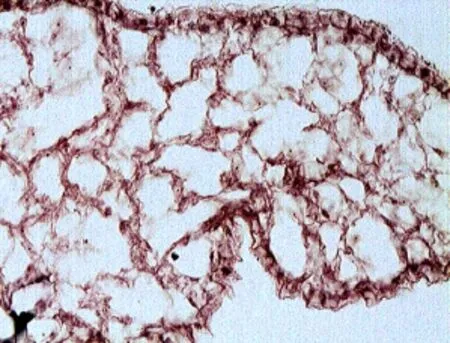
图7 II期花冠裂片横切面(10×40)

图8 III期花冠裂片横切面(10×40)

图9 IV期花冠裂片横切面(10×40)

图10 V期花冠裂片横切面(10×40)

表3 桂花开放5个时期花冠裂片解剖结构数量特征(单位/μm)
3 结论与讨论
植物体内的芳香油并非均匀分布,有的集中分布于根部和块茎内,有的以茎干中含量较高,有的以花中含量较高[8].有研究表明,某些植物花瓣的基本薄壁组织或部分特殊表皮细胞的内含物具有挥发性香气,该内含物可能为不溶性淀粉复合物或其它储藏物[9-10].张丽霞等[11]用电镜扫描观察不同释香阶段的离体茉莉花瓣,发现茉莉花瓣细胞含有大量颗粒状内含物,随着香气释放进一步加剧,其内含物数量不断减少,直至消失.由于实验仅采用普通生物光学显微镜观察,因而未能发现花冠裂片中存在颗粒状细胞内含物,只能观察到花冠裂片基本薄壁组织细胞排列紧密,大小有差异,未发现异细胞,并且在不同释香阶段,基本薄壁组织细胞不断膨大,甚至胀破.推测细胞的这种形态结构变化与释香进程有关,这有待于利用性能更高的电镜对花冠裂片进行扫描观察,探讨其颗粒状细胞内含物的具体化学成分,以及在细胞中的产生、形态、数量及位置的变化,进一步探讨挥发性香气的前体物产生与存在的部位和香气挥发的途径.
通过切片观察,在桂花花冠裂片表面发现具有条纹状皱褶形成的刷状毛,类似腺毛结构.植物的分泌结构主要有内分泌结构和外分泌结构两种类型[12],腺毛属于外分泌结构,这说明桂花的分泌结构是一种外分泌结构,其所分泌的芳香油类物质通过花冠裂片细胞间隙和细胞表面的刷状毛向外溢出,再挥发到空气中.这与尚富德[13]对桂花进行切片观察的研究结果一致.
因此在合适的时间段采摘桂花,可以利用更多的芳香油,从而较好保持其品质.根据花冠裂片显微结构观察结果,结合不同开花阶段桂花的香味程度可知,Ⅲ期和Ⅳ期桂花处在释香浓烈阶段,芳香油的含量最丰富,香气的品质最好,因此,在半开期和盛开期阶段采收桂花较为适宜.
[1]周媛,姚崇怀,王彩云.桂花切花品种筛选[J].浙江林学院学报, 2006,23(6):660-663.
[2]刘玉莲.桂花品种资源及其分类研究[J].江苏林业科技,2000,27 (S1):26-31.
[3]胡绍庆,邱英雄,吴关洪,等.桂花品种的ISSR-PCR分析[J].南京林业大学学报(自然科学版),2004,28(Z1):71-75.
[4]常炳华,胡永红,徐业根,等.桂花花冠裂片表面的超微结构观察[J].浙江林学院学报,2007,24(5):533-537.
[5]刘虹,何正洪,沈美英.超临界二氧化碳萃取桂花净油化学成分的研究[J].广西林业科学,1996,25(3):127-131.
[6]巫华美,陈训,何香银,等.贵州桂花净油的化学成分[J].云南植物研究,1997,19(2):213-216.
[7]麦秋君.桂花净油化学成分分析[J].广东工业大学学报,2000,17 (1):73-75.
[8]戴启金,戴启银.植物的芳香性与分泌结构[J].生物学通报,2005, 40(3):10-11.
[9]EFFMERTU,GROßEJ,RÖSEUSR,etal.Volatilecomposition, emissionpattern,andlocalizationoffloralscentemissioninMirabi⁃lisjalapa(Nyctaginaceae)[J].AmericanJournalofBotany,2005,92 (1):2-12.doi:10.3732/ajb.92.1.2.
[10]KOLOSOVAN,SHERMAND,KARLSOND,etal.Cellularand subcellularlocalizationofS-adenosyl-L-methionine:benzoicacid carboxylmethyltransferase,theenzymeresponsibleforbiosynthesis ofthevolatileestermethylbenzoateinsnapdragonflowers[J].Plant Physiology,2001,126(3):956-964.
[11]张丽霞,施兆鹏,刘德华,等.茉莉花瓣解剖结构的研究[J].湖南农业大学学报(自然科学版),1998,24(5):370-374.
[12]刘捷平.植物形态解剖学[M].北京:北京师范学院出版社,1991: 107-111.
[13]尚富德.桂花(OsmanthusfragransLour)生物学研究[D].南京:南京林业大学,2004.
【编校:王露】
AnatomicalStructureofCorollaLobesandEpidermalCellChangesinFloweringStageofOsmanthus Fragrans
ZHANGZehong,GUOShiqun
(SchoolofBiologicalScienceandTechnology,MinnanNormalUniversity,Zhangzhou,Fujian363000,China)
ThebasicmorphologicalanatomystructureofcorollalobesofOsmanthusfragransandthechangesofcellin theprocessofaromareleasingwerestudiedunderopticalmicroscopebyusingthebladeisolationmethodandtheparaffin sectionmethod,andsomequantitativecharacteristicsofthecorollalobesandmatureleavesweremeasuredandcompared withtodiscussthecellularstructuralbasisofaromareleasing.Theresultsshowthat:(1)Thecorollalobeiscomposed mainlyofthreeparts—theupperandlowerepidermis,parenchymaandslightlybasicbranchesofthevascularsystem. Theepidermalcellsareslightlyoutward,andthecellsurfaceiscoveredwiththerulesoftheprotrudingribs.(2)Theana⁃tomicalstructureofcorollalobesandmatureleavesaredifferent.(3)Theepidermalcellsofcorollalobesarechangedin theprocessofflowering.Thebasicparenchymacellsbecomethickandthecellscontinuetoexpand,buttherearenoidio⁃blast.ThesestructuresandchangeshavearoleindistributingfragranceofOsmanthusfragrans.
Osmanthusfragrans;corollalobes;theparaffinsectionmethod;anatomicalstructure
Q944.58
A
1671-5365(2015)12-0112-05
张泽宏,郭世群.桂花花冠裂片结构及其花期表皮细胞变化[J].宜宾学院学报,2015,15(12):112-116. ZHANGZH,GUOSQ.AnatomicalStructureofCorollaLobesandEpidermalCellChangesinFloweringStageofOsmanthus Fragrans[J].JournalofYibinUniversity,2015,15(12):112-116.
2015-09-25修回:2015-10-10
漳州市科协资助项目(漳科重2014012)
张泽宏(1981-),男,实验师,硕士研究生,研究方向为生物实验技术
时间:2015-10-1020:20
http://www.cnki.net/kcms/detail/51.1630.z.20151010.2020.001.html
