宫颈癌及癌前病变患者HPV感染与机体免疫状态的研究
2015-01-18蒋桔莲陈健钟倩怡金媛媛王美林陈琪卢洪胜
蒋桔莲 陈健 钟倩怡 金媛媛 王美林 陈琪 卢洪胜
宫颈癌及癌前病变患者HPV感染与机体免疫状态的研究
蒋桔莲 陈健 钟倩怡 金媛媛 王美林 陈琪 卢洪胜
目的钼探讨宫颈癌及癌前病变患者HPV感染及全身细胞免疫功能状态。方法钼选择2014年8月至2015年1月妇产科门诊就诊的宫颈癌及癌前病变患者271例,进行液基细胞学(TCT)、HPV-DNA和阴道镜下病理检查,同时行流式细胞术检测外周血淋巴细胞亚群。 结果 宫颈炎、宫颈上皮内瘤变Ⅰ级(CINⅠ)、宫颈上皮内瘤变Ⅱ级(CINⅡ)、宫颈上皮内瘤变Ⅲ级(CINⅢ)及宫颈鳞状细胞癌(SCC)患者随着宫颈病变程度的加重,HPV阳性率明显升高(P<0.05);随着病理分期的进展,HPV阳性率也明显升高(P<0.01)。CINⅠ、CINⅡ、CINⅢ及SCC组CD3+T细胞比例与宫颈炎组比较差异均无统计学意义(均P>0.05),CD4+T细胞比例逐渐下降,且SCC组与宫颈炎组相比有统计学差异(P<0.05),而CD8+T细胞比例有逐渐增加的趋势,且CINⅡ、CINⅢ、SCC组与宫颈炎组相比均有统计学差异(均P<0.05)。SCC及CINⅠ、CINⅡ、CINⅢ组CD19+B细胞比例比较差异均无统计学意义(均P>0.05),而NK细胞比例的差异与宫颈炎组比较均有统计学意义(均P<0.05),且随着病理分期进展逐渐递增。 结论 宫颈病变患者体内存在明显的淋巴细胞亚群偏移,可能与HPV病毒逃避免疫监视有关,了解这一变化可为免疫治疗干预癌前病变提供帮助。
液基细胞学 HPV-DNA 宫颈上皮内瘤样病变 宫颈癌 淋巴细胞亚群
宫颈癌是我国最常见的妇科恶性肿瘤之一,其发病率占女性恶性肿瘤第2位,仅次于乳腺癌。据统计,全球女性每年有新发宫颈癌病例约50万[1-2],在我国每年有14万新发病例[3],并且患者呈日益年轻化的趋势,对妇女的生命及生活质量造成了很大的威胁。目前认为,宫颈癌是由高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染引起的一种较常见的妇科疾病。HPV是一种无包膜的小型DNA病毒,研究提示HPV的清除失败与机体的细胞免疫功能异常有关[4]。本研究通过对不同级别宫颈病变患者进行HPV感染情况调查及外周血淋巴细胞亚群检测,来探讨宫颈病变患者的全身免疫功能变化,为宫颈癌的免疫治疗提供临床基础资料。
1 对象和方法
1.1 对象 选择2014年8月至2015年1月临海市妇幼保健院和台州市中心医院妇产科门诊就诊患者中,有宫颈糜烂、肥大、接触性出血、溃疡及乳头样增生等病变患者,进行液基细胞学(TCT)、HPV-DNA和阴道镜下病理活检3种方法检查。入选患者共271例,年龄21~68岁,平均(35.6±8.2)岁。
1.2 方法
1.2.1 主要试剂及仪器 CD3+-FITC/CD8+-PE/CD45+-PerCP/CD4+-APCCD3+-FITC /CD16+-PECD56+-PE/ CD45+-PerCP/CD19+-APC、同型对照及BD FACS Calibur配套试剂,均购自美国BD公司,检测仪器为BD FACS Calibur流式细胞仪。
1.2.2 TCT检查 用宫颈毛刷取宫颈外口和颈管的脱落细胞,将采集的细胞洗入盛有Thinprep 2000系统处理后,计算机程序控制自动完成,形成直径2 cm薄层均匀的图片,固定、染色、镜检。诊断标准采用2001年TBS诊断标准[3],包括炎症细胞改变、意义不明的非典型鳞状细胞(ASCUS)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)及鳞状细胞癌(SCC)。
1.2.3 HC2-HPV-DNA检测 采用美国Digene公司提供的第2代杂交捕获技术,可检测HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV68型13种高危型 HPV亚型。
1.2.4 宫颈组织病理活检 医生在阴道镜下行可疑部位多点活检或宫颈管搔刮术,标本送病理科检查,按2003年WHO子宫颈肿瘤组织学分类标准进行病理诊断和分期,包括慢性炎症、宫颈上皮内瘤变Ⅰ级(CINⅠ)、宫颈上皮内瘤变Ⅱ级(CINⅡ)、宫颈上皮内瘤变Ⅲ级(CINⅢ)、鳞状细胞癌(SCC)。
1.2.5 淋巴细胞亚群检测 所有观察对象均于清晨空腹抽取静脉血2~4ml,乙二胺四乙酸钾盐(EDTA-K2)抗凝。检测时吸取100~500μl静脉血加2~5ml不含固定剂的红细胞裂解液,分离有核细胞,用磷酸盐缓冲液制成细胞浓度为1×107/ml的单细胞悬液备用。按多色分析法进行染色,染色前按100μl/106细胞的比例加AB型血浆,4℃培养20min以阻断可结晶片段(Fc)受体。分别取EDTA-K2抗凝全血100μl加入3个试管,各自分别加入20μl同型对照、CD3+/CD8+/CD45+/CD4+、CD3+/ CD16+CD56+/CD45+/CD19+,室温下避光孵育20min,加入红细胞裂解液1ml,室温避光放置15~20 min,振荡混匀,1 500r/min离心5min,弃上清液,用2ml PBS洗涤1次,加入400μlPBS重新浮悬细胞,上流式细胞仪检测。使用BDFACSCalibur流式细胞仪配套的cellquest软件获取并分析10 000个细胞,同时设阴阳对照。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,组间比较采用方差分析。计数资料组间比较采用χ2检验。
2 结果
2.1 不同TCT检查结果患者HPV阳性率的比较 见表1。

表1 不同TCT检查结果患者HPV阳性率的比较[例(%)]
由表1可见,随着宫颈病变程度的加重,HPV阳性率明显升高(χ2=9.69,P<0.05)。
2.2 不同病理分期患者HPV阳性率的比较 见表2。
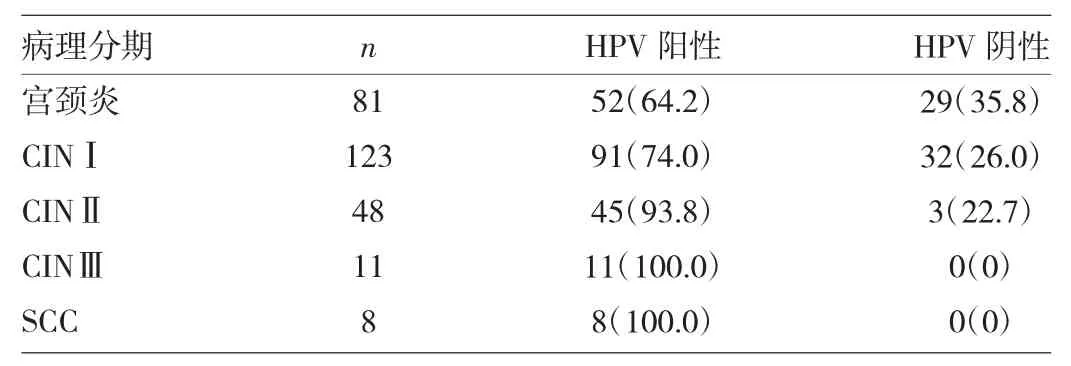
表2 不同病理分期患者HPV阳性率的比较[例(%)]
由表2可见,随着病理分期的进展,HPV阳性率明显升高(χ2=20.96,P<0.01)。
2.3 不同病理分期患者淋巴细胞亚群的表达 见表3。
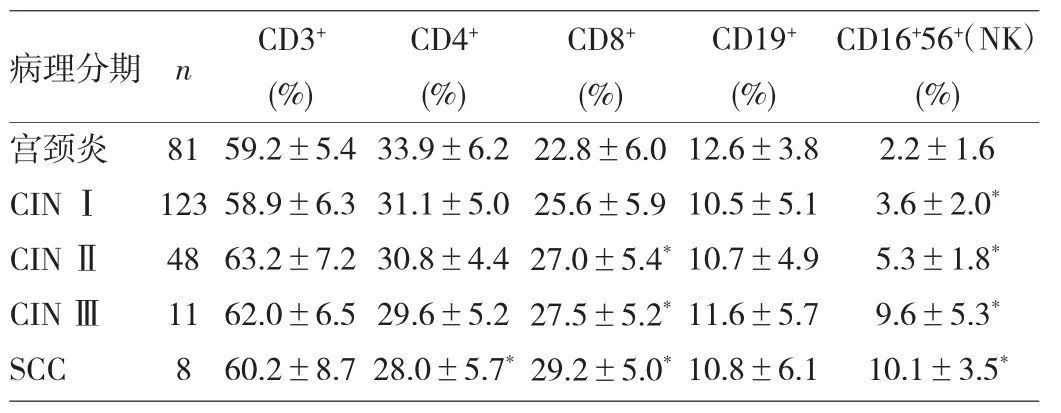
表3 不同病理分期宫颈病变患者淋巴细胞亚群表达水平比较
由表3可见,不同病理分期宫颈病变患者CD3+比例与宫颈炎组比较差异无统计学意义(P>0.05)。而随着宫颈病变病理级别的增高,患者的CD4+T细胞比例逐渐下降,SCC组与宫颈炎组相比有统计学差异(P<0.05);相反,CD8+T细胞比例有逐渐增加的趋势,且CINⅡ、CINⅢ、SCC组与宫颈炎组相比均有统计学差异(均P<0.05)。CD19+B细胞的表达在各组间的差异均无统计学意义(均P>0.05)。CINⅠ、CINⅡ、CINⅢ及SCC组NK细胞的表达与宫颈炎组比较差异均有统计学意义(均P<0.05),且随着病理分期的进展逐渐递增。SCC组与宫颈炎组外周血淋巴细胞流式细胞仪检测结果的比较见图1。

图1 SCC组与宫颈炎组外周血淋巴细胞流式细胞仪检测散点图(A1:宫颈炎组淋巴细胞;A2:宫颈炎组CD3+CD4+;A3:宫颈炎组CD3+CD8+;A4:宫颈炎组B淋巴细胞、NK细胞;B1:SCC组淋巴细胞;B2:SCC组CD3+CD4+;B3:SCC组CD3+CD8+;B4:SCC组B淋巴细胞、NK细胞)
由图1可见,宫颈炎组与SCC组淋巴细胞比例无差异,宫颈炎组CD3+CD4+细胞比例高于SCC组,宫颈炎组CD3+CD8+细胞比例低于SCC组,宫颈炎组B淋巴细胞、NK细胞比例低于SCC组。
3 讨论
宫颈癌是常见的女性生殖道恶性肿瘤之一,从CINⅠ、CINⅡ、CINⅢ最后发展到SCC是一个连续漫长的过程,持续的高危型HPV感染是其发生、发展的生物学病
因[5-6]。
HPV是一种无包膜的小型DNA病毒,主要编码两类蛋白,即早期蛋白(E)和晚期蛋白(L),它具有很强的免疫逃逸能力[7]。从免疫学的观点看,在HPV与人体免疫系统的对抗中,主要是病毒自身的或诱导的免疫逃逸机制和人体的免疫应答机制之间的平衡来决定病变的转归。淋巴细胞是构成机体免疫网络的重要组成部分,而T细胞介导的免疫反应在机体抗肿瘤过程中发挥着重要作用。由于NK细胞具有部分T细胞分化抗原,活化NK细胞可产生IFN-γ,因此一般认为NK细胞与T细胞在发育上关系非常密切[8]。淋巴细胞亚群分析是检测体液免疫功能和细胞免疫功能的重要方法,可以反映机体当前的免疫功能状态和平衡水平。HPV和异型增生细胞的清除与否,与宫颈局部的免疫微环境内的平衡息息相关,干预失衡状态并使其向促进免疫反应的方向发展,应该有助于HPV的清除和CIN的消退。细胞毒性T细胞(CTLs)是Thl免疫应答的主要效应成分,能够清除被病原微生物感染的细胞,人体清除被HPV感染的细胞可能主要是依靠细胞毒性作用完成[9]。
我们对宫颈病变患者外周血CD3+、CD4+、CD8+、CD19+、CD16+CD56+等淋巴细胞亚群与分期的关系进行了研究,研究结果显示,不同病理分期宫颈病变患者CD3+比例与宫颈炎组无统计学差异;CD4+T细胞比例随着宫颈病变病理级别的增加而逐渐下降,相反,CD8+T细胞比例逐渐升高;CD19+B细胞比例各组间均无统计学差异,而不同病理分期宫颈病变患者NK细胞比例与宫颈炎组比较有统计学差异,并随着病理及临床分期进展而逐渐递增。本研究的几项统计数据表明,随着宫颈细胞学及组织学检查结果严重程度的升级,宫颈HPV感染的检出率明显增加,差异有统计学意义。由此可见,宫颈癌前期病变及宫颈癌是以HPV感染为核心,以LSIL及HSIL病变构成的生物学谱系为特征的一组连续性病变[10]。患者体内存在明显的淋巴细胞亚群偏移,这可能是病毒发生免疫逃逸,由此避免免疫监视,而引起宫颈上皮细胞病变发生、发展的一种机制。因此,了解宫颈病变患者全身免疫功能的变化,可对其免疫治疗提供帮助。
[1] 宋云红.老年宫颈癌与中青年宫颈癌的临床及病理特点对比[J].中国老年学杂志,2013,33(22):5600.
[2] 李贞,孙小丽,吴坤河,等.CDK8在宫颈癌及宫颈上皮内瘤变中表达及意义的初步研究[J].实用妇产科杂志,2013,29(11):848.
[3] 邢志艳,徐东艳,郝百连,等.955例妇科就诊妇女人乳头瘤病毒感染筛查结果分析[J].生殖医学杂志,2013,22:951-953.
[4] 吕江涛,孙婷婷,陈飞,等.宫颈上皮内瘤变患者淋巴细胞亚群的分析[J].生殖医学杂志,2014,9(23):743-747.
[5] 严敏婵,张晓雪,陈东,等.人乳头状瘤病毒感染致宫颈癌及癌前病变风险研究[J].浙江医学,2010,32(6):825-828.
[6] 孙翀,张丽琴,岳天孚.HPV单一感染与多重感染对宫颈病变影响的比较[J].国际妇产科学杂志,2013,40(1):77-79.
[7] Zhao X,Deak E,Soderberg K,et al.Vagin al submucosal dendritic cells,but not Langerhans cells,induce protective Th1 responses to herpes simplex virus-2[J].J Exp Med,2003,197:153-162.
[8] Takeuchi O,Akira S.Recognition of viruses by innate immunity[J]. ImmunolRev,2007,220:214-224.
[9] Van der Burg S H,Palefsky J M.Human immunodeficiency virus and human papilloma virus-why HPV-induced lesions do not spontaneously resolve and why therapeutic vaccination can be successful[J].J TranslMed,2009,7:108.
[10] Robboy S J,Anderson M C,RussellP(美).女性生殖道病理学[M].回允中译.北京:北京大学医学出版社,2005:137-191.
HPV infection and immune status in cervical carcinoma and cervical intraepithelial neoplasia
JIANG Julian,CHEN Jian,ZHONG Qianyi,et al.Department of Gynecology and Obstetrics,Linhai Women's and Children's Hospital,Linhai 317000,China
【 Abstract】 Objective To investigate HPV infection and immune status in squamous cervical carcinoma(SCC)and cervical intraepithelial neoplasia(CIN). Methods Two hundred and seventy one patients with cervical lesions visiting outpatient department from August 2014 to January 2015 were included in the study.TCT,HPV-DNA tests and colposcopic cervical biopsies were performed,and peripheral blood lymphocyte subsets were examined with flow cytometry in all patients. Results In patients with chronic cervicitis,CINⅠ,CINⅡ,CINⅢand SCC the positives of HPVexpression were increased with the progress of cervical diseases(P<0.05).And with the progress of the pathological staging,the positive rates of HPV were increased(P<0.01).There was no significant difference in CD3+T-lymphocytes among chronic cervicitis,CIN and SCC(all P>0.05).CD4+T-lymphocytes were decreased with the progress of cervical diseases(P<0.05),while CD8+T-lymphocytes were increased(allP<0.05).There was no significant difference in CD19+B-lymphocytes(all P>0.05),while significant difference in NK cells among different cervical diseases(all P<0.05),the degree of positivity was correlated with clinicopathological stages. Conclusion HPVinfection rate is increased with the progress of cervical lesions,which is associated with the decreased immune status of patients.
TCT HPV-DNA Cervical intraepithelial neoplasia Cervical carcinoma Lymphocyte subsets
2015-05-11)
(本文编辑:沈叔洪)
317000 临海市妇幼保健院妇产科(蒋桔莲、金媛媛、王美林,蒋桔莲现在台州市立医院产科工作);台州医院恩泽妇产医院妇产科(陈健);台州市中心医院检验科(钟倩怡、陈琪),病理科(卢洪胜)
