不同分期胃腺癌及癌旁组织蛋白质表达谱的研究
2015-01-18褚美芬陈毓郭剑民吴怡春
褚美芬 陈毓 郭剑民 吴怡春
不同分期胃腺癌及癌旁组织蛋白质表达谱的研究
褚美芬 陈毓 郭剑民 吴怡春
目的钼建立II、IV期胃腺癌及癌旁胃组织的蛋白质表达谱并分析其表达的差异。方法钼从胃腺癌II期和IV期患者各3例提取胃癌组织(CaII和CaIV)及胃旁组织(PII和PIV)中总蛋白,采用双向凝胶电泳获得CaII、CaIV、PII、PIV胃组织蛋白质表达谱,通过基质辅助激光解吸电离串联飞行时间质谱(MALDI-TOF/TOF)对主要差异蛋白进行分析。 结果 PII与CaII之间蛋白质表达有显著差异(达2.0倍以上)的蛋白点有28个,CaII3个蛋白点表达上调,25个蛋白点表达下调;PIV与CaIV之间蛋白质表达有显著差异(达2.0倍以上)的蛋白点有25个,CaIV这些蛋白点表达均下调。使用MALDI-TOF/TOF质谱成功鉴定到8个蛋白点在CaII和CaIV中的表达与PII、PIV均有显著差异,分别是谷胱甘肽巯基转移酶、内质网蛋白ERP29、SH3P、蛋白质膜联蛋白A4、肝脏型脂肪酸结合蛋白、磷酸丙糖异构酶、Transgelin和磷脂酰乙醇结合蛋白,这些蛋白大多与细胞增殖、细胞凋亡及信号转导相关。 结论 不同分期胃癌与其癌旁组织之间存在蛋白质表达差异,有助于从分子水平了解胃癌的发病机制,探索新的胃癌相关标志物和基因治疗靶点。
胃腺癌 蛋白质组学 双向凝胶电泳 MALDI-TOF/TOF
【 Abstract】 Objective To analyze protein profiles in gastric carcinoma with different stages. Methods The total proteins were extracted from specimens of gastric carcinoma TNM stage II and VI(CaII,CaIV)and corresponding pericancerous gastric tissue(PII,PIV).The proteins were separated by two-dimensional gel electrophoresis(2-DE)and analyzed by laser desorption ionization time of flight mass spectrometry(MALDI-TOF/TOF). Results There were 28 significantly spots between PII and CaII(>2.0),among which 3 spots were up-regulated and 25 spots were down-regulated in CaII;25 significantly spots were found between PIV and CaIV(>2.0),all of which were down-regulated in CaIV.Eight spots in gastric carcinoma tissue were identified by MALDI TOF/TOF mass spectrometry.Glutathione S-transferase,ERP29,SH3P,Annexin A4,liver fatty acid binding protein,triosephosphate isomerase isoform 2,transgelin and phosphatidylethanolamine-binding protein 1 were identified in both CaII and CaIV,compared with the corresponding pericancerous tissue. Conclusion Protein expressions are different between gastric cancer tissue and the corresponding pericancerous tissue.
胃癌是消化系统最常见的恶性肿瘤之一[1]。每年胃癌新发病例大约为100万人,死亡病例87万人。据统计,大约有2/3的胃癌病例发生在发展中国家,是中国发病率较高的恶性肿瘤之一[2]。蛋白质组学是后基因组时代对蛋白质组研究和探索的一个新的领域,它主要是通过对蛋白质水平上细胞基因表达终产物进行定性和定量分析来揭示生命活动的过程和基因表达的调控机制[3]。很多研究已经证明蛋白质组学在恶性肿瘤研究中有显著的临床意义[4-5]。近几年,蛋白质组学在胃癌中也有较广泛的研究[6]。本研究拟采用传统双向凝胶电泳技术对胃癌不同分期组织蛋白质表达谱进行比较分析,再通过基质辅助激光解吸电离串联飞行时间质谱(MALDI-TOF/TOF)对主要差异蛋白进行分析,所得结果与蛋白质组数据库进行比对分析确定差异表达蛋白质,建立蛋白差异表达谱,以期为揭示差异表达蛋白质在不同时期胃腺癌动态变化规律及其内在联系提供依据。
1 材料和方法
1.1 材料
1.1.1 标本 胃癌组织及癌旁组织样本来自2013年10~12月浙江省肿瘤医院外科手术患者,均为男性,年龄53~65岁。根据TNM分期标准,经病理及免疫组化证实为Ⅱ期和Ⅳ期胃腺癌各3例。癌旁组织分别为癌灶周围5cm以外胃黏膜组织,均经病理证实无癌细胞侵润。6例患者均自愿入组并签署相关知情同意书。
1.1.2 试剂和仪器 NP-40、β-巯基乙醇、蛋白酶抑制剂cocktail、二硫苏糖醇(DTT)、碘乙酰胺、尿素、硫脲、CHAPS、琼脂糖、溴酚蓝、考马斯亮蓝、两性电解质载体、ImmobilineTM干胶条(13cm,pH3~10)、Bradford protein assay reagent均为美国GE Healthcare公司产品;Tris、甘氨酸、十二烷基硫酸钠(SDS)、丙烯酰胺、甲叉丙烯酰胺均为德国Amresco公司产品。EttanTMIPGphor3TM等电聚焦仪、SE600Ruby标准垂直电泳槽、图像分析软件ImageMaster 2D Platinum 6.0均为美国GE Healthcare产品;UMax Powerlook 2110XL扫描仪为美国GE Amersham公司产品;4800 Plus MALDI TOF/TOFTMAnalyzer为美国Applied Biosystems公司产品。
1.2 方法
1.2.1 组织标本的处理 无菌条件下切取手术后新鲜标本,用0.9%氯化钠溶液多次冲洗以去除血液并尽量切除结缔组织及坏死组织,处理后的样品立即置于-80℃冻存备用。
1.2.2 组织总蛋白的提取 将组织标本100mg快速浸于液氮之中充分研磨直至粉末状后,用1ml 2D裂解液(7mol/L尿素,2mol/L硫脲,4%CHAPS,40mmol/L Tris,0.5%TritonX-100,65mmol/L DTT,0.5%两性电解质载体pharmalyte)裂解后加入蛋白酶抑制剂(Cocktail)。冰浴超声裂解(80W,10次,每次10s,间隔15s,冰上完成)超声后离心12 000×g,45min,4℃,取上清液,加丙酮沉淀过夜,离心,弃上清液,用丙酮洗3次,晾干,加适量2D裂解液溶解沉淀,使用Bradford protein assay reagent测定蛋白质浓度,分装,置于-80℃保存备用。
1.2.3 双向凝胶电泳 第一向等点聚焦(IEF):采用13cm pH3~10的固相干胶条。样品和水化液共250μl用于IPG胶条上样,室温下吸胀过夜。等点聚焦使用Ettan IPGphor 3等点聚焦仪进行,运行参数如表1。聚焦结束后,将胶条置于平衡液I(6M尿素,pH8.8的50mM Tris-HCl,30%甘油,4%SDS,1%DTT)中平衡15min,然后在平衡液Ⅱ(6M尿素,pH8.8的50mM Tris-HCl,30%甘油,4%SDS,2.5%碘代乙酰胺)中平衡15min后转移至第二向进行分离。第二向 SDS-PAGE在SE600Ruby标准垂直电泳槽上进行,采用聚合度12.5%的分离胶浓度。

表1 IEF参数设置
1.2.4 凝胶染色并扫描分析 电泳结束取下凝胶,银染显色后用UMax Powerlook 2110XL扫描仪扫描凝胶,ImageMaster 2D Platinum 6.0胶图像分析软件依次对两组样品进行点检测、背景消减、均一化、建立平均凝胶,匹配、量化获取斑点的相关信息并对两组样品分别进行t-test分析,如果表达量差距在2.0倍以上则视为存在明显的差异表达并得出差异表达蛋白点的具体数据。
1.2.5 差异蛋白点的质谱鉴定 用枪头将选取的差异蛋白质斑点从预制胶上取下,超纯水洗涤3次,按50μl/蛋白点依次加入工作液Ⅰ[30mmol/L K3Fe(CN)6]和Ⅱ(100mmol/L Na2S2O3),1∶1混合,振荡摇匀,洗至蛋白质点颜色消失,去除上清液,用超纯水漂洗数次终止反应。终止后,加入溶液(Ⅲ200mmol/L NH4HCO3)静置20min,吸取上清液,纯水漂洗数次终止反应,反复加入乙氰使胶脱水至白色,真空干燥冻干。冻干后,加入酶解缓冲液Ⅳ(10ng/μl Trypsin,50mmol/L NH4HCO3,pH8.0),37℃孵育过夜。酶解后,加入10~20μl溶液V(50%乙氰(Acetonitrile,CAN),0.1% 三氟乙酸 (Trifluoroacetic acid,TFA),超声15min,抽提肽片段,将抽提液真空干燥,冻干。冻干的样品用0.1%TFA复溶,通过C18 ZipTip(Millipore,Bedford,MA)进行脱盐,基质选用5mg/ml的α-4-羟基肉桂酸(α-4-hydroxy cinnamic acid,CHCA)溶解在0.1%TFA和50%ACN中,进行质谱分析,利用MASCOT在NCBI蛋白质网站数据库中进行检索。
2 结果
2.1 双向凝胶电泳 分别对Ⅱ期癌旁组织(PⅡ)和Ⅱ期胃癌组织(CaⅡ)、Ⅳ期癌旁组织(PⅣ)和Ⅳ期胃癌组织(CaⅣ)进行3次重复双向凝胶电泳,PⅡ和CaⅡ,PⅣ和CaⅣ的蛋白双向电泳凝胶图见图1。利用Image-Master 2D Platinum 6.0胶图像分析软件进行分析,两两比较后发现,PⅡ与CaⅡ之间蛋白质表达有显著差异(达2.0倍以上,P<0.05)的蛋白点有28个,CaⅡ3个蛋白点表达上调,25个蛋白点表达下调;PⅣ与CaⅣ之间蛋白质表达有显著差异(达2.0倍以上,P<0.05)的蛋白点有25个,CaⅣ这些蛋白点表达均下调。部分差异蛋白点在PⅡ与CaⅡ及PⅣ与CaⅣ组织中两两比对放 大图谱如图2所示。

图1 胃腺癌组织蛋白质双向凝胶电泳图谱

图2 部分胃癌组织双向凝胶电泳放大图谱(A:PⅡ和CaⅡ差异表达蛋白;B:PⅣ与CaⅣ差异表达蛋白)
2.2 差异蛋白点的质谱鉴定 切取在CaⅡ和CaⅣ中表达差异2.0倍以上的蛋白点44个,使用MALDI TOF/ TOF质谱成功鉴定到38个蛋白点,鉴定成功率95%。经MASCOT搜索NCBI数据库后发现有8个蛋白在Ⅱ期和Ⅳ期胃癌组织中均有显著差异表达,见表2。结果显示,谷胱甘肽巯基转移酶(spot 1400)、内质网蛋白ERP29(spot 1441)、SH3P(SH3 domain-binding glutamic acid-rich-like protein,spot 1874)、蛋白质膜联蛋白A4(ANXA4,sopt 1316)、肝脏型脂肪酸结合蛋白(spot1892)、磷酸丙糖异构酶(spot 1503)、Transgelin(spot 1593)及磷脂酰乙醇结合蛋白(spot 1618)在CaⅡ和CaⅣ胃癌组织中均比其对应的PⅡ和PⅣ中显著下调;其中谷胱甘肽巯基转移酶、内质网蛋白ERP29、SH3P在CaⅡ和CaⅣ中下调表达幅度基本一致;而蛋白质膜联蛋白A4、脂肪酸结合蛋白在CaⅣ中下调幅度更大;磷酸丙糖异构酶、转凝蛋白、磷脂酰乙醇结合蛋白在CaⅡ中的表达下调更显著。
3 讨论
近年来通过蛋白质组学寻找分子标记物来治疗胃癌越来越受到研究者的重视[7-8]。本研究运用传统的双向凝胶电泳技术建立了人CaⅡ和CaⅣ蛋白差异图谱,并用ImageMaster 2D Platinum 6.0胶图像分析软件找出在CaⅡ和CaⅣ中均有差异蛋白点,并对其进行质谱鉴定。通过初步探讨,发现这些差异表达蛋白与胃癌细胞信号传导、维持细胞形态及正常防御功能、促进细胞分裂增殖及细胞凋亡等有关。
谷胱甘肽巯基转移酶(GSTs)是人体内生物转化最重要的Ⅱ相代谢酶之一,是细胞抗氧化损伤、抗癌变的主要解毒酶,与人类肿瘤关系密切[9-10]。有研究显示,GSTs-π在胃癌组织中呈高表达,GSTs-π的过度表达有利于细胞内解毒,但同时也促进细胞分化进而促进细胞癌变[11]。本研究中GSTs在CaⅡ和CaⅣ中均表达下调,这可能由于GSTs低表达导致解毒功能降低从而增加了胃癌的发生。
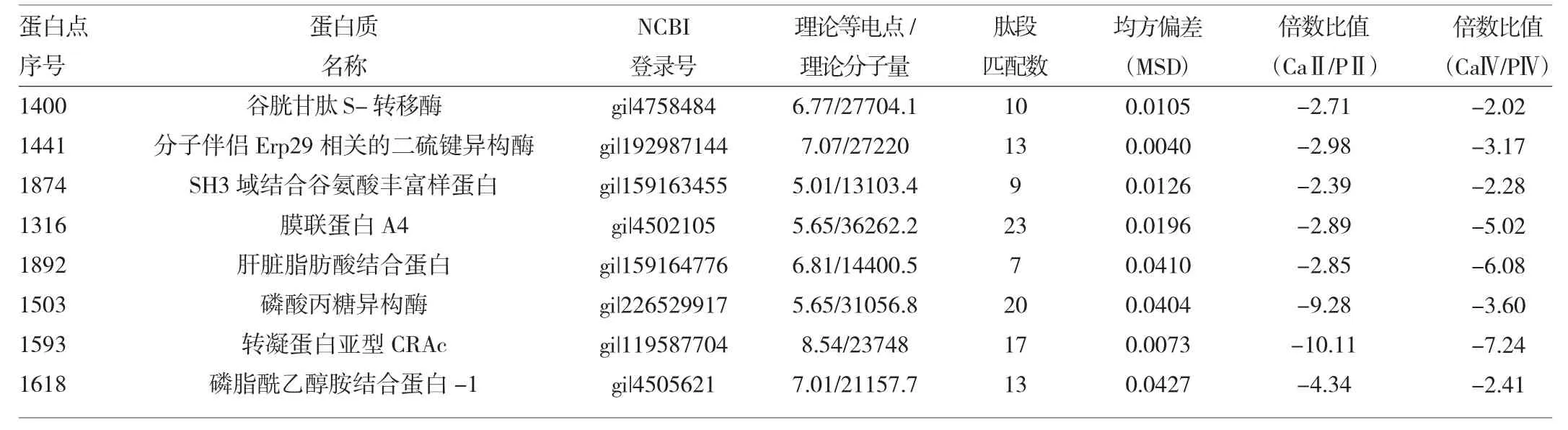
表2 差异蛋白质谱鉴定结果
近年来,研究者们发现内质网分子伴侣(ERP29)在多种肿瘤如乳腺癌、肝癌、结直肠癌等中表达下调,具有抑癌基因的作用,与肿瘤细胞增殖、侵袭、迁移和凋亡密切相关,对于肿瘤的诊断、治疗和预后具有重要意义[12]。近期,有研究发现ERP29在胃癌组织中也下调表达[13],但是关于ERP29在胃癌中的具体机制依然不清楚。本研究结果显示:ERP29在CaⅡ和CaⅣ中均表达下调,这可能是胃癌细胞由于缺氧、营养物质缺乏等微环境改变,参与启动细胞防卫性反应的ERP29表达下调,不能有效消除内质网应激反应,从而导致胃癌的进一步发生。
SH3LP是谷胱甘肽依赖的氧化还原酶超级家族成员。有研究显示,SH3LP在大脑多形性胶质母细胞瘤中表达上调[14]。然而,本研究结果显示:SH3LP在CaⅡ和CaⅣ中均表达下调,这可能是由于SH3LP的下调表达引起细胞内活性氧水平下降,影响细胞凋亡的进程[15],进而促进癌细胞的增殖。
ANXA4,是细胞内的Ca2+传感器,最初在上皮细胞中发现,并且参与细胞凋亡、细胞周期和抗凝各种生物进程[16]。在胃癌细胞中,ANXA4触发信号级联,导致上皮细胞增殖的增加,最终促进癌变[17]。但是当肿瘤出现向外侵袭时,瘤内的ANXA4的表达反而下调[18]。本研究中ANXA4在CaⅡ和CaⅣ中均表达下调,且在Ⅳ期胃癌组织中表达下调更显著。提示Ⅳ期胃癌患者,肿瘤可能已经开始出现向外侵袭的现象,其临床意义及机制仍需进一步研究。
脂肪酸结合蛋白是细胞内脂肪酸载体蛋白,其在细胞内利用脂肪酸发挥着重要作用,主要参与胞内长链脂肪酸的摄取、转运、代谢调节以及保护细胞免受游离脂肪酸毒性反应[19]。在长沙鼠胃癌模型的蛋白质组学研究[20]及DNA芯片技术筛选胃癌基因的研究[21]中均发现脂肪酸结合蛋白表达下调,这与我们的研究结果一致,而且本次研究还发现在Ⅳ期胃癌组织中其表达下调更明显。这提示,可能随着癌细胞增殖,脂肪酸结合蛋白表达下降,不能及时清除游离脂肪酸毒性,同时抑制细胞凋亡的发生。
磷酸丙糖异构酶是糖酵解途径中的关键酶。研究显示,部分糖酵解关键酶在肿瘤中除了参与葡萄糖代谢以外,还能够促进恶性肿瘤增殖、抵抗癌细胞死亡,具有促癌作用[22]。本研究结果显示:该蛋白在CaⅡ和CaⅣ中均表达下调,但与CaⅡ相比,在CaⅣ中的表达比CaⅡ中略有上调。我们推测磷酸丙糖异构酶在胃癌组织中表达下调导致能量代谢受阻,之后随着肿瘤的增殖,抵抗癌细胞死亡能力减弱,导致其在Ⅳ期癌组织中的表达出现一定程度的上调。这需要我们进一步的验证。
Transgelin是一种MMP-9表达的转录调控因子,通过ERK激活受损的方式降低AP-1依赖的反式活化从而抑制MMP-9表达[23]。研究显示,Transgelin在胃癌组织中过表达[24],但具体与胃癌发生、发展机制尚不清楚。本研究结果显示:Transgelin在CaⅡ和CaⅣ中均下调表达,然而相比CaⅡ,该蛋白在CaⅣ中表达略有上调。可能是随着癌症进展,Transgelin又再次被激活从而导致其蛋白表达上调,推测transgelin的表达降低可能是在这些胃癌组织中MMP-9表达增加而造成的,这需要在以后的研究工作中进一步证实。
磷脂酰乙醇胺结合蛋白(PEBP)在肿瘤领域的临床研究价值得到了越来越多的支持和认可[25]。最近研究显示,诱导胃癌发生的幽门螺杆菌能够促进蛋白酶体介导的PEBP1的降解以及PEBP1转录抑制因子Snail的表达[26]。本研究结果显示:PEBP在CaⅡ和CaⅣ中均下调表达,提示胃癌的发生与PEBP之间存在一定的联系,但是具体机制仍需要进一步研究。
综上所述,本研究通过对CaⅡ和CaⅣ组织以及癌旁组织进行蛋白质组学分析,获得一定数量蛋白质表达谱数据。在CaⅡ和CaⅣ中发现多个蛋白参与到细胞信号转导、细胞增殖以及细胞凋亡过程中,为揭示差异表达蛋白在不同时期胃腺癌动态变化规律及其内在联系提供一定依据,但仍然需要大量样本进行进一步研究证实。
[1] JemalA,Center M M,DeSantis C,et al.Global patterns of cancer incidence and mortality rates and trends[J].Cancer Epidemiol Biomarkers Prev,2010,19(8):1893-1907.
[2] Jing J J,Liu H Y,Hao J K,et al.Gastric cancer incidence and mortality in Zhuanghe,China,between 2005 and 2010[J].World J Gastroenterol,2012,18(11):1262-1269.
[3] Williams K L.Genomes and proteomes:towards a multidimensionalview ofbiology[J].Electrophoresis,1999,20(4-5):678-688.
[4] de Wit M,Fijneman R J,VerheulH M,et al.Proteomics in colorectal cancer translational research:biomarker discovery for clinical applications[J].Clin Biochem,2013,46(6):466-479.
[5] Fontana S,Saieva L,Taverna S,et al.Contribution of proteomics to understanding the role of tumor-derived exosomes in cancer progression:state ofthe art and new perspectives[J].Proteomics, 2013,13(10-11):1581-1594.
[6] Fowsantear W,Argo E,Pattinson C,et al.Comparative proteomics of Helicobacter species:the discrimination of gastric and enterohepatic Helicobacter species[J].J Proteomics,2014,97:245-255.
[7] Aichler M,Luber B,Lordick F,et al.Proteomic and metabolic prediction ofresponse to therapy in gastric cancer[J].World journalof gastroenterology:WJG,2014,20(38):13648.
[8] Liu W,Yang Q,Liu B,et al.Serum proteomics for gastric cancer [J].Clin Chim Acta,2014,431:179-184.
[9] Tian Y,Tan A C,Sun X,et al.Quantitative proteomic analysis of ovarian cancer cells identified mitochondrial proteins associated with paclitaxelresistance[J].PROTEOMICS-ClinicalApplications, 2009,3(11):1288-1295.
[10]Ma Y,WeiX,Han G,etal.Glutathione S-transferase P1 Ile105Val polymorphism contributes to increased risk of gastric cancer in East Asians[J].Tumour Biol,2013,34(3):1737-1742.
[11] Xiuxue H L,Yue,Juan D.Expression and clinical significance of GST-π gene in gastric cancer tissues[J].International Journal ofLaboratory Medicine,2012,19:18.
[12] Zhang D,Richardson D R.Endoplasmic reticulum protein 29 (ERp29):An emerging role in cancer[J].Int J Biochem Cell Biol, 2011,43(1):33-36.
[13] 桑旭,张甲,袁光金,等.内质网分子伴侣29在胃癌中的表达及临床意义研究[J].中华全科医学ISTIC,2013,11(7):1021-1023.
[14] Khalil A A.Biomarker discovery:a proteomic approach for brain cancer profiling[J].Cancer Sci,2007,98(2):201-213.
[15] Xu C,Zheng P,Shen S,et al.NMR structure and regulated expression in APL cell of human SH3BGRL3[J].FEBS Lett,2005, 579(13):2788-2794.
[16] DreierR,Schmid K W,Gerke V,et al.Differential expression of annexins I,II and IV in human tissues:an immunohistochemical study[J].Histochem CellBiol,1998,110(2):137-148.
[17] Lin L L,Huang H C,Juan H F.Revealing the molecular mechanism ofgastric cancer marker annexin A4 in cancer cellproliferation using exon arrays[J].PLoS One,2012,7(9):e44615.
[18] 陈滨,彭民浩,李佳荃.膜联蛋白A4在原发性肝细胞癌中的表达及其意义[J].广西医学,2009,31(3):308-311.
[19] Sorof S.Modulation of mitogenesis by liver fatty acid binding protein[J].Cancer Metastasis Rev,1994,13(3-4):317-336.
[20] Zhao Y Y.Xie X,Chen,et al.Establishment of Mongolian gerbil modelof gastric cancer induced by Helicobacter pyloriinfection and its proteomics analysis[J].Zhonghua Bing Li Xue Za Zhi, 2014,43(12):820-826.
[21] Jin Y,Da W.Screening of key genes in gastric cancer with DNA microarray analysis[J].Eur J Med Res,2013,18:37.
[22] Hu Z Y,Xiao L,Bode AM,et al.Glycolytic genes in cancer cells are more than glucose metabolic regulators[J].JournalofMolecular Medicine,2014,92(8):837-845.
[23] AssinderS J,Stanton J A,Prasad P D.Transgelin:an actinbinding protein and tumour suppressor[J].Int J Biochem Cell Biol,2009,41(3):482-486.
[24] Huang Q,Chen W,Wang L,et al.Identification of transgelin as a potential novel biomarker for gastric adenocarcinoma based on proteomics technology[J].Journal of Cancer Research and ClinicalOncology,2008,134(11):1219-1227.
[25]楼剑洲.磷脂酰乙醇胺结合蛋白1在肿瘤中作用的研究进展[J].中国肿瘤生物治疗杂志,2013,20(3):376-380.
[26] Moen E L,Wen S,Anwar T,et al.Regulation of RKIP function by Helicobacter pylori in gastric cancer[J].PLoS One,2012,7(5): e37819.
(本文编辑:沈昱平)
《浙江医学》对图表的要求
稿件中若有图表,分别按其在正文中出现的先后次序连续编码。每幅图应冠有图题。说明性的文字应置于图下方注释中,并在注释中标明图表中使用的全部非公知公用的缩写。线条图应墨绘在白纸上,高宽比例以5∶7为宜。以计算机制图者应提供激光打印图样。照片图要求有良好的清晰度和对比度;图中需标注的符号(包括箭头)请用另纸标上,不要直接写在照片上。每幅图的背面应贴上标签,注明图号、方向及作者姓名。若刊用人像,应征得本人的书面同意,或遮盖其能被辨认出系何人的部分。大体标本照片在图内应有尺度标记。病理照片要求注明染色方法和放大倍数。图表中如有引自他刊者,应注明出处。电子版投稿中图片建议采用JPG格式。表格建议采用三横线表(顶线、表头线、底线),如遇有合计和统计学处理内容(如t值、P值等),则在此行上面加一条分界横线;表内数据要求同一指标有效位数一致,一般按标准差的1/3确定有效位数。
本刊编辑部
Proteomic analysis of gastric cancer with different stages
CHU Meifen,CHEN Yu,GUO Jianmin,et al.Department of Laboratory Medicine,Zhejiang Medical College,Hangzhou 310053,China
Gastric cancerProteomics Two-dimensional gel elctrophresis MALDI-TOF/TOF
2015-04-24)
浙江省医药卫生科技计划(2013KYA047)
310053 杭州,浙江医学高等专科学校检验系(褚美芬、陈毓、吴怡春);浙江省肿瘤医院腹部外科(郭剑民)
吴怡春,E-mail:wuyichun1@yeah.net
