C臂CT引导经皮乙醇消融术在巨块型肝癌经肝动脉化疗栓塞后的近期疗效
2015-01-16黄郭灏任建庄段旭华张萌帆
黄郭灏, 任建庄, 段旭华, 张 凯, 张萌帆
·肿瘤介入Tumor intervention·
C臂CT引导经皮乙醇消融术在巨块型肝癌经肝动脉化疗栓塞后的近期疗效
黄郭灏, 任建庄, 段旭华, 张 凯, 张萌帆
目的 评价C臂CT引导经皮无水乙醇消融术 (PEI)在巨块型肝癌经肝动脉化疗栓塞术(TACE)后的可行性及近期疗效。方法回顾分析巨块型肝癌患者95例,其中40例行单纯TACE治疗(对照组),55例行TACE联合PEI治疗(联合组)。对照组1个月后重复TACE治疗1次。联合组TACE 1周后行PEI。术前经C臂CT扫描评估碘油沉积情况,定位穿刺路径及注入部位。2周后对碘油沉积缺损部分追加PEI。3个月后两组复查CT,对碘油沉积分布情况进行统计学分析。结果联合组初次PEI术后显示碘油沉积为Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型病灶分别为41.8%(23/55)、49.1%(27/55)、7.3%(4/55)和1.8%(1/55);2周后分别为25.4%(14/55)、50.9%(28/55)、16.4%(9/55)和7.3%(4/55)。再次对除Ⅰ型病灶外的41例患者行PEI。3个月后复查CT,对照组碘油沉积Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型病灶分别为7.5%(3/40)、30%(12/40)、42.5%(17/40)、20%(8/40);联合组碘油沉积Ⅰ型、Ⅱ型、Ⅲ型及Ⅳ型病灶分别为30.9%(17/ 55)、40%(22/55)、23.6%(13/55)、5.5%(3/55)。两组差异有统计学意义。结论C臂CT成像技术在TACE术后联合PEI治疗巨块型肝癌的指导和评估中具有重要价值,保证了手术的安全性、准确性和有效性。
C臂CT;巨块型肝癌;经皮无水乙醇消融术;肝动脉化疗栓塞术
经肝动脉化疗栓塞术(TACE)治疗中晚期肝癌疗效肯定,已被作为肝癌首选微创疗法[1-2]。巨块型肝癌需要反复多次TACE治疗,但容易导致正常肝细胞的明显损害,且多次大剂量的X线照射及化疗药物的不良反应,会导致患者免疫功能明显受损,也易导致转移的发生[3]。随着C臂血管造影系统实现三维容积CT成像,即C臂CT成像技术的应用,C臂CT在介入术中即可获得类似CT平扫或CTA样图像[4],为介入治疗开拓了许多新的应用领域,特别是为肿瘤的介入治疗,如栓塞、穿刺化疗和射频消融,提供了更有效治疗方案的可能。我院自2009年引入妙手多轴血管造影设备(Artis Zeego)后,在其扫描重建成像指导下,完成了多例TACE后联合经皮无水乙醇消融(PEI)治疗巨块型肝癌,取得满意效果,现报道如下。
1 材料与方法
1.1材料
1.1.1临床资料 回顾分析了我院从2010—2013年巨块型肝癌患者95例。其中40例行单纯TACE治疗(对照组),40例中男28例,女12例,年龄38~ 68岁,平均51岁,术前评估肝功能Child-Pugh A级18例,B级22例;55例行TACE联合PEI治疗 (联合组),其中男36例,女19例,年龄32~75岁,平均55岁,术前评估肝功能Child-Pugh A级23例,B级22例。所有患者经影像学检查证实均为单发局限性病灶,肿块直径5~16 cm,平均8.3 cm,无肝内及肝外转移病变,无治疗禁忌证,如大量腹水、严重凝血功能障碍等。联合组患者行PEI前均实施C臂CT扫描重建定位。
1.1.2使用设备 采用妙手多轴机器人血管造影系统(Siemens Artis Zeego,German),图像后处理为Siemens SyngoWorkstation三维影像工作站。
1.2方法
1.2.1治疗方法TACE术后1周行PEI的55例联合组患者,取仰卧或侧卧位,进行正侧位透视定位,将肝脏感兴趣区置于旋转采集中心点,选择C臂CT 8 s DR采集程序,同时训练患者持续屏气时间为12~15 s,进行旋转采集,完毕后把采集到的原始资料在4 min内输送到3D工作站上,选用Inspace方法对肝脏进行自动三维重建,包括采用最大密度投影技术(MIP)法、容积再现技术(VR)等,然后重建出一系列图像如矢状面、冠状面、横断面断层图像及3D图,以判断显示肿瘤形态、数目及与周围正常组织毗邻关系,选择可避开重要脏器、血管及骨骼的进针路线,并最终确定穿刺针进入肝脏的方向、角度和深度(图1)。
进针穿刺点宜选择在肿瘤中央区,或每次按象限注射,可避免药物注射不均匀影响疗效。2%利多卡因5ml局部逐层麻醉至肝包膜下,在C臂CT引导下将无水乙醇专用注射针沿制定进针路径,经肿瘤侧面正常肝组织穿刺至肿瘤远侧与正常组织交界约0.5 cm处,回抽无血及胆汁后缓慢注入无水乙醇与碘化油(比例为9∶1),边后退边旋转穿刺针,直至肿瘤浅面。用量依据瘤体大小、TACE后瘤灶内碘化油沉积情况和患者耐受程度,采用多点及分次注射,使药物尽量充盈病灶,避免乙醇流至肝包膜下(图2)。注射结束,保留3~5min后退针。术后即刻行C臂CT扫描对病灶碘油沉积情况进行评估,术后监测血压、心率、呼吸等生命体征6 h,并给予止血、保肝、止痛等处理。2周后,经上述相同方法再次对存在的碘油缺损区行乙醇消融术。对照组患者间隔1个月后重复治疗1次。
1.2.2疗效观察 观察肿瘤栓塞和消融术后碘油沉积情况;根据碘油沉积分级标准[5]:Ⅰ型,指均匀沉积;Ⅱ型,指部分缺失;Ⅲ型,指分散沉积;Ⅳ型,指少许或无明显沉积。所有患者术后3个月复查增强CT,评估病灶碘油沉积情况以判断近期疗效。

图1 肝右叶巨块型肝癌C臂CT进针过程
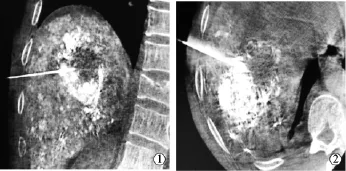
图2 C臂CT引导下补充消融
1.3统计方法
两组碘油沉积分布情况采用SPSS17.0软件行Kruskal-Wallis Test,以P<0.05为差异有统计学意义。
2 结果
2.1疗效
联合组55例患者经TACE治疗1周后,在C臂CT引导下行PEI术。初次消融术后显示碘油沉积为Ⅰ型病灶占41.8%(23/55),Ⅱ型病灶占49.1%(27/55),Ⅲ型病灶占7.3%(4/55),Ⅳ型病灶占1.8%(1/55)。2周后,C臂CT下显示碘油沉积Ⅰ型病灶占25.4%(14/55),Ⅱ型病灶占50.9%(28/55),Ⅲ型病灶占16.4%(9/55),Ⅳ型病灶占7.3%(4/55)。再次对除Ⅰ型病灶外的41例病灶行PEI,3个月后复查CT显示碘油沉积Ⅰ型病灶占30.9%(17/55)、Ⅱ型病灶占40%(22/55)、Ⅲ型病灶占23.6%(13/55)、Ⅳ型病灶占5.5%(3/55)(表1)。对照组40例患者间隔1个月后重复治疗1次,3个月后复查CT显示碘油沉积Ⅰ型病灶占7.5%(3/40)、Ⅱ型病灶占30%(12/ 40)、Ⅲ型病灶占42.5%(17/40)、Ⅳ型病灶占20%(8/40)(表1)。
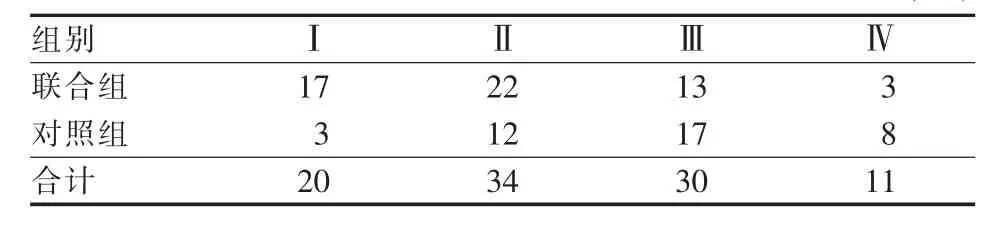
表1 术后3个月对照组与联合组碘油沉积分布情况(例)
2.2不良反应
联合组患者术后出现不同程度局部疼痛、发热和一过性转氨酶增高,经过保肝治疗,1周左右恢复。对照组并发症主要为栓塞后综合征,对症处理后恢复可。两组患者均未出现瘤灶破裂出血、肝昏迷等与治疗相关的严重并发症。
2.3统计学结果
应用SPSS17.0软件对两组患者3个月后碘油沉积分布情况行Kruskal-Wallis Test,χ2=13.357>χ20.05,2,P<0.05为有统计学意义。可认为TACE联合PEI与单纯TACE对碘油沉积的近期结果差异有统计学意义,前者明显优于后者。
3 讨论
对于巨块型肝癌,单纯TACE治疗体积较大肿瘤病灶时治疗常不彻底,术后肿瘤残余及复发率仍较高[6]。吴汉平等[7]研究:TACE术后肿瘤和正常组织缺血、缺氧,肿瘤细胞和瘤周正常组织分泌促血管生成物质,促使血管侧支循环形成,肿瘤组织增殖复发。经多次TACE治疗后的肝癌,随着治疗次数的增加,肿瘤供血动脉闭塞及侧支循环建立的发生率明显升高,且单纯TACE治疗的完全坏死率仅为20%[8-9]。将PEI与TACE联合,发挥2种治疗方法的优势,可使肿瘤的完全坏死率从单一TACE治疗的20%左右提高到80%左右。对于富血供的肝癌应先TACE,2周后序贯PEI;对于乏血供的肝癌,主张先行化学消融,2周后序贯TACE[10]。
早先经皮消融主要用于不能手术的肝癌的姑息性治疗,2000年巴塞罗那会议将经皮消融界定为原发性肝细胞癌的治愈性方法[11]。巴塞罗那肝癌小组(the Barcelona-Clinic Liver Cancer Group)治疗指南中提到的只有无水乙醇注射术,其疗效得到目前循证医学证据的支持。以往认为由于乙醇的弥散非均匀性和不可控性,乙醇消融适应于治疗对象是直径≤3 cm,病灶数目不超过3个的小肝癌,特别是对早期孤立性乏血供有包膜的小肝癌更为合适。较大肝癌需反复多次治疗,才能达到疗效,尤其是瘤内纤维隔影响无水乙醇的弥散,效果差[12]。随着各种影像设备引导下微创穿刺技术的发展,治疗范围推广到直径≥5 cm的肝癌。据Livraghi等[13]报道,一次PEI最大可以杀灭直径8.2 cm的肝癌病灶。
C臂CT成像技术利用C臂的旋转运动将平板探测器采集到的影像数据同步传送至工作站,利用Inspace的功能进行三维影像重建,采用MIP技术,通过MIP的层厚和窗位,得到与常规DSA造影相似图像,同时重建出横断面、矢状面、冠状面断层图像,还可以根据需要获得任意角度的重组影像,达到类似螺旋CT重建的效果[4,14]。采用C臂CT经校正后进行断层重建,虽然与常规CT相比,C臂CT的密度分辨率要低一些,仅有10 HU,仅能分辨出肌肉、视神经和出血灶等软组织,但已经能够满足介入诊疗的需要[15]。
C臂CT的平板探测器取代了传统的影像增强器,使X线信号得到最大程度的利用,大幅度减少了X线的照射剂量。Baba等[16]认为,低辐射剂量是平板探测器影像增强系统中的一个显著特点。然而对于屏气困难的老年患者,呼吸运动产生的伪影对C臂CT影像质量有明显的影响,检查前必须给予适当的心理指导,以消除C臂快速旋转所带来的紧张情绪,同时,进行简单的屏气训练,清除腹部金属异物,减少伪影,提高影像质量[17]。
术前进行C臂CT扫描能准确定位病变所在位置,清晰地显示穿刺断面的解剖结构及病变与周围组织的结构和空间关系,可观察含有对比剂的消融剂在病变中的分布,充分显示瘤灶内碘化油沉积缺损区和疏松区,为介入术中评估碘油沉积提供了更精确的判断手段[18],也为PEI明确注射目标并大体估计无水乙醇的用量。在C臂CT引导下将无水乙醇注射针尽可能插送至瘤灶内碘油沉积缺损区,注入适量混有碘化油的无水乙醇,杀死TACE后残余的瘤细胞同时破坏肿瘤血管使之闭塞,造成瘤灶最大程度的坏死并提高碘化油在癌灶中的沉积量,巩固了TACE的作用,减少了复发转移的发生率。由于肝癌组织内细胞间结构松散,而肿瘤周围肝组织由于纤维样变的存在阻止乙醇进一步扩散,使无水乙醇注入后“选择性”在癌肿内的扩散,因而能迅速有效破坏肿瘤组织,对正常肝组织损伤却较小[19]。联合组55例患者经C臂CT下PEI后仅有部分出现轻微不良反应,无一例出现与治疗相关并发症。消融范围应力求包括5 mm的癌旁正常组织(Clinical Tumor Volume,CTV,临床肿瘤体积),以获得安全边缘,彻底杀灭肿瘤。对边界不清晰、形状不规则浸润型癌或转移癌,在邻近肝组织及结构条件许可下建议扩大瘤周安全范围达10mm或以上[20]。姜秀杰等[21]研究发现,肝癌瘤灶血供在TACE后1周开始下降,第3周达到高峰,故PEI治疗一般选择在TACE后1~3周进行。
介入术后观察瘤区内碘油聚集情况对判断患者的预后具有重要意义[22]。术后瘤灶内碘油沉积情况是与肿瘤坏死相关的,并且在平扫CT上致密的碘油可能代表着坏死的肿瘤;碘油沉积越完全,肿瘤坏死就越彻底,越能获得较好的治疗效果[23]。Takayasu等[24]认为最高程度的坏死通常在介入术后立即发生,如果肿瘤未能完全坏死,残留癌细胞将再生。因此介入术后必须即刻判断碘油沉积情况。联合组55例均通过平扫C臂CT的多平面重组图像评价术后碘油沉积情况。因为X线透视是二维的冠状面图像,前后方向的碘油沉积可能存在相互重叠与掩盖,从而高估沉积状态。而C臂CT的多平面重组图像与普通CT图像同样是多层的横断面,能够全方位查看病灶的碘油沉积情况。对于平扫C臂CT评价碘油沉积为Ⅱ型的病灶,我们建议继续缓慢推注碘油栓塞,直至血流减慢或出现碘油反流为止。对于平扫C臂CT显示的Ⅲ型或Ⅳ型的病灶,我们建议适当缩短随访时间,必要时更改后续治疗方案,如选择射频消融或消融联合TACE治疗等。
总之,C臂CT在查看碘油沉积方面较X线透视具有明显优势,其将代替X线透视图像用来快速评价术后碘油沉积情况,对随访的CT也将起到辅助作用。TACE术后联合PEI治疗是对TACE的有效补充,采用C臂CT技术可即刻对TACE联合PEI治疗后病变做出全面准确的评估。在C臂CT引导下行TACE术后联合PEI保证了治疗的安全性、准确性和有效性,对治疗巨块型肝癌具有重要临床价值。
[1]Sakr AA,Saleh AA,Moeaty AA,et al.The combined effect of radiofrequency and ethanol ablation in the management of large hepatocellular carcinoma[J].Eur JRadiol,2005,54:418-425.
[2]徐 克,于世平.原发性肝癌的肝动脉化疗栓塞治疗[J].中国实用外科杂志,2004,24:463-465.
[3]李兴睿,杨志芳,易继林.肝癌经肝动脉栓塞化疗后VEGF和CD44v6表达的意义[J].世界华人消化杂志,2006,14:1305-1308.
[4]徐 霖,杨守俊,陈平有,等.DSA类CT成像技术在经皮穿刺椎体成形术中的临床应用 [J].放射学实践,2009,24:1254-1257.
[5]Matsuo N,Uchida H,Sakaguchi H,et al.Optimal lipiodol volume in transcatheter arterial chemoembolotherapy for hepatocellular carcinoma:study based on lipiodol accumulation patterns and histopathologic findings[J].Semin Oncol,1997,24:S6-61.
[6]Llovet JM,Bruix J.Novel advancements in the management of hepatocellular carcinoma in 2008[J].JHepatol,2008,48:S20-S37.
[7]吴汉平,冯敢生,李 欣,等.血管内皮生长因子反义寡聚脱氧核苷酸与碘油混合栓塞治疗大鼠肝癌的实验研究[J].中华放射学杂志,2003,37:1062-1067.
[8]鲁 东,吕维富,王伟昱,等.肝癌动脉血供变异在介入治疗中的意义[J].医学影像学杂志,2007,17:700-703.
[9]徐 辉,王 滨,高志芹,等.肝动脉化疗栓塞对肝癌肿瘤新生血管生成的影响 [J].实用放射学杂志,2004,20:620-622.
[10]黄满平,古善智,李国文,等.探讨化学消融在肝周转移瘤治疗中的价值[J].介入放射学杂志,2012,21:232-234.
[11]Bruix J,Sherman M,Llovet JM,et al.Clinicalmanagement of hepatocellular carcinoma.conclusions of the barcelona-2000 EASL conference[J].JHepatol,2001,35:421-430.
[12]Bruix J,Llovet JM.Prognostic prediction and treatment strategy in hepatocellular carcinoma[J].Hepatology,2002,35:519-524.
[13]Livraghi T,Benedini V,Lazzaroni S,et al.Long term results of single session percutaneous ethanol injection in patients with large hepatocellular carcinoma[J].Cancer,1998,83:48-57.
[14]肖运平,刘惕生,许 彪,等.C臂CT在腹部介入诊疗中的初步应用[J].介入放射学杂志,2011,20:410-413.
[15]翟凤杰.血管造影三维软组织成像技术(DynaCT)[J].中国医疗器械信息,2007,13:41-42,75.
[16]Baba R,Konno Y,Ueda K,et al.Comparison of flat-panel detector and image-intensifier detector for cone-beam CT[J]. ComputMed Imaging Graph,2002,26:153-158.
[17]施惠斌,王建华,冯 豪,等.腹部DynaCT断层及Inspace 3D重建图像在肝肿瘤介入治疗中的应用价值 [J].中国介入影像与治疗学,2007,4:396-399.
[18]Wallace MJ,Kuo MD,Glaiberman C,et al.Three-dimensional C-arm cone-beam CT:applications in the interventional suite[J].JVasc Interv Radiol,2008,19:799-813.
[19]包乐群,徐 虎.TACE联合PEIT治疗转移性肝癌 [J].肿瘤防治研究,2009,36:775-777.
[20]Gattoni F,Dova S,TonoliniM,et al.Study of the liver and the portal venous system with digital rotational angiography[J]. Radiol Med,2001,101:118-124.
[21]姜秀杰,胡元清,赵立峰,等.经皮肝瘤内注入无水乙醇结合TACE治疗中晚期原发性肝癌的疗效观察 [J].当代医学:中国介入放射学,2008,2:55-57.
[22]施振静,虞希祥,郝伟远,等.C臂CT在肝癌TACE术中评估碘油沉积的应用价值[J].介入放射学杂志,2013,22:301-304.
[23]Nakayama A,Imamura H,Matsuyama Y,et al.Value of lipiodol computed tomography and digital subtraction angiography in the era of helical biphasic computed tomography as preoperative assessment of hepatocellular carcinoma[J].Ann Surg,2001,234:56-62.
[24]Takayasu K,Arii S,Matsuo N,etal.Comparison of CT findings with resected specimens after chemoembolization with iodized oil for hepatocellular carcinoma[J].AJR,2000,175:699-704.
The short-term efficacy of C-arm CT-guided percutaneous ethanol ablation for massive hepatocellular carcinoma after transcatheter arterial chemoembolization treatment
HUANG Guo-hao,REN Jianzhuang,DUAN Xu-hua,ZHANG Kai,ZHANG Meng-fan.Department of Interventional Radiology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan Province 450052,China
REN Jian-zhuang,E-mail:rjzjrk@126.com
ObjectiveTo evaluate the feasibility and the short-term efficacy of C-arm CT-guided percutaneous ethanol injection(PEI)in treatingmassive hepatocellular carcinoma after transcatheter arterial chemoembolization(TACE)treatment.MethodsDuring the period from 2010 to 2013,a total of 95 patients withmassive hepatocellular carcinoma were treated at author’s hospital.The clinical data were retrospectively analyzed.Simple TACE was employed in 40 patients(control group),while combination use of TACE and PEIwas carried out in 55 patients(combination group).In the control group,TACE was repeated onemonth after the initial TACE.In the combination group,PEIwas carried out one week after TACE.Before TACE,the deposition extent of iodized oil was evaluated,and the puncturing route as well as the injection site was checked.Two weeks later the subsequent PEIwas carried out to make an additional treatment for the areas where the tumor was lack of iodized oil deposition.Three months after the treatment,CT scanning reexamination was conducted in all the patients of both groups.The iodized oil deposition extent and distribution pattern were determined,and the results were statistically analyzed.ResultsIn the combination group,the iodized oil deposition pattern of typeⅠ,Ⅱ,ⅢandⅣafter the initial PEIwas seen in 41.8%(23/55),49.1%(27/55),7.3%(4/55)and 1.8%(1/55)of lesions respectively,and two weeks later the iodized oil deposition pattern of typeⅠ,Ⅱ,ⅢandⅣwas found in 25.4%(14/55),50.9%(28/55),16.4%(9/55)and 7.3%(4/55)of lesions respectively.PEIwas performed again for the lesions(n=41)except the lesions of typeⅠ.In the control group,TACE was repeated onemonth after the initial treatment. On CT scans performed threemonths after the treatment,the iodized oil deposition pattern of typeⅠ,Ⅱ,ⅢandⅣin the control group were 7.5%(3/40),30%(12/40),42.5%(17/40)and 20%(8/40)of the lesions respectively,while in the combination group itwas 30.9%(17/55),40%(22/55),23.6%(13/55)and 5.5%(3/55)respectively.The differences between the two groups were statistically significant. Conclusion C-arm CT imaging technology is of great significant value in guiding the performance of PEI combined with TACE treatment formassive hepatocellular carcinoma,it can reliably ensure a safe,accurate and effective therapeutic procedure.(J Intervent Radiol,2015,24:41-45)
C-arm computed tomography;massive hepatocellular carcinoma;percutaneous ethanol injection ablation;hepatic arterial chemoembolization
R735.7
A
1008-794X(2015)-01-0041-05
2014-03-18)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.01.010
450052 郑州 郑州大学第一附属医院介入科
任建庄 E-mail:rjzjrk@126.com
