不同肾上腺能受体激动剂对冷暴露中缅树鼩产热能力的影响
2015-01-16朱万龙王政昆
朱万龙,王政昆
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室/云南师范大学 生命科学学院,云南 昆明 650500)
不同肾上腺能受体激动剂对冷暴露中缅树鼩产热能力的影响
朱万龙,王政昆
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室/云南师范大学 生命科学学院,云南 昆明 650500)
研究了冷驯化条件下不同肾上腺能受体激动剂对中缅树鼩产热能力的影响,测定了其静止代谢率和非颤抖性产热。结果表明:冷驯化组中缅树鼩的静止代谢率(Resting metabolic rate,RMR)较对照组增加,β3-NST(注射β3-肾上腺素激动剂BRL37344)和NST(注射NE)较对照组均极显著增加。冷驯化组和对照组在注射NE和BRL37344后其耗氧量均有极显著的增加。对照组中缅树鼩的NST高于β3-NST,但两者之间差异不显著。冷驯化组中缅树鼩NST与β3-NST差异极显著。以上结果说明冷驯化可使中缅树鼩的产热能力显著增强,其BAT中可能存在有β3-肾上腺能受体(β3-adrenergic receptor,β3-AR),推测β3-AR可能并不是中缅树鼩BAT中唯一的肾上腺能受体,NE可能通过多种肾上腺能途径来增加产热,肾上腺能受体通路在中缅树鼩适应性产热中起到了重要作用。
中缅树鼩;肾上腺能激素;产热
1 引言
低温胁迫是刺激小型哺乳动物产热能力增加的主要环境因子之一[1]。低温条件下小型哺乳动物往往会增加其静止代谢率(Resting metabolic rate, RMR)和非颤抖性产热(Nonshivering thermogenesis, NST)[2]来适应这样的环境。低温胁迫刺激静止代谢率和非颤抖性产热增加的产热机理是不同的,刺激静止代谢率的增加主要来自内脏器官产热能力的增加,如肝脏[3],非颤抖性产热的增加则主要是通过褐色脂肪组织(Brown adipose tissue, BAT)中解偶联蛋白(Uncouping protein, UCP)的数量和活性的增加,从而使得非颤抖性产热增加[4]。
静止代谢率是动物维持正常生存的最低代谢水平[5],能反映不同种群或物种的能量消耗水平,对动物适应环境的理解具有重要的意义[6]。动物主要是通过交感神经释放去甲肾上腺素(norepinephrine, NE)来参与非颤抖性产热的调节,之前的研究认为非颤抖性产热是肾上腺能受体刺激的产热[7],非颤抖性产热对于小型哺乳动物适应低温环境具有重要的意义[8]。β3-肾上腺能受体(β3-adrenergic receptor, β3-AR)特异性激动剂BRL37344能有效激活BAT产热系统,导致非颤抖性产热产热显著增加[9]。中缅树鼩(Tupaiabelangeri)属攀鼩目(Scandentia)树鼩科(Tupaiidae),为东洋界特有的小型哺乳动物,我国云贵高原及其附近的横断山区可能是中缅树鼩的分布的北限[10]。对中缅树鼩冷驯化条件下的RMR和NST的研究有助于了解中缅树鼩在低温胁迫条件下的适应对策,从而进一步阐述该动物对环境变化的适应性。
2 材料和方法
2.1 动物来源
实验动物捕自冬季大理青光山,动物灭蚤后,带回云南师范大学动物饲养房饲养,单笼饲养(300 mm×200 mm×120 mm),无巢材,光照条件12L:12D,每日喂以标准饲料和加少许水果和面包虫[11],塑料瓶供水,自由取食和进水。实验用中缅树鼩均为成年非繁殖期个体。实验前适应30 d后开始实验,实验分为3组:未注射组、注射β3-肾上腺素激动剂组和注射NE组。实验0 d测定3组的RMR、β3-NST和NST,然后将3组动物放入驯化房,进行冷驯化实验,温度为5±1 ℃,光照条件12L:12D,驯化28 d。28 d后,再次测定RMR、β3-NST和NST。实验前3组实验动物的体重差异不显著(P>0.05)。
2.2 RMR测定
用开放式呼吸仪(ADML870型,澳大利亚生产)测定动物的RMR,具体的测定方法参照Zhu[12],代谢率的计算方法参照Hill[13]。
2.3 NST测定
皮下注射去甲肾上腺素(norepinephrine, NE),测定NST。诱导NST的NE剂量为0.8 mg/kg,NST测定时间为30 min,期间出现的最大持续耗氧量视为动物的NST[11]。
2.4 β3-NST的测定
肩脚部位皮下注射β3肾上腺素激动剂BRL37344,测定其呼吸率的变化情况。注射剂量经预备实验确定为0.4 mg/kg。以注射BRL37344后的最大持续耗氧量为动物的β3-NST。
2.5 数据处理
采用SPSS16.0软件包进行实验数据的统计。数据经过正态分布和方差齐性检验,符合参数检验条件。驯化前、驯化后动物的BMR、β3-NST和NST的差异采用单因素方差分析(one-way ANOVA)检验,并采用Duncan多重比较。组间同一指标的差异采用独立样本t检验。结果均以平均值±标准误(Mean±SE)表示,P<0.05为差异显著,P<0.01为差异极显著。
3 结果分析
实验后,对照组中缅树鼩的RMR较0 d时增加,但是两者之间差异不显著(t=-0.752,P>0.05, 表1)。与对照组相比较,无论是驯化0 d还是驯化后28 d,β3-NST和NST较对照组(0 d)均极显著的增加(驯化0 d:β3-NST,t=-1.635,P<0.01;NST,t=-1.986,P<0.01;驯化28 d:β3-NST,t=-2.356,P<0.01;NST,t=-2.871,P<0.01,图1)。驯化0 d时NST组的产热能力高于β3-NST组,但是两者之间差异不显著(t=-0.236,P>0.05)。冷驯化28 d后中缅树鼩NST组的产热能力高于β3-NST组,且两者之间差异极显著(t=1.843,P<0.01)。
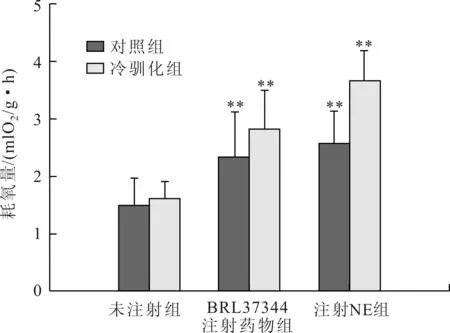
图1 不同肾上腺能受体激动剂对中缅树鼩产热能力的影响(与对照组比较)

表1 不同肾上腺能受体激动剂对中缅树鼩产热能力的影响
4 讨论
本研究组先前的研究表明:随着中缅树鼩栖息地纬度和海拔高度的增加,中缅树鼩RMR和NST出现明显的季节性变化[14],低温[15]和短照[16]胁迫可以显著刺激产热能力的增加,而且在低温驯化条件下中缅树鼩的RMR增加的比例大于NST增加[17],本研究在此基础上,对冷驯化条件下不同肾上腺能受体激动剂对中缅树鼩产热能力的影响进行了研究。
产热能力的增加是小型哺乳动物应对低温胁迫的一种重要生理适应对策[1]。NST产热能力的大小是决定动物抵抗低温能力的主要影响因子之一[4],具有重要的生物学意义[5]。低温暴露可使小型哺乳动物的NST显著增加[7]。BRL37344是β3-AR受体特异性激动剂,而NE是一种非特异性的肾上腺能受体激动剂,两者都可诱导NST产热[18]。本文的实验结果表明,冷驯化后中缅树鼩的RMR,β3-NST和NST均比对照组(未冷驯化)增加,表明低温可使中缅树鼩的产热能力显著增强,这与本研究组之前的实验结果一致[15]。这与其他一些小型哺乳动物在低温条件下的适应策略相似[19]。
BAT的产热主要是由β3-AR介导,研究表明低浓度的NE也能刺激BAT的产热反应[20]。本研究结果表明,与对照组相比较,无论是驯化前还是驯化28 d后,注射NE后其NST增加极显著,可能说明β3-AR在中缅树鼩NST产热过程中的非常重要的作用。对布氏田鼠的研究也表明,BAT的β-AR在低温条件下也起到重要的作用[21]。另外,注射BRL37344组不论无论是驯化前还是驯化28 d后其NST诱导的产热显著增加,说明这两种药物的作用是相互独立的。这一特征与其他实验啮齿动物相似[21],如金黄仓鼠[22]。此外,本研究还发现,无论是驯化0 d还是冷驯化28 d,在注射BRL37344后,与未注射的对照组相比较,其NST产热增加极显著,这可能说明β3-AR确实能使中缅树鼩产热能力显著增加,中缅树鼩BAT中存在有β3-AR。已有研究表明BAT中存在有两种肾上腺能受体:α-AR和β-AR,其中β-AR的三种亚型,即β1-AR、β2-AR和β3-AR[22]。因为NE是一种非特异性的肾上腺能受体激动剂,它可以刺激多种肾上腺能受体,并诱导相应的生理反应,而本研究中β3-AR诱导中缅树鼩的NST显著低于NE诱导产热,这可能说明β3-AR并不是中缅树鼩BAT中唯一的肾上腺能受体。
冷驯化可使中缅树鼩的产热能力显著增强,其BAT中可能存在有β3-AR,并且β3-AR可能并不是BAT中唯一的肾上腺能受体,肾上腺能受体通路在中缅树韵适应性产热中起到了重要作用。
[1]Zhao Z J, Cao J, Liu Z C,et al. Seasonal regulations of resting metabolic rate and thermogenesis in striped hamster (Cricetulus barabensis) [J]. Therm Biol,2010,35(1):401~405.
[2]Zhu W L, Wang Z K. Seasonal changes in body mass, serum leptin levels and hypothalamic neuropeptide gene expression in male Eothenomys olitor[J]. Comparative Biochemistry and Physiology,2015,184(1):83~89
[3]Zhu W L, Cai J H, Lian X, et al. Adaptive character of metabolism in Eothenomys miletus in Hengduan Mountains region during cold acclimation[J]. Journal of Thermal Biology,2010,35(8):417~421.
[4]Zhang Z Q, Wang D H. Seasonal changes in thermogenesis and body mass in wild Mongolian gerbils (Meriones unguiculatus)[J]. Comp Biochem Physiol, 2007(148):346~353.
[5]MaNab B K. On the utility of uniformity in the definition of basal rate of metabolism[J]. Physiol Zool,1997(70):718~720.
[6]Bozinovic F, Gallardo P. The water economy of South American desert rodents: from integrative to molecular physiological ecology[J]. Comp Biochem Physiol,2006(142):163~172.
[7]Speakman J R. The energy cost of reproduction in small rodents[J]. Acta Ther Sin,2007(27):1~13.
[8]Tang G B, Cui J G, Wang D H. Role of hypoleptinemia during cold adaptation in Brandt's voles (Lasiopodomys brandtii)[J]. Am J Physiol Regul Integr Comp Physiol, 2009,297(5):1293~1301.
[9]Strosberg A D. Strueture and function of the adrenergic receptor[J]. Annu Rev Pharmacol Toxicol,1997(37):421~450.
[10]Sloan Wilson D, Clark A B, Coleman K. Shyness and boldness in humans and other animals[J]. Trends Ecol Evol,1994,9(11):442~446.
[11]Zhu W L, Jia T, Huang C M, et al. Changes of energy metabolism, thermogenesis and body mass in the tree shrew (Tupaia belangeri chinensis) during cold exposure[J]. Italian Journal of Zoology,2012,79(2):175~181.
[12]Zhu W L, Mu Y, Liu J H, et al. Energy requirements during lactation in female Apodemus chevrieri (Mammalia: Rodentia: Muridae) in Hengduan mountain region[J]. Italian Journal of Zoology,2015,82(2):165~171.
[13]Hill R W. Determination of oxygen consumption by use of the paramagnetic oxygen analyser[J]. Appl Physiol,1972(33):261~263.
[14]Zhu W L, Zhang H, Wang Z K. Seasonal changes in body mass and thermogenesis in tree shrews (Tupaia belangeri) the roles of photoperiod and cold[J]. Journal of Thermal Biology,2012(37):479~484.
[15]Zhang L, Zhu W L, Wang Z K. Role of photoperiod on hormone concentrations and adaptive capacity in tree shrews, Tupaia belangeri[J]. Comparative Biochemistry and Physiology,2012(163):253~259.
[16]Zhang L, Zhang H, Zhu W L, et al. Energy metabolism, thermogenesis and body mass regulation in tree shrew (Tupaia belangeri) during subsequent cold and warm acclimation[J]. Comparative Biochemistry and Physiology,2012(162):437~442.
[17]Zhang L, Liu P F, Zhu W L, et al. Variations in thermal physiology and energetics of the tree shrew (Tupaia belangeri) in response to cold acclimation[J]. Journal of Comparative Physiology,2012(182):167~176.
[18]Heldmaier D. Source if heat during nonshivering thermogenesis in Djungarian hamster[J]. Comp Physiol,1985(156):237~245.
[19]王政昆,李庆芬,孙儒泳.褐色脂肪组织产热及其调节机理[J].生理科学进展,27(4):353~355.
[20]Nedergaard J, Valeria G, Anita M, et al. UCP1: the only protein able to mediate adaptive non-shivering thermogenesis and metabolic inefficiency[J]. Biochimica et Biophysica Acta, 2001(1504):82~106.
[21]李庆芬,刘小团,黄晨西.长爪沙鼠冷驯化过程众褐色脂肪组织产热活性及解偶联蛋白基因表达[J].动物学报,2001,47(4):388~393.
[22]Zhao J, Cannon B, Nedergaard J. Thermogenes is β3-but not βl-adrenergically mediated in rat brown fat cells, even after cold acclimation[J]. Am J Physiol,1998,275(6):2002~2011.
Study on the Effects of Different Adrenergic Agonistson the Thermogenic Capacity of Tupaia BelangeriUnder Cold Exposure
Zhu Wanlong, Wang Zhengkun
(KeyLaboratoryofEcologicalAdaptiveEvolutionandConservationonAnimals-PlantsinSouthwestMountainEcosystemofYunnanProvinceHigherInstitutesCollege,SchoolofLifeSciences,YunnanNormalUniversity,Kunming650500,China)
his article mainly studies oneffect of different β-AR agonists on the thermogenic capacity ofTupaia belangeri under the condition of cold exposure and tests Tupaia belangeri's resting metabolic rate (RMR) and nonshivering thermogenesis (NST). The results show that RMR increasesin the group ofcold exposure compared with control group (out of cold exposure).But β3-NST and NST increase significantly compared with control group. After the injection of NE and BRL37344, the oxygen consumption increases obviously in both groups. NST is higher thanβ3-NST in control group, but the differences are not obvious. In the group of cold exposure, the differences between NST and β3-NST are obvious. All of results indicate that the cold exposure makes theTupaia belangeri's thermogenic capacity stronger and there exists β3-AR in BAT. The article speculates thatβ3-AR is not the only AR in BAT. Perhaps, and NE may enhance thermogenesis by many adrenergic approaches, which may play an important role in the adaptive thermogenesis in T. belangeri.
Tupaia belangeri; adrenaline; thermogenesis
2015-09-30
国家国际科技合作项目(编号:2014DFR31040) ;十二五国家支撑计划(编号:2014BAI01B00);国家自然科学基金项目(编号:31360096)资助
朱万龙(1983—),男,江苏南京人,博士,副教授,主要从事动物生理生态学研究。
Q953
A
1674-9944(2015)12-0001-03
