“益气化瘀、温阳利水方”治疗肺心病的作用机理
2015-01-13杨兴嫕史锁芳
蔡 敏, 杨兴嫕, 史锁芳
(1. 南京中医药大学,江苏 南京210029;2. 六安市中医院,安徽 六安230006;3. 江苏省中医院,江苏南京210029)
慢性肺源性心脏病(chronic pulmonary heart disease,CPHD,简称肺心病,PHD)是由支气管-肺组织、胸廓或肺血管病变,导致肺血管阻力增加,产生肺动脉高压,继而导致右心结构和功能改变的疾病[1]。肺血管舒缩功能异常及重构导致的肺动脉高压是本病的发病基础,右心结构和功能改变是本病的结局。研究表明,以上病理变化与多种因子的异常变化及发生的时序性密切相关[2]。其中,血栓 素 (thromboxane,TXA2)、前 列 环 素 (proctacyclin,PGI2)、血管紧张素Ⅱ(angiotensin,AngⅡ)、心房尿钠肽(atrial natriuretic peptide,ANP)在肺血管的舒缩及重构、心肌重构中扮演不同的角色。能够针对以上因子进行有效的干预,对肺心病的治疗具有重要的意义。
本病属于中医学“肺胀”、 “喘病”、 “水肿”等范畴[3],肺、脾、心、肾亏虚,痰、瘀、水稽留是缓解期的主要病机。导师史锁芳教授根据多年的经验,创制“益气化瘀、温阳利水方”[4](党参、苏木、生黄芪、汉防己、茯苓、制附片、炒白术、白芍、葶苈子、桑白皮等)治疗本病。既顾肺、脾、心、肾虚衰之本,又可以兼痰、瘀、水三大主要病理因素,临床应用取得了良好的效果。基于本方临床疗效,我们设计了该实验,探讨“益气化瘀、温阳利水方”的作用机制。
1 实验材料
1.1 药物及试剂 “益气化瘀、温肾利水方”(党参、苏木、生黄芪、汉防己、茯苓、制附片、炒白术、白芍、葶苈子、桑白皮,由江苏省中医院制剂部制备,质量浓度为6 g/mL),卡托普利(中美上海施贵宝制药有限公司,批号1308032),野百合碱(monocrotaline,MCT,上海远慕生物制品有限公司,HPLC >99%,批号131117),大鼠TXA2、PGI2、AngⅡ、ANP ELISA 试剂盒均由上海远慕生物科技有限公司提供,其他试剂均为国产分析纯。
1.2 动物与饲养 清洁级雄性SD 大鼠60 只,由南京军区总院动物实验中心提供,合格证号SCXK (军)2012-0014。饲养于江苏省中医院药理实验室,全自动供水,自由进食,室温(22 ±2)℃,湿度55% ~65%,光照适度,通风洁净良好。
1.3 实验器材 FA1004 型电子分析天平(上海精科实业有限公司),R-911 全自动放免计数仪(中国科技大学),Vevo2100 小动物专用高频彩色超声系统(加拿大VisuaSonics),Leica ASP300S 全自动真空组织脱水机(德国Leica),组织包埋机 (德国Medite),全自动染色机 (德国Medite)。
2 实验方法
2.1 给药及造模 参照文献方法建立MCT 致肺心病大鼠模型[5]:SD 大 鼠60 只,随 机 分 为[6]空 白 组 (Control group)、模型组 (MCT group)、卡托普利组 (Captopril group)、复方低剂量组(Low-dose compound group)、复方高剂量组(High-dose compound group),每组12 只。实验第1 天,除空白组外其余四组大鼠,每只一次性腹腔注射1% MCT 60 mg/kg (溶媒为无水酒精∶生理盐水按2 ∶8 体积分数配制),空白组大鼠腹腔注射相应剂量的酒精溶媒。造模第14 天开始灌胃给药,空白组、模型组给予灭菌蒸馏水,其余各组参照文献[7]计算给药量:卡托普利组予卡托普利2.7 mg/kg,复方高剂量组按20 g/kg,复方低剂量组按7 g/kg 稀释后灌胃。
2.2 心脏彩超 MCT 腹腔注射第15、30 天,腹腔麻醉后行心脏超声检查,检测右心Tei 指数和平均肺动脉压(mean pulmonary artery pressure,mPAP)。Tei = (NFTPET)/PET (NFT 为右心室非充盈时间,PET 为肺动脉射血时间),mPAP=79 - (0.45 ×PAT)(PAT <120 ms,PAT为肺动脉加速射血时间)。
2.3 检测说明 MCT 腹腔注射第31 天,10%水合氯醛腹腔麻醉后腹主动脉取血,2 000 r/min 低温离心10 min,取上层血清-20 ℃冻存。ELISA 法测定TXA2、PGI2、AngⅡ、ANP 浓度。取心脏称重后,中性甲醛固定,行HE 染色观察心室变化;左肺HE 染色观察小动脉结构。拍照后用图像分析软件分别测量肺小血管管壁厚度(wall thickness,WT)、血管外径(external diameter,ED)、管壁面积(wall area,WA)、管腔面积 (lumen area,LA)、血管总面积(total area,TA)。心脏:右室壁面积(RV)、室间隔面积(IVS)、左室面积(LV)。计算出管壁厚度与血管外径比值(WT%)、管壁面积与血管总面积比值(WA%)和管腔面积与血管总面积比值 (LA%)及右室体积分数RV% =[RV/ (RV+IVS)]。
2.4 统计方法 采用SPSS 17.0 统计软件进行统计学分析,经正态检验、方差齐性检验后,组间比较采用单因素方差分析,方差齐选择LSD 法,方差不齐选择Tamhane’s T2 法。P <0.05 表示有统计学意义,数据结果以均数(x)±标准差(s)表示。
3 实验结果
3.1 大鼠体质量增加情况 大鼠初始体质量各组之间比较无统计学差异,第30 天,模型组体质量较空白组有显著的降低,模型组的体质量增长与其余各组比较最为缓慢,卡托普利组、复方高剂量组较模型组有显著增高,与空白组无统计学差异,见表1。
表1 大鼠体质量变化(±s,n=10)
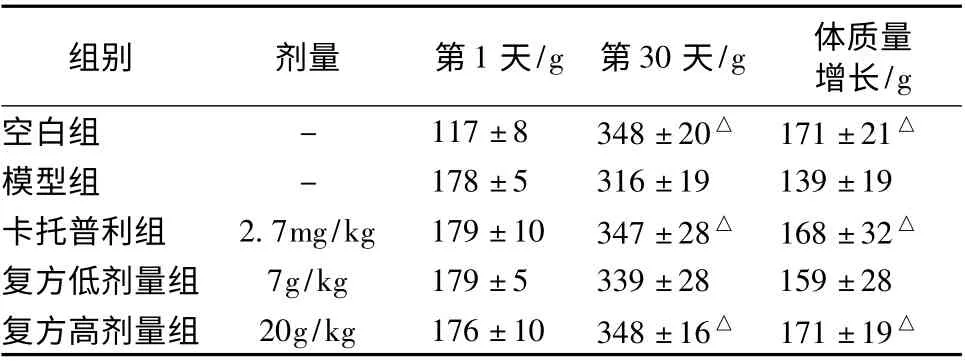
表1 大鼠体质量变化(±s,n=10)
注:与模型组比较,△P <0.05
组别 剂量 第1 天/g 第30 天/g 体质量增长/g空白组 - 117 ±8 348 ±20△ 171 ±21△模型组 - 178 ±5 316 ±19 139 ±19卡托普利组 2.7mg/kg 179 ±10 347 ±28△ 168 ±32△复方低剂量组 7g/kg 179 ±5 339 ±28 159 ±28复方高剂量组 20g/kg 176 ±10 348 ±16△ 171 ±19△
3.2 大鼠心脏彩超 MCT 腹腔注射第15 天时,模型组的mPAP 较空白组升高即具有统计学差异(P <0.05),复方高剂量组与空白组无明显差异但明显低于模型组。卡托普利组、复方低剂量组与空白组及模型组比较均无统计学差异(P >0.05)。MCT 腹腔注射第30 天时,空白组mPAP前后变化不显著,模型组升高最为显著,卡托普利组、复方低剂量组、复方高剂量组mPAP 较空白组均有不同程度的升高(P <0.05),复方低剂量组mPAP 与模型组mPAP无明显差异 (P >0.05),卡托普利组、复方高剂量组mPAP 较模型组有显著降低(P <0.05)。
MCT 腹腔注射第15 天时,各组大鼠Tei 之间比较无统计学意义,在MCT 腹腔注射第30 天时,模型组Tei 较空白组显著增高(P <0.01),与模型组比较,卡托普利组及复方高剂量组Tei 值显著降低(P <0.05),而复方低剂量组与模型组差异未能显示出统计学差异(P >0.05),见表2。
表2 MCT 注射第15、30 天各组大鼠mPAP、Tei 指数(±s,n=8,mmHg=0.133 kPa)

表2 MCT 注射第15、30 天各组大鼠mPAP、Tei 指数(±s,n=8,mmHg=0.133 kPa)
注:与空白组比较,▽P <0.05,▼P <0.01;与模型组比较,△P <0.05,▲P <0.01
MCT 注射第30 天右心Tei指数空白组 - 63.4±1.1△ 0.28±0.02 64.8±3.4▲ 0.27±0.06▲模型组 - 66.8±2.3▼ 0.37±0.13 74.2±3.5▼ 0.54±0.14▼组别 剂量MCT 注射第15 天mPAP(mmHg)MCT 注射第15 天右心Tei指数MCT 注射第30 天mPAP(mmHg)卡托普利组 2.7 mg/kg 64.4±1.5 0.34±0.06 69.5±1.3△▽0.37±0.12△复方低剂量组 7 g/kg 64.3±1.1 0.36±0.13 71.6±1.4▼ 0.42±0.17复方高剂量组 20 g/kg 63.6±1.2△ 0.31±0.12 69.1±4.2▲▽0.33±0.14△
3.3 肺小动脉HE 染色 各组大鼠肺小动脉HE 染色情况见图1,各组WT%与WA%的变化趋势相似但与LA%相反,模型组的WT%、WA% 较空白组显著增大 (P <0.01),卡托普利组、复方高级量组WT%、WA%与模型组比较有显著的降低(P <0.05),复方低剂量组与模型组差异不著。模型组LA%较空白组显著降低,卡托普利组、复方高剂量组LA% 较模型组增高具有统计学意义(P <0.05),复方低剂量组与模型组差异不显著,见图1、表3。

图1 各组大鼠肺小动脉结构(×100)
3.4 心脏变化情况 比较大鼠心脏重量发现,给予MCT的各组大鼠心脏较空白组显著增加,其中模型组增加最为明显(P <0.01),药物干预三组大鼠的心脏重量较模型组均有不同程度降低,其中卡托普利组、复方低剂量组大鼠心脏重量与模型组比较(P <0.05),复方高剂量组大鼠心脏重量较模型组显著降低(P <0.01)。与空白组比较,模型组、复方高低剂量组右心面积分数增加显著(P <0.05),卡托普利组则无统计学差异(P >0.05);药物干预各组与模型组比较发现,各组右心室面积分数较模型组均显著降低(P <0.01),见表4、图2。

图2 大鼠心室HE 染色(HE×10)
表3 各组大鼠肺小动脉血管情况(±s,n=10)
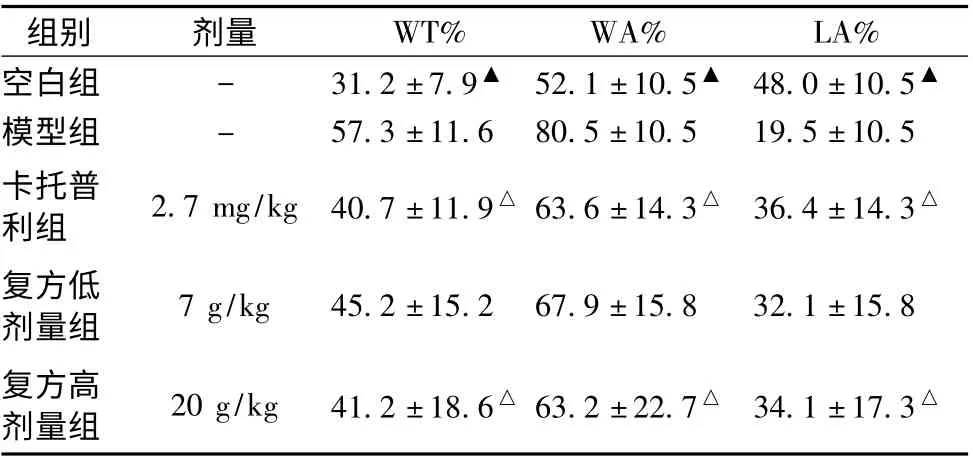
表3 各组大鼠肺小动脉血管情况(±s,n=10)
注:WT%为管壁厚度与血管外径比值,WA%为管壁面积与血管总面积比值,LA%和管腔面积与血管总面积比值。与模型组比较,△P <0.05,▲P <0.01
组别 剂量 WT% WA% LA%空白组 - 31.2 ±7.9▲ 52.1 ±10.5▲ 48.0 ±10.5▲模型组 - 57.3 ±11.6 80.5 ±10.5 19.5 ±10.5卡托普利组 2.7 mg/kg 40.7 ±11.9△63.6 ±14.3△ 36.4 ±14.3△复方低剂量组 7 g/kg 45.2 ±15.2 67.9 ±15.8 32.1 ±15.8复方高剂量组 20 g/kg 41.2 ±18.6△63.2 ±22.7△ 34.1 ±17.3△
表4 各组大鼠心脏重量及右心室面积分数(±s,n=10)
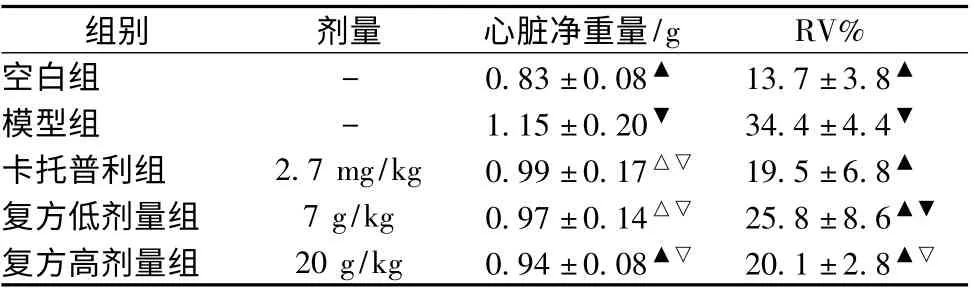
表4 各组大鼠心脏重量及右心室面积分数(±s,n=10)
注:与空白组比较,▽P <0.05,▼P <0.01;与模型组比较,△P <0.05,▲P <0.01
组别 剂量 心脏净重量/g RV%空白组 - 0.83 ±0.08▲ 13.7 ±3.8▲模型组 - 1.15 ±0.20▼ 34.4 ±4.4▼卡托普利组 2.7 mg/kg 0.99 ±0.17△▽ 19.5 ±6.8▲复方低剂量组 7 g/kg 0.97 ±0.14△▽ 25.8 ±8.6▲▼复方高剂量组 20 g/kg 0.94 ±0.08▲▽ 20.1 ±2.8▲▽
3.5 大鼠血清AngⅡ、ANP、TXA2、PGI2变化 由表5 可见,模型组AngⅡ较空白组显著升高(P <0.01),复方低剂量组AngⅡ与模型组比较无显著差异(P >0.05),卡托普利组和复方高剂量组AngⅡ较模型组降低有统计学意义(P <0.05)。模型组大鼠血清ANP 水平较空白组显著升高(P <0.01),卡托普利组、复方高剂量组大鼠血清ANP 水平较模型组均有显著降低(P <0.05)。模型组TXA2较空白组显著升高(P <0.01),卡托普利组与模型组之间比较差异未能显示出统计学差异(P >0.05),复方高剂量组能够显著降低大鼠血清TXA2水平(P <0.05)。空白组PGI2水平较高,模型组PGI2较空白组显著降低(P <0.01),卡托普利组与模型组血清PGI2水平差异无统计学意义(P >0.05),复方高剂量组血清PGI2浓度较模型组有显著上升(P <0.05)。
表5 大鼠血清细胞因子变化(±s,n=8)
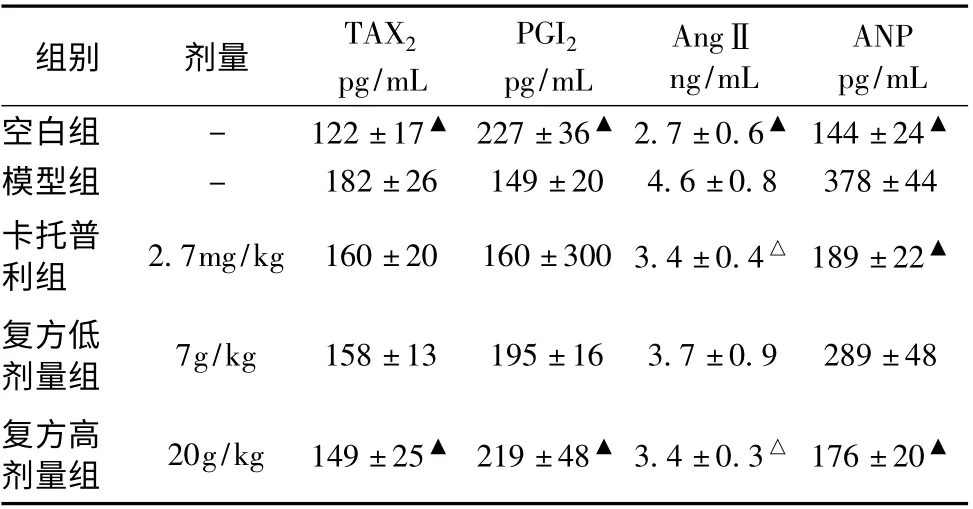
表5 大鼠血清细胞因子变化(±s,n=8)
注:与模型组比较,△P <0.05,▲P <0.01
组别 剂量 TAX2 pg/mL PGI2 pg/mL ANP pg/mL空白组 - 122 ±17▲ 227 ±36▲2.7 ±0.6▲ 144 ±24▲模型组 - 182 ±26 149 ±20 4.6 ±0.8 378 ±44 AngⅡng/mL卡托普利组 2.7mg/kg 160 ±20 160 ±300 3.4 ±0.4△ 189 ±22▲复方低剂量组 7g/kg 158 ±13 195 ±16 3.7 ±0.9 289 ±48复方高剂量组 20g/kg 149 ±25▲ 219 ±48▲3.4 ±0.3△ 176 ±20▲
4 讨论
肺动脉高压是PHD 的病理生理基础,持续存在的肺动脉高压,势必影响右心的功能;在右室负荷增加的早期,通过心肌收缩力的增加,发挥代偿性作用[8];当肺动脉压继续增高,右室失代偿则发展至心力衰竭。诸如TXA2、PGI2、AngⅡ、ANP 的异常变化,在形成肺动脉高压到过度到心衰的病程中扮演着重要的角色。
研究认为TXA2/PGI2平衡对维持血液循环的通畅,调节血管的舒缩具有重要的意义[9]。TXA2/PGI2失衡会影响肺部血管,特别是小血管、毛细血管状态,及肺部血小板聚集状态,从而影响肺血管压力和血流情况;是促进肺动脉高压发生、发展的重要因素之一[10]。AngⅡ是血管平滑肌细胞的强丝裂原,在肺动脉压增高、肺血管重构[11]及心肌重构的发生发展中起重要作用[12]。ANP 具有利钠、利尿、舒张血管等作用[13],在心衰的代偿阶段发挥重要的作用[14],由于RAAS 系统的持续激活,使其无法延缓肺心病的进展,确在一定程度上反映心衰的严重程度。我们的研究显示,模型组大鼠肺小动脉管壁增厚、mPAP 升高,心脏重量增加、右心室体积分数增大、右心Tei 指数升高是伴随着TXA2、AngⅡ、ANP 升高及PGI2降低这一系列细胞因子的变化。进一步说明TXA2/PGI2平衡、AngⅡ、ANP 与肺心病的发病和进程密切相关。卡托普利组能显著降低AngⅡ、ANP 水平,抑制大鼠肺小动脉管壁及右心室的增厚,降低mPAP 及右心Tei 指数。“益气化瘀、温阳利水”方在高剂量时不仅能降低Ang Ⅱ、ANP 水平,还具有调节TXA2/PGI2平衡的作用;其能够抑制肺血管及右心室的重构,降低mPAP、右心Tei 指数,从而发挥治疗PHD 的作用。
目前右心导管检测mPAP 是确诊肺动脉高压的金标准,在动物实验中应用早已开展;心脏彩超检查在临床中应用广泛[15],其在动物实验中的应用尚未普及,我们的实验较早地使用心脏彩超实现对大鼠mPAP 和Tei 指数的动态监测。实验中,mPAP 是根据肺动脉加速射血时间接计算而得的,尽管所测mPAP 较文献中通过右心导管检测的数值偏高,通过组间比较仍然说明其在评估mPAP 和Tei 中具有重要意义。下一步的研究,可以依托于VisuaSonics Vevo2100超声平台实现对心功能进行更全面的评估;同时拓展与PHD 相关因子[16]的研究。
[1] 中华医学会. 临床诊疗指南呼吸病学分册[M]. 北京:人民卫生出版社,2009:6-8.
[2] 李广斌. 慢性肺源性心脏病发病机制及其治疗靶点研究进展[J]. 天津医科大学学报,2014,20(2):162-164.
[3] 中华中医药学会肺系病专业委员会. 慢性肺源性心脏病中医诊疗指南(2014 版)[J]. 中医杂志,2014,55(6):526-531.
[4] 蔡 敏. “温肾利水”法治疗肺心病感染后期的临床和实验研究[C]. 南京中医药大学,2014.
[5] Humann Matori,Soban Umar,Rangarajan D,et al. Genistein,a soy phytoestrogen,reverses sesere pulmonary hypertension and prevents right heart failure in ratsp[J]. Hypertension,2012,60(8):425-430.
[6] 李志春,桂立辉. 利用Excel 实现对实验对象随机分组的应用[J]. 毒理学杂志,2005,19(3):235-236.
[7] 黄继汉,黄晓晖,陈志扬,等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学,2004,9(9):1069-1072.
[8] 崔健嫦,左万里,黄吉雄,等. 法舒地尔对肺动脉高压大鼠右心功能的影响[J]. 实验研究,2012,10(23):120-121.
[9] Hong D,Hong Z G,Chen W G. The mechanism and treatment of pulmonary arterial hypertension-mediated right ventricular failure[J]. Chin J Hypertens,2012,20(7):604-607.
[10] 东南大学医学院. 肺心病自由基代谢与TXA2/PGI2平衡的系列研究[Z]. 国家科技成果,2001.
[11] 乔莉娜,许红波,石 坤,等. 抑制Notch 信号对血管紧张素Ⅱ诱导的肺血管重构的影响[J]. 中国当代儿科学杂志,2011,13(6):503-508.
[12] McKie P M,Cataliotti A,Boerrigter G,et al. A novel artial natriuretic peptide based therapeutic in experimental angitotensinⅡmediated acute hypertension[J]. Hypertension,2010,56(6):1152-1159.
[13] Jankowski M. B-type natriuretic peptide for diagnosis and therapy[J]. Recent Pat Cardiovasc Drug Discov,2008,2(3):77-83.
[14] Dietz J R. Mechanisms of atrial natriuretic peptide secretion from the atrium[J]. Cardiovasc Res,2005,68(1):8-17.
[15] 许 红,宋爱萍. Tei 指数对慢性阻塞性肺病患者右心室功能的评价[J]. 中国临床医学,2013,20(4):574-576.
[16] 徐东江,朱广瑾. 几种肺动脉高压相关因子的研究进展[J]. 中国病理生理杂志,2010,26(4):819-822.
