雌二醇和孕酮对双侧卵巢切除小鼠子宫局部巨噬细胞及M-CSF表达的影响研究
2015-01-12姚国荣浙江省湖州市中心医院妇产科浙江湖州313000
姚国荣浙江省湖州市中心医院妇产科,浙江湖州313000
雌二醇和孕酮对双侧卵巢切除小鼠子宫局部巨噬细胞及M-CSF表达的影响研究
姚国荣
浙江省湖州市中心医院妇产科,浙江湖州313000
目的分析雌二醇和孕酮对双侧卵巢切除小鼠子宫内膜巨噬细胞及巨噬细胞集落刺激因子表达的影响。方法将双侧卵巢切除小鼠作为研究对象,分为对照组、雌激素组和孕激素组,对照组小鼠皮下注射芝麻油0.1 mL,雌激素组皮下注射雌二醇(100 ng/只),孕激素组皮下注射孕酮(2 mg/只),分析各组小鼠子宫内膜巨噬细胞的数量和巨噬细胞集落刺激因子的表达强度。结果雌激素组和孕激素组小鼠子宫内膜巨噬细胞数量明显高于对照组,差异具有统计学意义(F=17.35,P<0.05,t雌激素6h=9.21,t雌激素24h=9.32,t孕激素6h=9.56,t孕激素24h=8.94);雌激素组与孕激素组小鼠子宫内膜M-CSF表达6 h、24 h后明显高于对照组,差异具有统计学意义(F=9.03,P<0.05,t雌激素6h=224.14,t雌激素24h=218.15,t孕激素6h=15.72,t孕激素24h=13.44)。结论雌二醇和孕酮都对子宫内膜巨噬细胞有趋化作用,并可以诱导巨噬细胞集落刺激因子的表达。
雌二醇;孕酮;巨噬细胞;巨噬细胞集落刺激因子
子宫是哺乳动物胚胎生长发育的场所,雌激素可使子宫内膜增生增厚,为胚胎着床提供重要条件[1]。孕酮由黄体细胞分泌,为受精卵的发育提供适宜的环境[2]。巨噬细胞(macrophage)是子宫内一种常驻免疫细胞,对子宫的免疫调节起到重要作用[3]。巨噬细胞集落刺激因子(macrophage colony-stimulating factor,MCSF)是一种多肽造血生长因子,对哺乳动物的生殖功能起着重要作用[4]。已有研究显示,人和啮齿类动物子宫内巨噬细胞的表达和分布与卵巢甾体性激素——雌孕激素密切相关[5],但具体机制未见深入研究。本文对去势模型小鼠子宫内膜巨噬细胞及巨噬细胞集落刺激因子表达受雌二醇和孕酮的影响做了进一步的研究。
1 对象与方法
1.1 实验对象
性发育成熟的雌性昆明小鼠(浙江中医药大学实验动物中心提供),体重(31±3)g,8~10周龄,自由饮水摄食。
1.2 时间及地点
实验于2014年12月~2015年2月在浙江省湖州市中心医院完成。
1.3 试剂
所用试剂:雌激素(美国Sigma公司),孕激素(美国Sigma公司),一抗:大鼠抗小鼠F4/80(BM8)抗体(上海优宁维生物科技有限公司),二抗:兔抗大鼠IgG(上海优宁维生物科技有限公司),芝麻油(美国Sigma公司),1%戊巴比妥钠(美国Sigma公司),DAB显色剂(上海沪震实业有限公司),即用型SABC试剂盒(北京诺博莱德科技有限公司),枸橼酸盐缓冲液(pH=6.0)(北京诺博莱德科技有限公司),PBS缓冲液(pH=7.4~7.6)(北京诺博莱德科技有限公司),内源性过氧化物酶抑制剂(北京诺博莱德科技有限公司),4%多聚甲醛(阿拉丁试剂(上海)有限公司)。
1.4 设备
石蜡切片机,石蜡包埋机(德国徕卡公司),生物组织摊烤片机(湖北孝感市诺普电子科技有限责任公司),恒温箱(四川瑞朗医疗器械有限公司),光学显微镜,微量加样枪(0.5~10 μL、20~200 μL,赛默飞世尔科技中国有限公司),Nikon显微镜和照相系统(尼康仪器(上海)有限公司)以及剪刀、镊子、解剖盘等解剖工具。
1.5 方法
1.5.1 建立去势小鼠模型双侧卵巢切除小鼠(去势小鼠)模型建立方法:每只小鼠腹腔注射0.3 mL 1%戊巴比妥钠溶液,小鼠完全麻醉后,取一侧身体朝上,脱毛后用75%酒精消毒,并用无菌棉签擦干。用手术剪在右侧部皮肤取约1 cm切口,在右侧卵巢脂肪垫上的皮肤做切口,用摄子夹住脂肪垫,将输卵管和卵巢拉出腹腔。使用镊子撕开输卵管和卵巢外面包裹的囊膜,使卵巢暴露。在卵巢与输卵管之间用缝线结扎,剪刀剪去卵巢,用镊子把子宫角送回腹腔,再关闭腹腔。切除左侧卵巢方法同上。术后保暖小鼠直至苏醒,继续正常喂养至术后18 d,此时小鼠体内雌孕激素可代谢完全。
1.5.2 建模成功验证①小鼠子宫形态学观察:将处于动情期、动情间期的正常小鼠5只以及去势小鼠5只于术后18 d颈椎脱臼处死,腹部脱毛后酒精消毒,用剪刀和镊子在腹部剪开约0.5 cm长的刀口,分离皮肤肌层。换一套新的剪刀和镊子剪开腹膜。找到子宫,另换剪刀和镊子去除周围脂肪组织,将子宫整个取出。②血中雌孕激素测定:分别取5只正常小鼠和去势小鼠,眼眶采血,离心20 min后取上清进行检测。
1.6 分组及干预
将48只去势小鼠分为雌激素组、孕激素组和对照组,每组16只。雌激素组皮下注射雌二醇0.1 mL(100 ng/只),通过颈椎脱臼法6 h后处死8只,24 h后处死剩余8只。孕激素组皮下注射孕酮0.1 mL(2 mg/只),通过颈椎脱臼法6 h后处死8只,24 h后处死剩余8只。对照组皮下注射芝麻油0.1 mL,不进行其他处理。分别取其子宫待检,方法同1.5.2中①所述。
1.7 免疫组织化学染色
采用免疫组织化学染色法研究不同时间点小鼠子宫内膜巨噬细胞的数量和M-CSF的表达强度:①取材:取子宫标本固定、包埋、切片;②脱蜡:经二甲苯、无水乙醇、乙醇脱蜡处理;③冲洗:流动水冲洗10 min;④处理:使用内源性抗过氧化物酶抑制剂来处理切片,并再次清洗、甩干;⑤抗原修复:切片置入枸橼酸盐配制成的缓冲液中,反复加热1~2次,冷却后用PBS洗涤;⑥孵育:依次滴加兔血清、大鼠抗小鼠F4/80抗体、兔抗大鼠IgG和SABC试剂,每次操作后在室温下孵育一段时间;⑦显色:使用DAB显色试剂盒,A、B、C试剂与蒸馏水混匀加至切片,室温下显色;⑧蓝化:苏木精复染,在盐酸乙醇中分色后再用自来水冲洗,等待切片呈蓝色;⑨脱水:依次经过乙醇、无水乙醇脱水,经二甲苯透明处理;⑩封固:用中性树脂封固,将切片放入烘箱中过夜。
处理后的石蜡标本切片,切片厚度4 μm,每个标本取5张切片,每张切片在显微镜下观察,随机取3个视野,观察并记录阳性巨噬细胞的数量和M-CSF积分光密度IOD值。
1.8 统计学方法
2 结果
2.1 建模验证结果
2.1.1 小鼠子宫形态学观察与正常小鼠相比,去势小鼠18 d后子宫呈线状,明显萎缩。见图1。
2.1.2 血中雌孕激素测定结果正常小鼠血中雌孕激素浓度分别为(130.35±25.31)pmol/L、(25.34±4.09)nmol/L,去势小鼠血中雌孕激素浓度分别为(42.13±7.87)pmol/L、(6.37±1.02)nmol/L,正常小组血中雌孕激素含量显著高于去势组小鼠,差异具有统计学意义(t=15.21、13.29,P均<0.05)。

图1 小鼠子宫形态学比较
2.2 免疫组化结果
巨噬细胞和M-CSF阳性部位呈现棕褐色或棕黄色,阳性颗粒分别位于细胞膜质和细胞浆中,与背景色对比显著。
2.2.1 雌二醇、孕酮对小鼠子宫内膜巨噬细胞数量的影响小鼠子宫内膜巨噬细胞呈圆形或不规则形,主要分布在腺体周围。对照组小鼠子宫内膜巨噬细胞很少,集中分布在内膜底部和基层交界处,雌激素组与孕激素组小鼠子宫内膜巨噬细胞6 h后明显增加,24 h后与对照组相比仍呈增加趋势,差异具有统计学意义(F=17.35,P<0.05,t雌激素6h=9.21,t雌激素24h=9.32,t孕激素6h=9.56,t孕激素24h=8.94)。见表1、图2。
表1 三组小鼠子宫内膜巨噬细胞数量对比
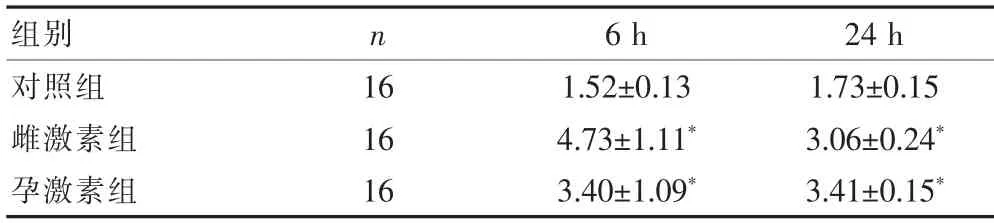
表1 三组小鼠子宫内膜巨噬细胞数量对比
注:*与对照组相比,P<0.05
组别n6 h24 h对照组雌激素组孕激素组16 16 16 1.52±0.13 4.73±1.11*3.40±1.09*1.73±0.15 3.06±0.24*3.41±0.15*
2.2.2 雌二醇、孕酮对小鼠子宫内膜M-CSF表达强度的影响对照组小鼠子宫内膜M-CSF表达呈弱势,雌激素组与孕激素组小鼠子宫内膜M-CSF表达6 h、24 h后明显增强,与对照组相比差异具有统计学意义(F=9.03,P<0.05,t雌激素6h=224.14,t雌激素24h=218.15,t孕激素6h=15.72,t孕激素24h=13.44),见表2、图3。
表2 三组小鼠子宫内膜M-CSF表达量对比

表2 三组小鼠子宫内膜M-CSF表达量对比
组别n6 h24 h对照组雌激素组孕激素组16 16 16 76.12±15.37 96325.78±693.61 6079.14±177.52 79.08±19.54 40089.21±9298.24 6910.31±982.35

图2 三组小鼠子宫内膜巨噬细胞镜检图(免疫组化染色,X 400)
3 讨论
3.1 雌孕激素对巨噬细胞数量影响
作为胚胎及胎儿生长和发育的部位,子宫在哺乳动物繁衍中发挥重要作用。子宫内的主要白细胞亚型包括中性粒细胞、巨噬细胞和T淋巴细胞[6]。巨噬细胞来源于血液,属于单核细胞,是子宫内常驻免疫细胞的一种,参与子宫免疫调节、应答和免疫效应等环节,对机体生殖能力,特别是妊娠建立与维持有重要影响[2]。
雌激素是体内非常重要的甾体性激素,在子宫内膜受容性的建立以及调节过程中起着重要作用[7],已有研究表明巨噬细胞表面存在着雌激素受体[8]。本研究证实雌激素对巨噬细胞具有趋化作用,初步推测其机制是雌激素与子宫内部的雌激素受体特异性结合,促进巨噬细胞趋化因子表达,从而增加巨噬细胞的数量。
孕酮是维持妊娠的主要激素,是一种重要的生殖激素[9]。国内外已有关于孕酮对巨噬细胞数量影响的研究,但是结果存在争议,其主要原因是研究对象的条件各异,存在不同干扰因素,如胚胎在妊娠期对巨噬细胞的影响,雌、孕激素水平和比值等;离体条件下的研究无法反映在体条件下激素对巨噬细胞的影响[10-13]。Wood等采用去势小鼠作为研究对象,发现外源性补充雌激素时小鼠子宫巨噬细胞数量增加,若同时给予雌激素和孕激素会使小鼠子宫巨噬细胞进一步增多,说明适量孕激素对雌激素巨噬细胞的趋化作用起到协同效应[14]。但也有学者使用体外培养的子宫内膜细胞研究发现,孕激素可分泌巨噬细胞趋化因子,推测孕酮本身对巨噬细胞具有趋化作用[15]。
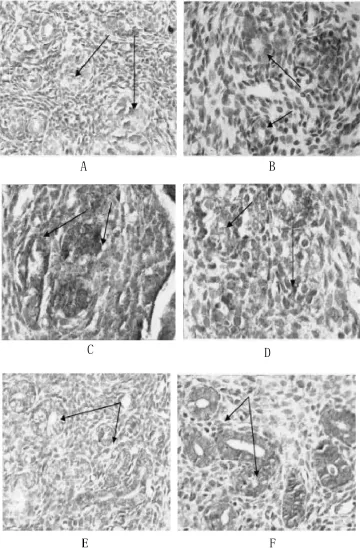
图3 三组小鼠子宫内膜M-CSF镜检图(免疫组化染色,X 400)
本研究采用去势小鼠作为研究对象,去势小鼠造模后子宫中巨噬细胞数量明显减少,补充给予孕激素6 h后,与对照组比较,巨噬细胞明显增加,表明孕激素本身对子宫巨噬细胞具有趋化作用。实验中造模小鼠全部待术后18 d进行试验,消除了体内生殖激素的影响,结果可靠。
3.2 雌孕激素对M-CSF表达的影响
M-CSF是一种由二硫键连接的同源双体糖蛋白,其表达形式有3种:膜结合型、细胞外基质结合型和可溶型[16]。人和啮齿类动物的大部分器官都能够表达M-CSF,不过表达量较少,只有在子宫中出现高度表达,胎盘及子宫内膜组织中都可见M-CSF表达[17]。成熟M-CSF分子在靠近N端的150氨基酸在和MCSF受体结合过程中发挥关键作用,人与小鼠的M-CSF分子在这个区域的结构高度保守,同源性高达80%;人的M-CSF可作用于小鼠,但是小鼠的M-CSF具有其种属特异性[18]。机体的多种细胞可以产生M-CSF,如纤维细胞、骨髓基质细胞、脑星状细胞、激活的巨噬细胞、T细胞、B细胞与内皮细胞等[19];另外淋巴母细胞性白血病、乳腺癌、卵巢癌和肺腺癌等多种肿瘤细胞也可以产生M-CSF[20]。
本研究以去势小鼠为模型,研究单一雌激素及孕激素对M-CSF表达的影响。结果显示,外源性补充雌激素6 h及24 h后,子宫M-CSF表达显著升高。补充孕激素后24 h子宫M-CSF表达显著升高。证实单一雌激素或孕激素可促使子宫M-CSF的表达。
综上所述,单一剂量雌、孕激素可以促进巨噬细胞数量增加,诱导M-CSF的表达,并且巨噬细胞数量和M-CSF表达的变化一致。
[1]黄海玲,谭慧欢,赵琼芝,等.葛根素与雌二醇对去卵巢大鼠子宫的影响[J].重庆医学,2013,42(1):37-39.
[2]宁程程,单伟伟,杨冰义,等.肿瘤相关巨噬细胞(TAMs)促进Ⅰ型子宫内膜癌细胞增殖和侵袭[J].复旦学报(医学版),2014,41(4):447-453.
[3]王丽平,汪沙,张颖,等.雌二醇对子宫腺肌病患者子宫内膜-肌层交界区平滑肌细胞游离Ca2+调节模式的初步研究[J].中华妇产科杂志,2012,47(5):351-354.
[4]冯桂梅,肖丽,黄薇,等.宫腔镜下子宫中隔切除术后放置宫内节育器及应用激素补充治疗对术后妊娠结局的影响[J].实用妇产科杂志,2013,29(10):769-772.
[5]贾永芳,吴雷振,张瑞平,等.花旗松素,槲皮素对LPS诱导流产小鼠子宫巨噬细胞的抑制作用[J].中国免疫学杂志,2013,29(7):723-727.
[6]肖卫华,陈佩杰,王茹,等.过度训练及补充二联甲苯或谷氨酰胺对大鼠腹膜巨噬细胞活性氧和诱导型一氧化氮合酶的影响[J].体育科学,2011,31(2):49-54.
[7]刘卓,金英,隋海娟,等.知母皂苷对Aβ25-35引起的巨噬细胞炎症介质释放的抑制作用及信号转导机制[J].中国药理学通报,2011,27(5):695-700.
[8]潘欣,李广波,李晗,等.鼠伤寒沙门菌对巨噬细胞内过氧化物酶体与诱导型一氧化氮合酶结合的诱导作用[J].解放军医学杂志,2011,36(10):1023-1026.
[9]Snijders AM,Langley S,Mao JH,et al.An interferon signature identified by RNA-sequencing of mammary tissues varies across the estrous cycle and is predictive of metastasis-free survival[J].Oncotarget,2014,5(12):4011.
[10]杨洋,徐晓玉.巨噬细胞在子宫内膜异位症中的作用研究进展[J].重庆医学,2011,40(15):1532-1534.
[11]Quillay H,El Costa H,Marlin R,et al.Distinct characteristics of endometrial and decidual macrophages and regulation of their permissivity to HIV-1 infection by SAMHD1[J].Journal of virology,2015,89(2):1329-1339.
[12]王乾兴,郎楠,贺斌,等.孕酮回植时间对小鼠月经样模型中子宫内膜基质细胞凋亡的影响[J].中国计划生育学杂志,2013,21(7):441-444.
[13]姚佳,刘淑君,彭大才,等.孕酮对雌性小白鼠不同器官中不同分子量蛋白质合成作用的影响[J].安徽农业科学,2013,53(6):2490-2493.
[14]李长兴,李红芳,黄金炳,等.白藜芦醇对雌二醇诱发的去卵巢大鼠子宫内膜渗出和血清VEGF的影响[J].中国现代医学杂志,2013,19(3):23-26.
[15]海娜,刘义,吕立群,等.基因转染DKK1对17β-雌二醇促进子宫内膜异位症患者在位子宫内膜间质细胞VEGF和MMP-9表达的影响[J].华中科技大学学报:医学版,2011,39(6):738-743.
[16]卢燕琼,蒋斯,张洁清,等.雌二醇诱导子宫内膜癌细胞产生的VEGF和bFGF对MAPK通路的影响[J].中华妇产科杂志,2014,49(12):925-931.
[17]镇澜,刘义,吕立群,等.17β-雌二醇对子宫内膜异位症患者在位子宫内膜间质细胞ERK1/2信号转导通路活化的影响[J].华中科技大学学报:医学版,2010,39(4):446-451.
[18]刘勤兴,李炳奇,邵会娟,等.促孕灌注液中黄酮对小白鼠卵巢、子宫及激素的影响[J].西北农业学报,2010, 19(5):32-34.
[19]丁玉达,杨箐岩,刘戈力,等.卵巢及子宫形态学检查和GnRH激发试验的关系[J].天津医药,2012,40(5):427-429.
[20]丁培杰,段长恩,张世杰,等.重组人生长激素对人巨噬细胞分泌IL-1、IL-6和TNF-α的影响[J].郑州大学学报:医学版,2011,46(5):684-686.
Effects of estradiol and progesterone on local macrophage and M-CSF expression in mouse uterus of resection of both ovaries
YAO Guorong
Department of Obstetrics and Gynecology,Huzhou City Central Hospital,Zhejiang,Huzhou313000,China
ObjectiveTo analyze the effects of estradiol and progesterone on endometrium macrophages and M-CSF(macrophage colony-stimulating factor)expression in mice with bilateral oophorectom.MethodsMice with bilateral oophorectom were selected as the research objects and divided into estrogen group,progesterone group and control group respectively.Mice of control group was subcutaneously injected 0.1 mL sesame oil,mice of estrogen group was subcutaneously injected estradiol 100 ng per one,mice of progesterone group was subcutaneously injected orogesterone 2 mg per one.The number of endometrial macrophages and the expression level of M-CSF were analyzed.Results The number of endometrial macrophages in estrogen group and in progesterone group were both more than the control group’s,the difference was statistically significant(F=17.35,P<0.05,testrogen6h=9.21,testrogen24h=9.32,tprogesterone6h=9.56,tproges-terone24h=8.94).Also,the expression level of M-CSF in estrogen group and progesterone group were higher than that in the control group,the difference was statistically significant(F=9.03,P<0.05,testrogen6h=224.14,testrogen24h=218.15,tprogesterone6h=15.72,tprogesterone24h=13.44).Conclusion Both estradiol and progesterone can increase the number of endometrial macrophage and induce the expression of M-CSF.
Estradiol;Progesterone;Macrophages;M-CSF
R96
A
1673-9701(2015)18-0022-04
2015-04-13)
