笃斯越橘新品种“紫水晶”离体培养关键技术研究
2015-01-12田新华翁海龙邢亚娟
田新华, 翁海龙, 李 京, 邢亚娟
(黑龙江省林业科学研究所,黑龙江哈尔滨 150081)
笃斯越橘新品种“紫水晶”离体培养关键技术研究
田新华, 翁海龙, 李 京, 邢亚娟*
(黑龙江省林业科学研究所,黑龙江哈尔滨 150081)
[目的]探讨笃斯越橘新品种“紫水晶”离体培养的关键技术。[方法]通过对外植体灭菌方法,取材时期,增殖、壮苗、生根培养的筛选与优化,建立适合笃斯越橘新品种“紫水晶”的无性配套繁殖体系。[结果]外植体灭菌采用0.1% HgCI2消毒3 min;WPM(改良)+6-BA 1.0 mg/L+ZT1.0 mg/L为笃斯越橘新品种“紫水晶”分化增殖培养基;9月份将无根试管苗移栽到混配有机基质锯末∶树皮∶草炭=1∶1∶1基质中,空气相对湿度80%~90%,培养温度为20~25 ℃,50 d后生根率达72.4%。[结论]建立了笃斯越橘新品种“紫水晶”离体培养关键技术,为大规模工厂化育苗提供技术支持。
笃斯越橘;紫水晶;离体培养;条件优化
笃斯越橘新品种“紫水晶”是以野生笃斯越橘为母本,北美蓝莓为父本的杂交品种,2014年12月鉴定的新品种。该品种树体高大,成年树高0.5~0.8 m,结实量1 200 kg/hm2,总状花序,果实蓝紫色,适合加工,百粒重约60 g。与国外同类品种对比,具有抗旱抗寒优势,定植1年成园,第2年达到丰产。适宜种植在大兴安岭-黑河-小兴安岭一线,活动积温在2 300 ℃以下。
目前,国内对于笃斯越橘的应用与新品种的选育研究较少,而笃斯越橘的离体培养体系尚未建立,组培苗移栽存活率仍较低[1-4],不利于新品种的规模化生产与推广应用。因此,笔者对新品种“紫水晶”的配套繁育技术进行研究,以期为大规模工厂化育苗提供技术支持。
1 材料与方法
1.1 试验材料选用“紫水晶”休眠枝条为供试材料,用清水浸泡催芽,每2 d换1次水,水温控制在18~20 ℃,7 d左右休眠枝条开始萌芽。
1.2 试验方法
1.2.1外植体灭菌。腋芽萌发后,剪取长约1.0 cm的带芽茎段,用清水反复冲洗。在超净工作台上进行灭菌处理:①75%乙醇浸泡30 s,0.1%HgCI2浸泡3 min,然后用无菌水冲洗3次;②75%乙醇浸泡30 s,0.1% HgCI2浸泡5 min,用无菌水冲洗3次;③0.1% HgCI2浸泡3 min,之后用无菌水冲洗3次;④0.1% HgCI2浸泡5 min,用无菌水冲洗3次;⑤75%乙醇浸泡30 s,5%次氯酸钠浸泡5 min,用无菌水冲洗3次;⑥75%乙醇浸泡30 s,5%次氯酸钠浸泡10 min,用无菌水冲洗3次。以上材料灭菌后取出,用无菌滤纸吸干表面多余水分。每组处理10个茎段,3次重复,5 d后观察效果。
1.2.2取材时期及芽苗生长状况。于4月采集健壮无病的“紫水晶”休眠枝条,采用水培催芽的方式,将突破芽鳞的嫩芽接种于改良WPM[用Ca(NO3)2·4H2O,KNO3代替原WPM培养基中的CaCl2、K2SO4];7月、10月分别采集当年生单芽茎段接种,接种后7、14、21 d分别观察染菌情况,研究不同接种时间对芽苗长势的影响。培养基中添加蔗糖30 g/L,日产琼脂粉6 g/L,pH调至5.8,培养温度白天(25±1)℃,夜间(20±1)℃,光照强度2 000 lx,光照时间12 h/d。
1.2.3诱导侧芽生长。以改良的WPM培养基[用Ca(NO3)2·4H2O,KNO3代替原WPM培养基中的CaCl2、K2SO4]为基本培养基,在无菌条件下将单芽茎段接种于WPM(改良)+ZT 0.5 mg/L +30 g/L蔗糖+琼脂粉6 g/L培养基上诱导芽苗生长。培养条件同“1.2.2”。
1.2.4试管苗分化增殖培养。待茎段腋芽伸长后,分别转接于以改良WPM为基本培养基,以6-苄基腺嘌呤(6-BA),玉米素(ZT)为2个因素,每因素设置3个水平。采用L9(34)正交试验设计进行芽增殖培养基筛选。每个处理2次重复,每个重复接种10瓶,35 d后调查苗高和苗数。
1.2.5笃斯越橘壮苗培养。笃斯越橘的试管苗相对柔嫩纤细,需进行一段时间的壮苗培养,才能诱导生根。剪取长约1.0 cm的试管苗转接于WPM(改良)+ZT 1.0 mg/L+30 g/L蔗糖液体培养基,分别置于2 000 lx(处理①)、3 000 lx(处理②)的光照条件下培养50 d。每个处理2次重复,每个重复接种10瓶,培养50 d后调查苗高、茎粗、分化增殖倍数、生长状况。
1.2.6试管苗瓶外生根培养。
1.2.6.1不同有机基质对笃斯越橘苗瓶外生根的影响。经发酵腐熟处理的有机基质经饱和KMnO4溶液消毒30 min后,大量清水冲洗,塑料薄膜覆盖阳光暴晒24 h以上,通风备用。供试基质:①草炭+稻壳+树皮=1∶1∶1;②针叶+树皮+阔叶=1∶1∶1;③针叶+阔叶+稻壳=1∶1∶1; ④树皮+阔叶=1∶1;⑤锯末+树皮+草炭=1∶1∶1;⑥草腐菌菌糠+树皮=1∶1。
将经过壮苗培养的芽苗扦插于以下6种有机基质,每个处理扦插20株,重复3次,30 d后统计不同基质中笃斯越橘试管苗存活率,筛选出适宜笃斯越橘生根的移栽基质。
1.2.6.2不同激素浓度对笃斯越橘组培苗移栽的影响。选用第⑤、⑥号基质为栽培基质,将无根组培苗分别蘸取ABT 500、1 000 mg/L,速蘸30 s后移栽在基质中,50 d后分析不同激素处理对笃斯越橘试管苗瓶外生根的影响。
1.2.6.3不同湿度条件对笃斯越橘瓶外生根的影响。将笃斯越橘移栽培养的温度控制在白天(20~25)℃,夜间(10~15)℃,针对移栽培养不同湿度进行试验,筛选出适于诱导苗生根的环境条件。
1.2.6.4不同移栽时间对笃斯越橘试管苗瓶外生根的影响。选用第⑤、⑥号基质为栽培基质,将组培苗分别蘸取ABT 500、1 000 mg/L,速蘸30 s,分别在5、7、9月进行移栽试验,30 d后统计存活率,分析最适宜笃斯越橘试管苗移栽的时间。
1.3 数据处理采用Microsoft Excel 2003统计工具进行计算并作图,DPS 7.05数据统计软件对试验数据进行方差分析和差异显著性测验(SSR法)[5]。
2 结果与分析
2.1 不同灭菌方法的灭菌效果由表1可知,处理⑤、⑥灭菌不充分,污染率超过60.0%;处理①、②、④灭菌过度,大部分外植体切口处出现褐化,尽管污染数少,但苗木褐化较严重,己经影响到苗木正常生长;处理③即用0.1%升汞浸泡3 min,之后用无菌水冲洗3次的灭菌方法,污染率为16.7%,褐化率为13.3%,为较适宜的灭菌方法,既能达到灭菌的目的,又对外植体无损伤。

表1 不同灭菌时间的灭菌效果
2.2 不同取材时期对笃斯越橘芽苗生长的影响分别于第2年3、7、10月进行笃斯越橘外植体的接种,于接种后7、14、21 d观察结果发现,取材于不同时期的芽,分化率和嫩梢伸长都有所差异。3月接种的嫩芽相对染菌率低,同时由于经过冬季休眠,营养的累积,自身调节已处于萌动期,春季接种的芽苗生长势强,生长速度较快,初分化天数早,在接种的第8天就开始分化。7月接种的芽染菌较严重,向高生长速度快,节间距离大,叶片大而薄,多汁,易产生玻璃化现象,分化相对较少,苗木较细弱。10月接种的芽启动生长速度慢,甚至停滞,从接种的16 d开始有分化迹象。
2.3 笃斯越橘侧芽生长情况笃斯越橘腋芽在改良后的初代培养基上培养10 d左右开始萌动,培养15 d后节间伸长、叶片展开,培养25 d后繁殖系数较高(平均新生芽苗数4.7个),叶片较多(平均叶片数6.0枚),芽苗生长速度较快(平均新生芽苗高0.67 cm),平均芽苗高1.54 cm。
2.4 笃斯越橘试管苗增殖培养基的筛选将经初代培养的试管苗切成1.0 cm左右的茎段转接入不同激素组合的增殖培养基中培养。通过观察各处理培养35 d后的试管苗可知,因激素种类、浓度的不同,不定芽的生长状况表现出明显的不同。笃斯越橘茎段或茎尖的离体增殖率受到培养基中细胞分裂素的调控,伸长生长除受细胞分裂素调控外,还受生长素的调控。将试管苗各性状测量结果进行极差分析。结果表明,无论苗高还是分化增殖苗数均是RZT>R6-BA,即玉米素对试管苗的纵向生长、苗的分化增殖都起着决定性调控作用。但对于苗高性状而言,ZT的1水平作用效果明显;对于分化增殖而言,ZT的2水平作用效果明显。添加6-BA时,外植体也增殖,但增殖效果远不如ZT。方差分析表明,无论对于控制笃斯越橘试管苗的苗高还是分化增殖数,6-BA、ZT两因素不同水平间差异均极显著(P<0.01)。按F值分析,F值大的因素对结果影响较大,结果也与上述分析一致。由表2可知,处理①培养的试管苗向高生长最快,其次是处理⑧,且与其他处理间差异显著(P<0.05);以处理⑧培养的试管苗分化增殖倍数最多,其次是处理⑤,且与其他处理间差异显著(P<0.05)。综上所述,在保证试管苗增殖率的前提下,应选择苗木较高、生长旺盛的处理,即选择培养基(处理⑧)WPM(改良)+6-BA1.0 mg/L+ZT1.0 mg/L为笃斯越橘的分化增殖培养基。
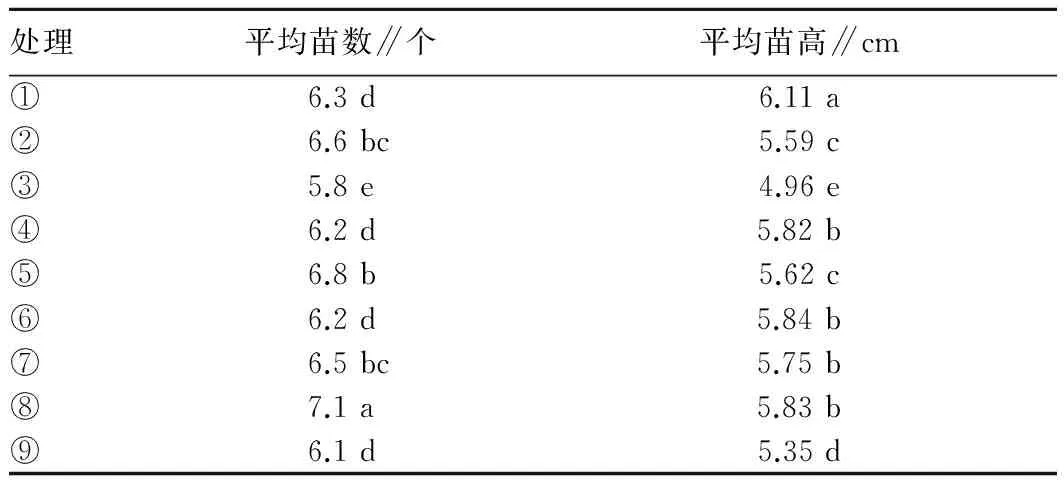
表2 不同处理笃斯越橘植株性状比较
注:要求芽苗高度≥0.5 cm;同列不同小写字母表示差异显著(P<0.05)。
2.5 笃斯越橘试管壮苗的培养将接种试管苗的培养瓶放置于不同光照条件下,培养50 d,结果见表3。由表3可知,经不同光照处理的试管苗生长状况也不同。处理①培养的试管苗长势相对较弱,呈纤细状态,叶片小,叶色嫩绿,茎杆柔嫩、色浅。处理②培养的苗木茎杆相对粗壮,色红,有一定的韧性,叶片完全展开,叶色浓绿、有光泽。虽然高度低于处理①,但其他性状均优于处理①。因此,在试管苗移栽前进行壮苗培养非常必要,使试管苗茎杆增粗,叶片发红,幼茎组织充实,提高木质化程度。经过锻炼的试管苗,叶片抗蒸腾作用和适应能力增强,光合性能显著提高,适应外界环境的能力增强,从而促进根系萌发,提高瓶外生根率。

表3 不同光照处理笃斯越橘试管苗生长状况
2.6 笃斯越橘试管苗瓶外生根技术研究
2.6.1不同基质对笃斯越橘存活率的影响。将经过壮苗培养的试管苗成丛取出,剪去顶端部分保留苗高约2.0 cm,用清水洗净基部培养基。试管苗基部速蘸0.5%KMnO4消毒,然后浸蘸生根激素ABT 30 s,栽到经KMO4消过毒的有机基质中诱导生根。
苗木移栽7 d左右不同基质上的试管苗出现不同程度的萎蔫,其中以掺有稻壳成分的基质较为严重。移栽后约12 d苗木从靠近基质的部位开始返青,移栽后约18 d存活的植株都已经返青,并出现不同程度的生长。茎杆增粗,植株挺立,叶片展开,浓绿。萎蔫的苗木则全株枯黄,埋入基质部分已经腐烂。其中以基质⑤、⑥效果最好,存活率分别为63.4%和56.8%(表4)。

表4 不同基质中笃斯越橘苗木存活情况 %
2.6.2不同激素浓度对笃斯越橘试管苗生根的影响。从笃斯越橘试管苗移栽的第2周开始,每周喷施一次与移栽时相同浓度的生根激素,保持空气相对湿度在80%~90%。通过6组试验得出,在同一移栽基质中蘸取生根激素ABT 1 000 mg/L的组培苗生根较早,且生根速度较快。生根最早的是经ABT 1 000 mg/L处理的⑤号基质,试管苗约在移栽第13天开始生根,第18天根长可达1.2 cm,且有分支;而蘸取生根激素ABT 500 mg/L的组培苗约在移栽的第21天开始生根,生根速度相对较慢。以基质⑤培养的试管苗生根速度较快,根系较多、有分支,且以ABT 1 000 mg/L处理的试管苗平均生根率最高,为72.4%(表5)。
2.6.3不同空气湿度对笃斯越橘苗木存活率的影响。将苗木移栽到基质⑤中,20 d后统计苗木存活状况。由表6可知,在一定空气湿度范围内,组培苗存活率与空气相对湿度呈正相关,空气湿度越高,组培苗的存活率越高,其中以处理③最高。可见,组培苗移栽后,在苗床上方搭建小拱棚并覆盖一层透明塑料布有助于保持空气湿度,从而提高组培苗的存活率。
2.6.4不同移栽时间对笃斯越橘试管苗存活率的影响。将未切除愈伤组织的组培苗进行室外移栽,结果表明,不同月份移栽的笃斯越橘试管苗存活率差异较大(表7),5月份棚内温度中午可达30 ℃,笃斯越橘组培苗成活率较低;7月份气温达到一年中最高值,笃斯越橘组培苗移栽成活率最低;9月份气温开始下降,白天气温在20~26 ℃,但夜间温度为5~10 ℃,气温转凉后比较适于笃斯越橘这种喜阴凉植物的生长,存活率也大幅提升。

表5 不同激素处理笃斯越橘试管苗生根情况

表6 空气湿度对笃斯越橘组培苗移栽存活率的影响

表7 不同移栽时间笃斯越橘的存活率 %
3 讨论
(1)针对笃斯越橘在试管中难以生根或根系发育不良,吸收功能极弱,移栽后不易成活的特点,该试验把生根和驯化相结合,采用试管苗瓶外生根技术,有效地缩短了育苗周期,降低生产成本,节省空间,同时杜绝因炼苗移栽造成死亡的现象,提高了苗木存活率。
(2)试管苗一般在高湿、弱光、恒温条件下进行异养培养,出瓶后极易失水死亡。因此瓶外生根采取覆膜或喷雾等方法保证空气相对湿度(80%~90%),温度控制在25 ℃左右较为适宜,并及时增加光照,以保证苗基部的正常呼吸,并防止叶片失水萎蔫。瓶外生根后期加强通风逐渐降低湿度和温度,以增强幼苗的自养能力,促进叶片保护功能快速完善,气孔变小,增强抗性和适应外界环境条件的能力,生根率提高。温度、光照、基质水分和空气湿度的平衡是获得较高生根率的保证[6]。
(3)该研究采用经发酵的混合有机基质诱导生根,结果表明,不同基质试管苗生根效果差异较大,其中以处理⑤较适宜诱导生根,且以ABT 1 000 mg/L生根效果较好。该基质比无机基质轻,营养丰富,便于携带,有效地降低劳动强度。同时利用该基质可以有效减少换苗床土造成的苗木死亡率。
4 小结
(1)笃斯越橘新品种“紫水晶”外植体采用0.1%升汞消毒3 min是较合适的灭菌方法,既达到灭菌的目的,又对外植体无损伤。
(2)以3月份接种的嫩芽相对染菌率低,生长速度较快,初分化早,在接种的第8天开始分化。7月接种染菌率高,10月接种芽苗生长缓慢。
(3)该研究表明,WPM(改良)+6-BA 1.0 mg/L+ZT 1.0 mg/L为笃斯越橘“紫水晶”的分化增殖培养基,培养35 d平均苗数7.1个,平均苗高5.83 cm。
(4)通过增加光照强度(3 000 lx)进行试管壮苗培养,使试管苗茎杆增粗,叶片发红,幼茎组织充实,木质化程度提高,从而增强适应外界环境的能力。
(5)将经过壮苗培养的试管苗速蘸(30 s)ABT 1 000 mg/L于9月份进行试管外生根诱导,移栽基质为混配有机基质锯末+树皮+草炭=1∶1∶1,空气相对湿度80%~90%,培养温度为20~25 ℃,移栽50 d后生根率达72.4%。
[1] 王辉,王鹏云,王蜀,等.我国蓝莓发展现状及前景[J].农业现代化研究,2008,29(2):250-253.
[2] 刘庆忠,赵红军,郑亚芹,等.高灌蓝莓离体繁殖的研究[J].安徽师范大学学报:自然科学版,2004,27(3):314-317.
[3] 李灿,于强,沙玉芬.蓝莓苗木繁殖技术[J].烟台果树,2006(4):47.
[4] 张力思,魏海蓉,艾呈祥,等.培养基组分对蓝莓组培增殖效率的影响[J].落叶果树,2006(4):13-14.
[5] 唐启义,冯明光. 实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002.
[6] 张彩玲,朱延明,曹天旭. 蓝莓“美登”组培快繁及瓶外生根技术的研究[J].特产研究,2012(1):40-43.
Key Technology of CultureinvitroofVacciniumuliginosum“Zishuijing”
TIAN Xin-hua, WENG Hai-long, LI Jing, XING Ya-juan*
(Heilongjiang Institute of Forestry Sciences, Harbin, Heilongjiang 150081)
[Objective] To discuss cultureinvitrokey technology forVacciniumuliginosum“Zishuijing”. [Method] Through explants sterilization method, sampling time, proliferation, rooting, seedling screening and optimization of culture, asexual matching reproduction system suitable for “Zishuijing” was established. [Result] The experiment shows: the sterilization of explants disinfection using 0.1% HgCl23 min; WPM (improved) +6-BA1.0 mg/L+ZT1.0 mg/L “Zishuijing” differentiation medium; rootless plantlets transplanted to sawdust mixed organic matrix in September: bark peat 1∶1∶1, air relative humidity 80%-90%, culture temperature of 20-25 ℃, the rooting rate reached 72.4%. [Conclusion]invitroculture key technology forVacciniumuliginosum“Zishuijing” was established, which will provide technical support for large-scale seedling.
Vacciniumuliginosum; Zishuijing;invitro; Condition optimization
黑龙江省林业厅资助项目(201004068-6);森工总局科技成果转化项目(sgzjT2013005)。
田新华(1976- ),女,黑龙江肇东人,副研究员,硕士,从事森林培育、遗传育种研究。*通讯作者,研究员,博士,从事森林培育方面研究。
2015-02-09
S 188
A
0517-6611(2015)09-030-03
