吡格列酮抑制体外高糖培养乳鼠心肌细胞炎症作用的研究
2015-01-11鲍翠玉骆晓艳
胡 梅,鲍翠玉,骆晓艳
(湖北科技学院,湖北 咸宁 437100)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种独立于冠状动脉粥样硬化性心脏病、高血压性心脏病、心脏瓣膜病及其它心脏病的特异性心肌疾病,它是糖尿病患者常见的心血管并发症之一,与糖尿病患者心力衰竭发生率和死亡率密切相关。现已引起临床医生和流行病学专家高度的重视。目前关于DCM 各方面的报道很多,其确切发病机制不是很清楚,也没统一的治疗方案。高糖血症是引起DCM 的主要病因,研究表明[1,2],炎症反应在DCM 的发生与发展中起着重要作用。吡格列酮(pioglitazone,PGZ)是临床上常用的一种新型降糖药,研究证明[3],它不仅能降低血糖而且对组织器官有抗氧化、抗炎等保护作用。目前关于PGZ 对糖尿病心肌的抗炎作用尚少见报道,本实验通过体外培养乳鼠原代心肌细胞,观察PGZ 对高糖培养下的心肌细胞的炎症因子影响,探讨PGZ 对DCM 的保护作用可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康SD 新生大鼠,出生0~3d,雌雄不拘。由武汉大学实验动物中心提供(NO.42000500004462)。
1.1.2 主要实验试剂 PGZ 原粉剂(中国食品药品检定研究院),DMEM 粉状培养基(Gibco),胎牛血清(Gibco),炎症因子检测ELISA 试剂盒(欣博盛公司),细胞核蛋白与细胞浆蛋白抽提试剂盒(碧云天生物),单克隆p38 抗体,单克隆磷酸化p38 抗体,单克隆p65 抗体均购自Cell Signaling Technology。
1.2 实验方法
1.2.1 乳鼠心肌细胞的培养 取出生0~3d 的乳鼠若干只,用75%的酒精消毒表面皮肤,随后迅速取出心脏并置于4℃预冷的D-Hank’s 液中洗净污血,用眼科剪减去心脏周围的大血管和组织,将心脏剪碎大约1~2mm2大小,用胰酶与Ⅱ型胶原酶混合消化10min,收集上清液,常温下1000rpm,10min 离心,去掉上清,收集离心管下面的沉淀即所得细胞,采用差速贴壁法纯化心肌细胞。最后将细胞接种于含有20% 的胎牛血清DMEM 培养液中,并置于CO2培养箱常规培养。
1.2.2 实验分组及给药方法 将分离的乳鼠原代心肌细胞培养48h 首度换液,倒置显微镜下观察细胞长势,待其细胞长至90%融合时,将细胞分成以下几组并同时给药处理,正常对照组:5.5mmol/L 的葡萄糖DMEM 培养基加25mmol/L的甘露醇;高糖模型组:30mmol/L 的葡萄糖DMEM 培养基;低剂量组:30mmol/L 的葡萄糖的DMEM 培养基加入终浓度为10μmol/L 的PGZ;高剂量组:30mmol/L 的葡萄糖的DMEM 培养基加入终浓度为20μmol/L 的PGZ;以上各组细胞均继续培养48h 后进行以下指标测定。
1.2.3 乳酸脱氢酶(LDH)含量的测定 取培养后心肌细胞的上清液,用LDH 试剂盒检测,严格按照说明书操作,细胞培养液中LDH 的含量作为判断心肌细胞受损程度指标。
1.2.4 炎症因子IL-6 和TNF-α 含量的测定 取培养后心肌细胞的上清液,用ELISA 试剂盒检测,该指标用来判断高糖诱导下心肌细胞内的炎症因子水平的变化。
1.2.5 乳鼠心肌细胞内转录因子NF-κB 的活性检测 分析NF-κB 的活性采用Western blot 检测细胞核内NF-κB p65 蛋白表达量,H3 作为核内参,核蛋白的提取严格按试剂盒说明书操作。
1.2.6 乳鼠心肌细胞内P38MAPK 的蛋白水平测定 采用Western blot 方法分别检测磷酸化蛋白(P-P38)与P38MAPK 蛋白的表达量,并用P-P38/P38 作为判断P38MAPK 的激活状况。
1.3 统计学分析 数据用SPSS 17.0 统计软件处理,计量资料以均数±标准差表示,组间差异用两样本均数的t 检验进行比较,两组以上比较采用单因素方差分析作统计学处理。P <0.05 为差异有显著性,P <0.01 为差异有极显著性。
2 结果
2.1 各组细胞培养液中LDH 的含量 在高糖环境下,心肌细胞培养液中LDH、IL-6 和TNF-α 的含量显著上升,而给予PGZ 处理后,能明显的抑制LD、IL-6 和TNF-α 的改变,各组间比较有显著性差异(P <0.05)。见表1。
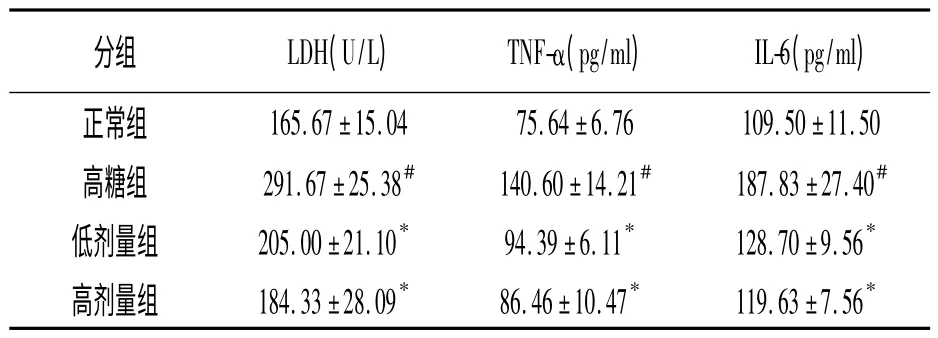
表1 高糖刺激和PGZ 处理对乳鼠心肌细胞培养液中LD、IL-6 和TNF-α 含量的影响
2.2 NF-κB 活性的检测结果 细胞在高糖的诱导下,心肌细胞核内的NF-κB p65 蛋白表达水平明显高于正常组,且差异有显著性意义,经PGZ处理后,能有效的抑制高糖对p65 蛋白表达量改变。见图1。

图1 高糖刺激和PGZ 处理对乳鼠心肌细胞胞核NF-κB p65 蛋白表达量的影响
2.3 乳鼠心肌细胞内P38MAPK 蛋白表达量的结果 高糖组P-P38 相对蛋白量与正常组比较呈明显上升趋势,且两组间差异成显著性,经药物处理后,上述上升的趋势得到有效的逆转。见图2。
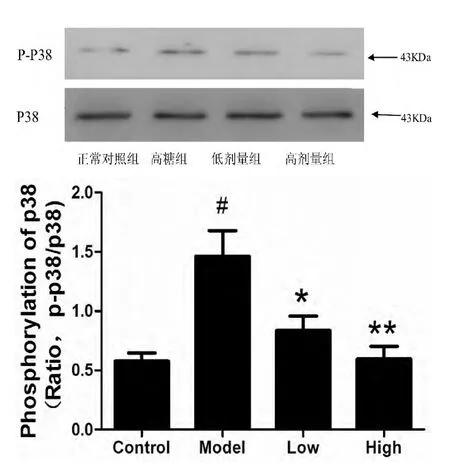
图2 高糖刺激和PGZ 处理对乳鼠心肌细胞p38 蛋白表达量的影响
3 讨论
多种机制共同参与了DCM 的病理生理过程,包括氧化应激、炎症反应、心肌细胞凋亡、细胞间质纤维化及左心室肥厚,其中炎症反应与氧化应激起着最上游的级联调控作用[4]。广泛研究证明了在糖尿病心肌组织中可见大量炎症因子水平上升,本实验也发现,乳鼠心肌细胞在高糖的诱导下,培养液中炎症因子IL-6 和TNF-α 的含量明显高于其它组,与此同时,高糖组培养液中LDH 的活性也增加,说明心肌细胞受损引起LDH 外漏,以上表明高糖能诱导原代心肌细胞产生炎症性损伤。
NF-κB 是重要的转录调节蛋白,P50/P65 是其常见的异源二聚体,NF-κB 激活后与抑制蛋白(IKB)解离,从胞浆移至胞核并与其特异的启动子结合来调控相关的基因表达。研究报道[5]它能调控炎症因子:IL-1、IL-6、TNF-α、VCAM-1 等的基因表达。心肌细胞表达促炎因子受体、IL-1、TNFα 及IKK(核因子抑制物激酶)复合体均需要NFκB 信号的活化。体内外研究表明[6],在糖尿病心肌损伤中可见NF-κB 的活化程度明显的上升。本次实验我们也发现,与正常组对比高糖组心肌细胞核内NF-κB p65 蛋白表达量显著升高,说明在高糖诱导下转录因子被激活后发生了核移位,在核内进一步调控炎症因子的基因表达,致使培养液中炎症因子 IL-1、TNF-α的水平上升。P38MAPK(丝裂原活化蛋白激酶)参与了多种信号通路的调控,Ulivi 等[7]的研究结果显示,在软骨细胞中P38MAPK 的激活可促进NF-κB 的活化,当给予P38MAPK 特异性抑制剂SB203580 后P38MAPK 和NF-κB 的活化都受到抑制。研究发现[8]p38MAPK 信号通路的激活进能促进IκBɑ(核因子NF-κB 抑制蛋白)磷酸化和降解,从而直接激活NF-κB 通路。而在糖尿病心肌病中对此通路研究甚少,本实验我们发现高糖组心肌细胞的P-P38/P38 比值明显升高,说明该组P38MAPK 通路已明显激活,因此有可能在糖尿病心肌病中通过P38MAPK/NF-κB 这条信号通路来调节心肌细胞中炎症反应。
PGZ 是噻唑烷二酮类降糖药,属胰岛素增敏剂,作用机制与胰岛素的存在有关,可减少外周组织和肝脏的胰岛素抵抗,增加依赖胰岛素的葡萄糖的处理,并减少肝糖的输出。PGZ 除了有降血糖作用外对组织器官还有它保作用,特别是对心肌组织。研究发现,PGZ 能改善心肌左室肥大、心肌纤维化、心室舒张期功能障碍和氧化应激。最近有发现PGZ 有抗炎症作用。刘亭亭[9]等用PGZ 处理炎症性肠病小鼠后,发现与对照组相比小鼠血清中炎症因子TNF-α、C-反应蛋白的水平明显下降。本实验我们发现细胞经PGZ 处理后培养液中 LDH 的活性、炎症因子的含量、P38MAPK 蛋白表达量以及NF-κB 的活化程度都得到有效的逆转,说明PGZ 能保护高糖诱导下心肌细胞的损伤,其保护作用机制可能抑制P38/NF-κB 通路的激活来减少炎症反应的产生,低剂量与高剂量组间没差异,说明PGZ 对心肌细胞的保护成一定的剂量依赖性。
综上所述,高糖可促进心肌细胞的炎症因子的产生增多,并对心肌细胞形成炎症性损伤,PGZ处理细胞后,对高糖下的心肌细胞有明显的保护作用,其作用机制可能与p38MAPK/NF-κB 此条信号通路有关。心肌细胞中的炎症反应能引起多种病理变化,最终导致心力衰竭的发生,严重影响糖尿病患者的生活质量,如果能够抑制心肌细胞的炎症反应,对心肌细胞是一种非常有效的保护方法,将成为临床上治疗DCM新的策略。本实验结果显示,PGZ对高糖诱导的乳鼠心肌细胞的炎症反应有一定的保护作用,这将为临床上开发新一代防治糖尿病心肌病的药物提供了实验依据。
[1]Lorenzo O,Picatoste B,Ares-Carrasco S,et al.Potential role of nuclear factor κB in diabetic cardiomyopathy[J].Mediators Inflammation,2011,2011:652097
[2]Boudina S,Abel ED.Diabetic cardiomyopathy,causes and effects[J].Reviews in Endocrine and Metabolic Disorders,2010,11(1):31
[3]Agrawal NK,Kant S.Targeting inflammation in diabetes:Newer therapeutic options[J].World Journal of Diabetes,2014,5(5):697
[4]Zhong P,Wu L,Qian Y,et al.Blockage of ROS and NFκB-mediated inflammation by a new chalcone L6H9 protects cardiomyocytes from hyperglycemia-induced injuries[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2015,28,1852(7):1230
[5]谭毅,王越晖,李校堃,等.心脏炎症反应在糖尿病心肌病发生发展中的病理作用[J].中国糖尿病杂志,2008,16(4):250
[6]Giuliani C,Napolitano G,Bucci I,et al.NF-κB transcription factor:role in the pathogenesis of inflammatory,autoimmune,and neoplastic diseases and therapy implications[J].La Clinica Terapeutica,2000,152(4):249
[7]Ulivi V,Giannoni P,Gentili C,et al.p38/NF-kB-dependent expression of COX-2 during differentiation and inflammatory response of chondrocytes[J].Journal of Cellular Biochemistry,2008,104(4):1393
[8]张苏皖,李素梅.P38 丝裂原活化蛋白激酶在炎症因子诱导糖尿病肾病中的作用[J].国际病理科学与临床杂志,2001,31(1):73
[9]刘亭亭,陈还珍,马文艳,等.吡格列酮对DSS 诱导的炎症性肠病小鼠血清TNF-α 与hs-CRP 水平的影响[J].中西医结合心脑血管病杂志,2015,13(1):61
