天然植物多糖分离纯化技术研究现状和进展
2015-01-11邹胜,徐溢,3*,张庆
邹 胜,徐 溢,3*,张 庆
1 重庆大学化学化工学院;2新型微纳器件与系统技术国防重点学科实验室;3微纳系统及新材料技术国际研发中心,重庆 400030
多糖(polysaccharide)是生物体内除蛋白质和核酸之外的另一类具有重要作用的生物大分子,也是机体内不可缺少的组成部分。多糖在自然界分布广泛,与许多疾病病理过程以及衰老过程密切相关。探索多糖先导药物并加以改造、合成已成为当今生命科学界、医药学界的热点[1]。植物多糖具有多羟基醛的结构,由10 个以上的单糖通过糖苷键聚合而成,分子量高、结构复杂、提取难度大、合成难度大,植物多糖的有效分离纯化是进行多糖结构和生物活性研究的首要前提。因此,为对植物多糖的结构及药理药效等进行深入研究,选择效率高的分离纯化方法具有重要的意义。
1 天然植物多糖的提取方法
植物多糖提取的宗旨是在不破坏多糖基本性质的基础上实现有效提取,多糖是极性大分子,一般不溶于有机溶剂,难溶于冷水,易溶于热水,多糖的传统提取方法多为热水提取。对于有些酸性多糖,或分子量较大的多糖,通常先用热水法提取,然后残渣再用稀碱溶液提取,这样可将大部分多种类型的多糖提取出来。热水提取法在多数植物多糖的提取中得到应用,如穿龙薯蓣多糖、香菇多糖及佛手多糖等的提取[2-4]。为提高多糖的提取效率,在传统的水提法基础上引入一些辅助手段如添加特异性的酶、超声、微波、高压等方法的使用,为不同环境下多糖的获取提供了可靠支持。
1.1 微波辅助提取法
多糖是一类亲水性大分子,与其他亲脂性物质在微波场中吸收微波能力存在差异,利用微波能的加热效应来加速溶剂对物料中多糖组分的溶解,可提高萃取效率并具有较好的选择性[5]。微波辅助法能缩短提取时间,减少溶剂用量、促进有效物质溶出,显著地提高提取效率,广泛应用于香椿叶多糖、山茱萸多糖和卷丹多糖的提取[6-8]。
1.2 超高压提取技术
天然植物中获取胞内多糖时,细胞壁在一定程度上阻碍了胞内多糖的提取效率,在常温下可利用超高压力作用于物料,迫使细胞壁破裂,释放出胞内多糖并溶于提取溶剂中达到提取的目的[9]。敬思群等[10]运用超高压技术提取金鸡菊多糖,极大的缩短提取时间,降低提取温度,保护多糖免受高温的影响。Chen[11]等采用超高压提取技术提取冬虫夏草多糖,通过响应面分析法(RSM)获得最佳的提取条件,保证多糖的生理活性的前提下最大限度获取冬虫夏草的多糖成分。
1.3 酶提取法
酶提取法是一种较温和并能有效提高多糖提取效率的提取方法,用酶处理天然植物的细胞壁组织,破坏其细胞壁结构,或切断多糖与组织中蛋白质的结合,可以促进多糖的有效提取。Chen 等[12]应用葡萄糖氧化酶法提取黄芪多糖,响应面分析法确定最佳的条件下的提取效率为29.96±0.14%。You等[13]优化了酶法提取山茱萸多糖的条件使得多糖提取率为9.29±0.31%,与传统方法比较提取效率更高。
1.4 超声波辅助提取法
超声波辅助提取法是一种通过机械破壁而提高多糖的提取效率的方法,该法有别于酶辅助破壁的方法,其操作条件更简单且易控制,在当归多糖、红参果多糖和黄芪多糖的提取中都得到了充分的应用,提取时能耗明显降低[14-16]。但值得提出的是,多糖的活性很大程度上依赖其结构性质[17],超声提取时,功率过大、超声时间过长均可引起多糖结构的改变,多糖的生理活性也随之改变。
1.5 超临界流体萃取法
超临界流体萃取法以其温和的提取操作条件,提高多糖提取效率的同时保持多糖原始结构方面显示出优势。超临界流体萃取技术应用于天然多糖的提取,没有有机溶剂残留,且对提取出的多糖本身的结构没有破坏[18]。Chen 等[19]运用超临界萃取方法提取艾草种子的多糖组分,在设计的最佳提取条件下:提取压力为45 MPa、温度为45℃、二氧化碳流速为20 L/h、提取时间为2 h,多糖的提取效率为18.59%(w/w)。
1.6 双水相萃取
双水相萃取技术在多糖的提取中应用相对较少,但其分离操作简单、条件温和,可在接近生理环境的条件下进行提取和分离,在萃取多糖时不会引起活性多糖性质的改变,目前多用于实验室研究,在工业化生产中该方法在也具有一定的实用前景。如在螺旋藻多糖和香菇多糖的分离时运用乙醇/硫酸铵双水相体系、聚乙二醇(PEG)-硫酸铵双水相体系进行萃取分离,结果对应多糖的产率分别达到84.5%和57.42%,相较于传统方法具有很大的提高[20,21]。
实现天然植物多糖的有效提取是多糖分析的首要步骤,综述当前多糖的提取方法如表1 所示。

表1 天然植物多糖提取方法比较表Table 1 Comparison of extraction methods for polysaccharides from natural plants

上述多种提取法在提取效率上优于传统提取方法,但必须注意的是在多糖提取时必须保证多糖的基本性质不发生改变,如微波、超声、酶解都有可能造成多糖结构的改变,而糖类成分结构复杂,性质各异,相应的提取方法也就很难整齐划一。因此,需了解物种特性、依据实际情况并结合文献调研来设计提取方案。
2 天然植物多糖的纯化技术
天然植物有效提取后获得的粗多糖尚难以满足多糖结构和活性研究的需要,必须采用适当的手段除去非糖类杂质,并将混合多糖分离纯化成化学组成、聚合度和分子形状相同的均一多糖。多糖的纯化方法可按纯化机制和过程大致可分为三类:一是基于分子量大小和溶解度差异的物理分离过程,二是基于分子间作用力的柱层析分离纯化法,第三即化学沉淀法。
2.1 物理分离过程
2.1.1 膜分离法
膜分离技术是以压力差、浓度差、电位差等为动力,依据相对分子量的不同进行的分离过程,具有分子筛作用,常用于除杂和分离纯化大分子物质。如采用无机陶瓷微滤膜处理虫草菌丝体的粗多糖溶液可以很好的实现去除溶液中的无机盐和小分子肽等物质[22]。分离丹皮多糖、灵芝多糖、白术多糖及青钱柳多糖等[23-26]选用不同截留分子量的超滤膜可以实现多糖的分级,获得不同分子量段的多糖。截留范围更低的纳滤膜则可用于低聚糖的精制和分离,如六味地黄方药液活性多糖[27]的分离。膜分离代替柱层析法对混合多糖按照分子量进行分离具有明显的优点:一是膜分离设备简单,能耗低,在良性使用环境下,可以连续使用,并保持较好的分离效果;二是不损坏多糖的活性,分离过程不引入化学试剂,对多糖本身无污染。然而,活性多糖属于结构复杂的大分子化合物,有黏性,在膜分离过程中加重浓差极化和膜污染等造成的膜渗透通量下降,更易产生膜污染和堵塞,在实际应用中其分离提纯难度较大,此为膜分离应用必须解决的关键问题[28-30]。
此外,利用分子大小差异的分离方法还有基于多糖在超速离心的条件下沉积比率不同的规律而得以分离的超速离心法,虽然该方法对多糖本身的破坏小,分离效果好,但是仪器要求高,操作困难。
2.1.2 分步沉淀和盐析纯化法
分步沉淀通常指根据不同分子量多糖在不同浓度乙醇溶液中的溶解度不同,依此增加醇浓度,从而将多糖按分子量从大到小的沉淀出来的分离过程。分步沉淀实际上可视为一种同时利用分子量大小和溶解度差异的分离过程。该分离方法在多糖的研究中使用最为广泛,同时,利用该方法还可以脱除一些脂溶性的色素等杂质[31,32]。
盐析是另一种常见的利用溶解度差异的分离方法,根据不同多糖在不同浓度盐溶液中具有不同溶解度的性质,加入不同盐析剂使不同多糖逐步析出。该方法也属于分步沉淀,不同之处在于该法使用的是不同浓度的盐溶液而非醇溶液,该法通常仅限于酸性多糖的分离。常用的盐有 NaCl、KCl、(NH4)2SO4,其中以(NH4)2SO4最佳[33]。
2.2 层析(色谱)分离法
在天然产物的分离纯化研究中,柱层析是常见的分离纯化方法,多糖纯化所使用的柱层析固定相有别于其他诸如黄酮、蒽醌、萜类等小分子成分,根据目标物的理化性质,选择最合适的固定相和流动相以实现目标物的高效分离纯化。在多糖的柱层析分离纯化中常见的固定相有纤维素、DEAE-纤维素、交联葡聚糖、琼脂糖、亲和葡聚糖凝胶等。根据待分离多糖与使用的固定相填料之间的作用力不同可将柱层析分为纤维素柱层析、离子交换柱层析、凝胶柱层析、亲和柱层析,其中离子交换柱层析和凝胶柱层析应用最为广泛[34-41]。
纤维素柱层析法适于分离各种酸性多糖和中性多糖,在多糖的除色素中也常常使用[42]。纯化时常选用不同浓度的洗脱液阶段洗脱,首先是小分子被洗脱,然后是大分子的多糖。此法效果好,多糖纯度高,溶剂消耗量大,但分离耗时,尤其分离粘性多糖时易粘附流速更慢。离子交换柱层析是目前多糖纯化中应用最广的一种方法,适合于分离各种酸性、中性粘多糖,如带负电荷的多糖可在阴离子型DEAEcellulose 柱或DEAE-Sephadex柱上达到分级[43]。特别是对于体积较大的多糖,大多采取阴离子交换柱层析纯化,甚至可以分离到均一组分,如穿龙薯蓣粗多糖[2]、巴豆多糖[44]、白桦茸水溶性多糖[45]、白毛藤多糖[46]、四角蛤蜊多糖[47]及龙眼多糖[48]。使用较为普遍的交换剂有DEAE-纤维素(DEAE-cellulose)、DEAE-葡聚糖(DEAE-Sephadex)和DEAE-琼脂糖(DEAE-Sepharose)。凝胶柱层析是目前植物多糖最常用的纯化方法,实际上起分子筛作用,不同质量的多糖按分子量从大到小的顺序被洗脱出来,达到纯化的目的。其优点是简单、条件温和、快速,但不适宜粘多糖的分离。亲和层析需要将具有一定结构的亲和分子制成固定相吸附剂来对被分离物质进行吸附分离,因此具有特定结构的亲和分子“配基”显得尤为重要,由于植物多糖的复杂性,有些粘性多糖的粘性大,容易在层析柱上产生吸附,配基的选择也比较困难,因此这种层析方法的应用不是很多。
2.3 化学沉淀法
多糖作为一类大分子物质,在某些多糖的长链结构中可能会包含一些特殊取代基或基团如羧基、硫酸基等,使这些多糖具有特殊的化学性质,利用这些特性使多糖发生简单的化学反应并从溶剂中沉淀出来以实现多糖的有效分离。
长链季铵盐能与酸性多糖成盐形成水不溶性多糖季铵盐,以分离酸性及中性多糖的季铵盐沉淀法即为常见的化学沉淀法之一。在季铵盐沉淀法中,酸性强或分子量大的酸性多糖首先沉淀出来,控制季铵盐的浓度,也能分离各种不同的酸性多糖。常用的季铵盐是十六烷基三甲基铵的溴化物(CTAB)及其碱(CTA-OH)和十六烷基吡啶(CPC),如张锐等[49]对柚子皮果胶多糖提取时运用十二烷基伯胺乙酸盐盐析法。
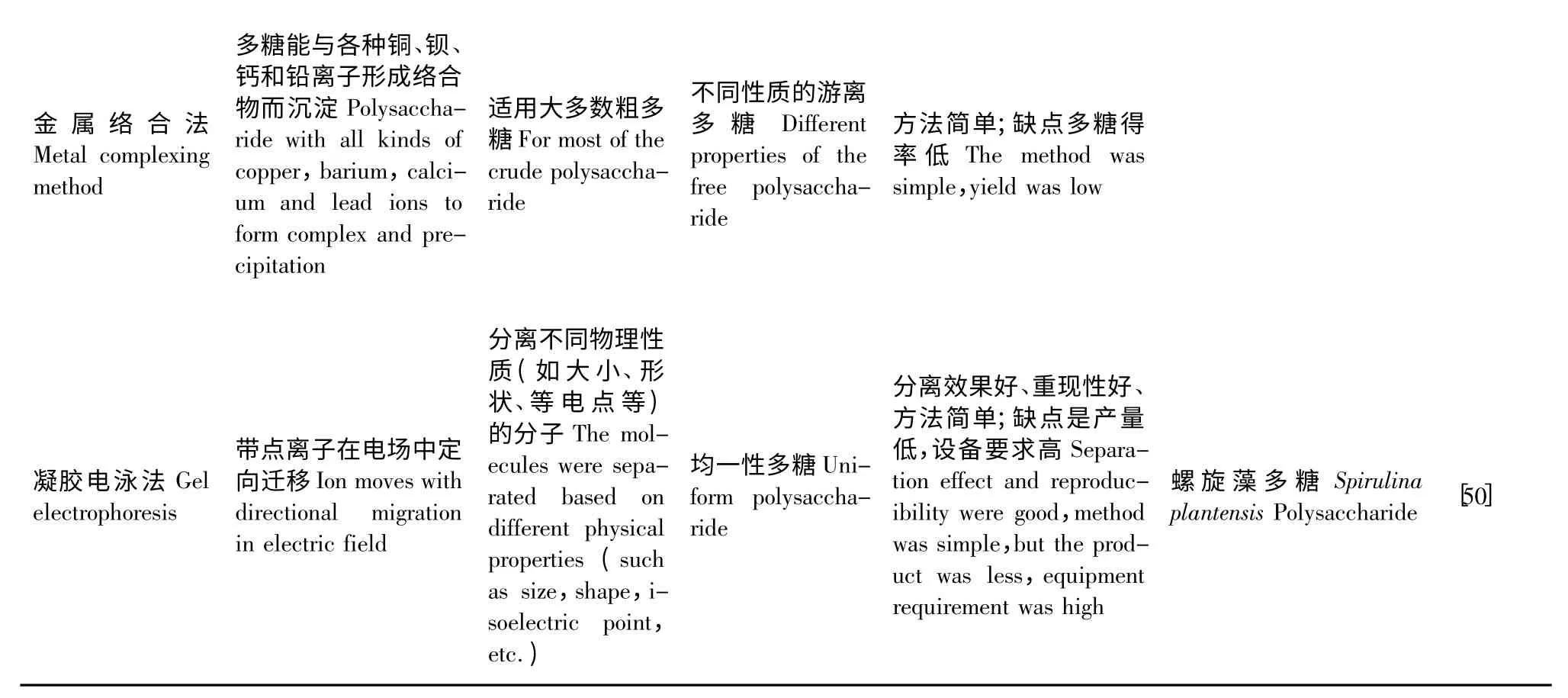
金属络合法则是另一种较为常见的用于多糖分离的方法,其分离过程是根据某些多糖能与金属离子如铜、钡、钙和铅等形成配合物而沉淀,将配合物沉淀充分洗涤后,用无机酸乙醇液或硫化氢处理,重新获得游离的多糖。常用的络合剂有含有Cu2+的斐林试剂、CuCl2、Ba(OH)2等。这一类基于简单化学反应的分离方法在分离化学性质差异明显的多糖时效果显著,但分离过程中需要严格控制反应程度,避免多糖结构的不可逆改变而影响其生理活性。
2.4 其他纯化方法
电泳法(制备型区域电泳)也可用于酸性多糖的分离、鉴定或提纯,其分离效果较好。但目前电泳技术应用于多糖研究存在缺陷,在多糖领域的应用上多是用来鉴定纯度,用于多糖分离时时间较长,分离量少[50]。
综上所述,中药多糖的纯化技术较多,利用多糖的理化性质进行物理的及化学的纯化方法,各纯化方法各有优缺点,文中将各种纯化技术总结汇总于表2。从各分离纯化方法的相关应用中可以看到,在对多糖实际样本进行纯化时往往不是上述几种方法的简单应用,一种方法往往不能一次性地获得均一性的多糖组分,只有综合利用几种方法才能达到理想的纯化效果。多糖的纯化应根据不同种类中药材的性质选择合适的纯化方法,尽量避免一种纯化方法劣势的同时充分联合应用两种或多种纯化方法。

表2 植物多糖的分离纯化方法比较表Table 2 Comparison of purification methods for polysaccharides from natural plants

3 总结及展望
随着人们对糖类的认识不再局限于能源和细胞结构材料,研究者们对多糖研究的无限可能充满期待。多糖所蕴藏的结构的多样性和复杂性远远超过了核酸或蛋白质的结构,一方面使其成为最有魅力的信息载体,另一方面也给我们的研究带来了巨大的困难,包括结构解析、构效关系等。但所有的研究难点都需要一个突破口——即采用高效的提取、分离纯化手段从天然产物中有效获取结构稳定、化学组成、聚合度均一的多糖。尽管本文对近年来多种提取及纯化方法被用于中药多糖成分的提取分离纯化进行了介绍,但由于多糖的复杂性,选择合适的方法得到具有较好均一性的多糖仍然是多糖研究领域的难题。未来天然多糖研究中,可根据不同来源、不同类别的多糖,兼顾其生物活性,建立起与之相应的一种高效稳定的分离纯化方法,避免在其后续的结构和生物活性研究中因分离纯化的差异而导致的不确定性。
1 Finkelstein J.Glycochemistry and glycobiology.Nature,2007,446:999.
2 Luo DH.Structural investigation of a polysaccharide(DMB)purified from Dioscorea nipponica Makino.Carbo Poly,2014,103:261-266.
3 Wang KP,et al.Structural differences and conformational characterization offive bioactive polysaccharides from Lentinus edodes.Food Res Int,2014,62:223-232.
4 Heng ZC,et al.Water-soluble polysaccharides from finger citron fruits(Citrus medica L.var.sarcodactylis).Carbo Res,2014,388:100-104.
5 Kratchanova M,et al.The effect of microwaveheating of fresh orange peels tissue and quality of extracted pectin.Carbo poly,2004,56:181-185.
6 Chen M(陈丛瑾),et al.Study on the hot water extraction process of polysaccharide from Toona sinensis(A.Juss.)Roem.leaves assisted by microwave pretreatment.Food Sci Technol(食品科技),2010,35:178-182.
7 Wu YF(吴艳芳),et al.Study on microwave-assisted extraction of polysaccharides from Corni Fructus.Hubei Agric Sci(湖北农业科学),2011,50:570-572.
8 Chen ZG,et al.Purification,preliminary characterization and in vitro immunomodulatory activity of Tiger lily polysaccharide.Carbo Poly,2014,106:217-222.
9 Huang HW,et al.Advances in the extraction of natural ingredients by high pressure extraction technology.Trends Food Sci Technol,2013,33:54-62.
10 Jing SQ(敬思群),et al.Optimization of the technology condition of ultra-high pressure on extraction polysaccharides from Coreopsis basalis.Food Sci Technol(食品科技),2013,38:168-172.
11 Chen RZ,et al.Ultrahigh pressure extraction of polysaccharides from Cordyceps militaris and evaluation of antioxidant activity.Sep Purific Technol,2014,134:90-99.
12 Chen HG,et al.Optimization of enzyme assisted extraction of polysaccharides from Astragalus membranaceus.Carbo Poly,2014,111:567-575.
13 You QH,et al.Enzyme assisted extraction of polysaccharides from the fruit of Cornus officinalis.Carbo Poly,2013,98:607-610.
14 Han RS(韩荣生),et al.Study of the extraction technical conditions of Angelica polysaccharide.World J Integ Tradit Western Med(世界中西医结合杂志),2011,6:234-237.
15 Chen LH(陈莉华),et al.Extraction and purification of polysaccharides from Hong Guo Ginseng and the comparison of antioxidant activity.Nat Prod Res Dev(天然药物研究与开发),2012,25:170-173.
16 Xu Y(徐艳),et al.Extract Astragalus polysaccharides by ultrasonic cell disrupter.Chin J Inf TCM(中国中医药信息杂志),2007,14(3):44-45.
17 Peng YF,et al.Structure and antitumor activities of the water-soluble polysaccharides from Ganoderma tsugae mycelium.Carbo Poly,2005,59:385-392.
18 Sahena F,et al.Application of supercritical CO2in lipid extraction-A review.J Food Eng,2009,95:240-253.
19 Chen J,et al.Supercritical CO2extraction and pre-column derivatization of polysaccharides from Artemisia sphaerocephala Krasch.Seeds via gas chromatography.Indus Crops Prod,2014,60:138-143.
20 Liu Y(刘杨),et al.Extraction of spirulina platensis polysaccharide by ethanol/(NH)2SO4.Chem Res Appl(化学研究与应用),2012,24:1781-1785.
21 Xu HJ(徐海军),et al.Extraction of lentinan by aqueous two-phase system.Nat Prod Res Dev(天然产物研究与开发),2013,25:982-985.
22 Han YP(韩永萍),et al.Research on inorganic ceramic micro-filtration membrane treating with rough Cordyceps mycelia polysaccharides solution.Food Ferment Ind(食品与发酵工业),2008,34(2):90-93.
23 Wang ZY(王子尧),et al.Study on separation of polysaccharides from moutan cortex by ultrafiltration technique.Mem Sci Technol(膜科学与技术),2009,29:99-100.
24 Yang ZJ(杨祖金),et al.Purification of Ganoderma lucidum polysaccharide by ultrafiltration technology.J Chin Med Mater(中药材),2009,32:126-129.
25 Zhou JR(周家容),et al.Isolation of Atractylodes macrocephala Koidz polysaccharides with ultrafiltration membrane and study of their antioxidant activity.J Southwest Univ,Nat Sci Ed(西南大学学报),2009,31(4):79-82.
26 Jian HX,et al.Separation of water-soluble polysaccharides from Cyclocarya paliurus by ultrafiltration process.Carbo Poly,2014,101:479-483.
27 Zhong L(钟蕾),et al.Effect analysis of the concentration of Liuwei Dihuang polysaccharides by the membrane separation technique and the traditional method.J Pharm Prac(药学实践杂志),2007,25:386-388.
28 Alain M,et al.Extraction and fractionation of polysaccharides and B-phycoerythrin from the microalga Porphyridium cruentum by membrane technology.Algal Res,2014,5:258-263.
29 Mi JZ(米吉造).Studies on Application of Membrane separation technology production of Vitamin C.Tianjin:Tianjin University(天津大学),MSc.2003.
30 Enrico D,et al.Membrane engineering in process intensification—An overview.J Mem Sci,2011,380:1-8.
31 Wu Z,et al.Extraction optimization,preliminary characterization,and in vitro antioxidant activities of crude polysaccharides from finger citron.Ind Crops Prod,2013,44:145-151.
32 Wang D,et al.Characterization of a water-soluble polysaccharide from Boletus edulis and its antitumor and immunomodulatory activities on renal cancer in mice.Carbo Poly,2014,105:127-134.
33 Sun WY(孙文怡),et al.Optimization of purification technique conditions of fruiting body polysaccharide of H.caputmedusae(Bull.Fr.)Pets.using salting-out method.J Jilin Norm Univ,Nat Sci(吉林师范大学学报,自科版),2011,3:88-91.
34 Tang W(汤伟),et al.Study on purification of polysaccharides in root of Salviam iltiorrhizaby macroporous adsorption resin and ion-exchange resin methods.J Chin Med Mater(中药材),2010,33:1937-1941.
35 Xie MY(谢明勇),et al.A Review about the research of structure and function of polysaccharides from natural products.J Chin Insti Food Sci Technol(中国食品学报),2010,10(2):1-11.
36 Zhao H,et al.Purification,characterization and immunomodulatory effects of Plantago depressa polysaccharides.Carbo Poly,2014,112:63-72.
37 Chi AP,et al.Morphological and structural characterization of a polysaccharide from Gynostemma pentaphyllum Makino and its anti-exercise fatigue activity.Carbo Poly,2008,74:868-874.
38 Sanya H,et al.Water-soluble polysaccharides with pharmaceutical importance from Durian rinds(Durio zibethinus Murr.):isolation,fractionation and bioactivities.Carbo Poly,2004,56:471-481.
39 Zhou R(周锐),et al.Purification and hepatoprotective effect of Momordica polysaccharides.Food Sci Technol(食品科技),2013,38:173-176.
40 Fang JN(方积年),et al.Bioactivities,isolation and purification methods of polysaccharide.Chin J Nat Med(中国天然药物),2007,5:338-347.
41 Halina L,et al.Affinity chromatography for the purification of lectins(a review).J Chromatogr A,1981,215:361-372.
42 Shen J(沈洁),et al.Research progress in extraction,chemical modification and anticancer activity of fungi polysaccharides.Nat Prod Res Dev(天然产物研究与开发),2014,26:1723-1727.
43 Zhang L,et al.Purification,antioxidant and immunological activities of polysaccharides from Actinidia Chinensis roots.Inter J Bio Macro,2015,72:975-983.
44 Begona M,et al.Characterization of a fucoarabinogalactan,the main polysaccharide from the Gum Exudate of Croton urucurana.J Nat Prod,2002,65:1143-1146.
45 Fan LP,et al.Antitumor and immunomodulatory activity of water-soluble polysaccharide from Inonotus obliques.Carbo Poly,2012,90:870-874.
46 Mao JS(毛建山),et al.Isolation,purification,and identification of polysaccharide of Solanum lyratum.Chin Trad Herb Drugs(中草药),2005,36:654-656.
47 Ling CW,et al.Isolation and structural elucidation of novel homogenous polysaccharide from Mactra veneriformis.Carbo Poly,2011,86:982-987.
48 Zhang MW,et al.A method of separation of neutral polysaccharide from longyan(一种中性龙眼多糖级分的分离方法).CN 201010603686.5,2010-12-24.
49 Zhang R(张锐),et al.Extraction of polysaccharides from grapefruit peel by salting-out with dodecylamine acetate salt.Sci Tech Food Ind(食品工业科技),2006,27:120-122.
50 Zheng ZH(郑震寰),et al.Studies on the electrophoreticmethods of acidic polysaccharide from Spirulina plantensis.Pharm Biol(药物生物技术),2004,11:104-107.
