紫叶李果实的化学成分研究
2015-01-11李晓男陈燕燕周江韬王跃飞姜苗苗
李晓男,陈燕燕,周江韬,王跃飞,姜苗苗*
1 天津市现代中药重点实验室天津中医药大学,天津 300193;2中药新药研发中心天津国际生物医药联合研究院,天津 300457
紫叶李(Pranus cerasifera Ehrh f.)又名红叶李,樱桃李,蔷薇科(Rosaceae)李属植物。紫叶李是落叶小乔木,叶常年紫色,著名观叶树种。原种产于亚洲西南部,具有耐湿,耐寒和一定的耐碱能力,因我国天津市滨海新区冬季寒冷干燥,夏季酷热潮湿,土壤盐分高,易旱,所以紫叶李在滨海新区得以广泛种植[1]。国内外学者对紫叶李同属植物的化学成分进行了报道,从它们的叶子、果实、种子等部位分离得到黄酮类、花色素类、香豆素类、新木脂素类等成分[2-5]。现在,随着对紫叶李的不断研究,已有文献报道紫叶李的叶子具有抗氧化活性[6],但是对紫叶李果实的化学成分研究甚少。
本文对紫叶李的新鲜果实进行化学成分研究,分离得到5 种化合物,分别为3-O-乙酰基原儿茶酸(1)、2(R)-羟基丁二酸-1-甲酯(2)、3,3',4,4'-四羟基联苯(3)、β-胡萝卜苷(4)和槲皮素(5)。化合物1~4 为首次从该植物中分离得到,其中,1 为新天然产物。
1 仪器与材料
Bruker PLUS 400 MHz 核磁共振波谱仪;Bruker AVANCE Ⅲ600 MHz 核磁共振波谱仪;Waters TQ-S质谱仪,Waters Xevo G2-S Q-TOF MS 质谱仪;旋转蒸发仪RE-52A(上海亚荣生化仪器厂);薄层层析硅胶GF-254、柱层析硅胶200~300 目(青岛海洋化工厂),ODS-A-HG 5~50 μm(日本YMC 公司),Sephadex LH-20 凝胶(瑞士GE Healthcare 公司),DPPH(2,2-二苯基-苦肼基,Sigma 公司),维生素C(天津市北方天医化学试剂厂),96 微孔板(美国Corning 公司);所用试剂均为分析纯(天津康科德试剂公司)。
紫叶李果实,2013 年9 月采集于天津市滨海新区,由天津中医药大学吴红华博士鉴定为蔷薇科李属植物紫叶李(Pranus cerasifera Ehrh f.)的新鲜果实。标本(B41320090001)存放于天津中医药大学中药新药研发中心化学与分析部。
2 提取与分离
将紫叶李果实在60 ℃恒温干燥箱中干燥,称重得2.0 kg,粉碎。用10 倍量的95%乙醇冷浸两次,每次7 d,将所得提取液合并过滤,减压浓缩至无醇味,得乙醇提取物800 g。将乙醇提取物用蒸馏水混悬均匀后依次用等体积乙酸乙酯,萃取3 次,合并萃取液,得到乙酸乙酯部位85 g。将乙酸乙酯部位经硅胶柱,以二氯甲烷-甲醇(v/v,二氯甲烷,100∶2,100∶3,100∶6,100∶10,100∶25,100∶50,甲醇)梯度洗脱得到8 个馏份(Fr.1~8)。Fr.2 经硅胶柱,得到亚馏分Fr.2.1 和Fr.2.2。Fr.2.1 经Sephadex LH-20(二氯甲烷∶甲醇=1∶1,v/v)纯化,得到化合物2(5 mg)、3(10 mg)。Fr.2.2 经硅胶柱色谱以二氯甲烷-甲醇(100∶3,v/v)洗脱得到Fr.2.2.1,经Sephadex LH-20(甲醇∶水=1∶1,v/v)反复纯化,得到化合物5(3 mg)。Fr.3 经硅胶柱色谱,以二氯甲烷-甲醇(100∶2,v/v)洗脱,得到Fr.3.1,再经硅胶柱色谱,以二氯甲烷-甲醇(100∶5,v/v)洗脱,再经Sephadex LH-20(甲醇∶水=1∶1,v/v)纯化,得到化合物1(25 mg)。Fr.4 经硅胶柱色谱和ODS 纯化,得到化合物4(20 mg)。
3 结构鉴定
化合物1 黄色针状晶体(甲醇);ESI-MS m/z:374[2M-H2O]+,195[M-H]-,ESI-MS2给出离子峰[M-H-60]-,中性失去60,提示结构中存在一分子乙酰 氧 基;HR-ESI-MS m/z:195.0294[M-H]-(C9H7O5,计算值为195.0293),确定其分子式为C9H8O5,不饱和度为5;UV(MeOH)λmax(log ε):292(0.29)nm;IR(KBr)νmax3210,2654,1697,1603,1528,1297,1098,943,766,640 cm–1;在1H NMR(CD3OD,400 MHz)中,由δ 7.43(overlapped),δ 7.41(1H,d,J=2.1Hz,H-2)和δ 6.80(1H,d,J=8.5Hz,H-5)提示化合物1 中存在一个1,3,4-三取代苯环,δ 2.56(3H,s,-CH3)提示化合物1 存在-CH3。在13C NMR(CD3OD,100 MHz)中显示9 个碳原子信号,其中δ 176.0,δ 169.1 为羰基碳原子信号,δ 150.5、δ 144.0、δ 122.7、δ 121.8、δ 116.3、δ 114.7 为芳香区碳原子信号,δ 29.8 为-CH3中碳原子信号。从HMBC 图谱中可以看到-CH3(δ 2.56)与C-1'(δ 176.0)相关,提示结构中含有一个乙酰基;另外δ 7.43(overlapped)、δ 7.41(H-2)与δ 169.1(C-7)相关,说明苯环上H-1 位置被羧基取代;通过对比化合物1 和原儿茶酸标准品的1H NMR和13C NMR 数据,发现C-3 化学位移存在差异,化合物1 的C-3 的比原儿茶酸的C-3 向高场移动δ 2.1,提示乙酰基将原儿茶酸中的C-3 位的酚羟基乙酰化,得到的乙酰化产物为化合物1,其结构与文献[7]一致,即化合物1 为3-O-乙酰基原儿茶酸(3-O-acetyl-protocatechuic acid)。1H NMR(CD3OD,400 MHz)δ:7.43(overlapped),7.41(1H,d,J=2.1Hz,H-2),6.80(1H,d,J=8.5Hz,H-5),2.56(3H,s,-CH3);13C NMR(CD3OD,100 MHz)δ:176.0(C-1'),169.1(C-7),150.5(C-4),144.0(C-3),122.7(C-6),121.8(C-1),116.3(C-2),114.7(C-5),29.8(C-2')。其化学结构见图1。
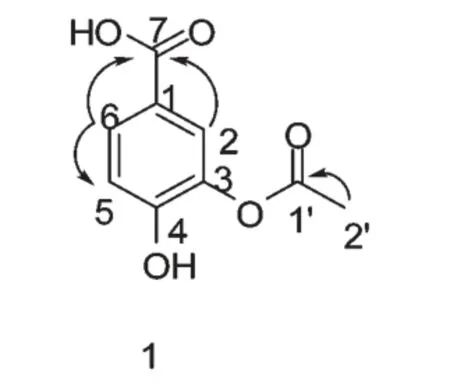
图1 化合物1 的化学结构和HMBC 相关Fig.1 Chemical structure and key HMBC correlations of compound 1
化合物2 无色结晶(甲醇);分子式C5H8O5;ESI-MS m/z:149[M+H]+,147[M-H]-;在1H NMR(CD3OD,600 MHz)中由δ 4.50(1H,dd,J=7.3,4.7 Hz)上偶合常数判断为叔碳上的质子信号。δ 3.74(3H,s)为-OCH3上的质子信号,δ 2.67(1H,dd,J=16.2,7.3 Hz),δ 2.78(1H,dd,J=16.2,4.6 Hz)则为-CH2信号。13C NMR(CD3OD,100 MHz)显示6 个碳原子信号,其中δ 175.1、δ 174.1为两个羰基碳原子信号;δ 68.5、δ 39.8 由化学位移判断为相连的叔碳和仲碳原子信号;δ 52.6 则为-OCH3上碳原子信号。1H NMR(CD3OD,600 MHz)δ 4.50(1H,dd,J=7.3,4.7 Hz),3.74(3H,s,-OCH3),2.78(1H,dd,J=16.2,4.6 Hz),2.67(1H,dd,J=16.2,7.3 Hz);13C NMR(CD3OD,100 MHz)δ:175.1(C-1),174.1(C-4),68.5(C-2),52.6(-OCH3),39.8(C-3)。以上数据与文献[8]报道基本一致,故化合物2 鉴定为2(R)-羟基丁二酸-1-甲酯(2(R)-hydroxybutanedioic acid-1-methyl ester)。
化合物3 白色粉末(甲醇);分子式C7H6O4;ESI-MS m/z:435[2M-H]-,217[M-H]-;1H NMR(CD3OD,400 MHz)δ:6.97(1H,d,J=2.0Hz,H-2),6.86(1H,dd,J=2.0,8.4Hz,H-6),6.79(1H,d,J=8.4,H-5);13C NMR(CD3OD,100 MHz)δ:146.3(C-4,4'),145.2(C-3,3'),134.8(C-1,1'),118.9(C-6,6'),116.5(C-5,5'),114.6(C-2,2')。以上数据与文献[9]报道基本一致,故化合物3 鉴定为3,3',4,4'-四羟基联苯(3,3',4,4'-Tetrahydroxybiphenyl)。
化合物4 白色粉末(甲醇);分子式C35H60O6;10%硫酸乙醇溶液显紫红色;其1H NMR 和13C NMR谱与胡萝卜苷标准谱一致,故化合物4 鉴定为β-胡萝卜苷(β-daucosterol)。
化合物5 黄色针状晶体(甲醇);分子式为C15H10O7;ESI-MS m/z:303[M+H]+,301[M-H]-;1H NMR(CD3OD,400 MHz)δ:7.72(1H,d,J=2.0 Hz,H-2'),7.61(1H,dd,J=2.0,8.4 Hz,H-6'),6.86(1H,d,J=8.4 Hz,H-5'),6.37(1H,d,J=2.0 Hz,H-8),6.16(1H,d,J=2.0 Hz,H-6);13C NMR(CD3OD,100 MHz)δ:177.4(C-4),165.7(C-7),162.6(C-5),158.2(C-9),148.8(C-2),148.0(C-4),146.3(C-3'),137.3(C-3),124.2(C-1'),121.7(C-6'),116.3(C-5'),116.0(C-2'),104.5(C-10),99.3(C-6),99.4(C-8)。以上数据与文献[10]报道基本一致,故化合物5 鉴定为槲皮素(Quercetin)。
4 抗氧化活性测定
待测的5 个化合物对DPPH 自由基的清除作用,按文献[11]方法测定。待测化合物清除DPPH 自由基的IC50值如下表1 所示。结果显示化合物3、5清除DPPH 自由基的能力与Vc 相当,与它们的化学结构中含有较多的酚羟基数目有关。

表1 待测化合物清除DPPH 自由基的IC50值Table 1 IC50of DPPH scavenging of the isolated compounds
1 Wei J(魏剑),Wang SJ(王素君).The ecological landscaping plants configuration of Tianjin Binhai new area.Sci Technol Tianjin Agric Forest(天津农林科技),2011,5:26-28.
2 Wu B(吴波),Zhang WN(张维农),Yan JF(严建芳),et al.Optimum extraction technology of kaempferol in Prunus cerasifera leaves.Nat Prod Res Dev(天然产物研究与开发),2011,23:952-955.
3 Koestsu T,Youhei T,Hiroya O,et al.Variation of fragrance constituents in the leaves of Prunus.Biochem Syst Ecol,2006,34:127-135.
4 Farnk SS,Santamour J,Louisse GH,et al.Distribution and inheritance of scopolin and herniarin in some Prunus species.Biochem Syst Ecol,1994,22:197-201.
5 Liu QB,Huang XX,Yan XJ,et al.Neolignans from the seeds of Prunus tomentosa(Rosaceae)and their chemotaxonomic interest.Biochem Syst Ecol,2014,55:236-240.
6 Hu YF(胡迎芬),Meng J(孟洁),Hu BL(胡博璐).An-tioxidant activity and stability of the exact of Pranus cerasifera Ehrh Cv.Food Sci(食品科学),2002,23:274-276.
7 Schuster B,Winter M,Herrmann K.4-O-β-D-Glucosides of hydroxybenzoic and hydroxycinnamic acids-their synthesis and determination in berry fruit and vegetables.J Biosciences,1986,41c:511-520.
8 He XJ,Liu RH.Cranberry phytochemicals:Isolation,structure elucidation,and their antiproliferative and antioxidant activities.J Agric Food Chem,2006,54:7069-7074.
9 Fu C(付琛),Chen C(陈程),Zhou GX(周光雄),et al.Chemical constituents from fruits of Amomum villosum.Chin Tradit Herb Drugs(中草药),2011,42:2410-2412.
10 Young HC,Hye KK,Huub JM,et al.NMR metabolomics to revisit the tobacco mosaic virus infection in Nicotiana tabacum leaves.J Nat Prod,2006,69:742-748.
11 Cai YZ,Sun M,Xing J,Luo Q,et al.Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants.Life Sci,2006,78:2872-2888.
