动脉自旋标记脑灌注技术在快速动眼睡眠障碍研究中的应用
2015-01-11汤伟军左传涛葛璟洁张卫国
汤伟军 鹿 蓉 左传涛 葛璟洁 于 欢 魏 青 张卫国
快速动眼睡眠障碍(REM sleep behavior disorder,RBD)是以REM睡眠时骨骼肌失迟缓,同时出现与梦境相关的言语或动作为特征的疾病,RBD可以是原发的,也可以继发于某些神经系统疾病。目前,它被认为很可能是许多神经退行性疾病,如帕金森病(Parkinson disease,PD)、路易小体痴呆(dementia with Lewy bodies,DLB)和多系统萎缩(multiple system atrophy,MSA)等的前驱表现。
RBD的诊断主要通过临床表现、脑电图、多导睡眠图(polysomnography,PSG)及实验室检查等方法进行。神经功能影像技术是目前研究睡眠疾病的发病机制、病理改变及与其他神经系统疾病关系的重要手段。本文采用磁共振动脉自旋标记技术(arterial spin labeling,ASL)对原发性RBD患者的脑血流灌注情况进行研究。
方 法
1.临床资料
2013年6月至2014年6月复旦大学附属华山医院神经内科或睡眠障碍诊治中心确诊的原发性RBD患者20例,其中男性14例,女性6例,年龄57~79岁,平均62岁,RBD的诊断参考美国睡眠协会中RBD的最低诊断标准[1],均经同步视频多导睡眠监测(polysomnography,PSG)证实。对照组为年龄、性别与RBD患者匹配的健康中老年人,共15例,无神经系统疾病的主诉和体征。其中男性10例,女性5例,年龄51~75岁,平均60岁。本研究经医院伦理委员会审核通过,所有被试在检查前均签署知情同意书。
2.检查方法
RBD患者和正常志愿者的磁共振检查均在GE Discovery MR750 3.0T扫描仪上采用12通道头部线圈进行图像采集。扫描序列包括用于常规诊断的核磁共振扫描(T1WI、T2WI、FLAIR和DWI)及轴位3D-ASL序列和3D-BRAVO序列扫描。3D-ASL成像参数为:TR/TE/TI/FA=4844ms/10.5ms/2025/111,PLD(post labeling delay)=2025ms,FOV=24cm,矩阵=128×128,层厚=4.0mm;3D-BRAVO的成像参数为:TR/TE/TI/FA=8.16/3.18/450/12,FOV=25.6cm,矩阵=256×256,层厚=1.0mm。扫描结束后由放射科两位经验丰富的医师进行阅片,对大脑的神经退行性改变情况作出评估,得到两组被试全脑皮质萎缩(global cortical atrophy,GCA)及脑白质损害评定量表(Fazekas scale)视觉评分。
3.图像分析
3D-ASL序列的原始图像及CBF图、3D-BRAVO的结构图像均以DICOM格式通过PACS传送至后处理工作站。图像的预处理和统计分析均在MATLAB(Version 2010b,Mathworks Inc,Sherborn,MA)平台上通过SPM8软件完成(Wellcome Department of Imaging Neuroscience, Institute of Neurology,London,UK)。具体过程包括:
(1)采用SPM的Coregister工具对3D-ASL和3D-BRAVO的图像进行配准。
(2)采用SPM的Segment工具对配准后的3D-BRAVO高分辨率脑结构图像进行分割,获得脑灰质(GM)、白质(WM)和脑脊液(CSF)的概率分布图。
(3)采用公式CBFcorr=CBForig/(GM+0.4×WM)对CBF图像的部分容积效应(partial volume effect,PVE)进行校正。
(4)采用SPM的Normalise工具对校正后的CBF图进行空间标准化,使得标准化后的CBF图转换至蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)的标准脑空间。
(5)采用SPM的Smooth工具,以8mm×8mm×8mm的半高宽对标准化后的图像进行空间平滑。
(6)采用SPM的Second level Analysis工具,对进行平滑后的CBF图以双样本t检验对RBD组和对照组间的差异进行统计显著性的检验,以未校正的P<0.001为差异显著性的阈值(空间阈值<10个体素)。
(7)统计学检验的结果的呈现和提取采用xjview工具包(www.alivelearn.net/xjview8/)。
结 果
1.临床情况
两组被试间年龄分布的差异无统计学意义;所有患者均经临床及常规磁共振检查排除继发性原因,并均经PSG监测显示存在REM期肌肉失弛缓及异常复杂运动,确诊为原发性RBD。
大脑神经退行性改变的MRI评估结果显示,两组被试间GCA和脑白质损害评分的差异无统计学意义,P<0.01。
2.SPM统计分析结果
对照组与RBD组被试的脑皮质灌注图经PVE校正后,通过t检验显示两者之间的差异情况见图1和表1。
我们的结果显示跟正常志愿者相比,RBD患者皮质灌注增高的区域主要位于额叶、前扣带皮质、辅助运动区、壳核、海马旁回、楔前叶和脑桥等;皮质灌注降低的区域主要位于枕叶、舌叶、颞叶中部等。
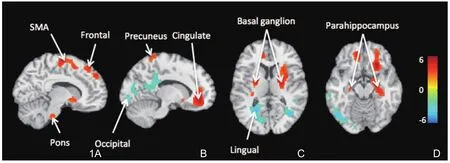
图1 对照组与RBD组被试脑皮质灌注的差异采用SPM双样本t检验后获得的t值图,暖色为RBD组大于对照组的区域,冷色为RBD组小于对照组的区域。
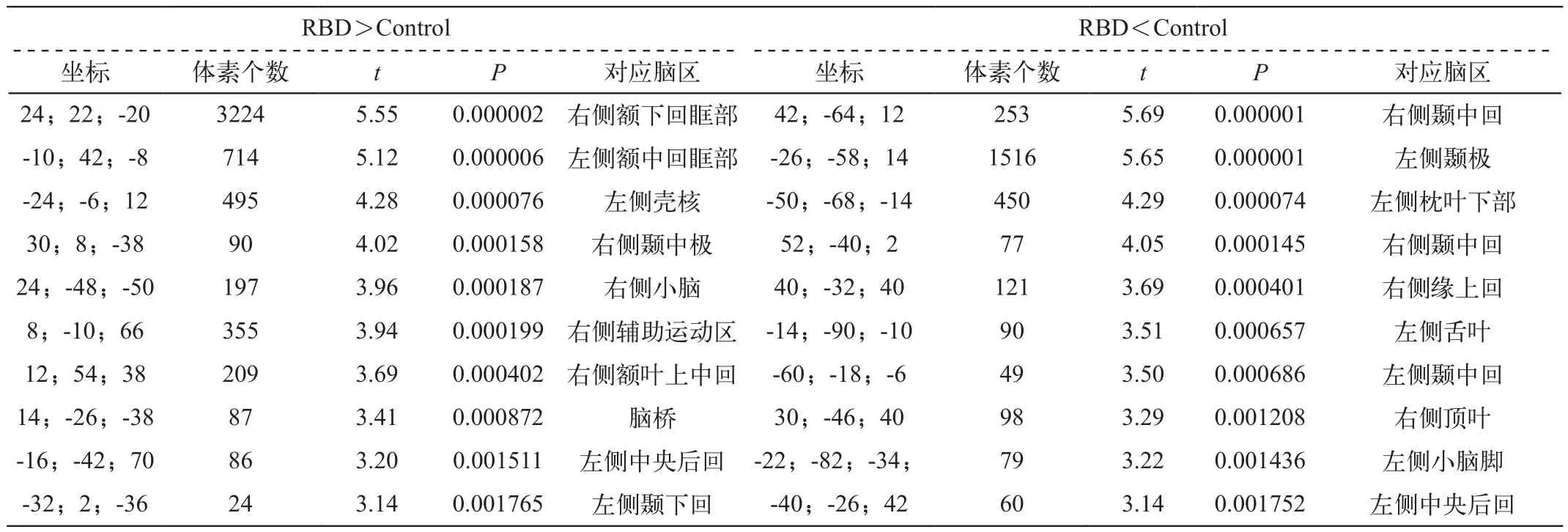
表1 对照组与RBD组被试脑皮质层灌注的差异采用SPM双样本t检验后获得的统计学结果及对应脑区的定位
讨 论
RBD在睡眠障碍患者中占4.8%[2],以50岁以上男性多见,我们研究中患者的平均年龄为62岁,其中70%为男性,与文献报道相仿。RBD的病因及病理机制目前仍不十分清楚,多项临床和病理研究显示RBD与神经退行性疾病中的α-突触核蛋白疾病族,如帕金森病(Parkinson disease,PD)、多系统萎缩症(multiple system atrophy,MSA)、Lewy小体性痴呆等有密切联系,其症状常在这些疾病的其他症状数年之前出现,它们共同的病理基础是不可溶性α-突触核蛋白选择性地在易感神经元和神经胶质细胞沉积[3-4],因此,RBD被认为可能是其发展过程中的某个阶段。
原发性RBD患者通常没有明显脑结构上的改变,我们的结果显示RBD组和对照组在全脑皮质萎缩和脑白质损害评定量表视觉评分上的差异没有统计学意义。常规磁共振的形态学检查对RBD的诊断价值仅在于排除其他继发性原因。PSG是RBD诊断的重要手段,REM睡眠期无肌肉弛缓消失(REM sleep without atonia,RSWA),有助于鉴别非快速眼动(NREM)期睡眠行为异常、睡眠周期性肢体活动、梦魇、癫痫、睡眠呼吸事件相关的睡眠觉醒、与多巴胺应用有关的夜间幻觉、夜间谵妄等。我们研究中所有患者均经PSG监测证实。
目前, RBD的PET和SPECT研究显示RBD患者存在脑代谢和脑灌注的异常。但由于PET和SPECT存在放射性,是有创的检查方法,很难在临床上推广应用。ASL是一种磁共振灌注成像技术,它利用流动血液中的水分子作为对比剂,能够定量测定CBF,不受血脑屏障破坏的影响,由于其不必注射对比剂,无电离辐射,因此是一种安全无创的检测方法[5]。研究表明ASL技术定量的CBF与其他血流成像技术(如PET、SPECT)有很好的相关性。
我们利用全脑3D-ASL灌注成像技术及基于体素的分析方法对脑血流灌注进行了定量测定,结果显示跟正常志愿者相比,RBD患者皮质灌注存在异常,与文献中PET和SPECT报道的灌注异常分布的区域基本类似,但灌注增加和减低略有不同[4,6-8]。多数文献报道额叶和运动皮质的低代谢,我们的结果显示为高灌注,这可能与我们所纳入患者的病情严重程度以及不同的转归有关,这有待于对这些患者随访以及样本量扩大后进一步观察。
我们研究结果显示RBD患者脑桥、双侧壳核、海马、海马旁回灌注增加,颞-顶叶部分区域灌注减低,这些灌注异常区域与PD脑部葡萄糖代谢改变区域一致。而双侧顶枕皮质、边缘叶的下降,与PD、DLB 及MSA 的PET表现也极为相似。目前认为,壳核高灌注可能是黑质纹状体功能改变的间接反应,颞-顶低灌注可能是纹状体-丘脑环路异常导致传入神经阻滞所致[4]。因此,我们研究结果支持RBD是神经退行性疾病早期表现的理论。
综上所述,ASL 作为一种非侵袭性的MR 灌注成像技术,其无创方法的优点将带给患者更为普及便捷的检查模式,将其与多导睡眠图监测(polysomnography,PSG)联合应用,将有助于RBD的早期诊断,便于我们及早地干预其进一步演变为神经退行性疾病,而通过ASL技术应用于RBD研究,也将有助于我们对其病理生理学机制的深入了解。
[1] American Academy of Sleep Medicine. International classification of sleep disorders. 2nd ed. Diagnostic and Coding Manual.Westchester, Illinois: American Academy of Sleep Medicine, 2005:148-1531.
[2] Frauscher B, Gschliesser V, Brandauer E, et al. REM sleep behavior disorder in 703 sleep-disorder patients: The importance of eliciting a comprehensive sleep history. Sleep Med, 2010, 11: 167-171.
[3] Iranzo A, Molinuevo JL, Santamaria J, et al. Rapid-eyemovement sleep behavior disorder as an early marker for aneurodegenerative disorder: a descriptive study. Lancet Neurol, 2006, 5: 572-577.
[4] Mazza S, Soucy JP, Gravel P, et al. Assessing whole brain perfusion changes in patients with REM sleep behavior disorder. Neurology,2006, 67: 1618-1622.
[5] Ferré JC, Bannier E, Raoult H, et al. Arterial spin labeling (ASL)perfusion: techniques and clinical use. Diagn Interv Imaging, 2013,94: 1211-1223.
[6] Hanyu H, Inoue Y, Sakurai H, et al. Voxel-based magnetic resonance imaging study of structural brain changes in patients with idiopathic REM sleep behavior disorder. Parkinsonism &Related Disorders, 2012:136-139.
[7] Vendette M, Gagnon J-F, Soucy J-P, et al. Brain perfusion and markers of neurodegeneration in rapid eye movement sleep behavior disorder. Mov Disord, 2011, 26: 1717-1724.
[8] Shirakawa S, Takeuchi N, Uchimura N, et al. Study of image findings in rapid eye movement sleep behavioural disorder.Psychiatry. Clin Neurosci, 2002, 56: 291-292.
