补肾益精方含药血清对D-半乳糖致原代培养神经元损伤影响的研究
2015-01-09史国娟贺燕勤于顾然
史国娟贺燕勤于顾然
(1.南京中医药大学,江苏南京210029;2.南京中医药大学第二附属医院,江苏南京210017;3.南京中医药大学附属医院,江苏南京210029)
补肾益精方含药血清对D-半乳糖致原代培养神经元损伤影响的研究
史国娟1贺燕勤2于顾然3
(1.南京中医药大学,江苏南京210029;2.南京中医药大学第二附属医院,江苏南京210017;3.南京中医药大学附属医院,江苏南京210029)
目的:探讨补肾益精方含药血清对D-半乳糖致原代培养神经元损伤的保护作用机制。方法:将培养第6天的原代神经元分成5组(空白组、D-半乳糖模型组和补肾益精方低、中、高剂量组),分别加相应药物处理后检测各组的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、乳酸脱氢酶(LDH)、丙二醛(MDA)、NO含量,并用MTT法检测各组细胞活性。结果:补肾益精方高、中、低剂量组SOD、GSH-Px水平明显高于D-半乳糖模型组(P<0.01,P<0.001),而LDH、MDA和NO水平明显低于D-半乳糖模型组(P<0.001)。MTT检测细胞活性,补肾益精方各剂量组也明显高于D-半乳糖模型组(P<0.05,P<0.001)。结论:补肾益精方含药血清通过抑制D-半乳糖引起的神经细胞氧化应激,减轻其神经毒性作用。
补肾益精方 含药血清 脑神经元 氧化应激 细胞活性
阿尔茨海默病(Alzheimer’s disease,AD)是一种原发性大脑神经退行性病变,其典型的组织病理学改变是老年斑(SP)和神经纤维缠结(NFT)[1]。氧化应激-自由基损伤理论,是AD形成的重要机理之一。D-半乳糖可使动物出现衰老和智力低下的表现,常用于制作痴呆和衰老动物模型[2-4]。另外,D-半乳糖致原代培养的神经元损伤模型,也可用于AD药理研究[5]。补肾益精方由元代宫廷医家许国祯的《御药院方》神仙六子丸化裁而来,于顾然教授根据《难经》“损其肾者益其精”理论,运用补肾益精方治疗阿尔茨海默病取得较好的临床疗效[6]。本实验探讨该方含药血清对D-半乳糖引起的原代神经元凋亡的影响,并从氧化应激角度探讨其作用机理。
1 实验材料
1.1 实验动物 健康雄性SD大鼠30只,体重(250±10)g,由江苏省中医院实验动物中心提供;16~18d胚鼠,由南京医科大学实验动物中心提供。
1.2 药品与试剂 补肾益精方由江苏省中医院制剂室制成颗粒剂,药物组成:菟丝子、蛇床子、覆盆子、楮实子、熟地黄、人参、茯苓、白术、海风藤、石菖蒲(1∶1∶1∶1∶2∶1∶3∶1∶1∶0.6)。D-半乳糖(Galactose,C6H12O6),美国SIGMA公司;B27 SUPPLEMERT、NeuroBasal Medium、DMEM/F12液体培养基、青链霉素双抗,均购自美国GIBCO公司;胎牛血清,杭州四季青制品公司;四甲基偶氮唑盐(MTT),美国SIGMA公司;一氧化氮(NO)试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶 (SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒,均购自南京建成生物医学工程研究所。1.3 主要仪器 CO2培养箱(德国BINDER)、万能显微镜(Olympus)、倒置相差显微镜(德国LEICA)、精密天平(Mettler Switzerland)、酶联免疫检测仪(瑞士TECAN)、高速冷冻离心机 (美国Beckman-Coulter)、恒温水浴锅(中国华仪仪器公司)、多聚赖氨酸(美国SIGMA公司)。
2 实验方法
2.1 补肾益精方含药血清的制备 临用按给药剂量=临床常用量×动物等效剂量系数(按体表面积)×培养基内稀释度[7-8],制成浓度为1.5g/mL的水煎液,4℃保存。30只大鼠随机分为空白组和补肾益精方给药组,每日灌胃1次生理盐水或补肾益精方水煎液,剂量为每日2mL/只,连续给药7d。末次给药后禁食24h,腹主动脉取血,6000r/min离心 10min,56℃水浴锅30min灭活后用0.45μm微孔滤膜过滤除菌,分装,-80℃保存备用。
2.2 原代神经元的培养 参考文献[9]原代神经元培养方法。接种前用多聚赖氨酸铺板,在冰上无菌操作,取18~22d胚鼠大脑15个,无菌条件下取脑,分离皮层神经元,用冰浴D-Hank’s液洗2次,切成小块,剪碎,0.125%胰蛋白酶2mL,37℃消化30min,每5min振荡1次。用等体积含10%胎牛血清的DMEM终止消化,吹打成细胞悬液,1000r/min离心10min,弃上清,吹打分散细胞,经200目筛网过滤。加入皮层神经元培养液,即在NeuroBasal Medium培养基中加入2%B27SUPPLEMERT+10%的胎牛血清和1%双抗(100U/mL链霉素,100U/mL青霉素)。将细胞悬液稀释至所需密度接种于用0.1mg/mL多聚赖氨酸处理的培养板。置于37℃、5%CO2、饱和湿度培养箱中培养,48h后加入终浓度为10μmol/L阿糖胞苷作用24h更换新培养液,以后每天半量换液,培养6d的皮层神经元用于实验。倒置相差显微镜下观察到原代培养神经元三个生长发育阶段:成活阶段——第1~3日,所有细胞均存活,消除非神经元后,神经元迅速分化,出现神经元的形态特征;成熟并稳定阶段——第4~6日,神经元已充分分化,并维持稳定的结构。
2.3 实验分组 在D-半乳糖致原代培养神经元细胞损伤的实验中,我们将D-半乳糖稀释成不同浓度:0.1、1、10、20、30、50mg/mL,利用MTT方法确立D-半乳糖损伤细胞模型的最佳浓度为10mg/mL。为了探讨补肾益精方含药血清对D-半乳糖致原代培养神经元细胞损伤的作用及是否存在浓度依赖性,我们将含药血清干预组分为3种剂量:补肾益精方低剂量组(10%补肾益精方含药血清+20%的正常血清+70%培养液+D-半乳糖)、补肾益精方中剂量组(20%补肾益精方含药血清+10%的正常血清+70%培养液+D-半乳糖)和补肾益精方高剂量组(30%补肾益精方含药血清+70%培养液+D-半乳糖)。另设不加D-半乳糖的空白组 (30%的正常血清+70%培养液)和不加含药血清的D-半乳糖模型组(30%的正常血清+70%培养液+D-半乳糖)
2.4 MTT实验 取对数生长期的细胞接种于96孔板中,每组设6个复孔。待24h细胞贴壁后,按照“2.3实验分组”部分进行加药。在D-半乳糖致原代培养神经元细胞损伤的实验中,将贴壁后的细胞与D-半乳糖共孵育24h,避光加入MTT溶 液 (5mg/mL), 每 孔101μL,继续在37℃条件下孵育4h。4h后弃上清,每孔加入DMSO 100μL,置于摇床上振摇10min,在酶联免疫检测仪上492nm波长处测定各孔 OD值。在补肾益精方含药血清对D-半乳糖致原代培养神经元细胞损伤的实验中,先将贴壁后的细胞与补肾益精方含药血清预孵2h,然后再加入D-半乳糖,按上述步骤操作。
2.5 生化指标检测 按试剂盒说明书,分别检测各组神经元SOD、MDA、NO、LDH和GSH-PX水平。
2.6 统计学方法 数据采用统计软件SPSS13.0处理,各组数据以(±s)表示,用t检验比较组间差别,P<0.05为差异有显著性意义。
3 实验结果
3.1 各组神经元细胞活性比较 结果见表1。D-半乳糖可以使原代皮层神经元细胞的生存活力下降,补肾益精方对D-半乳糖致原代神经元损伤有保护作用。
表1 各组神经元细胞活性比较(±s)

表1 各组神经元细胞活性比较(±s)
注:与空白组比较,▲▲▲P<0.001;与D-半乳糖模型组比较,*P<0.05,***P<0.001;与补肾益精方低剂量组比较,△△△P<0.001;与补肾益精方中剂量组比较,#P<0.05。
组别 动物数(只) 补肾益精方含药血清OD值空白组6-0.7395±0.0490 D-半乳糖模型组 0.3293±0.0647▲▲▲补肾益精方低剂量组 0.4106±0.0573*补肾益精方中剂量组 0.4682±0.0147***补肾益精方高剂量组 0.5682±0.0573***△△△#6 -6 10μL 6 20μL 6 30μL
3.2 各组皮层神经元SOD活性与GSH-Px活性比较 结果见表2。与空白组相比,D-半乳糖模型组皮层神经元SOD活性与GSH-Px活性明显降低 (P<0.01,P<0.001),提示D-半乳糖介导的自由基损伤降低了皮层神经元SOD与GSH-Px活性。给予补肾益精方含药血清可使D-半乳糖模型的皮层神经元SOD与GSH-Px活性显著升高(P<0.01,P<0.001),且存在一定剂量依赖性。
表2 各组皮层神经元SOD、GSH-pX活性比较(±s)
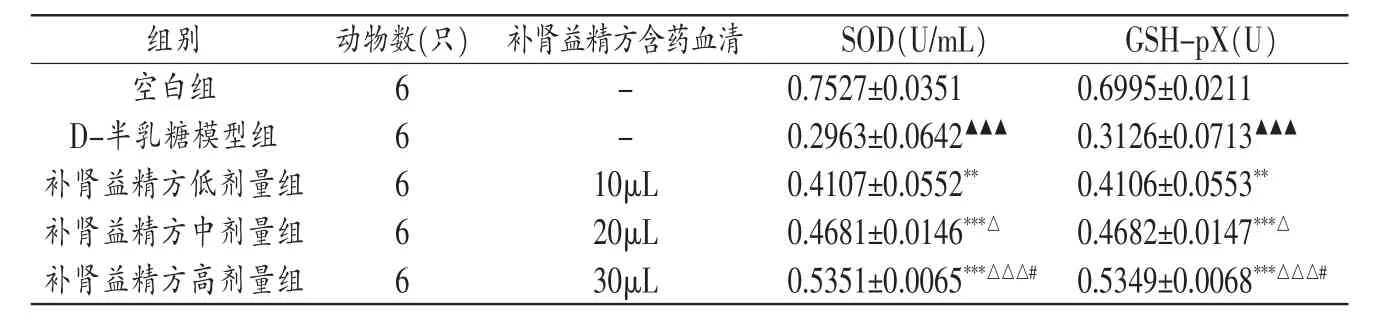
表2 各组皮层神经元SOD、GSH-pX活性比较(±s)
注:与空白组比较,▲▲▲P<0.001;与D-半乳糖模型组比较,**P<0.01,***P<0.001;与补肾益精方低剂量组比较,△P<0.05,△△△P<0.001;与补肾益精方中剂量组比较,#P<0.05。
组别 动物数(只) 补肾益精方含药血清空白组 6 SOD(U/mL)-GSH-pX(U)0.7527±0.03510.6995±0.0211 D-半乳糖模型组 6补肾益精方低剂量组 6补肾益精方中剂量组 6补肾益精方高剂量组 6 -0.2963±0.0642▲▲▲0.3126±0.0713▲▲▲10μL 0.4107±0.0552**0.4106±0.0553**20μL 0.4681±0.0146***△0.4682±0.0147***△30μL 0.5351±0.0065***△△△#0.5349±0.0068***△△△#
表3 各组皮层神经元NO、MDA、LDH值比较(±s)

表3 各组皮层神经元NO、MDA、LDH值比较(±s)
注:与空白组比较,▲▲▲P<0.001;与D-半乳糖模型组比较,***P<0.001;与补肾益精方低剂量组比较,△P<0.05,△△△P<0.001;与补肾益精方中剂量组比较,#P<0.05。
组别 动物数(只)补肾益精含药血清 NO(μmol/L)MDA(nmol/mL)空白组 6- 0.2684±0.0375 LDH(U/L)0.2022±0.00930.2604±0.03901 D-半乳糖模型组 6补肾益精方低剂量组 6补肾益精方中剂量组 6补肾益精方高剂量组 6 - 0.6339±0.0166▲▲▲10μL 0.4552±0.0242***20μL 0.3535±0.0444***△△△30μL 0.3434±0.0489***△△△0.5353±0.0097▲▲▲0.5669±0.0542▲▲▲0.4590±0.0184***0.4924±0.0647***0.3985±0.0522***△0.4152±0.0525***△0.3251±0.0700***△△△0.3417±0.0625***△△△#
3.3 各组皮层神经元MDA、LDH与NO含量比较
见表3。与空白组比较,D-半乳糖模型组皮层神经元MDA、LDH与NO水平明显升高(P<0.001)。给予补肾益精方含药血清可使皮层神经元MDA、LDH与NO水平显著下降(P<0.001),且存在一定剂量依赖性。
4 讨论
氧化应激和凋亡被认为是阿尔茨海默病主要的致病机制。机体在遭受有害刺激时,活性氧自由基(ROS)和活性氮自由基(RNS)产生过多,大量生成的ROS或RNS不仅可以直接攻击细胞生物膜,引起神经元细胞内具有酶原活性蛋白质的变性,损伤细胞核内或线粒体内的DNA等,导致神经细胞的损伤和凋亡。SOD、GSH-Px是机体两种重要的抗氧化酶,可对抗并阻断因氧化自由基对组织细胞造成的损害,并及时修复受损组织细胞。MDA是脂质过氧化的终末代谢产物,可反映机体受ROS攻击的程度。另外,MDA的自身毒性,也是导致AD发病过程中神经元细胞变性坏死凋亡的重要原因[10]。LDH广泛存在于组织细胞内,正常细胞几乎不释放LDH,其释放量的多少可反映细胞膜的完整性,因此LDH活性增加为细胞损伤的重要标志之一。NO是中枢神经系统(CNS)中一种重要的生物信使分子,在CNS中具有双重作用,过量的NO则会作为强氧化剂与超氧阴离子发生反应,对细胞产生毒性从而导致衰老的发生[11]。
D-半乳糖是一种二醛糖,它在醛糖还原酶的作用下生成半乳糖醇和H2O2,同时在反应过程中产生超氧阴离子,过量的氧自由基在动物体内可与细胞中的脂质、蛋白和核酸产生非酶糖基化、氧化应激-自由基损伤作用及诱导醛糖还原酶活性增强等一系列病理改变,从而导致衰老。大脑特别容易氧化是因为它的高代谢率和低抗氧化能力[12]。自由基学说是重要的衰老学说之一[13]。D-半乳糖可致神经细胞凋亡,常注射于动物脑区,用于制作痴呆的动物模型。
本研究运用D-半乳糖制作氧化应激致AD的细胞模型,以补肾益精方含药血清干预该细胞模型,发现补肾益精方含药血清可提高D-半乳糖损伤的原代培养神经元抗氧化酶SOD与GSH-Px活性,降低脂质过氧化分解产物MDA与强氧化剂NO的含量,减少神经细胞凋亡及LDH释放,提高神经细胞存活率。并且,随着补肾益精方含药血清浓度的增加,其抗氧化应激及神经元保护作用也相应增强。即补肾益精方可以通过减少细胞凋亡对D-半乳糖损伤原代皮层神经元细胞起保护作用,补肾益精方抗凋亡作用是通过其抗氧化应激反应来实现的,且其作用强度呈浓度依赖性。
本研究结果为临床推广补肾益精方防治阿尔茨海默病提供了实验室依据,但本研究只从体外细胞水平揭示补肾益精方减轻氧化应激、保护损伤的神经元等作用,由于痴呆有多种形成机制,包括炎症因子、凋亡、自噬等,而中药作用是多靶点的,减轻氧化应激只是其作用的一个方面。下一步的研究将针对本方的抗凋亡作用,研究其对凋亡信号通道——丝裂原活化蛋白激酶信号通道的影响;另外,除了体外细胞培养研究之外,我们还将探讨该方在动物体内减轻脑细胞凋亡的机制,以期更全面地揭示该方治疗痴呆的机理。
[1] Armstrong RA.The molecular biology of senile plaques and neurofibrillary tangles in Alzheimer's disease.Folia Neuropathol,2009,47(4):289
[2] Cui X,Zuo P,Zhang Q,et al.Chronic systemic D-galactose exposure induces memory loss,neurodegeneration,and oxidative damage in mice:protective effects of R-alphalipoic acid.J Neurosci Res,2006,84(3):647
[3] Yoo DY,Kim W,Lee CH,et al.Melatonin improves D-galactose -induced aging effects on behavior,neurogenesis,and lipid peroxidation in the mouse dentate gyrus via increasing pCREB expression.J Pineal Res,2012,52(1):21
[4] Xian YF,Lin ZX,Zhao M,et al.Uncaria rhynchophylla ameliorates cognitive deficits induced by D-galactose in mice.Planta Med,2011,77(18):1977
[5] 蔡大勇,赵雁,黄启福.D-半乳糖致原代培养神经元损伤模型的建立.中国病理生理学杂志,2002,18(6):18
[6] 贺燕勤,于顾然.运用《难经》“益精”理论治疗痴呆探讨.陕西中医,2012,33(6):746
[7] 李义奎.中药药理实验方法学.上海:上海科学技术出版社,2006:50
[8] 孟李,王宁生.含药血清的制备方法研究.中药新药与临床药理,1999,10(5):290
[9] 司徒镇强,吴军正.细胞培养.西安:世界图书出版公司,1999:121,181
[10] CioancaO,Hritcu L,Mihasan M,etal.Cognitiveenhancing and antioxidant activities of inhaled coriander volatile oil in amyloid β(1-42)rat model of Alzheimer's disease.Physiol Behav,2013(120):193
[11] Luth HJ,HolzerM,GartnerU,etal.Expression of endothelial and inducible NOS-isoforms is increased in Alzheimer's disease,in APP23 transgenic mice and after experimental brain lesion in rat:evidence for an induction by amyloid pathology.Brain Res,2001,913(1):57
[12] Reynolds A,Laurie C,Mosley RL,et al.Oxidative stress and the pathogenesis of neurodegenerative disorders. Int Rev Neurobiol,2007,82:297
[13] 李素云,王立芹,郑稼琳,等.自由基与衰老的研究进展.中国老年学杂志,2007,27(10):2046
R289.5
A
1672-397X(2015)02-0080-03
史国娟(1987-),女,硕士研究生,中西医结合临床(神经内科)专业。
于顾然,教授,主任中医师,硕士生导师。dr.ygrdf@163.com
2014-09-30
编辑:吴 宁
江苏省中医药管理局基金资助(LZ13027)
